Орнитин спортвики: Недопустимое название — SportWiki энциклопедия
L-Аргинин + L-Орнитин (150 caps)
Client Silver
0 грн
Client Gold
0 грн
Cl. Platinum
0 грн
Бесплатно
при заказе от 1700 грн
Батончик в подарок
за каждую 1000 грн в заказе
Снят с продажи
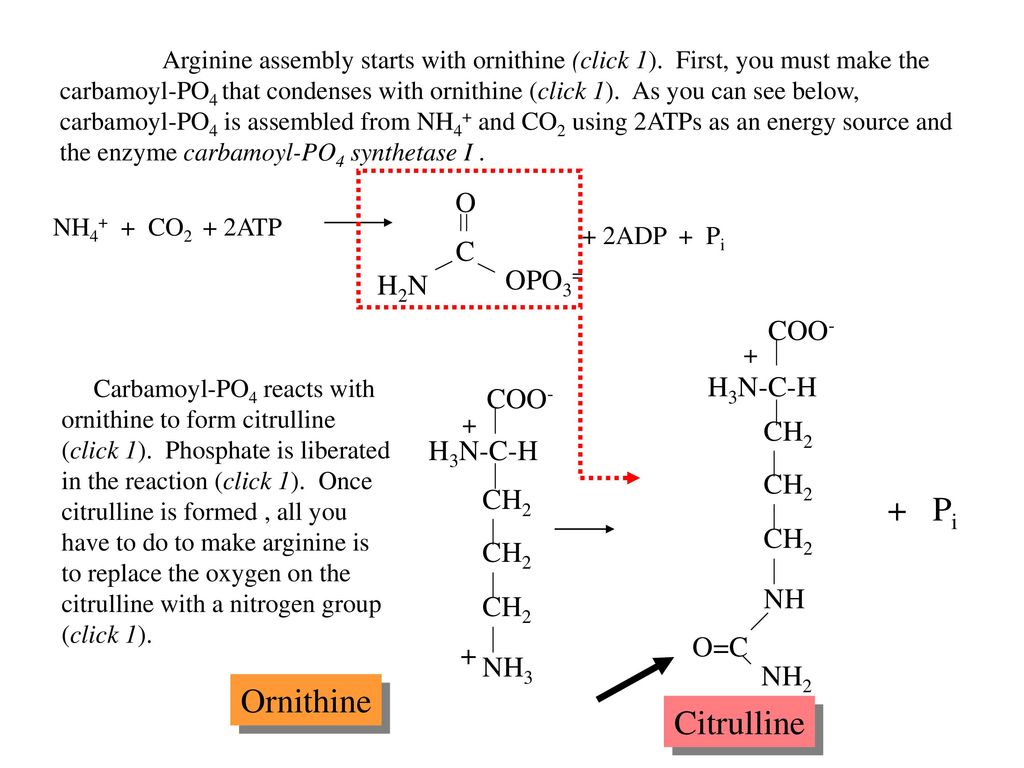
Повышенное содержание гормона роста увеличивает синтез белка, усиливает задержку азота в мышечных тканях, способствует сжиганию излишнего жира и стимулирует рост мышечных клеток.
Кроме того, L-орнитин активно участвует в утилизации аммиака и способствует выделению инсулина, а L-аргинин действует как сосудорасширяющее средство, тем самым помогая полноценной циркуляции крови по всем, даже самым отдаленным, мышечным тканям организма спортсмена.
Витамин В6 принимает участие в метаболизме аминокислот, улучшая их усвоение.
Максимальная активность гормона роста проявляется во время сна и во время физических нагрузок, поэтому этот комплекс рекомендуется принимать перед сном и перед интенсивными физическими нагрузками.
Способ употребления. Принимать по 3-5 капсул перед тренировками и по 5-7 капсул на пустой желудок перед сном. Запивать водой или не кислым соком. Не запивать жидкостями, содержащими белок.
Ванситон L-Аргинин + L-Орнитин хорошо совместим и наиболее эффективен при совместном приеме с энергетическими продуктами, особенно содержащими креатина моногидрат.
Условия хранения. Хранить в сухом прохладном месте при температуре до 25оС и относительной влажности не более 85%.
Энергетическая и пищевая ценность в 100 г:
Энергетическая ценность | 398 ккал / 1692 кДж |
Белки | 99,6 г |
Углеводы | 0 г |
Жиры | 0 г |
Состав в 1 капсуле:
L-аргинин | 375,0 мг |
L-орнитина гидрохлорид | 175,0 мг |
Витамин В-6 (пиридоксина HCl) | 2,0 мг |
Отзывы
Хемомикробиомный анализ молекулы орнитина | Торшин
1. Громова О. А., Торшин И. Ю., Лазебник Л. Б., Максимов В. А. Систематический компьютерный анализ исследований орнитина для выявления наиболее перспективных трендов терапевтического использования — акцент на функцию печени. Экспериментальная и клиническая гастроэнтерология. 2021;191(7):26-32. doi: 10.31146/1682-8658-ecg-191-7-26-32.
Громова О. А., Торшин И. Ю., Лазебник Л. Б., Максимов В. А. Систематический компьютерный анализ исследований орнитина для выявления наиболее перспективных трендов терапевтического использования — акцент на функцию печени. Экспериментальная и клиническая гастроэнтерология. 2021;191(7):26-32. doi: 10.31146/1682-8658-ecg-191-7-26-32.
2. Horvath A., Leber B., Feldbacher N., Steinwender M., Komarova I., Rainer F., Blesl A., Stadlbauer V. The effects of a multispecies synbiotic on microbiome-related side effects of long-term proton pump inhibitor use: A pilot study. Sci Rep. 2020 Feb 17;10(1):2723. doi: 10.1038/s41598-020-59550-x. PMID: 32066847.
3. Громова О. А., Ребров В. Г. “Витамины, макро- и микроэлементы. Обучающие программы РСЦ института микроэлементов ЮНЕСКО” ISBN: 978-5-97040814-8. М., Гэотар-Медиа, 2008, 954 с.
4. Торшин И. Ю., Громова О. А., Захарова И. Н., Максимов В. А. Хемомикробиомный анализ Лактитола. Экспериментальная и клиническая гастроэнтерология. 2019;164(4):111-121. doi: 10.31146/1682-8658-ecg-164-4-111-121.
doi: 10.31146/1682-8658-ecg-164-4-111-121.
5. Торшин И. Ю., Галустян А. Н., Иванова М. И., Хаджи-дис А. К., Громова О. А. Хемомикробиомный анализ синергизма D-маннозы и D-фруктозы в сравнении с другими метабиотиками. Эффективная фармакотерапия. 2020. Т. 16. № 4. С. 8-18. Doi: 10.33978/23073586-2020-16-8-18.
6. Громова О. А., Торшин И. Ю., Наумов А. В., Максимов В. А. Хемомикробиомный анализ глюкозамина сульфата, пребиотиков и нестероидных противовоспалительных препаратов. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2020;13(3):270-282. doi: 10.17749/2070-4909/farmakoekonomika.2020.049.
7. Maguire A., Rugg-Gunn A. J. Xylitol and caries prevention — is it a magic bullet? Br Dent J. 2003 Apr 26;-194(8):429-36. doi: 10.1038/sj.bdj.4810022. PMID: 12778091.
8. Shawcross D. L., Jalan R. Treatment of hepatic encephalopathy: it’s not lactulose. BMJ. 2004 Jul 10;329(7457):112; author reply 112. doi: 10.1136/bmj.329.7457.112. PMID: 15242927.
9. Barclay T., Ginic-Markovic M., Johnston M. R., Cooper P., Petrovsky N. Observation of the keto tautomer of D-fructose in D(2) O using (1) H NMR spectroscopy. Carbohydr Res. 2012 Jan 10;347(1):136-41. doi: 10.1016/j.carres.2011.11.003. Epub 2011 Nov 12. PMID: 22129837.
Barclay T., Ginic-Markovic M., Johnston M. R., Cooper P., Petrovsky N. Observation of the keto tautomer of D-fructose in D(2) O using (1) H NMR spectroscopy. Carbohydr Res. 2012 Jan 10;347(1):136-41. doi: 10.1016/j.carres.2011.11.003. Epub 2011 Nov 12. PMID: 22129837.
10. Torshin I. Y., Rudakov K. V. On the theoretical basis of metric analysis of poorly formalized problems of recognition and classification. Pattern Recognit. Image Anal. 25, 577-587 (2015). doi: 10.1134/S1054661815040252.
11. Torshin I. Y., Rudakov K. V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 1: Factorization approach. Pattern Recognit. Image Anal. 27, 16-28 (2017). doi: 10.1134/S1054661817010151.
12. Torshin I. Y., Rudakov K. V. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. Part 2: Metric approach within the framework of the theory of classification of feature values. Pattern Recognit. Image Anal. 27, 184-199 (2017). doi: 10.1134/S1054661817020110.
Pattern Recognit. Image Anal. 27, 184-199 (2017). doi: 10.1134/S1054661817020110.
13. Torshin I. Y., Rudakov K. V. On metric spaces arising during formalization of recognition and classification problems. Part 1: Properties of compactness. Pattern Recognit. Image Anal. 26, 274-284 (2016). doi: 10.1134/S1054661816020255.
14. Torshin I. Y., Rudakov K. V. On metric spaces arising during formalization of problems of recognition and classification. Part 2: Density properties. Pattern Recognit. Image Anal. 26, 483-496 (2016). doi: 10.1134/S1054661816030202.
15. Torshin I. Yu., Rudakov K. V. On the procedures of generation of numerical features over the splits of a set of objects and the problem of prediction of numeric target variables. Pattern Recognition and Image Analysis. 2019; 29(2): 65-75. doi: 10.1134/S1054661819040175.
16. Maier L., Pruteanu M., Kuhn M., et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature. 2018 Mar 29;555(7698):623-628. doi: 10.1038/nature25979. Epub 2018 Mar 19. PMID: 29555994.
doi: 10.1038/nature25979. Epub 2018 Mar 19. PMID: 29555994.
17. A framework for human microbiome research. Nature. 2012 Jun 13;486(7402):215-21. doi: 10.1038/nature11209. PMID: 22699610.
18. The Integrative Human Microbiome Project: dynamic analysis of microbiome-host omics profiles during periods of human health and disease. Cell Host Microbe. 2014 Sep 10;16(3):276-89. doi: 10.1016/j.chom.2014.08.014. PMID: 25211071.
19. Kim S., Chen J., Cheng T., et al. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 2019 Jan 8;47(D1): D1102-D1109. doi: 10.1093/nar/gky1033. PMID: 30371825.
20. Barkham T. M. Laboratory safety aspects of SARS at Biosafety Level 2. Ann Acad Med Singapore. 2004 Mar;33(2):252-6. PMID: 15098644.
21. Torshin I. Yu. Sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009, In “Bioinformatics in the Post-Genomic Era” series, ISBN 1-60692-217-0.
22. Cegielska A., Dabrowska M. , Lammek B., Mackiewicz Z., Taylor A., Kupryszewski G. Antibacterial peptide derivatives. Part VI. Derivatives of the L-lysine and L-ornithine dipeptides and their effect on the morphology of bacterial cells. Mater Med Pol. 1979 Oct-Dec;11(4):324-9. PMID: 122002.
, Lammek B., Mackiewicz Z., Taylor A., Kupryszewski G. Antibacterial peptide derivatives. Part VI. Derivatives of the L-lysine and L-ornithine dipeptides and their effect on the morphology of bacterial cells. Mater Med Pol. 1979 Oct-Dec;11(4):324-9. PMID: 122002.
23. Penninckx M., Gigot D. Synthesis of a peptide form of N-delta-(phosphonoacetyl)-L-ornithine. Its antibacterial effect through the specific inhibition of Escherichia coli L-ornithine carbamoyltransferase. J Biol Chem. 1979 Jul 25;254(14):6392-6. PMID: 376531.
24. Pan M., Lu C., Zheng M., Zhou W., Song F., Chen W., Yao F., Liu D., Cai J. Unnatural Amino-Acid-Based StarShaped Poly(l-Ornithine)s as Emerging Long-Term and Biofilm-Disrupting Antimicrobial Peptides to Treat Pseudomonas aeruginosa- Infected Burn Wounds. Adv Healthc Mater. 2020 Oct;9(19): e2000647. doi: 10.1002/adhm.202000647. Epub 2020 Sep 6. PMID: 32893500.
25. Lohan S., Monga J., Cameotra S. S., Bisht G. S. In vitro and in vivo antibacterial evaluation and mechanistic study of ornithine based small cationic lipopeptides against antibiotic resistant clinical isolates. Eur J Med Chem. 2014 Dec 17;88:19-27. doi: 10.1016/j.ejmech.2014.06.039. PMID: 24961161.
Eur J Med Chem. 2014 Dec 17;88:19-27. doi: 10.1016/j.ejmech.2014.06.039. PMID: 24961161.
Health Aid — L-аргинин и L-орнитин
Перейти в конец галереи изображений
Перейти к началу галереи изображений
Об этом продукте
- Способствуют высвобождению гормона инсулина
- Способствует нейтрализации аммиака в печени
- Улучшить процесс заживления и восстановления
- Способствует образованию новых костей и сухожилий
- Помощь в мышечном метаболизме
- Улучшает образование оксида азота, влияющего на сексуальную функцию
- Может помочь поддерживать нормальную фертильность
- Может помочь укрепить иммунную систему и повысить уровень энергии
L-аргинин и L-орнитин 300 мг Таблетки содержат аминокислоты аргинин и орнитин, которые необходимы для выработки гормонов роста, необходимых для мышечной энергии, синтеза мышечной ткани, роста и восстановления мышц. Эти аминокислоты играют важную роль, помогая печени выводить токсины из организма и эффективно вырабатывать желчь для оптимизации жирового обмена. Комбинация аргинина и орнитина помогает усилить синтез коллагена и, следовательно, ускорить время восстановления поврежденных тканей. Это также помогает эффективно повысить иммунную систему. Добавление витамина B6 помогает максимизировать скорость усвоения отдельных аминокислот. Кроме того, одним из ключевых преимуществ L-аргинина для здоровья является то, что он используется в организме для выработки особого газа, называемого оксидом азота, который расширяет и расслабляет кровеносные сосуды, помогая поддерживать нормальное кровяное давление и улучшая кровообращение.
Комбинация аргинина и орнитина помогает усилить синтез коллагена и, следовательно, ускорить время восстановления поврежденных тканей. Это также помогает эффективно повысить иммунную систему. Добавление витамина B6 помогает максимизировать скорость усвоения отдельных аминокислот. Кроме того, одним из ключевых преимуществ L-аргинина для здоровья является то, что он используется в организме для выработки особого газа, называемого оксидом азота, который расширяет и расслабляет кровеносные сосуды, помогая поддерживать нормальное кровяное давление и улучшая кровообращение.
Указания по применению
- Взрослым и детям старше 16 лет по одной-две таблетки в день натощак, при необходимости можно увеличить до трех. Не превышайте рекомендуемую суточную дозу, если это не рекомендовано квалифицированным специалистом.
- не должны использоваться в качестве замены разнообразного и сбалансированного питания и здорового образа жизни.

Пищевые добавки
Пищевая ценность может различаться в зависимости от вкуса
| ||||||||||||||||||
Об этом бренде
Напишите свой собственный отзыв
>
Ферментативное производство диамина путресцина: системная метаболическая инженерия Corynebacterium Glutamicum
1. Шаффер С., Хаас Т. Биокаталитическое и ферментативное производство альфа, омега-бифункциональных полимерных предшественников. [(по состоянию на 11 февраля 2015 г.)];Org. Процесс. Рез. Дев. 2014 18: 752–766. Доступно в Интернете: http://dx.doi.org/10.1021/op5000418 [Google Scholar]
Шаффер С., Хаас Т. Биокаталитическое и ферментативное производство альфа, омега-бифункциональных полимерных предшественников. [(по состоянию на 11 февраля 2015 г.)];Org. Процесс. Рез. Дев. 2014 18: 752–766. Доступно в Интернете: http://dx.doi.org/10.1021/op5000418 [Google Scholar]
2. Рыдз Дж., Сикорска В., Кюлавска М., Христова Д. Полиэфирные (био)разлагаемые полимеры как экологически безопасные материалы для устойчивого развития. Междунар. Дж. Мол. науч. 2014; 16: 564–596. doi: 10.3390/ijms16010564. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Kroschwitz J.I., Seidel A. Kirk-Othmer Encyclopedia of Chemical Technology. 5-е изд. Wiley-Interscienc; Hoboken, NJ, USA: 2004. [Google Scholar]
4. Schneider J., Eberhardt D., Wendisch V.F. Улучшение производства путресцина Corynebacterium glutamicum путем тонкой настройки активности орнитинтранскарбамоилазы с использованием системы зависимости от плазмид. заявл. микробиол. Биотехнолог. 2012;95:169–178. doi: 10.1007/s00253-012-3956-9. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00253-012-3956-9. [PubMed] [CrossRef] [Google Scholar]
5. Schneider J., Wendisch V.F. Производство путресцина с помощью инженерии Corynebacterium glutamicum . заявл. микробиол. Биотехнолог. 2010; 88: 859–868. doi: 10.1007/s00253-010-2778-x. [PubMed] [CrossRef] [Google Scholar]
6. Qian Z.G., Xia X.X., Lee S.Y. Метаболическая инженерия Escherichia coli для производства путресцина: четырехуглеродный диамин. Биотехнолог. биоинж. 2009; 104: 651–662. [PubMed] [Академия Google]
7. Мейсвинкель Т.М., Риттманн Д., Линднер С.Н., Вендиш В.Ф. Производство аминокислот и путресцина на основе сырого глицерина Corynebacterium glutamicum . Биоресурс. Технол. 2013; 145: 254–258. doi: 10.1016/j.biortech.2013.02.053. [PubMed] [CrossRef] [Google Scholar]
8. Мейсвинкель Т.М., Гопинат В., Линднер С.Н., Нампутири К.М., Вендиш В.Ф. Ускоренное использование пентозы Corynebacterium glutamicum для ускоренного производства лизина, глутамата, орнитина и путресцина. микроб. Биотехнолог. 2013;6:131–140. дои: 10.1111/1751-7915.12001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
микроб. Биотехнолог. 2013;6:131–140. дои: 10.1111/1751-7915.12001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Uhde A., Youn J.W., Maeda T., Clermont L., Matano C., Kramer R., Wendisch V.F., Seibold G.M., Marin K. , Глюкозамин как источник углерода для Corynebacterium glutamicum , продуцирующих аминокислоты. заявл. микробиол. Биотехнолог. 2013; 97: 1679–1687. doi: 10.1007/s00253-012-4313-8. [PubMed] [CrossRef] [Google Scholar]
10. Мейсвинкель Т.М., Линднер С.Н., Вендиш В.Ф. Производство аминокислот и путресцина на основе густого сока по Глутаминовая коринебактерия . Дж. Биотехнология. Биоматер. 2014 г.: 10.4172/2155-952X.1000167. [PubMed] [CrossRef] [Google Scholar]
11. Peters-Wendisch P., Gotker S., Heider S.A., Komati Reddy G., Nguyen A.Q., Stansen K.C., Wendisch V.F. Инженерные биотиновые прототрофные штаммы Corynebacterium glutamicum для производства аминокислот, диамина и каротиноидов. Дж. Биотехнология. 2014; 192:346–354. doi: 10.1016/j.jbiotec.2014.01.023. [PubMed] [CrossRef] [Академия Google]
2014; 192:346–354. doi: 10.1016/j.jbiotec.2014.01.023. [PubMed] [CrossRef] [Академия Google]
12. Shinfuku Y., Sorpitiporn N., Sono M., Furusawa C., Hirasawa T., Shimizu H. Разработка и экспериментальная проверка модели метаболизма в масштабе генома для Corynebacterium glutamicum . микроб. Клетка. Факт. 2009 г.: 10.1186/1475-2859-8-43. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Blombach B., Riester T., Wieschalka S., Ziert C., Youn J.W., Wendisch V.F., Eikmanns B.J. производство изобутанола. заявл. Окружающая среда. микробиол. 2011;77:3300–3310. дои: 10.1128/AEM.02972-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Rittmann D., Lindner S.N., Wendisch V.F. Разработка пути утилизации глицерина для производства аминокислот Corynebacterium glutamicum . заявл. Окружающая среда. микробиол. 2008; 74: 6216–6222. doi: 10.1128/AEM.00963-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Хадиати А., Кран И., Линднер С.Н., Вендиш В.Ф. Разработка Corynebacterium glutamicum для выращивания и производства L-орнитина, L-лизина и ликопина из гексуроновых кислот. Биоресурс. Биопроцесс. 2014 г.: 10.1186/s40643-014-0025-5. [Перекрестная ссылка] [Академия Google]
Хадиати А., Кран И., Линднер С.Н., Вендиш В.Ф. Разработка Corynebacterium glutamicum для выращивания и производства L-орнитина, L-лизина и ликопина из гексуроновых кислот. Биоресурс. Биопроцесс. 2014 г.: 10.1186/s40643-014-0025-5. [Перекрестная ссылка] [Академия Google]
16. Usuda Y., Tujimoto N., Abe C., Asakura Y., Kimura E., Kawahara Y., Kurahashi O., Matsui H. Молекулярное клонирование Corynebacterium glutamicum (« Brevibacterium lactofermentum » AJ12036) ген odhA , кодирующий новый тип 2-оксоглутаратдегидрогеназы. Микробиология. 1996; 142:3347–3354. doi: 10.1099/13500872-142-12-3347. [PubMed] [CrossRef] [Google Scholar]
17. Schwinde JW, Hertz P.F., Sahm H., Eikmanns BJ, Guyonvarch A. Липоамиддегидрогеназа из Corynebacterium glutamicum : Молекулярный и физиологический анализ гена lpd и характеристика фермента. Микробиология. 2001;147:2223–2231. [PubMed] [Google Scholar]
18. Нибиш А., Кабус А., Шульц С. , Вейл Б., Ботт М. Коринебактериальная протеинкиназа G контролирует активность 2-оксоглутаратдегидрогеназы посредством статуса фосфорилирования белка OdhI. Дж. Биол. хим. 2006; 281:12300–12307. doi: 10.1074/jbc.M512515200. [PubMed] [CrossRef] [Академия Google]
, Вейл Б., Ботт М. Коринебактериальная протеинкиназа G контролирует активность 2-оксоглутаратдегидрогеназы посредством статуса фосфорилирования белка OdhI. Дж. Биол. хим. 2006; 281:12300–12307. doi: 10.1074/jbc.M512515200. [PubMed] [CrossRef] [Академия Google]
19. Kawahara Y., Takahashi-Fuke K., Shimizu E., Nakamatsu T., Nakamori S. Взаимосвязь между продукцией глутамата и активностью 2-оксоглутаратдегидрогеназы в Brevibacterium lactofermentum . [(по состоянию на 24 июля 2014 г.)]; Biosci. Биотехнолог. Биохим. 1997 61: 1109–1112. Доступно в Интернете: http://dx.doi.org/10.1271/bbb.61.1109 [PubMed] [Google Scholar]
20. Асакура Ю., Кимура Э., Усуда Ю., Кавахара Ю., Мацуи К., Осуми Т., Накамацу Т. Изменение метаболического потока из-за делеции odhA вызывает перепроизводство L-глутамата у Corynebacterium glutamicum . заявл. Окружающая среда. микробиол. 2006; 73: 1308–1319. doi: 10.1128/AEM.01867-06. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Raasch K., Bocola M., Labahn J., Leitner A., Eggeling L., Bott M. Взаимодействие 2-оксоглутаратдегидрогеназы OdhA с его ингибитор OdhI в Corynebacterium glutamicum : Мутанты и модель. Дж. Биотехнология. 2014; 191:99–105. doi: 10.1016/j.jbiotec.2014.05.023. [PubMed] [CrossRef] [Академия Google]
Raasch K., Bocola M., Labahn J., Leitner A., Eggeling L., Bott M. Взаимодействие 2-оксоглутаратдегидрогеназы OdhA с его ингибитор OdhI в Corynebacterium glutamicum : Мутанты и модель. Дж. Биотехнология. 2014; 191:99–105. doi: 10.1016/j.jbiotec.2014.05.023. [PubMed] [CrossRef] [Академия Google]
22. Krawczyk S., Raasch K., Schultz C., Hoffelder M., Eggeling L., Bott M. Домен FHA OdhI взаимодействует с карбоксиконцевым доменом 2-оксоглутаратдегидрогеназы OdhA в Corynebacterium glutamicum . ФЭБС лат. 2010; 584:1463–1468. doi: 10.1016/j.febslet.2010.03.028. [PubMed] [CrossRef] [Google Scholar]
23. Schultz C., Niebisch A., Schwaiger A., Viets U., Metzger S., Bramkamp M., Bott M. Генетический и биохимический анализ серина/треонина. протеинкиназы PknA, PknB, PknG и PknL из Corynebacterium glutamicum : Доказательства несущественности и фосфорилирования OdhI и FtsZ множественными киназами. Мол. микробиол. 2009; 74: 724–741. doi: 10.1111/j.1365-2958. 2009.06897.x. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
2009.06897.x. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
24. Schultz C., Niebisch A., Gebel L., Bott M. Производство глутамата Corynebacterium glutamicum : зависимость от белка-ингибитора оксоглутаратдегидрогеназы OdhI и протеинкиназа PknG. заявл. микробиол. Биотехнолог. 2007;76:691–700. doi: 10.1007/s00253-007-0933-9. [PubMed] [CrossRef] [Google Scholar]
25. Юкава Х., Инуи М., Вертес А.А. Геномы и инженерия на уровне генома бактерий, продуцирующих аминокислоты. В: Вендиш В.Ф., редактор. Биосинтез аминокислот — пути, регуляция и метаболическая инженерия. Том 5. Спрингер; Гейдельберг, Германия: 2007. стр. 349–401. [CrossRef] [Google Scholar]
26. Peters-Wendisch P.G., Wendisch V.F., Paul S., Eikmanns B.J., Sahm H. Пируваткарбоксилаза как анаплеротический фермент в Глутаминовая коринебактерия . Микробиология. 1997; 143:1095–1103. doi: 10.1099/00221287-143-4-1095. [CrossRef] [Google Scholar]
27. Peters-Wendisch P.G., Schiel B. , Wendisch V.F., Katsoulidis E., Mockel B., Sahm H., Eikmanns B.J. Коринебактерии глютаминкум . Дж. Мол. микробиол. Биотехнолог. 2001; 3: 295–300. [PubMed] [Google Scholar]
, Wendisch V.F., Katsoulidis E., Mockel B., Sahm H., Eikmanns B.J. Коринебактерии глютаминкум . Дж. Мол. микробиол. Биотехнолог. 2001; 3: 295–300. [PubMed] [Google Scholar]
28. Jojima T., Fujii M., Mori E., Inui M., Yukawa H. Разработка метаболизма сахара Corynebacterium glutamicum для производства аминокислоты l-аланина в условиях кислородного голодания. заявл. микробиол. Биотехнолог. 2010; 87: 159–165. doi: 10.1007/s00253-010-2493-7. [PubMed] [CrossRef] [Google Scholar]
29. Shirai T., Fujimura K., Furusawa C., Nagahisa K., Shioya S., Shimizu H. Изучение роли анаплеротических путей в гиперпродукции глутамата Corynebacterium glutamicum по анализу метаболических потоков. микроб. Клетка. Факт. 2007 г.: 10.1186/1475-2859-6-19. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Зидлер С., Линднер С.Н., Брингер С., Вендиш В.Ф., Ботт М. Восстановительная биотрансформация целых клеток с помощью Corynebacterium glutamicum : улучшение образования НАДФН из глюкозы циклическим пентозофосфатным путем с использованием pfkA и Делеционные мутанты gapA . заявл. микробиол. Биотехнолог. 2013;97:143–152. doi: 10.1007/s00253-012-4314-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
заявл. микробиол. Биотехнолог. 2013;97:143–152. doi: 10.1007/s00253-012-4314-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Jiang L.Y., Chen S.G., Zhang Y.Y., Liu J.Z. Метаболическая эволюция Corynebacterium glutamicum для увеличения производства L-орнитина. БМС Биотехнология. 2013 г.: 10.1186/1472-6750-13-47. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Kim S.Y., Lee J., Lee S.Y. Метаболическая инженерия Corynebacterium glutamicum для производства l-орнитина. Биотехнолог. биоинж. 2015; 112:416–421. doi: 10.1002/бит.25440. [PubMed] [CrossRef] [Google Scholar]
33. Lee S.Y., Shin H.S., Park J.S., Kim Y.H., Min J. Пролин снижает связывание регулятора транскрипции ArgR до argB в Corynebacterium glutamicum . заявл. микробиол. Биотехнолог. 2010; 86: 235–242. doi: 10.1007/s00253-009-2264-5. [PubMed] [CrossRef] [Google Scholar]
34. Ронш Х., Крамер Р., Морбах С. Влияние осмотического стресса на регуляцию объема, состав цитоплазматического раствора и выработку лизина в Corynebacterium glutamicum Mh30-22B. Дж. Биотехнология. 2003; 104:87–97. doi: 10.1016/S0168-1656(03)00166-4. [PubMed] [CrossRef] [Google Scholar]
Дж. Биотехнология. 2003; 104:87–97. doi: 10.1016/S0168-1656(03)00166-4. [PubMed] [CrossRef] [Google Scholar]
35. Weinand M., Kramer R., Morbach S. Характеристика множественности переносчиков совместимых растворенных веществ в Глутаминовая коринебактерия . заявл. микробиол. Биотехнолог. 2007; 76: 701–708. doi: 10.1007/s00253-007-0938-4. [PubMed] [CrossRef] [Google Scholar]
36. Schneider J., Niermann K., Wendisch V.F. Производство аминокислот l-глутамата, l-лизина, l-орнитина и l-аргинина из арабинозы с помощью рекомбинантных Corynebacterium glutamicum . Дж. Биотехнология. 2011; 154:191–198. doi: 10.1016/j.jbiotec.2010.07.009. [PubMed] [CrossRef] [Google Scholar]
37. Xu M., Rao Z., Dou W., Jin J., Xu Z. Исследования сайт-направленного мутагенеза сайтов связывания l-аргинина ингибирования обратной связи в N-ацетил-l-глутаматкиназа (NAGK) из Глутаминовая коринебактерия . Курс. микробиол. 2012; 64: 164–172. doi: 10.1007/s00284-011-0042-y. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
38. Schendzielorz G., Dippong M., Grunberger A., Kohlheyer D., Yoshida A., Binder S., Nishiyama C., Nishiyama M., Bott M., Эггелинг Л. Взятие контроля над контролем: использование определения продукта в отдельных клетках для устранения контроля потока ключевых ферментов в путях биосинтеза. АКС Синтез. биол. 2014;3:21–29. doi: 10.1021/sb400059y. [PubMed] [CrossRef] [Академия Google]
39. Нгуен А.К., Шнайдер Дж., Вендиш В.Ф. Устранение N-ацетилирования полиаминов и регуляторная инженерия улучшили производство путресцина с помощью Corynebacterium glutamicum . Дж. Биотехнология. 2015; 201:75–85. doi: 10.1016/j.jbiotec.2014.10.035. [PubMed] [CrossRef] [Google Scholar]
40. Itou H., Watanabe N., Yao M., Shirakihara Y., Tanaka I. Кристаллические структуры репрессора связывания множественных лекарственных средств Corynebacterium glutamicum CgmR в комплексе с индукторами и с оператором. Дж. Мол. биол. 2010; 403:174–184. doi: 10.1016/j.jmb.2010.07.042. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.jmb.2010.07.042. [PubMed] [CrossRef] [Академия Google]
41. Кинд С., Крейе С., Виттманн С. Метаболическая инженерия клеточного транспорта для перепроизводства основного химического вещества 1,5-диаминопентана в Corynebacterium glutamicum . Метаб. англ. 2011;13:617–627. doi: 10.1016/j.ymben.2011.07.006. [PubMed] [CrossRef] [Google Scholar]
42. Kind S., Jeong W.K., Schroder H., Zelder O., Wittmann C. Идентификация и устранение конкурирующего пути N-ацетилдиаминопентана для улучшения производства диаминопентана Corynebacterium глютамин . заявл. Окружающая среда. микробиол. 2010;76:5175–5180. doi: 10.1128/AEM.00834-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Эггелинг Л., Ботт М. Справочник по Corynebacterium Glutamicum. КПР Пресс; Бока-Ратон, Флорида, США: 2005. [Google Scholar]
44. Stansen C., Uy D., Delaunay S., Eggeling L., Goergen J.L., Wendisch V.F. Характеристика оперона утилизации лактата Corynebacterium glutamicum , индуцированного во время запускаемой температурой продукции глутамата. заявл. Окружающая среда. микробиол. 2005;71:5920–5928. doi: 10.1128/AEM.71.10.5920-5928.2005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
заявл. Окружающая среда. микробиол. 2005;71:5920–5928. doi: 10.1128/AEM.71.10.5920-5928.2005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
45. Schäfer A., Tauch A., Jäger W., Kalinowski J., Thierbach G., Puhler A. Получены небольшие мобилизуемые многоцелевые векторы клонирования из Escherichia coli плазмид pK18 и pK19: отбор определенных делеций в хромосоме Corynebacterium glutamicum . Ген. 1994; 145:69–73. doi: 10.1016/0378-1119(94)90324-7. [PubMed] [CrossRef] [Академия Google]
46. Ханахан Д. Исследования по трансформации Escherichia coli плазмидами. Дж. Мол. биол. 1983; 166: 557–580. doi: 10.1016/S0022-2836(83)80284-8. [PubMed] [CrossRef] [Google Scholar]
47. Гибсон Д.Г., Янг Л., Чуанг Р.Ю., Вентер Дж.К., Хатчисон К.А., 3-й, Смит Х.О. Ферментативная сборка молекул ДНК размером до нескольких сотен тысяч оснований. Нац. Методы. 2009; 6: 343–345. doi: 10.1038/nmeth.1318. [PubMed] [CrossRef] [Google Scholar]
48. Шелленбергер Дж., Куэ Р., Флеминг Р.М., Тиле И., Орт Дж.Д., Файст А.М., Зелински Д.К., Бордбар А., Льюис Н.Е., Рахманян С. и др. др. Количественное предсказание клеточного метаболизма с помощью моделей, основанных на ограничениях: COBRA Toolbox v2.0. Нац. протокол 2011;6:1290–1307. doi: 10.1038/nprot.2011.308. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Шелленбергер Дж., Куэ Р., Флеминг Р.М., Тиле И., Орт Дж.Д., Файст А.М., Зелински Д.К., Бордбар А., Льюис Н.Е., Рахманян С. и др. др. Количественное предсказание клеточного метаболизма с помощью моделей, основанных на ограничениях: COBRA Toolbox v2.0. Нац. протокол 2011;6:1290–1307. doi: 10.1038/nprot.2011.308. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Shen L., Haufe J., Patel M.K. Обзор продукции и прогноз рынка новых пластиков на биологической основе (Утрехтский университет), 2009 г. [(по состоянию на 9 февраля 2015 г.)]. Доступно в Интернете: http://en.european-bioplastics.org
50. Hoffelder M., Raasch K., van Ooyen J., Eggeling L. Домен E2 OdhA Corynebacterium glutamicum имеет сукцинилтрансферазную активность, зависящую от липоила. остатки ацетилтрансферазы AceF. Дж. Бактериол. 2010;192: 5203–5211. doi: 10.1128/JB.00597-10. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. Omumasaba C.A., Okai N., Inui M., Yukawa H.

