Белки и их роль в клетке: строение, свойства, функции — урок. Биология, 9 класс.
Белки, их строение и роль в клетке.
Белки, их строение и роль в клетке.
Белки — основная структурная единица клеток. Это полимеры, мономерами которых являются аминокислоты. В состав белков входит 20 типов аминокислот. В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот. Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
Соединение, состоящее из нескольких аминокислот, называют пептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура белка определяется последовательностью аминокислот в полипептидной цепи. Именно порядок чередования аминокислот в данной белковой молекуле определяет её особые физико-химические и биологические свойства.
Вторичная структура представляет собой белковую нить, закрученную в виде спирали. Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые слабее ковалентных, но при их большом числе обеспечивают образование прочной структуры.
Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые слабее ковалентных, но при их большом числе обеспечивают образование прочной структуры.
Третичная структура — это клубок, или глобула, в который свертывается спираль. Он образуется в результате взаимодействия различных остатков аминокислот. Для каждого белка характерна своя форма.
Некоторые белки имеют четвертичную структуру. Она характерна для сложных белков. Несколько глобул объединены вместе и удерживаются вместе благодаря ионным, водородным и другим нековалентным связям. Например, белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Под влиянием внешних факторов (изменение температуры, солевого состава среды, pH, под действием радиации и т.п. факторов) слабые химические связи, поддерживающие молекулу белка (вторичную, третичную, четвертичную структуры), разрываются, изменяются структура и свойства белка. Этот процесс называется денатурацией.
Этот процесс называется денатурацией.
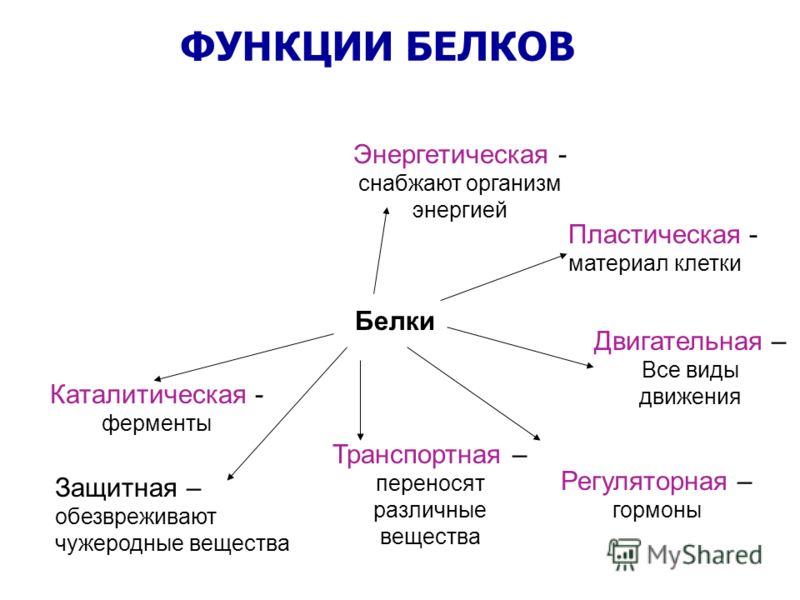
Роль белков:
- Строительная функция. Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов, главным компонентом опорных структур организма.
- Ферментативная функция. Многие белки служат биокатализаторами, ускоряют протекание различных химических реакций в организме.
- Регуляторная функция. Часть гормонов — белки. Они участвуют в регуляции активности клетки и организма. Например, инсулин регулирует обмен глюкозы.
- Защитная функция. Антитела, образуемые лимфоцитами, нейтрализуют чужеродных для организма возбудите лей заболеваний. Белки, участвующие в процессе свертывания крови (фибриноген и тромбин), предохраняют организм от кровопотери.
- Транспортная функция. Белки могут присоединять к себе различные молекулы и ионы и переносить их из одной части организма к другой. Например, гемоглобин переносит кислород и углекислый газ.

- Энергетическая функция. Белки могут служить источ ником энергии для клетки. При недостатке в организме yглеводов или жиров окисляются молекулы аминокислот. При расщеплении 1 г белков высвобождается 17,6 кДж энергии.
На этой странице искали :
- роль белков в клетке
- Белки и их роль в клетке
- строение и роль белков в клетке
- роль белков в клетке доклат
- белки их строение и роль в клетке
Строение и функции белков
Строение белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды.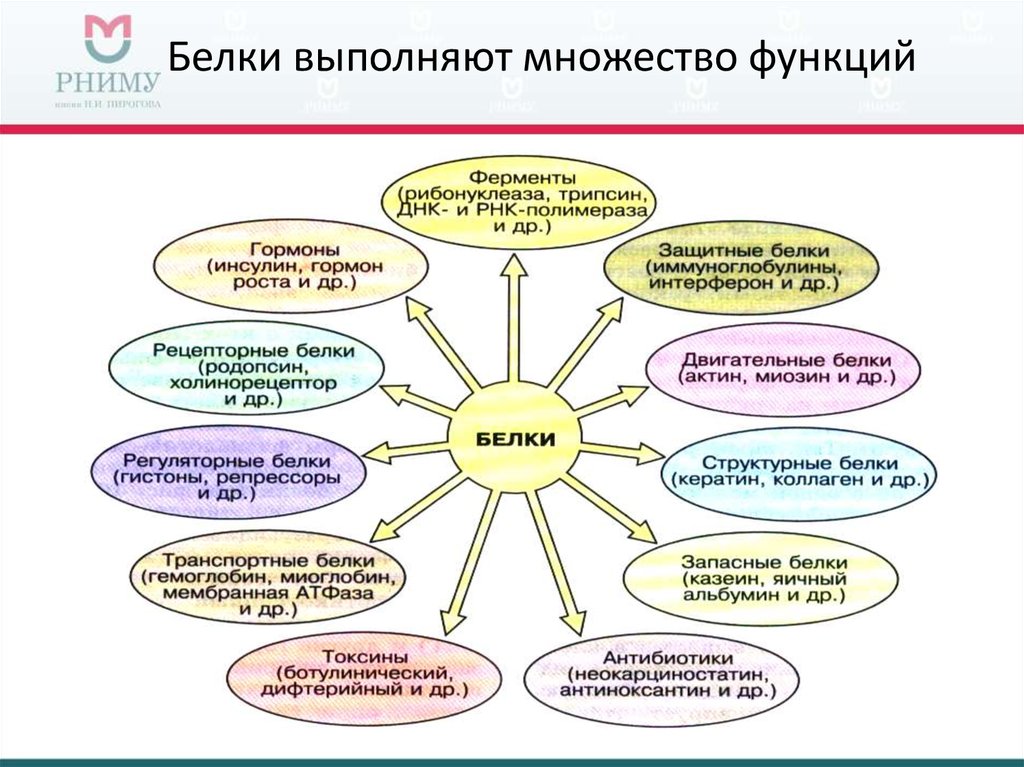 Их доля составляет 50 – 80% сухой массы клетки.
Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка.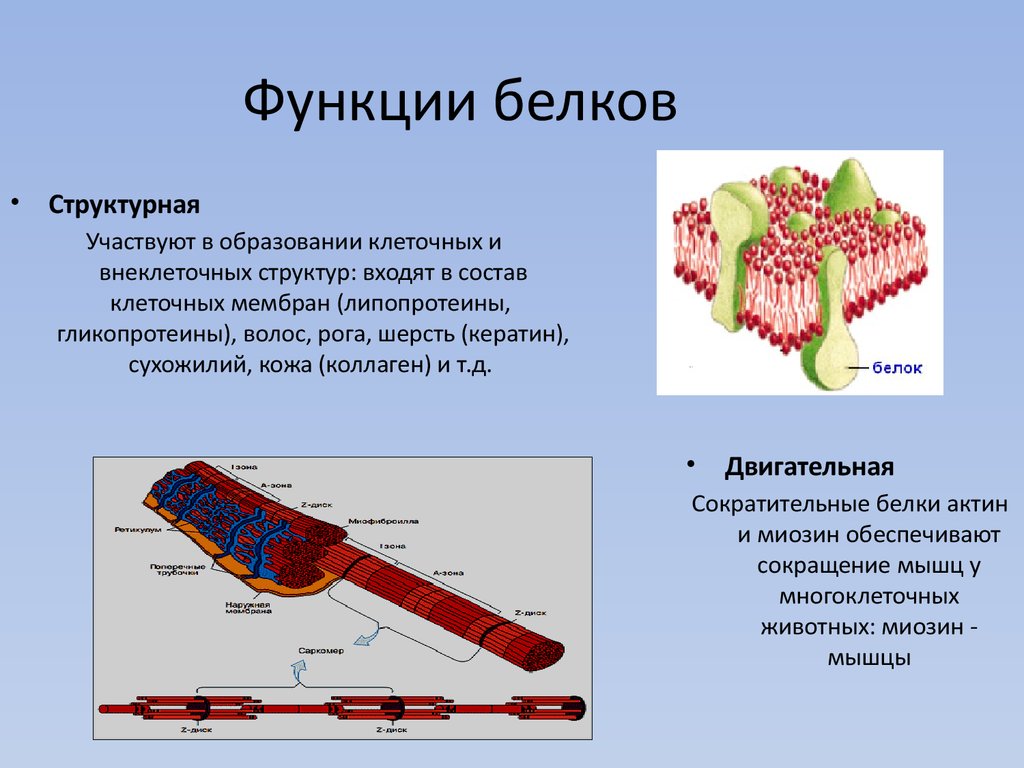 Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.

- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т. п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.

Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.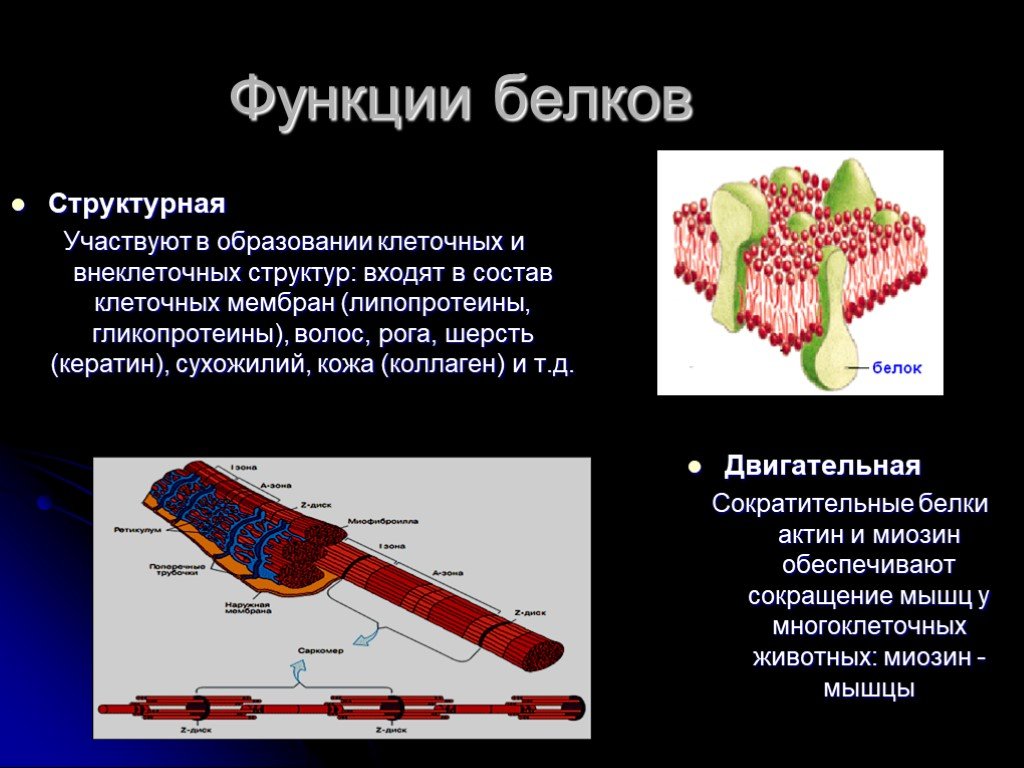
Ферменти, их роль в клетке
Определение 3
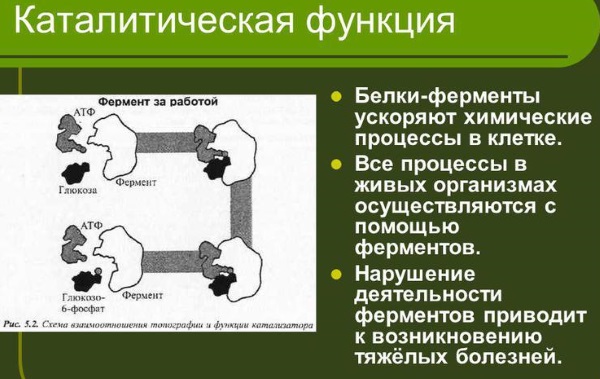
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует
лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
Функция белков | Биология для специальностей I
Результаты обучения
- Определение нескольких основных функций белков
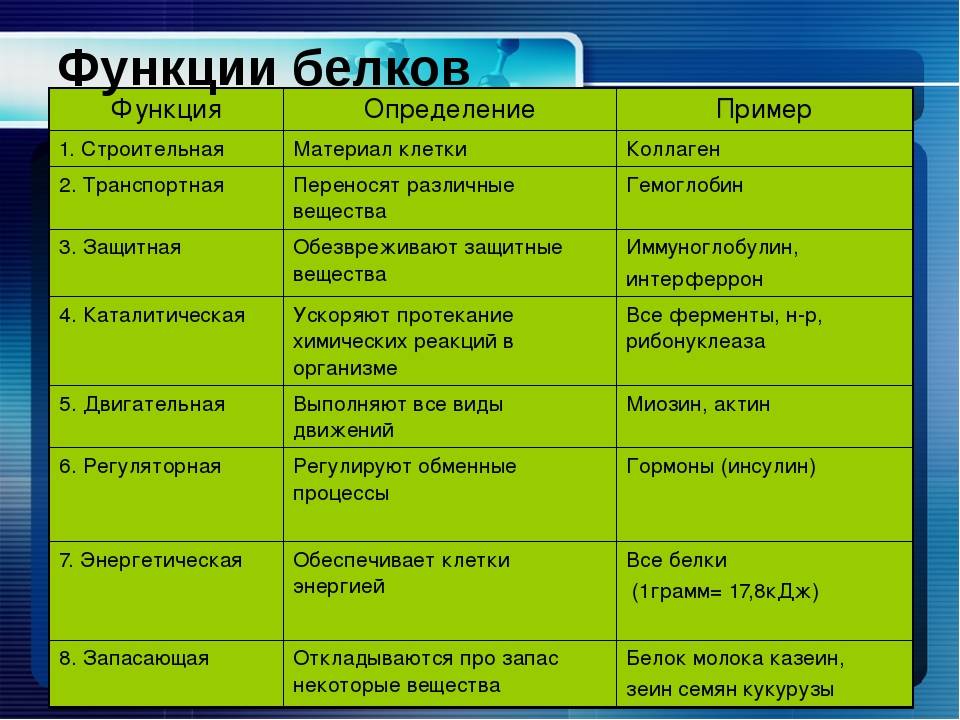
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин | Переносят вещества с кровью или лимфой по всему телу |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация деятельности различных систем организма |
| Защита | Иммуноглобулины | Защита организма от чужеродных патогенов |
| Сократительный | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечивает питание на раннем этапе развития зародыша и проростка |
Двумя особыми и распространенными типами белков являются ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (таких как пищеварение) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (таких как пищеварение) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация. Различное расположение одних и тех же 20 типов аминокислот составляют все белки. Недавно были обнаружены две новые редкие аминокислоты (селеноцистеин и пирролизин), и этот список может быть дополнен новыми открытиями.
Кратко: Функции белков
Белки представляют собой класс макромолекул, выполняющих разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки организованы на четырех уровнях: первичном, вторичном, третичном и (необязательно) четвертичном. Первичная структура представляет собой уникальную последовательность аминокислот. Локальная укладка полипептида с образованием структур, таких как спираль α и складчатый лист β , составляет вторичную структуру. Общая трехмерная структура является третичной структурой. Когда два или более полипептида объединяются, образуя полную структуру белка, такая конфигурация известна как четвертичная структура белка.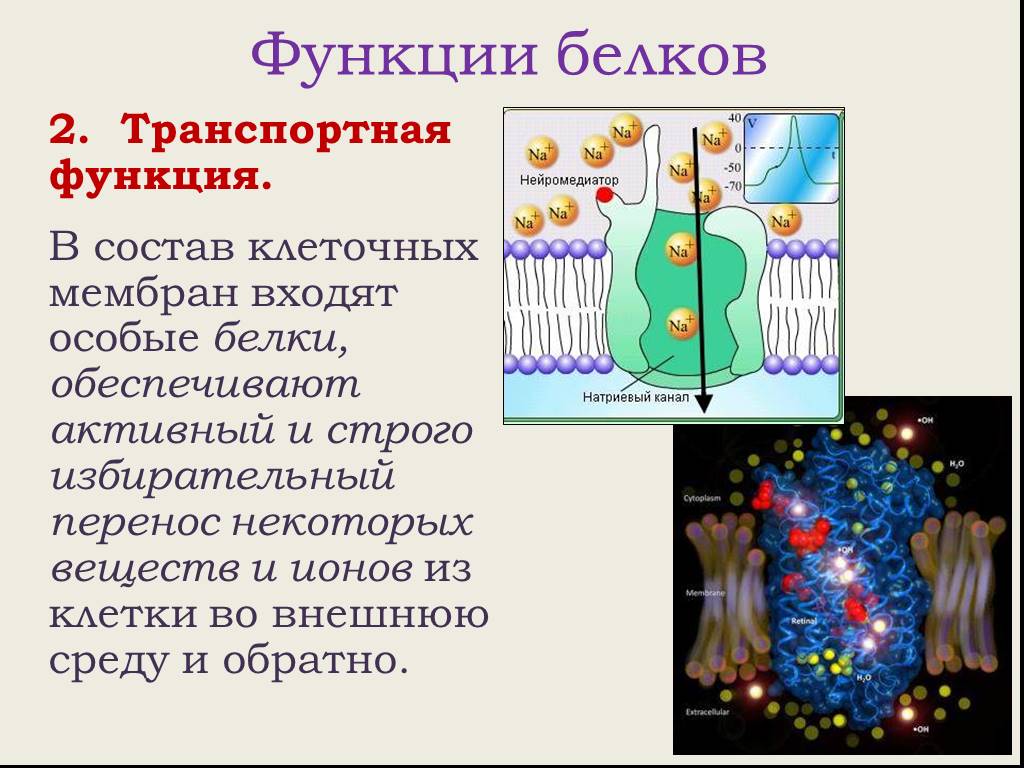 Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Попробуйте
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Роль белков в организме — Science Learning Hub
Добавить в коллекцию
Белки — это молекулы, состоящие из аминокислот. Они закодированы нашими генами и составляют основу живых тканей. Они также играют центральную роль в биологических процессах. Например, белки катализируют реакции в нашем организме, транспортируют такие молекулы, как кислород, поддерживают наше здоровье как часть иммунной системы и передают сообщения от клетки к клетке.
Синтез белка
Ген — это сегмент молекулы ДНК, который содержит инструкции, необходимые для создания уникального белка. Все наши клетки содержат одни и те же молекулы ДНК, но каждая клетка использует разную комбинацию генов для создания определенных белков, необходимых ей для выполнения своих специализированных функций.
Синтез белка состоит из 2 основных стадий. 1-й этап известен как транскрипция, где формируется молекула-мессенджер (мРНК). Эта молекула транскрибируется с молекулы ДНК и несет копию информации, необходимой для создания белка. На 2-м этапе молекула мРНК покидает ядро и направляется в цитоплазму, где клеточные рибосомы считывают информацию и начинают собирать белок в процессе, называемом трансляцией 9.0009
Во время трансляции рибосомы считывают последовательность мРНК из трех оснований за раз. Каждая из этих трехбуквенных комбинаций (называемых кодонами) кодирует определенную аминокислоту. Например, последовательность оснований ТТТ кодирует аминокислоту лизин.
Имеется 4 основания (аденин, тимин, гуанин и цитозин) и, следовательно, 64 (4 3 ) возможных кодонов, указанных с использованием комбинации из 3 оснований. Однако для построения всех белков в нашем организме требуется всего 20 аминокислот (некоторые аминокислоты определяются более чем одним кодоном). Именно определенная последовательность аминокислот определяет форму и функцию белка.
Именно определенная последовательность аминокислот определяет форму и функцию белка.
На синтез белка, как и на многие другие биологические процессы, могут влиять факторы окружающей среды. К ним относятся питание матери, температурный стресс, уровень кислорода и воздействие химических веществ
Различные типы белков
В нашем организме содержится множество различных типов белков. Все они играют важную роль в нашем росте, развитии и повседневном функционировании. Вот несколько примеров:
- Ферменты — это белки, которые облегчают биохимические реакции, например, пепсин — это пищеварительный фермент в желудке, который помогает расщеплять белки в пище.
- Антитела — это белки, вырабатываемые иммунной системой для удаления чужеродных веществ и борьбы с инфекциями.
- ДНК-ассоциированные белки регулируют структуру хромосом во время клеточного деления и/или играют роль в регуляции экспрессии генов, например, гистоны и когезиновые белки
- Сократительные белки участвуют в сокращении и движении мышц, например, актин и миозин
- Структурные белки обеспечивают поддержку в нашем организме, например, белки в наших соединительных тканях, такие как коллаген и эластин.