Какие белки выполняют двигательную функцию: Функции белка в организме
Функции белка в организме
☰
Белки в живых организмах выполняют множество важных функций. Поэтому в организмах существует множество различных белков.
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д. Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.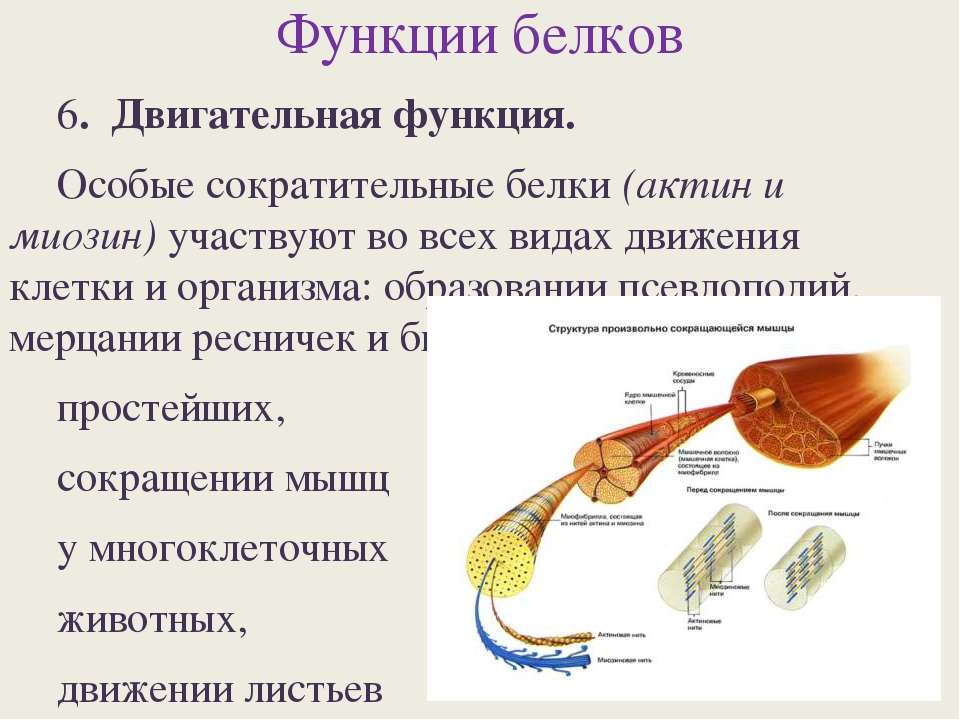
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
Функции белков в организме | Химия онлайн
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Видеофильм «Функции белков»
Разнообразные функции белков определяются a-аминокислотным составом и строением их высокоорганизованных макромолекул.
1. Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
2. Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др.
Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах.
Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
3. Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях.
Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
4. Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
5. Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
6. Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать!
В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
7. Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
8. Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
9. Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Белки
что является основными ферментативными функциями рибосомы или углеводов в организме и таблица об этом
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Функции белков в организме
Ни один из известных нам живых организмов не обходится без белков.
Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др. Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин.
Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах. Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях. Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др. ) выполняют почти исключительно структурную функцию. Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
) выполняют почти исключительно структурную функцию. Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источник: https://himija-online.ru/organicheskaya-ximiya/belki/funkcii-belkov-v-organizme.html
Функции белков в клетке:
- Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
- Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34. Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
- Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
- Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
- Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.

- Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, Nh4. Аммиак Nh4 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
- Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей.
Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
- лкилирования;
- нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Источник: https://megaobuchalka.ru/9/32081.html
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Источник: https://biokhimija.ru/belki/belki.html
Функции белка в клетке: структура белковой молекулы, виды органического вещества
Каждая клетка живого организма функционирует за счет содержания необходимых компонентов. Они выполняют важную роль, стимулируют обменные процессы и способствуют обновлению.
Особенно важны функции белка в клетке. Органические компоненты могут иметь разный состав, строение, некоторые отличия в жизненном цикле. Сегодня специалисты используют различные методы для исследования молекул и выявления их особенностей.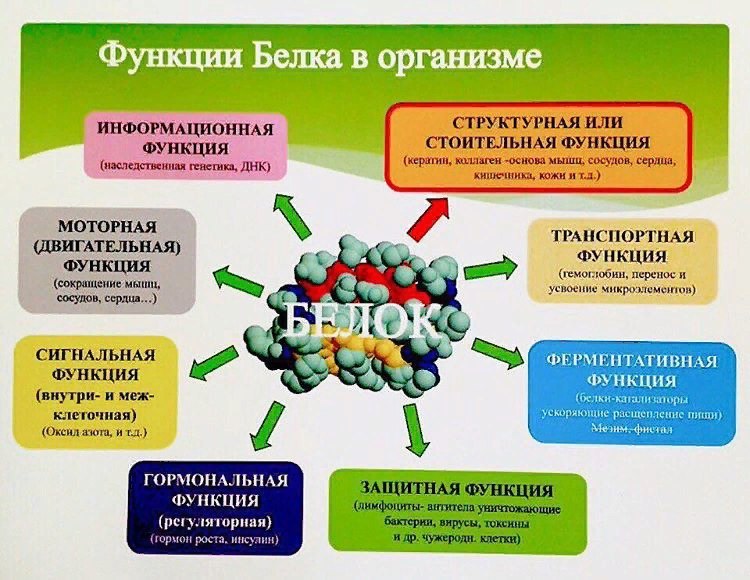
Что такое белки
Белки представляют собой органические соединения, имеющие различный состав и выполняющие важные функции в организме всех живых существ. Существует несколько видов этих молекул, каждый из которых имеет значение в процессе жизнедеятельности.
Состав
Органические вещества являются высокомолекулярными, поэтому могут включать в свой состав различные аминокислоты и другие соединения. Набор важных компонентов в каждой молекуле закладывается генетическим кодом животного или человека.
Основные компоненты каждой молекулы:
- углерод;
- кислород;
- азот;
- водород;
- сера.
Первый компонент обнаруживается в белке в наибольшем количестве, последний — не более 5 % от состава.
История открытия
Первый белок был получен необычным способом. Его выделили из пшеничной муки в виде клейковины. Произошло открытие в 1728 году, сделал его Якопо Беккари, итальянец. В качестве отдельного биологического класса молекулы белка были выделены в XVIII веке после обнародования работ французского ученого и химика Антуана де Фуркруа.
Другие ученые одновременно с французом отметили, что молекулы имеют свойство коагулировать (объединяться) под воздействием некоторых кислот или в процессе нагревания.
На тот момент ученые смогли изучить только альбумин, фибрин и глютен.
Только через 100 лет, в XIX веке, другие исследователи, изучив состав простых белков, отметили, что при нагревании происходит выделение аминокислот. Это помогло сделать вывод, что молекулы включают в себя довольно большое количество важных и разных аминокислот, а состав каждой из них индивидуален.
В 1836 году Мульдер предложил первую структурную формулу белков, основанную на теории радикалов. Он и еще несколько ученых вывели формулу протеинов, что в переводе с греческого означает «первый».
Мульдер также определил почти точную молекулярную массу наиболее простого белка, равную 131 дальтону. Дальтон — единица измерения молекул, называемая еще атомной массой или углеродной единицей.
Дальтон — единица измерения молекул, называемая еще атомной массой или углеродной единицей.
Позже ученые выявили, что молекулярная масса может быть различной и зависит от состава и структуры органического соединения. В 1880-х годах русский ученый Данилевский изучил пептидные группы и доказал их существование в белковой молекуле. К этому времени большинство аминокислот уже были изучены.
В 1894 году немецкий ученый и физиолог Альбрехт Коссель рассказал о своем предположении. Он считал, что именно аминокислоты являются основными структурными элементами белковой молекулы.
Его теория была подтверждена в начале ХХ века химиком из Германии Эмилем Фишером. Ученый в ходе своего эксперимента доказал, что каждая молекула содержит около 20 аминокислот.
Важность белка в живом организме была признана только в 1926 году благодаря эксперименту американца Джеймса Самнера. После этого начинается активное изучение структур молекулы, выделяются различные виды. В 60—80-ых годах ХХ века исследования продолжаются.
К 2012 году в базе данных насчитывалось около 87 тысяч структур. Сегодня методы изучения молекулы усовершенствованы, поэтому работа в этом направлении продолжается.
Строение
Белок считается макромолекулой, поскольку имеет большой размер и множество составляющих. В строении белков присутствуют разные аминокислоты или их остатки, они чередуются с полипептидными цепями.
В молекулу могут входить следующие аминокислоты:
- глицин;
- аланин;
- изолейцин;
- серин;
- лейцин;
- валин;
- треонин.
Эти встречаются в составе наиболее часто, сочетаются с пептидными цепями и аминокислотными остатками.
Классификация
Существуют несколько классификаций белков в зависимости от состава, строения, формы, растворимости в воде. Чаще всего молекулы делят на простые и сложные с учетом строения.
К простым относятся следующие:
- Альбумины — жизненно необходимы животным и человеку.
 Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания.
Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания. - Глобулины в воде слабо растворяются. Являются составляющими крови, мышечной ткани, оказывают влияние на свертываемость, выполняют защитную функцию.
- Протамины — низкомолекулярные белки, хорошо растворимые в воде. В организме выполняют структурную функцию, являются строительным материалом для мышц и других тканей.
- Гистоны — низкомолекулярные вещества, содержат большое количество лизина и аргинина. Принимают участие в формировании структуры молекул ДНК, предупреждают передачу генетической информации к РНК.
- Проламины — растительные белки с невысокой пищевой ценностью. Создают в организме резерв.
- Глютелины — растительные вещества, принимающие участие в формировании клеточной оболочки. Денатурация происходит в солевых растворах, в воде они не растворимы.
- Протеноиды — животные белки, богатые аминокислотами, не растворяются в воде, кислотах, щелочах, солевых жидкостях. Входят в состав костной, хрящевой ткани, связок, сухожилий.
Среди сложных белков выделяют фосфопротеины, гликопротеины, нуклеопротеины, липопротеины, хромопротеины, металлопротеины.
Каждый вид имеет свои особенности:
- Фосфопротеины — сложные белки, содержащие остатки фосфорной кислоты, связывающиеся с пептидными цепями. Выполняют в организме защитную, строительную, энергетическую функции.
- Гликопротеины — сложные органические компоненты, содержащие углеводный остаток. Принимают участие в выработке ферментов, выполняют защитную и секреторную функции, стимулируют образование важных для жизнедеятельности гормонов.
- Нуклеопротеины состоят из нуклеиновых кислот (нуклеотиды), наиболее распространенные РНК и ДНК.
 Содержатся в мембранах клетки, формируют генетический код человека.
Содержатся в мембранах клетки, формируют генетический код человека. - Липопротеины содержат липиды (жиры), присутствуют в лимфе и плазме крови, не растворяются в воде. Выполняют транспортировочную функцию, переносят липиды по всему организму.
- Хромопротеины называют «цветными белками». В составе содержат окрашивающий компонент. Участвуют в транспортировке кислорода. Яркий представитель вида — гемоглобин.
- Металлопротеины содержат ионы металла в составе. Транспортируют металл в организме, создают его резерв.
Любой из видов играет важную роль в метаболических процессах.
Функции
Различные виды белков выполняют в организме важные функции. При отсутствии основных типов нарушаются все жизненно важные процессы.
Каталитическая
Катализ реакций в организме осуществляется благодаря наличию ферментов, являющихся белками по своему составу и строению. Ферменты помогают расщеплять сложные вещества на простые, облегчают их переработку.
Благодаря этому возможно поступление полезных компонентов ко всем тканям, органам, регенерация клеток, осуществление нормального метаболизма.
Структурная
Осуществляется благодаря коллагену и эластину. Белки являются важным строительным элементом, стимулируют формирование костной ткани, мышц, хрящей, связок и сухожилий.
Выделяют 4 структуры белковой молекулы:
- Первичная структура представляет собой последовательность остатков аминокислот, чередующихся с полипептидной цепью. Встречается во многих тканях, на протяжении жизни организма не меняет строения.
- Вторичная структура — упорядочивание фрагментов полипептидной цепи, подверженное стабилизации за счет наличия водородных связей.
- Третичная структура — строение полипептидной цепи пространственного типа. При детальном рассмотрении можно увидеть, что строение напоминает вторичную структуру, но присутствуют гидрофобные взаимодействия.

- Четвертичная структура представляет собой белковое соединение, состоящее из нескольких пептидных цепей в одном комплексе.
Благодаря различной структуре белковых молекул осуществляется построение всех клеток и тканей в организме.
Защитная
Физическая защита осуществляется благодаря наличию в клетках и тканях коллагена, отвечающего за прочность и предотвращающего повреждения. Химическая защита осуществляется благодаря способности белков связывать токсины, выводить их из организма.
Иммунная защита возможна благодаря способности некоторых белков стимулировать образование лимфоцитов, уничтожать вирусы, патогенные микроорганизмы.
Сигнальная и регуляторная
Регуляция всех процессов в клетках осуществляется с участием белков, представленных ферментами. Часто компоненты связываются с другими веществами, стимулируют процессы регенерации, регулируют метаболизм.
Многие внутриклеточные белки осуществляют сигнальную функцию, помогают передавать информацию между тканями, клетками, органами. Обычно сигнальную функцию выполняют белки-гормоны.
Транспортная
Транспортная функция осуществляется в основном за счет белка-гемоглобина. Он доставляет кислород ко всем тканям и клеткам, переправляет в легкие углекислый газ для выведения его наружу. Ученые нашли во всех живых организмах молекулы, напоминающие по строению гемоглобин.
Запасная и моторная
Запасная или резервная функция возможна благодаря наличию в клетке белков, содержащих аминокислоты. Они служат источником питания и энергии при недостаточном поступлении подобных компонентов с пищей.
Моторная или двигательная функция играет важную роль. Разные виды белковых молекул принимают участие в сокращении мышечных волокон, передвижении лейкоцитов и других клеток для обеспечения иммунной защиты.
Свойства
Белковые соединения обладают физическими и химическими свойствами, отличающими их от других молекул.
Физические
Физические свойства позволяют выявить белок среди других соединений в живом организме.
Основными будут следующие:
- вес молекулы может достигать 1 млн дальтон;
- при попадании в водный раствор происходит формирование коллоидной системы;
- в зависимости от кислотности среды отличается заряд белкового соединения;
- самый крупный сегодня белок — титин.
Молекулярная масса у каждого соединения отличается, определяется разными способами.
Химические
При определенных условиях белковые соединения проявляют свои химические свойства.
Наиболее частыми реакциями будут следующие:
- Амфотерность — способность белков в зависимости от условий проявлять основные свойства и кислотные.
- Денатурация — изменение биологической активности соединения в результате потери вторичной, третичной или четвертичной структуры. Может быть механической, физической и химической, обратимой и необратимой, полной и неполной.
Химические свойства белков изучаются различными методами для выявления особенностей молекул.
Этапы синтеза белка
Биосинтез белка представляет собой процесс, состоящий из нескольких этапов, в ходе которых происходит созревание соединений. Протекает во всех живых организмах.
Основные этапы синтеза:
- Инициация. Образование аминоацеладинелата одновременно с активацией аминокислоты в присутствии АТФ и специфического фермента.
- Элонгация. Присоединение образовавшейся кислоты к специфичной тРНК с последующим освобождением аденозинмнофосфата.
- Терминация. Связывание соединения аминокислоты и тРНК с рибосомами.
- Трансляция. Включение аминокислоты в белковую молекулу с одновременным высвобождением тРНК.
У разных живых организмов процесс может проходить с разной скоростью, но последовательность этапов неизменна.
Методы изучения
Сегодня исследование белковых соединений продолжается в современных лабораториях.
Популярные методы изучения:
- Метод клеточной и молекулярной биологии используется с целью фиксирования локализации молекул в клетках, наблюдения за синтезом веществ. Для стимулирования реакции используются антитела. Наблюдение проводится посредством микроскопа. На предметное стекло помещается подготовленный белок и антитела, проводится эксперимент, результаты фиксируются.
- Биохимический метод предполагает изучение чистого белка, избавленного от дополнительных компонентов. Для дальнейшего изучения используют центрифугирование, высаливание, электрофокусирование.
- Протеомика — наука, изучающая совокупность белковых соединений в составе одной клетки. Для исследования используются специальные приборы, соединения, белковые микрочипы, позволяющие изучать сразу несколько молекул в клетке.
Благодаря новейшим современным методикам возможно прогрессирование науки в области исследования живых клеток и их составляющих.
Биологическое значение
Биологическое значение органических соединений объясняется множеством полезных функций. Компоненты принимают участие во всех жизненно важных процессах в организме, являются незаменимым строительным материалом, стимулируют выработку лимфоцитов, отвечающих за стойкость иммунной системы животного или человека.
При отсутствии сложных белков невозможно образование гормонов, новых клеток и регенерация тканей. Без белковых молекул в организме не осуществляется процесс дыхания, поскольку невозможен перенос кислорода и выведение углекислого газа.
Особенно важное значение имеют белки для человека, поскольку некоторые виды помогают связывать и выводить из организма токсины, вредные соединения. Длительное отсутствие в питании белка приводит к постепенному истощению и смерти организма.
Интересные факты
Некоторые интересные факты о белковых соединениях доказывают важность их в живых организмах.
Наиболее интересными считаются следующие:
- Около 50 % от сухого веса организма приходится на белки.
- Вирусы почти полностью состоят из этого компонента, некоторые на 95 %.
- Более 30 % органических веществ у человека концентрируется в мышцах.
- Клетки головного мозга состоят преимущественно из белковых молекул.
- Волосы на теле и голове человека представлены ороговевшими клетками, состоящими из белковых молекул.
- Недостаток вещества в пище отрицательно отражается на всех процессах.
- В более чем 50 % случаев аллергия на белок у человека проявляется в детском возрасте.
- Человеку одинаково необходим растительный и животный белок.
- Детям белковые соединения необходимы в больших количествах, чем взрослым.
- Яичный белок считается наиболее качественным и легко усваивается.
Белки в организме — незаменимый и необходимый ежедневно компонент, позволяющий обеспечивать здоровье и правильное функционирование клеток.
Источник: https://obrazovanie.guru/nauka/biologiya/funktsii-belka.html
§4. Свойства и функции белков
1. Как называется процесс нарушения природной структуры белка, при котором сохраняется его первичная структура? Действие каких факторов может приводить к нарушению структуры белковых молекул?
Процесс нарушения природной структуры белков под влиянием каких-либо факторов без разрушения первичной структуры называется денатурацией. Денатурация белков может быть вызвана действием различных факторов, например, высокой температуры, концентрированных кислот и щелочей, тяжёлых металлов.
2. Чем фибриллярные белки отличаются от глобулярных? Приведите примеры фибриллярных и глобулярных белков.
Молекулы фибриллярных белков имеют вытянутую, нитевидную форму. Глобулярные белки характеризуются компактной округлой формой молекул. К фибриллярным белкам относятся, например, кератин, коллаген, миозин. Глобулярными белками являются глобулины и альбумины крови, фибриноген, гемоглобин и др.
3. Назовите основные биологические функции белков, приведите соответствующие примеры.
● Структурная функция. Белки входят в состав всех клеток и межклеточного вещества, являются компонентами различных структур живых организмов. Например, у животных белок коллаген входит в состав хрящей и сухожилий, эластин – в состав связок и стенок кровеносных сосудов, кератин является важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт.
● Ферментативная (каталитическая) функция. Белки-ферменты являются биологическими катализаторами, ускоряя протекание химических реакций в живых организмах. Например, пищеварительные ферменты амилаза и мальтаза расщепляют сложные углеводы до простых, пепсин – белки до пептидов, под действием липаз происходит расщепление жиров до глицерина и карбоновых кислот.
● Транспортная функция. Многие белки способны присоединять и переносить различные вещества. Например, гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют высшие карбоновые кислоты, а глобулины – ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из неё.
● Сократительная (двигательная) функция. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Например, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения, тубулин входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
● Регуляторная функция. Некоторые белки и пептиды участвуют в регуляции различных физиологических процессов. Например, гормоны белково-пептидной природы инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) – процессы роста и физического развития.
● Сигнальная функция заключается в том, что некоторые белки, входящие в состав цитоплазматической мембраны клеток, в ответ на действие внешних факторов изменяют свою пространственную конфигурацию, тем самым обеспечивая приём сигналов из внешней среды и передачу информации в клетку. Например, белок опсин, входящий в состав пигмента родопсина, воспринимает свет и обеспечивает возникновение зрительного возбуждения рецепторов (палочек) сетчатки глаза.
● Защитная функция. Белки предохраняют организм от вторжения чужеродных объектов и от повреждений. Например, иммуноглобулины (антитела) участвуют в иммунном ответе, интерферон защищает организм от вирусной инфекции. Фибриноген, тромбопластин и тромбин обеспечивают свёртывание крови, предотвращая кровопотерю.
● Токсическая функция. Многие живые организмы выделяют белки-токсины, которые являются ядами для других организмов.
● Энергетическая функция. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии.
● Запасающая функция. Например, в семенах растений запасаются особые белки, которые используются при прорастании зародышем, а затем и проростком в качестве источника азота.
4. Что такое ферменты? Почему без их участия протекание большинства биохимических процессов в клетке было бы невозможным?
Ферменты – белки, которые выполняют функцию биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Они катализируют реакции синтеза и расщепления различных веществ. Без участия ферментов эти процессы протекали бы слишком медленно или не протекали бы вовсе. Практически все процессы жизнедеятельности организмов обусловлены ферментативными реакциями.
5. В чем заключается специфичность ферментов? Какова её причина? Почему ферменты активно функционируют лишь в определённом диапазоне температуры, рН и других факторов?
Специфичность ферментов заключается в том, что каждый фермент ускоряет только одну реакцию либо действует только на определённый тип связи. Эта особенность объясняется соответствием пространственной конфигурации активного центра фермента тому или иному субстрату (субстратам).
Ферменты являются белками. Изменение рН, температуры и других факторов может вызвать денатурацию ферментов, в результате чего они теряют способность связываться со своими субстратами.
6. Почему белки, как правило, используются в качестве источников энергии лишь в крайних случаях, когда в клетках исчерпаны запасы углеводов и жиров?
Белки – основа жизни. Они выполняют чрезвычайно важные биологические функции, многие из которых (ферментативную, транспортную, двигательную и др.) не способны выполнять ни углеводы, ни жиры. Белки, использованные в качестве энергетического субстрата, дают столько же энергии, сколько и углеводы (1 г – 17,6 кДж) и в 2,2 раза меньше, чем жиры (1 г – около 39 кДж). Кроме того, при полном расщеплении белков (в отличие от углеводов и жиров) образуются не только СО2 и Н2О, но также соединения азота и серы, причём некоторые из них токсичны для организма (например, NH3). Поэтому энергетическую функцию у живых организмов выполняют прежде всего углеводы и жиры.
7*. У многих бактерий в процессах синтеза веществ, необходимых для нормального роста и размножения, участвует парааминобензойная кислота (ПАБК). В то же время в медицине для лечения ряда бактериальных инфекций используются сульфаниламиды — вещества, по структуре сходные с ПАБК. Как вы думаете, на чём основано лечебное действие сульфаниламидов?
С помощью фермента (дигидроптероатсинтетазы) бактерии осуществляют превращение ПАБК в продукт (дигидроптероевую кислоту), который далее используется для синтеза необходимых ростовых факторов. Из-за структурного сходства с ПАБК, сульфаниламиды также способны связываться с активным центром этого фермента, блокируя его работу (т.е. наблюдается конкурентное ингибирование). Это ведёт к нарушению синтеза ростовых факторов и нуклеиновых кислот у бактерий.
* Задания, отмеченные звёздочкой, предполагают выдвижение учащимися различных гипотез. Поэтому при выставлении отметки учителю следует ориентироваться не только на ответ, приведённый здесь, а принимать во внимание каждую гипотезу, оценивая биологическое мышление учащихся, логику их рассуждений, оригинальность идей и т. д. После этого целесообразно ознакомить учащихся с приведённым ответом.
Дашков М.Л.
Сайт: dashkov.by
Вернуться к оглавлению
| < Предыдущая | Следующая > |
|---|
Свойства и функции белков.
Белки — это такие высокомолекулярные органические соединения, состоящие из аминокислот, включающих в себя атомы водорода, углерода, кислорода, азота, серы, железа, фосфора, йода. Основу структуры организма составляет большое разнообразие белков, которые обеспечивают выполнение множества функций. В состав человеческого организма, как правило, входит 20 различных аминокислот.
Белки имеют многообразные функции. Одной из важнейших является строительная функция. Они участвуют в образовании органоидов клетки и клеточных мембран, а также различных внеклеточных структур. Большое значение имеет ферментативная роль белков. Например, такие ферменты как пепсин, трипсин, липазы, пептидазы, амилазы, принимают участие в пищеварительном процессе. Специальными сократительными белками, находящимися в миофибриллах, обеспечивается двигательная функция. Транспортная функция переносит, к примеру, гемоглобин кислорода. Защитная функция обеспечивается выработкой особых белков — гамма-глобулинов, являющихся антителами. Белки также выполняют рецептивную функцию. Гормоны в клетках органов-мишеней взаимодействуют с рецепторами-белками, в связи с чем обеспечивается влияние гормонов процесс обмена веществ. За высокомолекулярными органическими соединениями закреплена и энергетическая функция: при расщеплении 1 г белка образуется 17,6 кДж энергии.
Белки в организме человека
При попадании белков в организм они распадаются на отдельные пептиды с вероятным высвобождением отдельных аминокислот. Аминокислоты, в свою очередь, попадая в кровяной поток, переносятся в клетки, где начинается синтез тканей и образуется формирование пептидных структур. В процессе расщепления соединений образуются азотистые продукты распада, которые выделяются с потом, мочой и фекалиями: мочевая кислота, мочевина и аммиак. Преимущественно в печени аммиак превращается в мочевину, которая выводится в дальнейшем с помощью почек. Аммиак очень токсичен для организма, поэтому преобразование его в мочевину, которая является безопасной, очень важно для организма. Поступая в кровь из тканей мочевая кислота, является продуктом распада различных нуклеиновых кислот. К таким продуктам распада относят креатинин и креатин, выделяющиеся с мочой. Также в процессе распада образуется азот. Количество выделяемого азота говорит о недостаточном либо достаточном поступлении в человеческий организм белка. Поэтому, в особенности спортивное питание цены на которое сравнимы со стоимостью обычного питания должны включать ингредиенты содержащие белок. Рассчитано, что при человеческом весе в 70 кг потери азота организмом составляют примерно 2—5 г, что соответствует 13—30 г белка.
С современной точки спортивное питание цены на которое невелики, можно сделать вывод, что любому спортсмену белок просто необходим. Прием белковой пищи желательно осуществлять равномерно в течение дня.
№AN28TP, Общий белок для хорьков: показатели, норма
ОПИСАНИЕ
Белки плазмы крови оказывают коллоидное осмотическое давление, участвуют в иммунных, воспалительных реакциях и в процессе свертывания крови, помогают в поддержании кислотно-щелочного баланса, а также выполняют регуляторную, двигательную, защитную, питательную и другие функции. Некоторые белки служат в качестве ферментов, антител, факторов свертывания, гормонов, белков острой фазы, транспортных веществ. Основным местом синтеза белков плазмы является печень. Также местом их образования является иммунная система.
В биохимических исследованиях используют сыворотку крови и плазму. Сыворотка содержит все белки плазмы, кроме фибриногена, V и VIII факторов свертывания, которые потребляются в процессе образования тромба. Различия между концентрацией белков сыворотки и плазмы, как правило, клинически незначимы, и составляют примерно 5% от белков плазмы.
Концентрация общего белка определяется содержанием альбуминов и глобулинов в крови. У домашних животных альбумин составляет от 35 до 50% от общей концентрации белка в сыворотке. Альбумин синтезируется в печени и регулируется интерлейкином 1 (IL-1) и другими цитокинами.
Существует прямая корреляция между обновлением альбумина и размером тела животного. Период полувыведения альбумина у собак составляет 8 дней, у лошадей ‒ 19 дней. В результате высокой концентрации и небольшого размера молекул альбумин на 75–80% определяет коллоидно-осмотическое давление плазмы. Многие компоненты плазмы транспортируются альбумином, и изменение его концентрации влияет на общее количество этих циркулирующих компонентов. Альбумин подавляет процесс агрегации тромбоцитов и усиливает активность антитромбина III. Поэтому значительное снижение концентрации альбумина в плазме может вызвать протромботические нарушения. Синтез альбумина уменьшается во время ответной реакции острой фазы.
Глобулины с помощью электрофореза разделяются на α-, β- и γ-глобулины.
Большинство α- и β-глобулинов синтезируются в печени. Липопротеины и белки острой фазы воспаления являются α- и β-глобулинами. Иммуноглобулины (γ-глобулины) секретируются В-лимфоцитами и плазматическими клетками во многих тканях, в частности, в лимфоидных органах.
Значение соотношения альбумина к глобулину (А/Г) используется при интерпретации результатов исследования общего белка. Это соотношение будет оставаться в пределах нормальных значений, если обе фракции изменяются равномерно (например, при потере как альбумина, так и глобулина в результате кровотечения, повышение концентрации альбумина и глобулина в результате обезвоживания). Снижение А/Г соотношения возникает при почечной протеинурии и/или усилении продукции иммуноглобулинов вследствие антигенной стимуляции. Увеличение А/Г соотношения возникает при подавлении синтеза иммуноглобулинов у взрослых или при недостаточном поступлении молозива у жеребят и телят.
ПРЕАНАЛИТИКА
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 3 дня при температуре хранения +2°С…+8°С; сохраняет стабильность 6 месяцев при замораживании -17С…-23С.
Гемолиз может повлиять на результаты исследования. Липемия и билирубинемия могут приводить к ложному увеличению концентрации общего белка. Значение содержания общего белка в крови увеличивается при высокой концентрации глюкозы, мочевины, натрия и хлорида в результате завышения показателя преломления (рефрактометрия).
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения в лабораторииVET UNION: г/л.
Референсные значения:
Собаки: 0–6 мес. ‒ 34–52 г/л; 6–12 мес. — 49–67 г/л; старше одного года — 54–77 г/л.
Кошки: 0–6 мес. — 38–65 г/л; 6–12 мес. — 33–75 г/л; старше одного года — 57–79 г/л.
Лошади: 55–73 г/л.
КРС: 59–82 г/л.
МРС: 60–79 г/л.
Хорьки: 51–74 г/л — альбиносы; 53–72 г/л ‒ темные.
Кролик:54–75 г/л.
Крыса:56–76 г/л.
Морская свинка:46–62 г/л.
Мышь: 35–72 г/л.
Песчанка: 43–125 г/л.
Хомяк:52–70 г/л.
Шиншилла: 38–56 г/л.
Тукан: 30–50 г/л.
Тигр:37–87 г/л.
Леопард: 49–95 г/л.
У млекопитающих и птиц наблюдаются изменения концентрации белков крови в зависимости от возраста. При рождении у млекопитающих выявляется низкая концентрации белков в крови, увеличение происходит до уровня взрослых животных в течение от шести месяцев до одного года. С возрастом концентрация альбумина немного уменьшается, в то время как уровень глобулинов, в частности, иммуноглобулинов и белков острой фазы, постепенно увеличивается. Эти изменения следует учитывать при интерпретации результатов исследования.
Общая концентрация сывороточного белка и содержание глобулинов в крови млекопитающих имеют тенденцию к снижению в течение последней трети беременности. Концентрации общего белка и альбумина в крови уменьшаются в период лактации.
Повышение уровня:
- Гемоконцентрация (дегидратация).
-
Воспалительный процесс (инфекционной, неинфекционной этиологии). -
Лимфоидный лейкоз (например, В-клеточная лимфома). -
Множественная миелома.
Понижение уровня:
Гемодилюция:
- Гиперволемия.
- Хроническая сердечная недостаточность.
- Нефротический синдром.
- Цирроз печени.
- Синдром неадекватной секреции антидиуретического гормона (СНАСАГ, синдром Пархона).
Потеря белка из сосудистого русла:
- Потеря крови.
- Энтеропатия с потерей белка.
- Нефропатия с потерей белка.
- Экссудативные формы заболевания кожи.
Недостаточный синтез белка или увеличение катаболизма белка:
- Голодание или кахексия.
- Нарушение переваривания пищи или мальабсорбция.
- Печеночная недостаточность.
- Нарушение пассивного транспорта.
- Снижение иммуноглобулинов.
ФУНКЦИИ БЕЛКОВ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.Ф.
Белки
выполняют множество самых разнообразных функций, характерных для живых
организмов, с некоторыми из которых мы познакомимся более подробно при
дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле
уникальные биологические функции белков, несвойственные или лишь частично
присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов.
Большинство известных в настоящее время ферментов, называемых
биологическими катализаторами, является белками. Эта функция белков, хотя и не
оказалась уникальной, определяет скорость химических реакций в биологических
системах.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода,
осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов
принимают участие альбумины сыворотки крови. Ряд других сывороточных белков
образует комплексы с жирами, медью, железом, тироксином, витамином А и другими
соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная
система, которая обеспечивает синтез специфических защитных белков-антител в
ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных
белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными
веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации
биологического действия антигенов. Защитная функция белков проявляется и в
способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В
результате свертывания фибриногена образуется сгусток крови, предохраняющий от
потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует
множество белковых веществ. Однако главную роль в этих жизненно важных
процессах играют актин и миозин – специфические белки мышечной ткани.
Сократительная функция присуща не только мышечным белкам, но и белкам
цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток
(расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают
по количеству первое место среди других белков тела человека. Среди них
важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной
ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др.
Большое значение имеют комплексы белков с углеводами в формировании ряда
секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с
фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными
механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не
только в железах внутренней секреции, но и во многих других клетках организма
(см. далее). Ряд гормонов представлен белками или полипептидами, например
гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются
производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки,
являющиеся источниками питания для плода, например белки яйца (овальбумины).
Основной белок молока (казеин) также выполняет главным образом питательную
функцию. Ряд других белков используется в организме в качестве источника
аминокислот, которые в свою очередь являются предшественниками биологически
активных веществ, регулирующих процессы метаболизма.
Можно назвать
еще некоторые другие жизненно важные функции белков. Это, в частности,
экспрессия генетической информации, генерирование и передача нервных импульсов,
способность поддерживать онкотическое давление в
клетках и крови, буферные свойства, поддерживающие физиологическое значение рН
внутренней среды, и др.
Таким
образом, из этого далеко не полного перечня основных функций белков видно, что
указанным биополимерам принадлежит исключительная и разносторонняя роль в живом
организме. Если попытаться выделить главное, решающее свойство, которое
обеспечивает многогранность биологических функций белков, то следовало бы
назвать способность белков строго избирательно, специфически соединяться с
широким кругом разнообразных веществ. В частности, эта высокая специфичность
белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител
с антигенами, транспортных белков крови с переносимыми молекулами других
веществ и т.д. Это взаимодействие основано на принципе биоспецифического
узнавания, завершающегося связыванием фермента с соответствующей молекулой
субстрата, что содействует протеканию химической реакции. Высокой
специфичностью действия наделены также белки, которые участвуют в таких
процессах, как дифференцировка и деление клеток, развитие живых организмов,
определяя их биологическую индивидуальность.
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ
Motor Proteins — обзор
1 Введение
Motor белки управляют активным АТФ-зависимым движением органелл вдоль филаментов цитоскелета, процессом, который необходим для гомеостаза белков, секреции и многих других жизненно важных клеточных функций (Barlan, Rossow, & Гельфанд, 2013; Вале, 2003). Двигатели динеина и кинезина транспортируют мембранные органеллы, а также другие грузы на большие расстояния по микротрубочкам (MT). Множественные моторы в комплексе с моторно-ассоциированными регуляторными белками обычно составляют механизм, который транспортирует одну органеллу (Gross, Vershinin, & Shubeita, 2007; Mallik & Gross, 2004).Эмерджентное поведение этих мультимоторных комплексов плохо изучено и не может быть обязательно выведено из свойств одномоторных белков (Mallik, Rai, Barak, Rai, & Kunwar, 2013; Rai, Rai, Ramaiya, Jha, & Mallik, 2013). .
Ряд белков, таких как динактин, Lis1, дополнительные белки кинезина, миро-милтон, JIP и т. Д., Взаимодействуют с моторами MT, чтобы регулировать их движение (Verhey & Hammond, 2009; Vallee, McKenney, & Ori-McKenney, 2012). Этот регламент контролирует многие моторные свойства, такие как скорость АТФазы, сродство к грузу или нити, генерирование силы, геометрическое расположение моторов на грузе, а также другие свойства.Совокупность этой регуляции проявляется в движении органелл внутри клеток, которое легко наблюдать. Однако интерпретация этого движения часто затруднена, потому что: (1) микроархитектура плотной цитоскелетной сети неизвестна и, вероятно, модулирует движение непредсказуемым образом, (2) дополнительные белковые факторы помимо моторов и их партнеров по связыванию могут влиять на движение (например, , МТ-связывающие белки). Кроме того, вмешательство РНКи или доминантно-негативных конструкций в функции специфических моторов / мотор-ассоциированных белков in vivo может привести к неизвестным плейотропным эффектам.
Для решения некоторых из этих проблем были приняты редукционистские подходы in vitro , в которых очищенные двигатели покрывают искусственными пластиковыми шариками, которые затем перемещаются как груз по одиночным филаментам цитоскелета, прикрепленным к покровному стеклу. Такие анализы выявили основные параметры одномоторной функции, такие как процессивность, скорость, сила, размер шага и корреляции силы и скорости (Маллик, Картер, Лекс, Кинг и Гросс, 2004; Райс, Перселл и Спудич, 2003). ; Свобода, Шмидт, Шнапп и Блок, 1993).Однако искусственное прикрепление моторного груза в этих анализах предотвращает прямую экстраполяцию этих результатов на транспорт in vivo . Альтернативный подход заключается в использовании двигательной подвижности органелл в клеточных экстрактах, что позволяет исследовать эндогенные двигательные комплексы на нативных мембранах. Подвижность органелл воспроизводится в клеточном экстракте нейрональных пузырьков (Brady, Lasek, & Allen, 1982; Vale, Schnapp, Reese, & Sheetz, 1985), эндосомах (Murray, Bananis, & Wolkoff, 2000), пигментных гранулах (Rogers, Tint, Fanapour, & Gelfand, 1997), органеллы пыльцевых трубок (Romagnoli, Cai, & Cresti, 2003), комплексы мРНП (Sladewski, Bookwalter, Hong, & Trybus, 2013), вирусные частицы (Lee, Murray, Wolkoff, & Wilson , 2006) и липидных капельках (LDs; Barak, Rai, Rai, & Mallik, 2013; Bartsch, Longoria, Florin, & Shubeita, 2013).Сниженная сложность этих анализов (по сравнению с транспортом in vivo ) дает возможность задавать вопросы, которые в противном случае были бы невозможны внутри клеток. Например, лекарства, антитела или пептиды, которые ингибируют определенный мотор, могут быть добавлены для идентификации мотора, участвующего в транспортной функции, и исследования последствий его ингибирования (Barak et al., 2013). После того, как мотор идентифицирован, эксперименты с использованием очищенных органелл и антител против моторов могут быть использованы для идентификации взаимодействующих с моторами регуляторных белков.Чтобы выяснить, как эти белки регулируют моторы, в анализ транспорта органелл можно добавить пептид, блокирующий функцию, который имитирует домен связывания мотора регулятора. Кроме того, чтобы исследовать связи между метаболизмом и двигательной активностью, органеллы могут быть изолированы от животных, подверженных определенным метаболическим условиям, а их подвижность исследована и сравнена (Barak et al., 2013). И последнее, но не менее важное: количественные измерения силы двигателей на органеллах с помощью оптического улавливания теперь возможны в клеточном экстракте (Barak et al., 2013). Это позволяет контролировать биофизические свойства моторов при почти клеточной сложности на поверхности органелл.
Анализы клеточного экстракта
не заменяют изучение подвижности in vivo , а, скорее, являются мощным помощником и способом повышения сложности внутриклеточного транспорта (Mallik et al., 2013). Однако есть проблемы. Цитозольные факторы, важные для транспорта, могут растворяться / инактивироваться в клеточном экстракте, а ионные концентрации также могут быть разными.Следовательно, необходимо предпринять усилия, чтобы проверить, что подвижность органеллы в клеточном экстракте аналогична ее подвижности in vivo (по крайней мере, в первом приближении). Здесь мы представляем методы восстановления подвижности фагосом латексных шариков (LBP) в экстрактах клеток Dictyostelium и LD, очищенных из печени крыс. Мы использовали эти анализы для решения таких вопросов, как механическое соревнование (перетягивание каната) между противостоящими двигателями (Soppina, Rai, & Mallik, 2009; Soppina, Rai, Ramaiya, Barak, & Mallik, 2009), переход от одиночного — молекулы к коллективной моторной функции (Rai et al., 2013; Соппина, Рай и Маллик, 2009 г .; Soppina, Rai, Ramaiya, et al., 2009) и возможную роль моторов в поддержании гомеостаза липидов в печени (Barak et al., 2013).
Что такое моторные белки актина?
Клетки используют только полимеризацию актина для создания некоторых типов движения, но многие другие формы движения требуют взаимодействия между актином и ферментом, называемым миозином.
Кредит: extender_01 / Shutterstock.com
Белки актина собраны в сеть нитей, называемую актиновым цитоскелетом, которая обеспечивает платформу треков, по которым может ползать миозин.Некоторые миозины связываются с другими белками и переносят их внутри клеток или между клетками с помощью актиновых нитей.
Миозин — это моторный белок актина, где миозин служит двигателем, филаменты актина обеспечивают дорожки, по которым миозин может двигаться, а источником энергии, подпитывающим движение, является аденозинтрифосфат (АТФ).
Структура миозина
Члены семейств миозина имеют отчетливую консервативную последовательность аминокислот, которая служит АТФ-связывающим «моторным доменом» молекулы, которая производит силу и придает специфическую функцию различным моторным белкам.Различные семейства миозина состоят из разных членов, которые выполняют разные клеточные функции.
Определенные миозины необходимы для сокращения мышц. Когда миозин движется по актиновым филаментам, он преобразует химическую энергию (посредством гидролиза АТФ) в механическую силу. Это приводит к укорачиванию структур внутри мышечных волокон, называемых саркомерами, основных функциональных единиц мышечного сокращения, так что достигается движение.
Члены семейства миозинов
За последние годы геномный анализ идентифицировал многих членов большого семейства генов миозина.Наиболее распространенными белками миозина являются миозин I и миозин II, которые присутствуют почти во всех эукариотических клетках. Миозин II отвечает за создание сократительной силы при сокращении скелетных мышц и, возможно, является наиболее изученным из белков. Миозин I и менее распространенный миозин V играют роль во взаимодействиях, происходящих между клеточной мембраной и цитоскелетом, таких как транспорт мембранных пузырьков.
Все миозины обычно состоят из одной или двух тяжелых цепей и по крайней мере четырех легких цепей.Тяжелые цепи организованы в три разных домена с разными структурами и функциями. В глобулярном «головном» домене есть сайты, которые связывают актин и АТФ для производства механической силы. Α-спиральная «шейная» область находится рядом с головным доменом и связана с легкими цепями, которые модулируют активность головного домена. Белки миозина также имеют хвостовой домен, в котором расположены сайты связывания, которые определяют специфическую активность миозина.
Cross Bridge Cycle Играть
Заболевания, вызванные мутациями миозина
Мутации в генах, кодирующих миозины, связанные с сокращением скелетных мышц, могут привести к серьезным нарушениям скелетных мышц или сердечной мышцы.Проблемы, вызванные аномалией сердечной мышцы, могут привести к сердечной недостаточности и смерти. Некоторые миозины расположены в структурах внутреннего уха, называемых стереоцилиями, и мутации, которые приводят к аномалии этих миозинов, могут привести к потере слуха.
Дополнительная литература
Моторные белки цитоскелета эукариот
Подвижность — признак жизни. Даже клетки, неспособные к
активное движение в своей среде выполняет существенные
внутриклеточные процессы моторики.Появился ряд механизмов.
для создания механических сил, необходимых для приведения в действие биологических
моторика. Особенно успешный и повсеместный механизм
производство биологической силы использует механохимические ферменты, или
«Моторные белки». Эти ферменты преобразуют химическую энергию,
обычно в форме аденозинтрифосфата (АТФ), в механический
сила.
Многие движения, как клеточные, так и субклеточные, эукариотических
клетки генерируются активностью моторных белков, которые воздействуют на
жесткие цитоскелетные волокна.Три надсемейства цитоскелетного мотора
белки были признаны. Двигатели суперсемейства миозинов действуют
на актиновых филаментах для генерации сокращений клеточной поверхности и других
морфологические изменения, подвижность везикул, поток цитоплазмы и
сокращение мышечных клеток. Члены динеина и кинезина
моторные суперсемейства на основе микротрубочек перемещают пузырьки и органеллы
внутри клеток, вызывают биение жгутиков и ресничек и действуют внутри
митотические и мейотические веретена для разделения реплицированных хромосом на
клетки-потомки.Члены каждого моторного суперсемейства могут быть распознаны по
наличие уникальной и консервативной аминокислотной последовательности, которая образует
АТФ-связывающий и производящий силу домен молекулы. Эти
консервативные «моторные домены» связаны с разнообразным набором
полипептидные последовательности, которые предположительно придают функциональную специфичность
различные моторы. Каждое из этих суперсемейств заполнено
многочисленные отдельные члены, которые выполняют разные клеточные роли. В
В последние годы молекулярно-генетические методы открыли новые двигательные
белки быстрее, чем наша способность определять их функции.Выступления на этой сессии German-American Frontiers of Science
на встрече обсуждались клеточные роли некоторых из этих моторных
белки.
Митотические двигатели дрожжей
Saccharomyces
cerevisiae .
Расщепление реплицированных хромосом в
эукариотические клетки выполняются митотическим веретеном,
Органелла, производящая силу, основанная на микротрубочках. Для митотического деления
Клетки S. cerevisiae (почкующиеся дрожжи), единственная важная роль
микротрубочек, по-видимому, выполняет функцию веретена.Не удивительно,
все, кроме одного, из семи моторов на основе микротрубочек (один динеин и шесть
kinesin-related), кодируемые геномом S. cerevisiae , имеют
связаны с функцией шпинделя (Таблица
1). Исключение, Smy1p,
играет несущественную роль в росте поляризованных клеток (1, 2). Из-за
функциональное перекрытие или резервирование, ни один из этих семи двигателей не
индивидуально важно для жизнеспособности клеток. В этом простом организме
каждое существенное движение шпинделя выполняется более чем одним
мотор.
Таблица 1
Экспериментально определенные роли для S.
cerevisiae
моторы на основе микротрубочек
Митотическое веретено представляет собой биполярную структуру, состоящую из двух
полушпиндели, которые обращены друг к другу своими микротрубочками
перепутать. Сборка биполярного шпинделя требует действий
кинезин-родственные белки семейства BimC (3, 4). Два двигателя BimC
в S. cerevisiae , Cin8p и Kip1p также производят внешне
направленная сила, действующая на полюса шпинделя, вызывающая удлинение
шпинделя в анафазе.Во время сборки биполярного шпинделя
стадии до анафазы, эта внешняя сила, производная от BimC, уравновешивается
направленной внутрь силой, действующей на полюса. Внутренняя сила
частично продуцируется кинезином Kar3p в S.
cerevisiae и родственными моторами у других эукариот (5-8).
Следовательно, сборка биполярного шпинделя осуществляется двигателями.
которые противодействуют друг другу, применяя силу в разных направлениях
(9).
Во время митоза веретена специфически расположены внутри эукариотических клеток.
клетки за счет подвижных процессов.Правильное позиционирование шпинделя часто бывает
необходим для процессов деления и дифференцировки клеток. В
асимметричное деление клеток, характерное для почкующихся дрожжей, требует, чтобы
шпиндель должен быть расположен и правильно ориентирован на шейке, разделяющей
тела материнских и почек. Четыре из семи S.
cerevisiae , основанные на микротрубочках, участвовали в этом
процесс (таблица 1; ссылки 10 и 11). Интересно, что антагонистический
взаимосвязь между двигательной активностью важна для
позиционирование шпинделя, а также для сборки шпинделя.в
отсутствие динеинового двигателя, позиционирование шпинделя
Kip3p и Kar3p противостоят действиям Kip2p, двигателя
обычно требуется для правильного позиционирования шпинделя
(10).
Роль динеина в сборке митотических веретен.
шпиндель
биполярность необходима для разделения дублированного набора
хромосом на две клетки-потомки. Один из фундаментальных вопросов
в сборке митотических веретен — вот как два полюса веретена
сформирован.У некоторых веретен эти полюса состоят из двух центросом.
(клетки животных) или тела полюса веретена (клетки грибов), которые определяют
два конца веретена зарождаются и регулируют микротрубочки веретена.
Однако в других веретенах полюса, кажется, образуют de novo .
без видимого направления центросомы или родственной структуры
(12). Сборку полюсов de novo можно изучить в
концентрированные экстракты яиц Xenopus , где после
добавление хроматина, полюса собираются микротрубочкой на основе
моторизованный процесс.Похоже, что полюса образуются путем сортировки
случайным образом зародышевые микротрубочки образуют биполярную структуру (13). Этот
Процесс требует активности цитоплазматического двигателя динеина.
Микротрубочки обладают структурной полярностью с отрицательными концами, связанными
с полюсами шпинделей. Цитоплазматические двигатели динеина движутся к
минусовые или полярные концы микротрубочек. Похоже, что ряд
динеины, сгруппированные вместе, возможно, на мембранном пузырьке, могут собираться
микротрубочки объединяются в два полюса с однородной полярностью микротрубочек.Способность моторов сортировать микротрубочки в полярные структуры является одним из важнейших факторов.
интересный пример самоорганизации в биологии.
Миозины в движении.
За последние годы количество выявленных
членов суперсемейства миозинов экспоненциально увеличивалось. Оно стало
Понятно, что практически все эукариотические клетки, а не только мышечные клетки,
экспрессируют множество различных молекул миозина (14). Миозины
разделяют консервативный моторный домен, который состоит из отдельных головы и шеи
регионы.Головная область содержит сайты связывания АТФ и актина и
проявляет актин-активируемую АТФазную активность. Область шеи состоит из
расширенная α-спираль переменной длины, связывающая от одного до шести
легкие полипептидные цепи кальмодулина или
белки, связанные с кальмодулином. Эта область шеи предлагается
служить рычагом для создания силы (15). Физиологический
модификация легких цепей (т.е. путем фосфорилирования) способствует
к регуляции двигательной функции. Во время механохимического цикла
миозин, отвечающий за сокращение мышц, не двигается
процессивно вдоль актиновой нити.Вместо этого он держится только на
короткий период, а затем проводит значительное время в отрыве от
нить (16). Следовательно, для достижения непрерывного движения по актину
филаментов, требуется высокая плотность миозиновых моторов. Соответственно,
мышечный миозин самособирается в нити. Множество новеньких
открытые молекулы миозина, как полагают, не образуют филаментов, и
механохимические свойства большинства из них еще предстоит изучить. В
Помимо моторного домена, различные молекулы миозина содержат
различные хвостовые домены, которые, как предполагается, определяют функцию, возможно
путем определения цели генерации силы.Эти хвостовые домены
часто содержат мотивы аминокислотной последовательности, которые также встречаются в
другие белки (17). Выяснение целей, к которым
связывание различных миозинов представляет собой важную проблему для
будущее. Хвостовой домен миозина, идентифицированного из ткани крысы, myr5,
служит для отрицательной регуляции передачи сигнала малым
Связанный с Ras G-белок Rho (18). Ро регулирует организацию
актиновый цитоскелет и различные другие клеточные процессы (19, 20). Этот
открытие предполагает захватывающую возможность того, что инициация и поток
информации может быть связано с направленным производством силы вдоль
актиновые филаменты.
Сноски
↵ † Кому следует обращаться с запросами на перепечатку: Department
биологии, Мадд Холл, Университет Джона Хопкинса, 3400 Северный Чарльз
Street, Baltimore, MD 21218. Эл. Почта: hoyt {at} jhu.edu.Этот документ представляет собой резюме сессии, представленной на третьем
ежегодный немецко-американский симпозиум «Границы науки», июнь
20–22, 1997 г. в Kardinal Wendel Haus в Мюнхене, Германия.Симпозиумы Frontiers of Science
последний из серии «От
Академия », которая представлена
изредка выделять работу
Академия, включая науку
основные отчеты Национального
Исследовательский совет.
- Copyright © 1997, Национальная академия наук США
Толкать или тянуть? Команды моторных белков имеют это в обоих направлениях
Моторные белки используют энергию, полученную в результате гидролиза АТФ, для однонаправленного движения по микротрубочкам и актиновым филаментам.Они играют в клетке многофункциональные роли, будучи непосредственно вовлечены в процессы транспорта, подвижности клеток, а также в организацию и поддержание структур цитоскелета. Во время митоза правильное расположение хромосом перед делением клетки включает движение как к полюсам веретена, так и от них, что, как считается, опосредуется как положительно, так и отрицательно направленными моторами микротрубочек. В нейронах везикулы транспортируются по микротрубочкам аксонов как к кончику аксона, так и от него, переносятся двигателями противоположной полярности.Учитывая функциональную важность встречного движения, вопрос о том, что определяет направленность мотора, стал актуальным (1). Наиболее эффективно он был решен путем сравнения двух молекул из семейства кинезинов, которые движутся в противоположных направлениях. Обычный кинезин и Ncd имеют сходные димерные структуры, состоящие из стебля в виде спиральной спирали, прикрепленного к паре моторных доменов, которые очень гомологичны между двумя видами. Тем не менее, кинезин движется к плюсовому концу микротрубочки, тогда как Ncd является минус-направленным двигателем.Установление того, что заставляет эти две молекулы двигаться в разных направлениях, может пролить свет на то, как работают моторные белки.
Если несколько двигателей работают в одном направлении, они увеличивают вероятность присоединения их товарищей по команде.
Первый интригующий результат был получен при использовании химеры, состоящей из моторного домена Ncd, слитого с областью кинезинового стебля ( 2, 3). В отличие от кинезина, Ncd непроцессивен; отдельная молекула не способна отслеживать микротрубочку.Итак, чтобы проверить двигательную направленность, был использован анализ скользящей подвижности. Двигатели были адсорбированы на поверхности с плотностью, достаточной для того, чтобы десятки молекул могли взаимодействовать с одной микротрубочкой. Наблюдая за движением микротрубочек с концевыми метками под микроскопом, было обнаружено, что химера продвигает их по поверхности в направлении, противоположном нативному белку Ncd. Ясно, что двигательная сфера не является единственным определяющим фактором направленности. Еще более поразительный результат был недавно получен Endow и Higuchi (4), которые создали мутант Ncd с одной аминокислотной заменой в области шеи, которая соединяет моторный домен со стеблем.В тесте скольжения мутант двигал микротрубочки в обоих направлениях. Обычно отдельная микротрубочка перемещалась на несколько микрометров своим положительным концом, затем резко меняла направление и проходила такое же расстояние в противоположном смысле. Скорость была примерно одинаковой в каждом направлении, и развороты происходили совершенно случайно. Все очень любопытно!
В этом выпуске PNAS Badoual et al. (5) представляет теоретическую модель, которая предполагает, что направленность в анализе скольжения является коллективным свойством и не может быть полностью сведена к характеристикам отдельной двигательной молекулы.Они приписывают способность мутантного Ncd толкать микротрубочки в обоих направлениях нестабильность коллективной динамики, которая возникает, когда многие двигатели работают вместе.
Можно использовать два разных подхода к моделированию динамики молекулярных моторов. Одна из возможностей — создать модель на основе известной структуры и биохимии конкретного моторного белка. Этот подход оказался продуктивным для актомиозина, где модель качающегося рычага может учитывать многие особенности сокращения мышц (6-8).В качестве альтернативы, если цель состоит в том, чтобы определить общие типы поведения, которые могут проявлять двигательные системы, более подходящим будет менее конкретный формализм. Badoual et al. (5) выберите второй маршрут.
Моторные белки обладают двумя основными характеристиками: они взаимодействуют с филаментами цитоскелета; и это взаимодействие модулируется по мере протекания реакции гидролиза, катализируемой моторным доменом. Их работу можно описать, по сути, с помощью упрощенной модели с двумя состояниями, называемой «изотермическим храповым механизмом» (9, 10) (изотермический, потому что молекулярные двигатели работают при фиксированной температуре, в отличие от двигателей внутреннего сгорания, с которыми мы знакомы). .Как показано на рис. 1 и , считается, что двигатель совершает стохастические переходы между состоянием изобилия и состоянием отсоединения, которые соответствуют двум различным состояниям нуклеотидов. Считается, что в связанном состоянии двигатель испытывает потенциал взаимодействия с филаментом, который зависит от положения, а не считается зафиксированным на сайте связывания. Поскольку филаменты цитоскелета являются полярными полимерами, этот потенциал, как правило, будет периодическим, но асимметричным.
Рисунок 1
Упрощенная изотермическая трещоточная модель моторного белка, рассмотренная Badoual et al. Двигатель выполняет стохастические переходы между связанным и отсоединенным состояниями с фиксированной скоростью. Потенциалы взаимодействия с нитью — разные для каждого состояния — указаны ниже. Присоединение может произойти в любом месте, но отсоединение разрешено только тогда, когда двигатель находится вблизи минимального потенциала. ( a ) Отдельный процессивный двигатель может нести груз в одном направлении вдоль полярной филамента цитоскелета. Только что отсоединившийся двигатель будет находиться в месте потенциального минимума, как показано.Свободная диффузия перенесет его за потенциальный пик вправо с большей вероятностью, чем за более удаленный пик слева. Следовательно, при повторном соединении он с большей вероятностью сместится к потенциальному минимуму вправо (как показано), чем к минимуму влево. Таким образом, общее движение в среднем направлено вправо. ( b ) Группа двигателей может управлять неполярной нитью накала как вперед, так и назад. Предположим, что нить движется вправо. Затем из-за отсоединения двигателей, которые недавно прошли через потенциальную яму, на левом склоне потенциала больше связанных двигателей, чем на правом склоне (как показано).Двигаясь вниз по склону, эти двигатели создают силу, поддерживающую движение вправо. Эквивалентный аргумент показывает, что нить с таким же успехом можно повернуть влево.
Если бы эта система находилась в химическом равновесии, соотношения локальных скоростей связывания и отщепления были бы фиксированы по принципу детального баланса, и можно доказать, что в этом случае нет чистого движения (9). Как и следовало ожидать из законов термодинамики, движение нельзя получить бесплатно.Но в клетке реакция гидролиза АТФ находится в неравновесном состоянии. Реакция, происходящая в нуклеотидном сайте, может, например, стимулировать отслоение мотора, когда он находится в определенном месте филамента. Как показано на рис. 1 и , двигатель затем продвигается в одном направлении по нити накала, хотя и неуверенно. Похоже, что некоторые одноголовые кинезины, такие как KIF1A, действительно действуют таким образом (11). Большинство процессных двигателей, таких как обычный кинезин, по-видимому, спроектированы более эффективно, и они двигаются менее стохастично (12).Их движение можно описать небольшим изменением модели с использованием двух потенциалов с минимумами в разных местах (9).
Что происходит, когда много двигателей работают вместе? Тот факт, что могут возникать новые явления — что «больше — это другое» — легче всего проиллюстрировать на гипотетическом случае неполярной нити. В этой ситуации отдельный двигатель не может двигаться по направлению. Но, как показано на рис. 1 b , несколько двигателей могут перемещать нить накала в любом направлении.Если несколько двигателей работают в одном направлении, они увеличивают вероятность того, что их товарищи по команде присоединятся и потянут в одном направлении. Однако это происходит только выше критической концентрации АТФ, для которой скорость стимулированного отслоения достаточно высока. Ситуация аналогична фазовым переходам в физике конденсированного состояния. Например, при ферромагнитном переходе кооперативные взаимодействия, превышающие критический уровень, заставляют множество спинов указывать в одном направлении. Действительно, общие математические свойства в критической точке тесно связаны в обеих системах.Но есть и существенные различия; Команда двигателей — это неравновесная система, управляемая химической кинетикой, в отличие от равновесной системы, которая регулируется температурой.
Впервые предсказание двунаправленности было сделано Юлихером и Простом 7 лет назад (13). Они изучили случай с бесконечным количеством двигателей. Badoual et al. (5) распространяет этот анализ на ситуацию, когда только несколько двигателей взаимодействуют с нитью накала — экспериментально значимый случай.Они предполагают, что мутация в шейке Ncd модифицирует эффективный потенциал взаимодействия мотора с микротрубочкой, так что она почти симметрична (несмотря на полярность микротрубочек). Тогда, согласно их модели, отдельный двигатель не будет иметь общего смещения при взаимодействии с микротрубочкой; но в скользящем анализе команда мутантов Ncd могла двигать микротрубочки в любом направлении. Однако нить накала не будет двигаться в одну сторону в течение неопределенного периода времени. Стохастические колебания количества толкающих и тянущих двигателей в конечном итоге вызовут резкий переход к альтернативному стационарному решению.Одно легко проверяемое предсказание модели состоит в том, что частота переключения должна сильно зависеть от количества двигателей, взаимодействующих с микротрубочкой; длинные микротрубочки должны менять направление гораздо реже, чем более короткие. Второе предсказание состоит в том, что двунаправленность должна исчезнуть, если концентрация АТФ снижается ниже критического значения, и что соотношение силы и скорости, измеренное в этой критической точке, должно демонстрировать характерное нелинейное поведение.
Самопроизвольное двунаправленное движение подразумевает наличие области гистерезиса на кривой сила-скорость.Этот вывод приводит к важному выводу: если нить накала соединена с упругим элементом, она должна колебаться, поскольку двигатели перемещают ее сначала вперед, а затем назад (14). Было бы интересно попытаться обнаружить такие колебания в тесте скольжения, например, удерживая микротрубочку гибкой микроиглой. Колебания происходят в ряде естественных систем моторных белков. Вибрация мускулов полета насекомых слишком высока, чтобы ими можно было управлять с помощью нервных импульсов от цикла к циклу, и считается, что она вызвана динамической нестабильностью актомиозиновой системы, которая может быть основана на типе механизма, описанном Badoual et al. (5). Сходным образом, волнистость жгутиков сперматазоидов может быть вызвана колебательной нестабильностью групп аксонемных динеиновых моторов (15).
Может ли эта привлекательно простая модель найти приложения за пределами области моторных белков цитоскелета? Одним из потенциальных кандидатов является жгутиковый мотор бактерий. Эта составная структура, состоящая из множества копий многочисленных продуктов генов, может вращаться как по часовой, так и против часовой стрелки со скоростью несколько сотен оборотов в секунду (16).В естественной среде он случайным образом переключается между двумя направлениями (17). Доля времени, проведенного в каждом состоянии, чувствительно контролируется (18) концентрацией сигнального белка — фосфорилированного CheY — свойства, которое бактерии используют для управления направлением своего плавания. Крутящий момент создается за счет взаимодействия между ротором, включающим кольцо из 34 белков FliM, и примерно 12 статорами, каждый из которых состоит из двух моторных единиц, MotA и MotB. В одной недавней модели (19) предполагается, что FliM существует в двух конформациях, каждая из которых создает крутящий момент в разном смысле при взаимодействии со статором.Аллостерические взаимодействия между белками FliM приводят к кооперативному переключению всего кольца, что объясняет внезапные стохастические изменения направления вращения. Симметричная изотермическая картина храповика, обсуждаемая Badoual et al. (5) может предоставить альтернативное описание. Задача состояла в том, чтобы понять, как связывание CheYp, возможно, за счет тонкого изменения эффективных потенциалов, могло бы чувствительно повлиять на относительные вероятности двух устойчивых состояний.
Анализ Badoual et al. (5) является своевременным напоминанием о том, что не все свойства системы могут быть сведены к характеристикам компонентов самого низкого уровня, и что коллективные эффекты, ведущие к фазовым переходам и нестабильности, преобладают в биологии. Действительно, недавние исследования показали, что некоторые биологические системы могут фактически поддерживать себя в непосредственной близости от фазового перехода, чтобы воспользоваться необычно чувствительной реакцией, которая там возникает. Примеры включают обнаружение лигандов мембранными рецепторами (20), обнаружение колебаний механосенсорами (21, 22) и регулирование ферментативных реакций (23).Но важно помнить, что, поскольку количество взаимодействующих компонентов в субклеточной биологической системе очень мало, флуктуации играют гораздо более значительную роль, чем в большинстве систем конденсированного состояния. Можно ожидать, что эволюция также положительно повлияла на этот элемент случайности, как, по всей видимости, имеет место бактерия Escherichia coli , которая использует колебания своего двигателя в качестве основы для принятия решения, куда двигаться.
Сноски
↵ * Эл. Почта: td18 {at} cam.ac.uk.
См. Сопутствующую статью на странице 6696.
- Copyright © 2002, Национальная академия наук
Глава 12, страницы 511-517, 473-491
В предыдущем разделе мы обсудили два из трех основных видов филаментов, которые составляют цитоскелет, промежуточные филаменты и микротрубочки. Мы продолжаем наше исследование цитоскелета с рассмотрения роли микротрубочек во внутриклеточном транспорте и позиционировании везикул и органелл.Затем мы перейдем к рассмотрению актиновых филаментов и их функций.
Как микротрубочки функционируют во внутриклеточном транспорте
пузырьков и органелл?
Микротрубочки функционируют как дорожки внутри клетки, по которым проходят грузы
материалов, таких как везикулы или органеллы, можно транспортировать. В
таким образом они могут направлять движение материалов через
клетка (обратите внимание, что актиновые филаменты, о которых мы поговорим позже,
может также функционировать таким образом). Помимо движущихся пузырьков
и микротрубочки органелл функционируют в движении хромосом во время
деление клеток, как мы уже видели.
Что заставляет везикулы и органеллы двигаться по ним
сотовые «треки»?
Два семейства моторных белков, называемых кинезинами , и
динеины , которые движутся по микротрубочкам, действуют как эвакуаторы,
прикрепить к грузу и потянуть по гусеницам к своему
назначения. Есть много видов кинезинов и динеинов, каждый из которых
из которых, как предполагается, перевозят разные грузы.
Что обеспечивает энергию для буксировки этих моторных белков
свои грузы?
Энергия для движения моторных белков и их грузов
обеспечивается АТФ, который в процессе расщепляется на АДФ.
В чем разница между кинезинами и динеинами?
Кинезины и динеины имеют сходство, но важное различие
заключается в том, что большая часть кинезинов движется к положительному концу микротрубочки
что они на (т.е., вдали от центра клетки), а
динеины перемещаются к минус-концу микротрубочки (к минус-концу микротрубочки).
центр ячейки). Таким образом, кинезинов функционируют к , принося
грузов на периферию ячейки, при динеинов
функция переносит грузы в центр ячейки.
См. Рисунок 12.51.
Как выглядят кинезины и динеины?
Хотя есть различия в деталях между кинезинами и
динеины, обе группы моторных белков имеют эти особенности в
общий:
— оба имеют глобулярные АТФ-связывающие головки, которые функционируют как мотор
домен и взаимодействуют с микротрубочками.
— оба имеют хвостовой домен, который участвует в привязке груза.
См. Рисунок 12.50
Как кинезины уходят только от центра клетки,
а динеины только движутся к нему?
Головки моторных белков обладают стереоспецифичностью, которая
означает, что они могут связываться с микротрубочкой только в том случае, если они «обращены
правильный путь «. Это определяет направление, в котором они
может двигаться.
Что еще делают кинезин и динеин, помимо доставки пузырьков
в их целевые места назначения?
Кинезин и динеин участвуют в удержании органелл в
ячейка установлена правильно.Считается, что
кинезины участвуют в поддержании растяжения ER
к периферии клетки
Считается, что динеины участвуют в поддержании комплекса Гольджи
рядом с центром клетки.
Актиновые нити
Что такое актиновые филаменты?
Актиновые филаменты являются наиболее многочисленными из трех типов цитоскелета.
нити. Нити актина состоят из белка и актина
и образуют длинные тонкие волокна.Эти волокна иногда могут быть сгруппированы
вместе, чтобы сделать пучки, или сшить, чтобы сделать трехмерный
сеть.
Каковы функции актиновых филаментов?
Актиновые филаменты необходимы для движения клеток , фагоцитоза и деления клеток .
Они также помогают в придании клетке формы
Они функционируют как треков для внутриклеточного трафика, как микротрубочки.
Они участвуют в сокращении мышц .
Как собираются актиновые филаменты?
-Отдельные молекулы актина представляют собой глобулярные белки, каждый из которых
может связываться с двумя другими молекулами актина, образуя тример.
— Эти тримеры могут затем образовывать длинные волокна путем добавления большего количества
молекулы актина на каждом конце.
-Подобно микротрубочкам, филаменты актина имеют положительный и отрицательный конец.
конец.
— То, как формируются актиновые филаменты, очень похоже на
что микротрубочки собраны (см. ниже).
Как происходит сборка актиновых филаментов, как у микротрубочек?
а чем он отличается?
Тубулиновые субъединицы микротрубочек имеют связанный с ними GTP, и этот GTP гидролизуется до GDP вскоре после добавления субъединицы к растущей микротрубочке. Точно так же мономеры актина имеют АТФ, связанный с ними, и этот АТФ гидролизуется до АДФ вскоре после того, как мономер присоединился к растущему актиновому филаменту (чтобы вспомнить, какой из них, вспомните А для актина и А для АТФ).Как и микротрубочки, актиновые филаменты легко разбираются и собираются заново. Подобно микротрубочкам, актиновые филаменты можно стабилизировать путем связывания специфических белков.
Как актиновые филаменты влияют на форму клеток и вызывают их движения?
Актиновые филаменты находятся в большом количестве внутри плазматической мембраны. Сеть актина и связанных белков в этой области называется клеточной корой , и она придает клетке ее характерную форму.Когда клеткам необходимо переместить или поглотить частицы, сеть актина, лежащая под плазматической мембраной, меняет форму за счет роста актиновых филаментов. Изменение актиновых филаментов приводит к образованию выступов клетки, которые помогают клетке «ползать» по поверхности или поглощать частицы путем фагоцитоза.
Что такое миозин?
Миозин — это белок, первоначально обнаруженный в скелетных мышцах, но теперь известно, что он присутствует и в других клетках.Существуют различные виды миозина, но группы миозина-I и миозина-II являются наиболее распространенными. Мышечный миозин принадлежит к семейству миозинов-II (см. Рисунок 12.25).
Как выглядит миозин?
Мышечный миозин (миозин-II) состоит из пары идентичных молекул миозина и имеет две глобулярные головки и хвост в форме спирали. Кластеры молекул миозина-II связываются друг с другом своими хвостами, образуя миозиновую нить.
Миозиновая нить организована в виде двусторонней стрелки с
два набора голов, направленных друг от друга.
Как миозиновые филаменты связаны с актиновыми филаментами в
мышечные клетки?
Один набор головок на миозиновом филаменте связан с одним набором актиновых филаментов, а другой набор головок связан с другим набором актиновых филаментов (рисунок 12.23). Такое расположение позволяет актиновым филаментам скользить друг мимо друга и сокращаться.Когда целые пучки актиновых и миозиновых нитей движутся таким образом в унисон, эти пучки могут генерировать сократительную силу, которая является основой движения мышц (рис. 12.23 и 12.24).
Вернуться в
Страница «Контуры лекций».
Авторские права © 2008 Индира Раджагопал
Белки
Аминокислоты
Белки — самые разнообразные биомолекулы на Земле, выполняющие множество функций, необходимых для жизни. Белковые ферменты являются биологическими катализаторами, поддерживающими жизнь, регулируя, где и когда происходят клеточные реакции.Структурные белки обеспечивают внутреннюю и внешнюю поддержку для защиты и поддержания формы клеток. Например, кератины представляют собой важный класс структурных белков, обнаруженных в волосах, коже, ногтях и перьях животных. Белки подвижности обеспечивают основу для движения клеток и всего организма, включая белки мышечных двигателей, которые могут перемещать целые животные! Мембранные белки передают сигналы во время межклеточной коммуникации, транспортируют молекулы в клетки и из них и защищают живые организмы, идентифицируя и помеча захватчиков.
Функции белков настолько разнообразны из-за множества уникальных трехмерных структур, которые образуют белковые полимеры. Несмотря на такое разнообразие, белки также имеют несколько общих структурных характеристик своих мономеров — аминокислот. Структурное сходство аминокислот делает синтез белка единообразным и регулируемым процессом; однако каждая аминокислота также содержит уникальный структурный компонент. Конкретные различия между каждой аминокислотой взаимодействуют, создавая уникальные трехмерные белковые структуры.В совокупности сходства и различия между аминокислотами объясняют, как клетки могут создавать разнообразный пул белков из одного и того же набора строительных блоков.
В каждой аминокислоте существует один центральный атом углерода — альфа-углерод (альфа-углерод). Из четырех групп атомов, ковалентно связанных с α-углеродом, три одинаковы для всех аминокислот. -Углерод всегда напрямую связан с одной аминогруппой и одной карбоксильной группой (карбоновой кислотой). Название «аминокислота» происходит от наличия этих двух функциональных групп (аминокислота + кислота).Все аминокислоты имеют третью общую ковалентную связь с атомом водорода, но четвертый атом (или атомная группа), связанный с α-углеродом, уникален в каждой аминокислоте.
Четвертая α-углеродная связь может соединяться с другим одиночным атомом водорода, как в глицине, или с группой атомов. Группы атомов различаются как по размеру, так и по полярности или заряду. Например, лизин содержит большую ионную группу атомов. Для простоты, когда конкретная аминокислота не идентифицирована, биологи используют термин «R-группа» для обозначения четвертого атома или группы, связанной с α-углеродом.Термин «R» обозначает остальную часть молекулы и используется при обсуждении общей структуры и реакционной способности аминокислот без усложнения структуры включением деталей R-группы.
Синтез белка включает построение полимера из аминокислот со сложной трехмерной структурой. Синтез дегидратации образует пептидную связь между аминокислотами и высвобождает молекулу воды. Дипептид образуется, когда между двумя отдельными аминокислотами создается пептидная связь, соединяющая углерод карбоксильной группы одной аминокислоты и азот аминогруппы другой аминокислоты.Поскольку дополнительные аминокислоты связываются посредством синтеза дегидратации, короткая цепь (пептид) растет. Полипептиды образуются, когда длина пептидной цепи достигает ста или более аминокислот. Белки образуются в виде аминокислот в одном или нескольких полипептидах, химически взаимодействуя с образованием сложной трехмерной структуры.
Живые организмы синтезируют почти все белки, используя всего двадцать различных аминокислот. Полипептиды образуют уникальную трехмерную структуру в зависимости от типа и положения (последовательности) этих аминокислот.Внутри последовательности R-группы аминокислот образуют химические взаимодействия, которые создают определенную трехмерную структуру. Эти R-группы обычно называют «боковыми цепями», потому что они не участвуют в пептидных связях. R-группы выступают на стороне полипептида, позволяя им химически взаимодействовать друг с другом. Взаимодействия с боковыми цепями образуют специфическую структуру каждого белка, структуру, уникально способную выполнять клеточную функцию этого белка.
Функциональные группы белков
Это задание проверяет вашу способность определять функциональные группы аминокислот в белках.
Построение и расщепление белков
Это задание проверяет вашу способность идентифицировать реагенты и продукты синтеза и гидролиза белка.
Структура и функция белка
В отличие от полисахаридов, полипептидные цепи собраны с широким спектром аминокислот в каждом полимере. Набор из двадцати аминокислот, обычно содержащихся в биологических белках, напрямую отвечает за разнообразие белковых структур в живых клетках.Каждый белок отличается по нескольким аспектам, которые определяют структуру и, следовательно, функцию. Белок может состоять из одной или нескольких полипептидных цепей. Гены клетки определяют длину каждой полипептидной цепи, а также тип и положение каждой аминокислоты в последовательности. Вместе эти факторы определяют структуру белка, которая определяет функцию, которую может выполнять белок.
Как структура белка определяет функцию? Трехмерная форма каждого белка идеально подходит для выполнения одной конкретной функции.Например, аквапорины — это канальные белки, которые образуют небольшие туннели через клеточную мембрану. Внутренняя поверхность аквапориновых туннелей имеет определенный диаметр и полярность. Эта структура идеально подходит для переноса молекул воды, но очень немногого другого, обеспечивая специфичность и функцию. Если структура белка изменяется, меняется и его способность функционировать.
Зная важность структуры белка в определении функции, как тогда определяется структура белка? Чтобы ответить на этот вопрос, мы должны сначала спросить, как только двадцать аминокислот могут создать разнообразие белков, которые мы видим в живых организмах.Это разнообразие легко объяснить тем, как полипептиды образуют последовательность. Представьте себе создание дипептида с использованием двадцати распространенных аминокислот. Существует двадцать вариантов для первого положения и двадцать вариантов для второго положения этого двух аминокислотного пептида. Математические расчеты говорят нам, что мы могли синтезировать четыреста различных дипептидов! Для каждых дополнительных аминокислот в пептиде мы снова умножаем это количество вариантов на двадцать. Представьте себе, сколько различных полипептидов может существовать в природе, имея более ста аминокислот в средней последовательности!
Помимо увеличения вариативности, каждая из двадцати общих аминокислот играет жизненно важную роль в структуре и функции белков во всех живых организмах.В то время как производители, такие как растения, синтезируют все двадцать распространенных аминокислот, потребители, которые получают энергию, поедая биомолекулы, полагаются на потребление с пищей для получения одной или нескольких аминокислот. Люди синтезируют десять из двадцати обычных аминокислот, но оставшиеся десять должны быть получены с пищей. Хотя всех аминокислот необходимы для жизни человека, «незаменимые аминокислоты» — это те аминокислоты, которые человек не может синтезировать самостоятельно. Употребление в пищу продуктов, богатых белком, обеспечивает клетки этими незаменимыми аминокислотами.
Живые организмы, управляемые генами, синтезируют полипептиды с использованием аминокислот. Уникальный порядок аминокислот в полипептиде называется первичной структурой и представляет собой первый уровень трехмерной структуры (конформации) белка. Первичная структура определяет каждый дополнительный уровень химических взаимодействий, управляя формированием окончательной конформации белка.
Если структура определяет функцию, как первичная последовательность аминокислот определяет трехмерную структуру? В процессе, называемом сворачиванием белка, стабильные химические взаимодействия образуются между аминокислотами в белке, изгибая и скручивая полимер в трехмерную форму.Сворачивание белков иногда требует помощи молекулярных белков-шаперонов, которые связывают вновь образующиеся полипептиды и способствуют формированию структуры.
Сворачивание белка включает три уровня химических взаимодействий, называемых вторичной, третичной и четвертичной структурой. Вторичная структура создается за счет образования водородных связей между соседними аминокислотами во время синтеза белка. Водородные связи во вторичной структуре включают полярные амино- и карбоксильные группы аминокислот, но не включают R-группы.По мере того как пептидная цепь продолжает расти, взаимодействия между боковыми цепями аминокислот (R-группами) образуют третичную структуру полипептида. Боковые цепи взаимодействуют друг с другом посредством:
- образование водородных связей в боковой цепи.
- агрегация гидрофобных боковых цепей.
- образование ионных (солевой мостик) и ковалентных (дисульфидный мостик) связей.
Хотя все химические взаимодействия важны для третичной структуры, белки сворачиваются в основном в ответ на то, какие боковые цепи способны образовывать водородные связи с водой.Поскольку молекулы воды составляют большую часть внутреннего раствора клетки, неполярные боковые цепи исключаются из раствора и объединяются по мере образования водородных связей с полярными и ионными боковыми цепями. Эти гидрофобные взаимодействия являются сильнейшим фактором, определяющим третичную структуру.
У некоторых белков сворачивание завершается после образования третичной структуры. В других случаях несколько полипептидных цепей объединяются, образуя четвертый уровень структуры, четвертичную структуру. Четвертичная структура включает два или более полипептидов, складывающихся вместе посредством тех же типов химических взаимодействий, которые сформировали третичную структуру.В четвертичной структуре боковые цепи разных полипептидов образуют водородные связи, гидрофобные взаимодействия и химические связи друг с другом. Гемоглобин, белок, переносящий кислород через кровоток, состоит из четырех полипептидов.
Что делать, если что-то нарушает структуру белка? Сильная жара, изменения pH и химические токсины — это лишь некоторые из причин денатурации белка, потери естественной структуры белка. Некоторые белки способны к рефолдингу, но большинство белков не могут восстановиться после значительной потери структуры белка.Например, приготовление яйца навсегда денатурирует его белки, изменяя внешний вид и текстуру яйца. Живые клетки затрачивают значительные усилия на поддержание гомеостаза, контролируя их внутреннюю среду, потому что неожиданные изменения могут разрушить белки клетки, убивая клетку.
Поскольку функция белка зависит от точного формирования структуры, сворачивание белка является ключевой темой научных исследований. Многие биохимики посвящают всю свою карьеру поиску способов предсказать, как будут складываться белки и как мутации повлияют на структуру и функцию белков.Мутации, которые изменяют первичную последовательность белка, могут привести к массивным изменениям в структуре белка и устранить или изменить функцию, что приведет к болезни или смерти. Иногда мутации приводят к улучшенным или новым функциям, приносящим пользу организму. Редкие полезные мутации распространяются среди популяций посредством естественного отбора, что приводит к эволюционным изменениям.
Денатурация белка
Эта анимация иллюстрирует процесс денатурации.
Белковые термины
Это задание проверяет вашу способность сопоставлять термины, относящиеся к белкам, с их определениями.
Белок, обеспечивающий бесперебойную работу мотонейронов
ДНК животного содержит инструкции по созданию каждого типа клеток в его теле. Во время развития генерация разных типов клеток (например, нейронов, клеток крови, мышечных клеток) зависит от разных наборов генов для каждого типа клеток, которые будут экспрессироваться в нужное время. Но что определяет, какие гены включены, а какие выключены или игнорируются?
Новое исследование, проведенное учеными из Чикагского университета на крошечном червяке под названием C.elegans показывает, что в моторных нейронах один белок координирует решение о том, какие гены будут включены, а какие выключены, определяя окончательную идентичность мотонейронов и их роли. Как только нейрон превратился в свою окончательную форму, этот же белок также регулирует экспрессию нужных молекул, чтобы поддерживать его правильное функционирование.
Нейроны отличаются от других типов клеток, потому что, достигнув своего конечного состояния, они перестают делиться и не обновляются.Нейроны долговечны и образуют связи друг с другом, чтобы выполнять жизненно важные функции движения, ощущений и связи между различными частями тела и мозга. И они должны продолжать делать это в течение длительного времени, в отличие, например, от клеток крови, которые постоянно пополняются и просто отмирают, когда начинают разрушаться.
Нейробиолог Пашалис Крациос, доктор философии, старший автор нового исследования, опубликованного в eLife , хотел понять, как разные типы нейронов поддерживают свои функции на протяжении всей жизни организма.
«Что означает функционирование определенного типа клеток?» — сказал Крациос. «Почему ваши нейроны выглядят как нейроны, или ваши глаза выглядят как глаза, или почему ваша кожа похожа на кожу? У них один и тот же материал ДНК, но разные молекулы экспрессируются в нейронах, глазах или коже, что делает эти клетки разными ».
Простая модель для понимания основных функций
Ученые работают с C. elegans , потому что это простой организм, который легко изучать.В нем всего 302 нейрона, выполняющих различные движения и сенсорные функции, поэтому исследователи могут довольно легко выделять разные гены и отслеживать их активность в течение короткого периода жизни червя (около трех-четырех недель).
Крациос и его команда сосредоточились на подмножестве моторных нейронов, которые необходимы для движения, и в конечном итоге остановились на белке UNC-3. UNC-3 — это фактор транскрипции, белок, который контролирует экспрессию нескольких генов. Его команда обнаружила, что UNC-3 работает с другими белками, чтобы включать определенные гены, необходимые для производства молекул для построения двигательных нейронов, а также отключать неродственные гены, которые производят молекулы, необходимые для работы других типов нейронов.
Исследователи также использовали инструменты редактирования генома CRISPR, чтобы выбить UNC-3 как во время развития, так и у взрослых червей с полностью функционирующими двигательными нейронами. Черви, лишенные UNC-3 от рождения, не развили функционирующие мотонейроны, в то время как взрослые особи с UNC-3, нокаутированные после развития, начали терять существующие функции мотонейронов. Эти эксперименты предполагают, что белок UNC-3 должен играть устойчивую регулирующую роль, чтобы двигательные нейроны функционировали должным образом.
«Этот механизм, кажется, имеет место на протяжении всей жизни нейрона», — сказал Крациос.«Без этого клетки в конечном итоге сбиты с толку, потому что они не только перестают производить свои обычные определяющие функцию молекулы, но также начинают производить другие нежелательные молекулы».
Это тоже кажется необычным способом работы этой молекулы. «Это похоже на то, что UNC-3 действует как« губка », ограничивая доступность другого консервативного фактора транскрипции в моторных нейронах, называемого LIN-39 / Hox», — сказал Вейдун Фэн, студент четвертого курса магистерской программы развития, регенерации и Stem Cell Biology (DRSB) и ведущий автор исследования.
Поиск той же функции у более сложных организмов
Эти открытия могут продвинуть наше понимание болезней человека, поражающих двигательные нейроны, таких как боковой амиотрофический склероз (БАС). В этих условиях мотонейроны развиваются должным образом и отлично работают в течение десятилетий, а затем начинают терять функцию в более позднем возрасте. Хотя сравнивать нервную систему C. elegans и человека — это большой скачок, ген, вырабатывающий белок UNC-3, высоко консервативен у разных видов, то есть у людей есть эквивалентная версия.Крациос сказал, что новое исследование может стать началом понимания молекулярных механизмов, которые поддерживают долгосрочную функцию двигательных нейронов у людей, и того, что идет не так, когда эта функция нарушается во время болезни.
Для следующего шага он и его коллеги переходят к поиску аналогичных процессов в другом научном модельном организме, мыши, имеющей сложную нервную систему, похожую на человеческую. Уже есть доказательства того, что у мышей есть белок, подобный UNC-3, в нейронах спинного мозга, что дает им отправную точку.
«Если задуматься, мы говорим о мотонейронах червя, которые выражают UNC-3, а затем, спустя миллионы лет эволюции, мы имеем гораздо более сложное животное, такое как мышь, у которого эквивалентная версия UNC-3 также экспрессируется в моторных нейронах спинного мозга », — сказал Крациос. «Это уже огромно, поэтому теперь большой вопрос заключается в том, сохранилась ли функция UNC-3 от червей до мышей».
Исследование «Конечный селектор предотвращает переключение транскрипции hox для защиты идентичности двигательных нейронов на протяжении всей жизни», поддержанное Национальным институтом неврологических расстройств и инсульта и Фондом Уайтхолла.Среди дополнительных авторов — Вейдун Фэн, Иинан Ли, Полин Дао, Джихад Абурас, Бенаяху Эльбаз и Анна Коларжик из Чикагского университета; и Приота Ислам и Андре Экс Браун из Лондонского института медицинских наук MRC и Имперского колледжа Лондона, Соединенное Королевство.
.


 Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания.
Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания. Содержатся в мембранах клетки, формируют генетический код человека.
Содержатся в мембранах клетки, формируют генетический код человека.