Состав протеина: Выбираем протеин. Состав, содержание белка, уловки продавцов
Состав протеина? | stalevar.com.ua — cпортивное питание
Состав протеина?
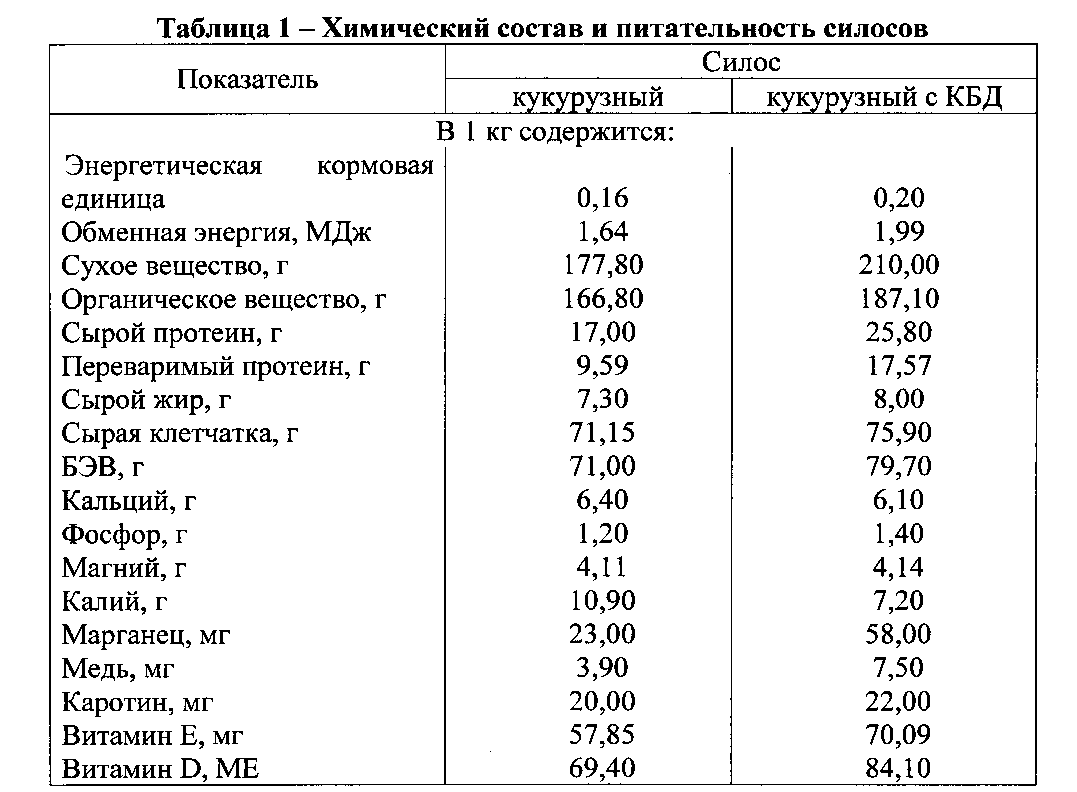
Протеины – это простые белки, которые относятся к сложным высокомолекулярным органическим веществам. Белки снабжают организм энергией. Их не заменят ни углеводы, ни жиры. В течение дня человек тратит много энергии, которую получает из пищевых продуктов. Во время непрерывного процесса обмена веществ происходит реакция расщепления белков и их потеря с потом и мочой. Людям с малой активностью достаточно около 1,5 грамма белка на килограмм веса в день, а спортсменам потребуется 2-3раза больше граммов, так что люди, ведущие активный образ жизни, занимающиеся спортом, нуждаются в дополнительных источниках энергии. Обычно килокалориями организм снабжается продуктами питания, но они не могут обеспечить необходимой комбинацией белков, углеводов и жиров. Эти дополнительные калории дают им специально разработанные пищевые добавки, то есть протеины. Протеин в переводе с английского языка означает белок. Он особенно необходим спортсменам-бодибилдерам, атлетам, занимающимся силовыми видами спорта, которые хотят, чтобы их мускулы стали упругими, рельефными. Чтобы добиться желаемого результата, спортсмены интенсивно тренируются и тратят много энергии. Протеины как концентрированное средство, заменяют им белки животного и растительного происхождения.
Чтобы добиться желаемого результата, спортсмены интенсивно тренируются и тратят много энергии. Протеины как концентрированное средство, заменяют им белки животного и растительного происхождения.
Виды протеина и их состав
Протеин, созданный искусственным способом, не содержит в себе вредные химические вещества. Получают его по принципу создания смесей для детского питания, поэтому в нем нет угрозы здоровью спортсменов.
Бодибилдеры пользуются обычно 3 –мя видами протеина:
- сывороточным;
- казеиновым;
- соевым.
Первые два вида по составу относятся к животным белкам, а соевый протеин – представитель растительного белка. Они обладают эффективностью и удобством в применении.
Сывороточный белок
Сывороточный протеин давно стал популярным видом источником белка. Он отличается способностью быстро активизироваться и вызвать усиление метаболизма в мышцах, помогает в поддержании чистой мышечной массы. Такой вид протеина выделяется из коровьего молока с применением особой технологии. В составе коровьего молока соотношение сыворотки и казеина бывает 80% к 20%. Технология перекрестной фильтрации дает возможность получения высококачественного продукта без жира и лактозы, с сохранением биоактивных пептидов.
Такой вид протеина выделяется из коровьего молока с применением особой технологии. В составе коровьего молока соотношение сыворотки и казеина бывает 80% к 20%. Технология перекрестной фильтрации дает возможность получения высококачественного продукта без жира и лактозы, с сохранением биоактивных пептидов.
На рынке спортивного питания выделяются два типа протеина из сыворотки:
- в виде концентрата;
- изолята.
Первый из них считается не самым чистым продуктом, так содержание белка в нем составляет от 40 до 80 %. При изготовлении его пользуются простой технологией. В процессе выделения из сыворотки белка лактоза и жиры в ней остаются. Изолят протеина является более чистым по составу порошком, содержание белка в нем доходит до 90%. В нем нет лактозы и жиров, которые мешают усвоению белка.
Состав протеина из сыворотки содержит много аминокислот с разветвленными цепями ВССА, протеин обогащен витаминами, микроэлементами железом и фосфором, калием и натрием, а также кальцием, важным для строения костей. А у людей, которые занимаются спортом и ведут активный образ жизни, потребность в витаминах и микроэлементах увеличивается.
А у людей, которые занимаются спортом и ведут активный образ жизни, потребность в витаминах и микроэлементах увеличивается.
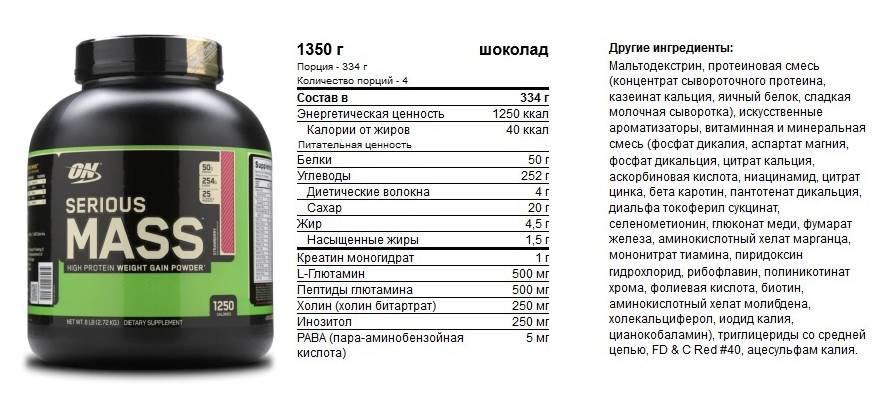
Например, протеин Syntha-6 состоит из шести высококачественных белков:
- концентрата сывороточного протеина;
- изолята сывороточного протеина;
- казеината кальция;
- мицеллярного казеина;
- изолята молочного протеина;
- яичного альбумина.
Глютамин- аминокислота, с ее помощью мышцы набирают массу. Бромелаин и папаин в составе способствуют быстрому усвоению протеина для подпитки мышечной массы.
В составе Optimum Nutrition Opti-Men содержится 8 самых основных аминокислот , 8 видов экстрактов различных фруктов, 25 витаминов и минеральные вещества, в числе которых группа витаминов В, цинк, медь, селен, кальций, марганец, инк и другие. Сывороточный вид протеин ценится спортсменами за качество, он идеальный вариант для компенсирования дефицита белков не только после тренировок, но и после них. Белки в его составе начинают действовать сразу после приема продукта и усваиваются быстро. С его помощью можно добиться длительности тренировок, быстрого сжигания жиров и наращивания мышечной массы.
Белки в его составе начинают действовать сразу после приема продукта и усваиваются быстро. С его помощью можно добиться длительности тренировок, быстрого сжигания жиров и наращивания мышечной массы.
Казеиновый протеин
Казеиновый протеин получают створаживанием молока, который в желудке переваривается долгое время и обеспечивает организм человека важными аминокислотами. Он подавляет аппетит, его употребляет больше всего опытные спортсмены для сжигания жира и сохранения мышц. Казеин принимают на ночь, так как он усваивается в течение 6-7 часов, его применяют те, кто страдает от аллергии на яйца. Казеином пользуются женщины для снижения веса, применяя его вместо обеда или ужина, потому что он надолго дает чувство сытости.
Он остоит из:
Триптофана и валина, лейцина, изолейцина, лизина, метионина и аргинина, глицина и других аминокислот. Все они помогают в снятии нервного напряжения и психической усталости после длительных физических тренировок. Есть в этом протеине глютамин для роста мышц, аланин для поддержки их тонуса.
Есть в этом протеине глютамин для роста мышц, аланин для поддержки их тонуса.
Соевый протеин
Соевый протеин относится к растительным белкам, в нем мало аминокислот для поступления «строительных кирпичиков» в организм, поскольку содержание белков в нем около 50% в чистом виде.
Но исследованиями последних лет доказано, что в соевом протеине содержится более высокий процент (35%) важных для организма аминокислот, например, лизина и глютамина, а также аргинина, которые играют большую роль в выработке энергии в мышцах, в укреплении иммунитета. Лизин является компонентом соединительной ткани, помогает усвоению кальция. Эти аминокислоты облегчают последствия напряженных тренировок.
В сое аминокислоты метионина мало, но сейчас многие производители соевого протеина добавляют его в состав спортивного питания. Поэтому соевые пищевые добавки не отстают по качеству от молочных и яичных протеинов.
Опасные ингредиенты протеина
Перед выбором протеина надо внимательно изучить состав смеси, потому что производители добавляют разные вещества, которые могут нанести вред здоровью. Спортсмены знают, что, кроме белков, углеводы тоже нужны в процессе набора мышечной массы, которые выполняют энергетическую, транспортную и защитную функцию. Именно поэтому они присутствуют в составе многих пищевых добавок для спортсменов и не представляют опасность организму.
Спортсмены знают, что, кроме белков, углеводы тоже нужны в процессе набора мышечной массы, которые выполняют энергетическую, транспортную и защитную функцию. Именно поэтому они присутствуют в составе многих пищевых добавок для спортсменов и не представляют опасность организму.
Для придания сладкого вкуса протеину некоторые производители добавляют небольшое количество сахара. В таких минимальных количествах сахар в протеине вреда не приносит. Но в дешевых БАДах содержится вредный для организма сахарозаменитель аспартам, с помощью которого производители хотят подсластить и замаскировать вкус добавки. Таурин добавляется с целью, чтобы спортсмен чувствовал прилив энергии. Но постоянная подпитка организма стимуляторами может привести к проблемам со сном. Нежелательно присутствие в составе протеина загустителей типа каррагенана и ксантановой камеди, добавляют их сделать продукт более густым. Но они просто заполняют желудок и ухудшают усвояемость протеина. К выбору протеина надо относиться со всей серьезностью.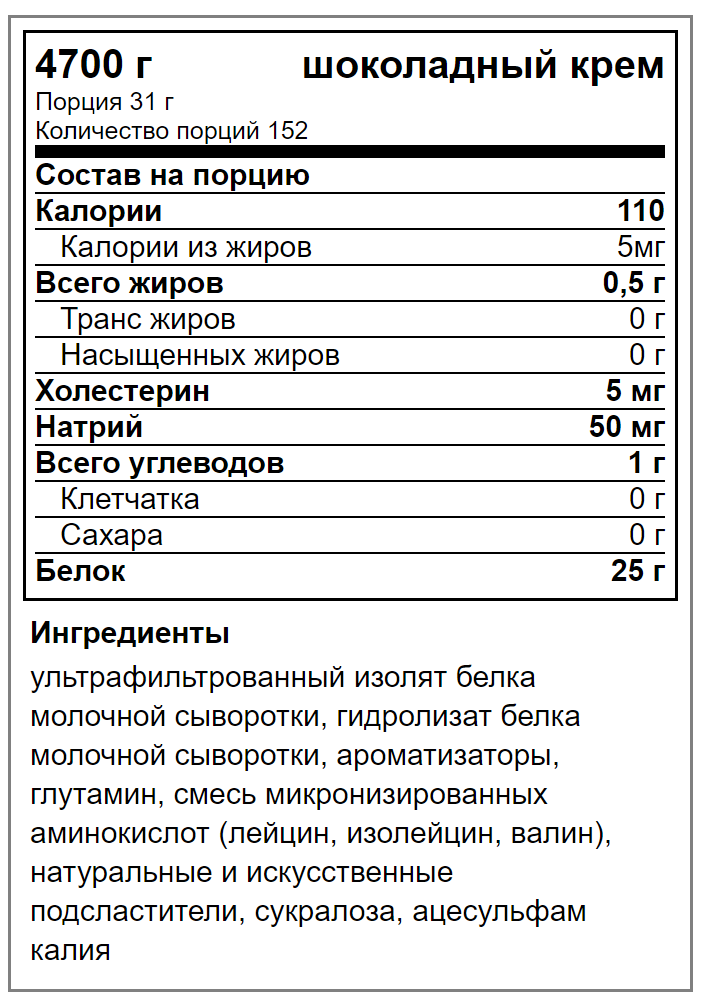 Любой его вид следует применить, заранее изучив его свойства, только тогда он будет помогать во время длительных тренировок.
Любой его вид следует применить, заранее изучив его свойства, только тогда он будет помогать во время длительных тренировок.
Так же вы можете получить консултацию и приобрести нужную вам продукцию по номеру телфона:
МТС:
+38 (095) 874-48-84
Киевстар:
+38 (096) 834-48-84
Статьи – АКАДЕМИЯ-Т
Протеин представляет собой полезный белок, который обладает высокой степенью как пищевой, так и биологической ценности. Очень многие производители стараются добавлять в протеиновые смеси дополнительные витамины и минералы. Основной задачей белка является восстановление и увеличение мышечной массы тела человека.
Основные виды протеина по сырьевой классификации:
- сывороточный протеин – содержит большое количество важных аминокислот, за cчет чего восстанавливает организм после тренировки или сна;
- яичный – самый высокий по степени усвояемости человеком;
- казеин – обеспечивает дополнительную «подпитку»;
- соевый – понижает уровень холестерина, является заменителем для молочной продукции;
- коллагеновый – способствует быстрому восстановлению суставов, соединительных тканей, связок и кожных покровов; дополнительно применяется в протеиновых смесях;
- молочный – сохраняет особенности сывороточных и казеиновых веществ в соотношении 20/80%.

Помимо основных оздоровительных качеств, правильный состав белковой смеси позволяет набрать дополнительную мышечную массу тем, кто хочет иметь идеальную фигуру – в этом случае белковые смеси просто незаменимы. Немаловажным является то, что употребляя протеины можно восстановить иммунитет и здоровье.
Коктейли с белковыми добавками сегодня не просто актуальны, они стали доступны не только для спортсменов, а для каждого, кто следит за своим здоровьем и телом.
Правильное употребление белка позволяет создать необходимый фундамент для дальнейшего образования мышц. Естественно одним приемом протеина не нарастишь необходимую массу, исходя из чего, следует использовать комплексные программы по питанию и тренировкам, включать в рацион дополнительные витамины, минералы. Однако почему именно протеин считается основным и фундаментальным элементом питания спортсменов?
Аминокислотный состав протеина представляется в двадцати наименованиях соединений, которые делятся на незаменимые и заменимые: лейцин, изолейцин, валин, гистидин, лицин, метионин, треонин, триптофан; цистин, серин, тирозин, глютамин, глютаминовая кислота, пролин, ланин, аргенин, глицин, аспарагин и аспарагиновая кислота.
Помимо этого, по аминокислотному составу белки делят на: полноценные, неполноценные, простые и сложные. Каждый тип определяет необходимую степень воздействия на организм.
Естественно, можно сделать только один вывод – протеин очень важен для организма каждого человека, для его физической подготовки и здоровья. При употреблении в комплексе должны выполняться постоянные тренировки, физические нагрузки и особенно правильное питание.
Следует так же помнить, что качественный белковый порошок следует брать у проверенных отечественных производителей, которые тщательно проводят исследования и выпускают лучшие смеси. В здоровом теле – здоровый дух.
Весь список акций
Поделиться
Другие акции
Как похудеть просто и доступно
10 правил безопасного применения витаминов и минералов
Набор массы, особенности питания и тренировок
Пищевые волокна что такое и для чего
Связанные товары
В корзину
Подробнее
Подписаться
Подробнее
Подробнее
В корзину
Подробнее
В корзину
Подробнее
В корзину
Подробнее
Белок | Определение, структура и классификация
синтез белка
Посмотреть все СМИ
- Ключевые люди:
- Джон Б.
 Фенн
Фенн
Тасуку Хондзё
Ричард Хендерсон
Уильям Г. Кэлин-младший
Джордж П. Смит
- Похожие темы:
- фермент
интерферон
фактор транскрипции
прион
фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных. Когда животное потребляет избыточное количество белков, они превращаются в жиры (глюкозу или триглицериды) и используются для получения энергии или создания запасов энергии. Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios , что означает «занимающий первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусины расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0053 см. питание человека).
Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0053 см. питание человека).
Содержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками. Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Белковый состав и структура — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1346
ДНК
кодирует последовательность одномерных аминокислот, которые преобразуются в трехмерные белки. Белки имеют первичную, вторичную и третичную структуру. Первичная структура состоит из аминокислот, которые связаны пептидными связями и образуют линейные цепи полипептидов. Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры представляют собой водорастворимые белки, которые конденсируются в компактные структуры.
Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры представляют собой водорастворимые белки, которые конденсируются в компактные структуры.
- Вторичная структура полипептидной цепи
- Рамачандран График
- α-спирали
- α-спираль
- β-склады
Белковые структуры
• Первичная структура (линейный полимер аминокислот)
(скреплены пептидными связями)
• Вторичная структура (стандартные трехмерные модели)
(а-спираль, ß-лист, удерживаемые Н-связями между атомами основной цепи)
• Третичная структура (детальная трехмерная конформация)
(связи между атомами боковой цепи)
• Четвертичная структура (комбинированная полимерные цепи)
Вторичная структура полипептидной цепи
Вторичная структура относится к форме сворачивающегося белка, обусловленного исключительно водородными связями между амидной и карбонильной группами его основной цепи.
 Вторичная структура не включает связи между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой.
Вторичная структура не включает связи между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой.Двумя наиболее часто встречающимися вторичными структурами полипептидной цепи являются альфа-спирали и бета-складчатые листы. Эти структуры являются первыми основными шагами в сворачивании полипептидной цепи, и они устанавливают важные топологические мотивы, которые определяют последующую третичную структуру и окончательную функцию белка.
Пептидные связи влияют на вторичную структуру
Напомним, что плоская амидная связь ограничивает плоскости изгибов цепи: нет вращения вокруг связей CO-N, но плоскости вращаются вокруг
Связи α-C-N (Φ) и α-C-C=O (Ψ)
График Рамачандрана
Показывает группировку комбинаций φψ и связывает их со структурами в реальных белках. Часто встречаются повторяющиеся структуры (α-спирали, β-листы)
http://commons.wikimedia.org/wiki/Fi…neral_100K.
 jpg
jpgспираль аминокислотных остатков на полипептидной цепи, обычно в пределах от 4 до 40 остатков. Этот виток удерживается вместе водородными связями между кислородом C=O в верхнем витке и водородом NH в нижнем витке. Такая водородная связь образуется ровно через каждые 4 аминокислотных остатка, а каждый полный оборот спирали составляет всего 3,6 аминокислотных остатка. Этот регулярный рисунок придает альфа-спирали весьма определенные черты в отношении толщины витка и длины каждого полного витка вдоль оси спирали.
Структурная целостность альфа-спирали частично зависит от правильной стерической конфигурации. Аминокислоты, у которых R-группы слишком велики (триптофан, тирозин) или слишком малы (глицин), дестабилизируют альфа-спирали. Пролин также дестабилизирует альфа-спирали из-за своей неправильной геометрии; его R-группа снова связывается с азотом амидной группы, что вызывает стерические затруднения. Кроме того, отсутствие водорода в азоте пролина не позволяет ему участвовать в образовании водородных связей.

Другим фактором, влияющим на стабильность альфа-спирали, является суммарный дипольный момент всей спирали за счет отдельных диполей групп C=O, участвующих в водородных связях. Стабильные альфа-спирали обычно заканчиваются заряженной аминокислотой для нейтрализации дипольного момента.
α-спираль
- 3,6 аминокислоты на виток
- 0,54 нм на виток
- боковые цепи направлены
- Н-связи параллельны оси
- n-4 дипольный момент
конец)
- нет про, менее гли, сер
- ограничено сходные заряды боковых цепей
α-спирали имеют дипольный момент; некоторые боковые цепи являются предпочтительными
β
— СКЛАДИРОВАННЫЕ ЛИСТЫ
Эта структура возникает, когда два (или более, например, пси-петля) сегмента полипептидной цепи накладываются друг на друга и образуют ряд водородных связей друг с другом. Это может происходить при параллельном расположении:
Или при встречно-параллельном расположении:
Параллельное и антипараллельное расположение является прямым следствием направленности полипептидной цепи.
 При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одной стороне для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях.
При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одной стороне для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях.Параллельное расположение менее стабильно, потому что геометрия отдельных молекул аминокислот вынуждает водородные связи располагаться под углом, что делает их более длинными и, следовательно, более слабыми. Наоборот, при антипараллельном расположении водородные связи располагаются прямо напротив друг друга, что делает связи более прочными и стабильными.
Обычно антипараллельный бета-складчатый слой образуется, когда полипептидная цепь резко меняет направление. Это может происходить в присутствии двух последовательных остатков пролина, которые создают угловой изгиб в полипептидной цепи и загибают ее обратно на себя.
 Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков.
Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков.Обратный поворот (ß-изгиб):
- R2 (сторона C=O) часто G,A
- R3 (сторона N-H) часто D
- Proline часто R2 или R3
α
— СКЛАДИРОВАННЫЕ ЛИСТЫ
Структура, аналогичная бета-складчатому листу, представляет собой альфа-складчатый лист. Эта структура энергетически менее выгодна, чем бета-складчатый лист, и довольно редко встречается в белках. Альфа-складчатый лист характеризуется выравниванием карбонильных и аминогрупп; все карбонильные группы выровнены в одном направлении, а все группы NH выровнены в противоположном направлении. Поляризация амино- и карбонильных групп приводит к чистому дипольному моменту на альфа-складчатом листе.
 Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.
Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.Третичная структура
http://commons.wikimedia.org/wiki/Fi…_Structure.png
Третичная структура включает связи между боковыми цепями:
• Водород (-O-H…O -)
•Ионные (обычно отталкивающие: -Ch3-Nh5+:::::::+h5N-Ch3-)
•Ван-дер-Ваальса (притяжение на короткое расстояние)
•Дисульфидные (ковалентные: -Ch3-S-S- Ch3-)
• Гидрофобные
Третичные связи влияют на положение вторичных структур.
А положение вторичной структуры в белке будет влиять на типы боковых цепей (третичная структура).
α-спираль на поверхности белка будет иметь гидрофильные боковые цепи с одной стороны оси спирали и гидрофобные боковые цепи с другой. α-спираль внутри белка будет иметь в основном гидрофобные боковые цепи. α-спираль, подвергающаяся воздействию раствора со всех сторон (необычно), будет иметь гидрофильные боковые цепи со всех сторон оси спирали (в основном).

Четвертичная структура
Четвертичные структуры включают отдельные полипептиды, удерживаемые вместе слабыми связями различной симметрии
Симметрии:
Гомомультимер::гетеромультимер
Гомомультимер, содержащий два или более полипептидных компонентов
3 : белок с несколькими полипептидными цепями, содержащий два или более различных компонента
Изологичный::гетерологичный
Closed::open
Сворачивание белка уменьшает свободную энергию (ΔG) системы.
Сворачивание белка происходит с участием как белка, так и растворителя.
ΔG = GF -GU
= ΔH — TΔS
=
+ ΔH (белок)
+ ΔH (растворитель)
— TΔS (белок)
— TΔS (растворт)
δG для фолдинг
мал (от -20 до -60 кДж/моль) и в основном за счет гидрофобных взаимодействий
Почему такой низкий?
Изменения формы являются важной частью функции белка и контроля. Например: изменение формы позволяет ДНК-метилтрансферазе выбирать полуметилированный me CG/GC для биметилирования до me CG/Gme C
Protein Composition and Structure распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.



 Фенн
Фенн Вторичная структура не включает связи между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой.
Вторичная структура не включает связи между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой. jpg
jpg
 При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одной стороне для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях.
При антипараллельном расположении С-конец одного сегмента находится на той же стороне, что и N-конец другого сегмента. При параллельном расположении С-конец и N-конец находятся на одной стороне для обоих сегментов. «Складка» возникает из-за чередующихся плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию с обращенной друг к другу на обращенную в противоположных направлениях. Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков.
Это не обязательно для отдаленных сегментов полипептидной цепи, чтобы сформировать бета-складчатые листы, но для проксимальных сегментов это является определенным требованием. На коротких расстояниях два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, причем 4 — минимальное количество остатков. Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.
Карбонильная сторона приобретает суммарный отрицательный заряд, а амино-сторона приобретает суммарный положительный заряд.