Сколько из известных аминокислот участвует в синтезе белков: Какие аминокислоты участвуют в синтезе белка: список и источники.
Белки
Какое количество известных аминокислот участвуют в синтезе белка:
20
30
100
200.
Какая часть молекул аминокислот отвечает за функцию различения их друг от друга:
радикал
карбоксильная группа
жирная кислота
аминная группа.
Какой белок был первым из синтезирован искусственно.
инсулин
каталаза
гемоглобин
интерферон
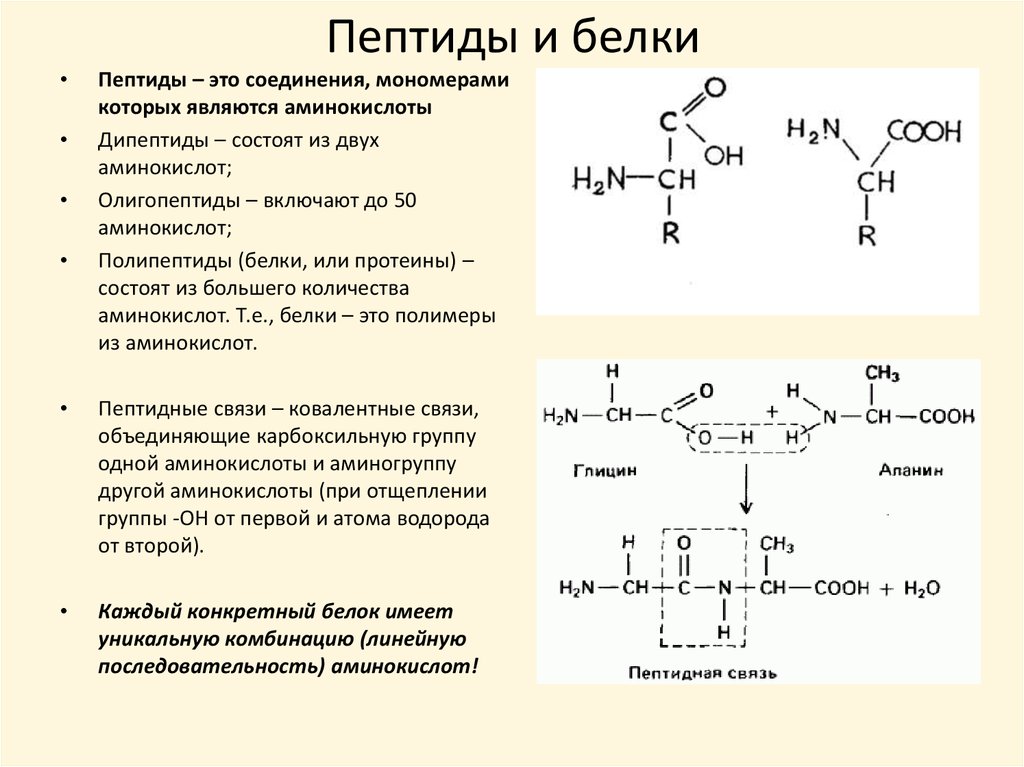
С помощью какой химической связи происходит соединение аминокислот между собой в молекуле белка первичной структуры?
дисульфидная
пептидная
водородная.
Какой белок выполняет ферментативную функцию.
гормон роста
фибрин
инсулин
актин
трипсин
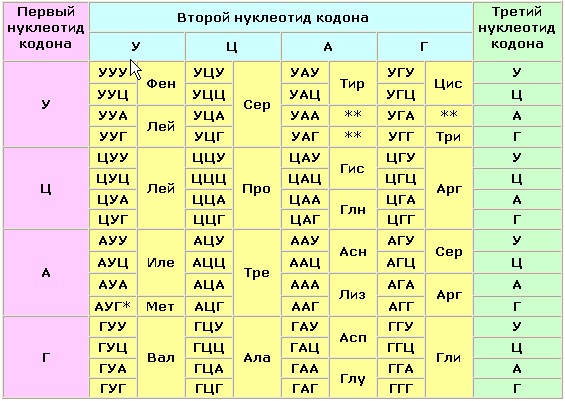
Где происходит синтез белка?
в хлоропластах
в митохондриях
в рибосомах
в эндоплазматической сети.
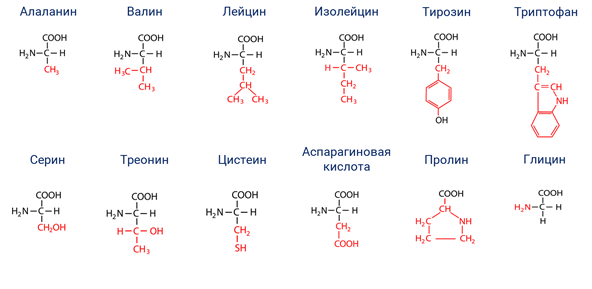
Что из ниже перечисленного относится к аминокислотам?
тубулин, коллаген, лизоцим
лизин, триптофан, аланин
холестерин, прогестерон, стеариновая кислота
валин, мальтаза, кератин
сахароза, лактоза, глицин
аденин, тимин, гуанин
Где находятся рибосомы:
в хлоропластах
в митохондриях
в мембране эндоплазматической сети.
Какие органические соединения содержатся в клетке в наибольшем
количестве (в % на сырую массу).
углеводы
липиды
белки
нуклеиновые кислоты
низкомолекулярные органические вещества
Сколько энергии освобождается при расщеплении 1 г белка:
17,6 кДж
35,2 кДж.
Какой белок выполняет рецепторную функцию.
лизоцим
протромбин
пепсин
родопсин
В чем отличие ферментов от других белков?
являются катализаторами химических реакций
включают в свой состав витамины, металлы
синтезируются на рибосомах.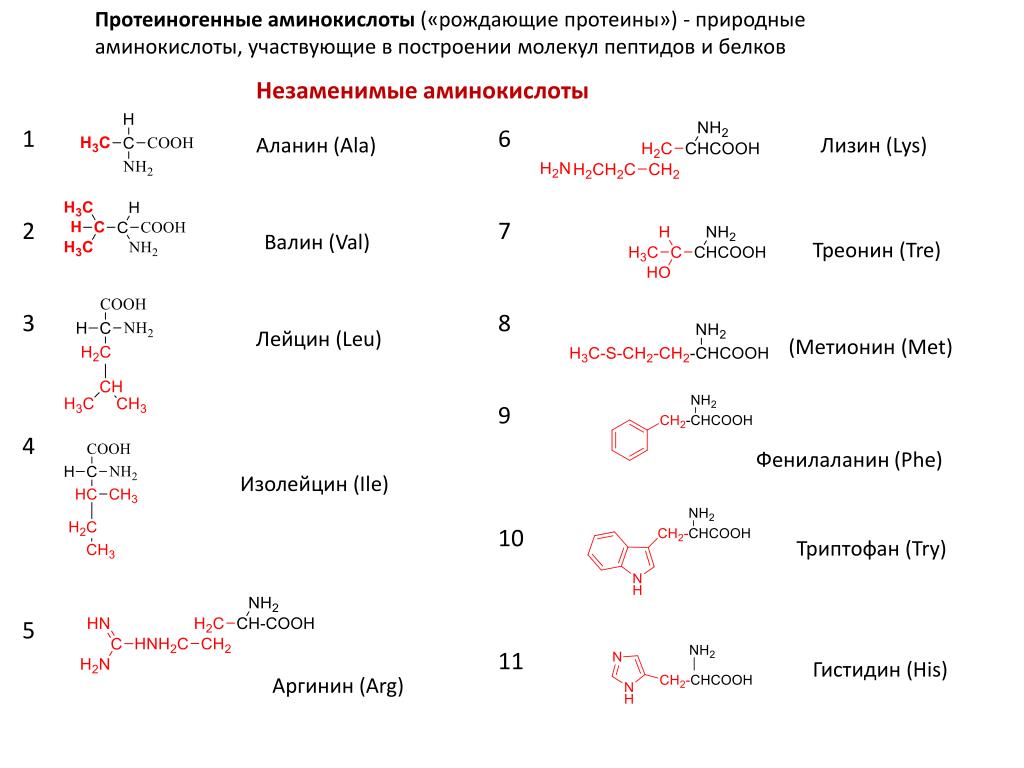
Как называется структура белков, которая разрушается под действием солей тяжелых металлов.
первичная
вторичная
третичная
Каковы главнейшие функции белков?
транспортная
защитная
каталитическая
строительная.
Благодаря чему разные белки похожи друг на друга?
количество аминокислот
количественное соотношение аминокислот разных видов
последовательность соединения аминокислот друг с другом
структура химических связей, участвующих в формировании
последовательности аминокислот
Какой белок выполняет в основном строительную функцию?
кератин
липаза
каталаза
гормон роста
нуклеаза
Между какими функциональными группами соседних аминокислот в белке образуется пептидная связь?
радикалы
карбоксильные группы
карбоксильная группа и аминогруппа
карбоксильная группа и радикал
радикал и ион водорода
аминогруппа и радикал
Какой белок выполняет по большей степени транспортную функцию?
коллаген
гемоглобин
кератин
миоглобин
фибрин
Какой из данных белков выполняет ферментативную функцию?
каталаза
глюкагон
протромбин
кератин
тубулин
Какую основную функцию выполняют такие белки – кератин, коллаген, тубулин?
двигательная
транспортная
защитная
строительная
ферментативная
В каком из данных вариантов все химические соединения являются белками?
сахароза, инсулин, урацил
фенилаланин, глюкагон, пепсин
глюкоза, фруктоза, гликоген
каталаза, глюкагон, кератин
рибоза, тимин, актин
Что из ниже перечисленного является белком волос?
кератин
миозин
актин
тубулин
коллаген
фибрин
Какое количество видов аминокислот входит в состав природных белков?
10
20
46
15
25
64
Название процесса образования первичной структуры белка?
транскрипция
диссимиляция
трансляция
полимеризация
редупликация
Какие аминокислоты участвуют в синтезе белка: список и источники.
24 Июня 2019
17 Апреля 2023
3 минуты
6147
ProWellness
Оглавление
- Для чего нужны аминокислоты?
- Незаменимые аминокислоты
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.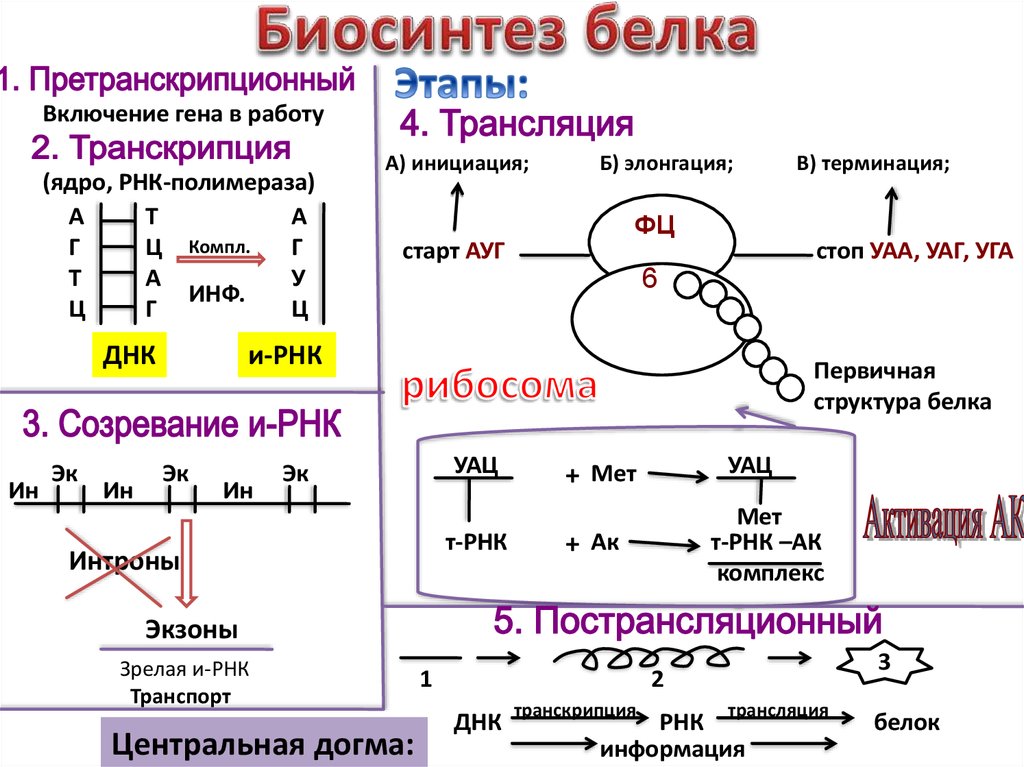
Какие аминокислоты участвуют в синтезе белка: список и источники.
Понятие аминокислот известно всем еще со школы. Аминокислоты представляют собой органические соединения, которые входят в клетки человеческого тела и участвуют в синтезе белка. Их значение очень важно для живых организмов.
Для чего нужны аминокислоты?
Главная задача аминокислот – это участие в биосинтезе, так как в процессе жизнедеятельности часть клеток отмирает, и на их месте появляются новые. Также аминокислоты отвечают за следующие процессы:
- насыщают жизненной энергией ткани и мышцы организма;
- помогают нервной системе осуществлять работу;
- участвуют в водно-солевом обмене;
- участвуют в синтезе гормонов.
Внимание! Аминокислоты, участвующие в синтезе белка, подразделяются на две большие группы – заменимые и незаменимые.
Незаменимые аминокислоты
Незаменимые аминокислоты получили свое название потому, что они не вырабатываются организмом, входят в состав ТРНК и должны поступать в тело человека вместе с пищей. К незаменимым аминокислотам относятся:
- Гистин. Это вещество участвует в процессе кроветворения, отвечает за нормальный уровень гемоглобина. Также гистин необходим тогда, когда ткани человеческого тела повреждаются. Для обогащения организма этим веществом требуется есть молочные продукты, говядину, злаки.
- Метионин. Метионин контролирует уровень холестерина в организме, очищает стенки сосудов от холестериновых отложений, нормализует работу печени. Это вещество содержится в кунжутных семенах, бразильских орехах, пшеничной муке, курином мясе, арахисе, рисе, капусте, бобовых культурах.
- Треонин. Он активно участвует в синтезе коллагена и эластина, отвечает за здоровье и красоту кожи.
 Также благодаря треонину у человека вырабатывается иммунитет к тем или иным заболеваниям. Он обеспечивает здоровье зубов и соединительных тканей. Содержится в следующих продуктах: яйца, фисташки, творог, ржаная мука, рыба, курица, сыр, икра рыбная.
Также благодаря треонину у человека вырабатывается иммунитет к тем или иным заболеваниям. Он обеспечивает здоровье зубов и соединительных тканей. Содержится в следующих продуктах: яйца, фисташки, творог, ржаная мука, рыба, курица, сыр, икра рыбная. - Изолейцин. Непосредственный участник энергетических обменов в организме, также отвечает за общее самочувствие человека. Данную аминокислоту можно найти в куриных яйцах, абрикосах, бананах, бобовых, баклажанах, огурцах, сладком перце.
- Лейцин. Участвует в синтезе белка, который необходим для здоровья мышц. Также лейцин отвечает за стройность, препятствует лишнему образованию и откладыванию жира. Содержится в рыбе и морепродуктах, фисташках, индейке, твороге.
- Лизин. Регенерирует поврежденные ткани, оздоравливает опорно-двигательный аппарат. Есть в фасоли, баранине, курице, треске.
- Фениланин. Главная его задача – выработка гормона дофамина, который обеспечивает хорошее настроение. Его можно получить из сыра твердых сортов, молочных продуктов, тунца, мяса птицы.

- Триптофан. Триптофан обеспечивает человеку хорошее самочувствие и психологический комфорт, регулирует циклы сна и бодрствования. Он есть в винограде, помидорах, репчатом луке, брюкве, баклажанах.
- Валин. Благодаря молекулам валина хорошо работает мозг, задействованы процессы памяти и мышления. Для этого нужно есть бурый рис, фундук, рыбу, яйца, зерновые культуры.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста.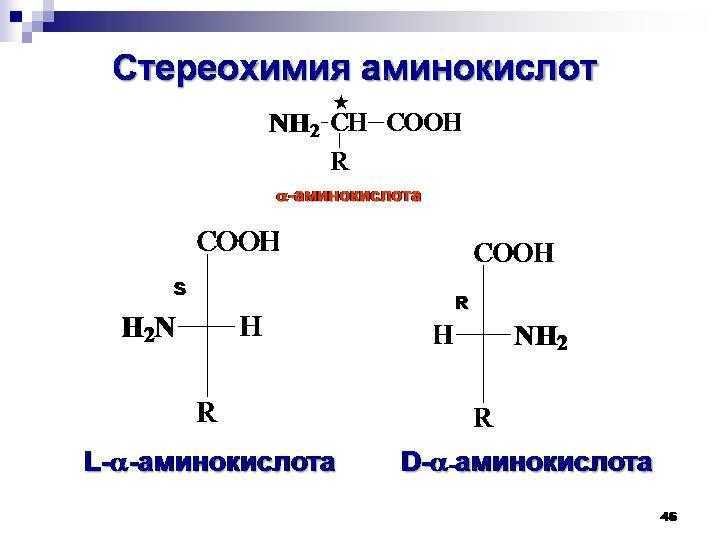 Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Эксперт: Елагина Мария Business Profi компании Siberian Wellness и нутрициолог по косметике
Рецензент: Екатерина Воробьева Адепт здорового и активного образа жизни
Читайте другие статьи по схожим темам
аминокислотасинтез белкааминокислоты этонезаменимые аминокислотызаменимые аминокислоты
Оцените статью
(0 голосов, в среднем 0)
Поделиться статьей
Биохимия, незаменимые аминокислоты — StatPearls
Майкл Дж. Лопез; Шамим С. Мохиуддин.
Информация об авторе и сведения о членстве
Последнее обновление: 13 марта 2023 г.
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма. Эти аминокислоты должны поступать из экзогенной пищи, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот.[1][2] В питании аминокислоты классифицируются как незаменимые и заменимые. Эти классификации возникли в результате ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или баланса азота даже при наличии достаточного количества альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоника PVT TIM HaLL («частный Тим Холл») — это обычно используемый способ запоминания этих аминокислот, поскольку он включает первую букву всех незаменимых аминокислот. С точки зрения питания, девять незаменимых аминокислот можно получить из одного полноценного белка. Полноценный белок по определению содержит все незаменимые аминокислоты.
Эти аминокислоты должны поступать из экзогенной пищи, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот.[1][2] В питании аминокислоты классифицируются как незаменимые и заменимые. Эти классификации возникли в результате ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или баланса азота даже при наличии достаточного количества альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоника PVT TIM HaLL («частный Тим Холл») — это обычно используемый способ запоминания этих аминокислот, поскольку он включает первую букву всех незаменимых аминокислот. С точки зрения питания, девять незаменимых аминокислот можно получить из одного полноценного белка. Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои.[4][5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно являются продуктами растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в наименьшем количестве в пищевом белке по сравнению с эталонным пищевым белком, таким как яичный белок. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не соответствует минимальным требованиям для человека.[6]
Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои.[4][5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно являются продуктами растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в наименьшем количестве в пищевом белке по сравнению с эталонным пищевым белком, таким как яичный белок. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не соответствует минимальным требованиям для человека.[6]
Основы
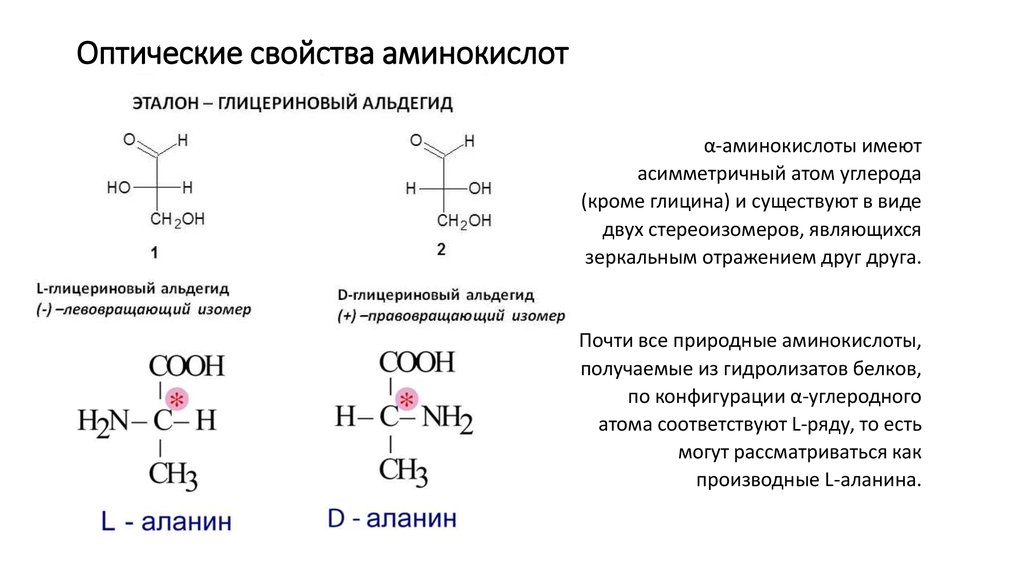
Аминокислоты являются основными строительными блоками белков и служат азотистым остовом для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота представляет собой органическое соединение, которое содержит функциональную группу как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислоты. Белки представляют собой длинные цепи или полимеры аминокислот определенного типа, известных как альфа-аминокислоты. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновой кислоты разделены только одним атомом углерода, который обычно представляет собой хиральный углерод. В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки.[7][8]
Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновой кислоты разделены только одним атомом углерода, который обычно представляет собой хиральный углерод. В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки.[7][8]
Белки представляют собой цепочки аминокислот, которые собираются посредством амидных связей, известных как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты. Затем уникальность различных белков определяется тем, какие аминокислоты они содержат, как эти аминокислоты расположены в цепи, а также дальнейшими сложными взаимодействиями цепи с самой собой и окружающей средой. Эти полимеры аминокислот способны создавать разнообразие, наблюдаемое в жизни.
В человеческом организме насчитывается около 20 000 уникальных генов, кодирующих более 100 000 уникальных белков. Хотя в природе встречаются сотни аминокислот, для производства всех белков, содержащихся в организме человека и большинства других форм жизни, требуется всего около 20 аминокислот. Все эти 20 аминокислот являются L-изомерами, альфа-аминокислотами. Все они, кроме глицина, содержат хиральный альфа-углерод. И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует отметить, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время рибосомного синтеза белка. Пирролоизин функционален в жизни; однако люди не используют пирролизин в синтезе белка. После трансляции эти 22 аминокислоты также могут быть модифицированы с помощью посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерируемые белки.[8]
Все эти 20 аминокислот являются L-изомерами, альфа-аминокислотами. Все они, кроме глицина, содержат хиральный альфа-углерод. И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует отметить, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время рибосомного синтеза белка. Пирролоизин функционален в жизни; однако люди не используют пирролизин в синтезе белка. После трансляции эти 22 аминокислоты также могут быть модифицированы с помощью посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерируемые белки.[8]
От 20 до 22 аминокислот, входящих в состав белков, включают:
Из этих 20 аминокислот девять незаменимых аминокислот:
Фенилаланин
Триллион
03
- 28 0003
Треонин
Изолейцин
Метионин
Гистидин
Лейцин
Лизин
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
- 1.
Hou Y, Yin Y, Wu G. Пищевая незаменимость «незаменимых аминокислот» для животных и людей. Exp Biol Med (Мейвуд). 2015 авг; 240(8):997-1007. [Бесплатная статья PMC: PMC4935284] [PubMed: 26041391]
- 2.
Hou Y, Wu G. Нутритивно незаменимые аминокислоты. Ад Нутр. 2018 01 ноября; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
Ридс П.
 Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]
Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]- 4.
Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии. Карр Геномикс. 2016 июнь; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 г., сен; 3 (3): 118–30. [Статья бесплатно PMC: PMC3905294] [PubMed: 24482589]
- 6.
Jood S, Kapoor AC, Singh R. Аминокислотный состав и химическая оценка качества белка злаков, пострадавших от заражения насекомыми. Растительные продукты Hum Nutr. 1995 г., сен; 48 (2): 159–67. [PubMed: 8837875]
- 7.
ЛаПелуса А., Кошик Р. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 14 ноября 2022 г. Физиология, белки. [PubMed: 32310450]
- 8.
Ву Г.
 Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]
Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]- 9.
де Конинг Т.Дж. Дефицит синтеза аминокислот. Handb Clin Neurol. 2013;113:1775-83. [PubMed: 23622400]
- 10.
Гедес Р.Л., Просдоцими Ф., Фернандес Г.Р., Моура Л.К., Рибейро Х.А., Ортега Х.М. Биосинтез аминокислот и пути ассимиляции азота: большая геномная делеция в ходе эволюции эукариот. Геномика BMC. 2011 г., 22 декабря; 12 Приложение 4 (Приложение 4): S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C. Чем меньше, тем лучше: селективные преимущества могут объяснить Потеря биосинтетических генов у бактерий. Эволюция. 2014 Сентябрь;68(9): 2559-70. [PubMed: 24910088]
- 12.
Shigenobu S, Watanabe H, Hattori M, Sakaki Y, Ishikawa H. Последовательность генома внутриклеточного бактериального симбионта тли Buchnera sp.
 АПС. Природа. 07 сентября 2000 г .; 407 (6800): 81-6. [PubMed: 10993077]
АПС. Природа. 07 сентября 2000 г .; 407 (6800): 81-6. [PubMed: 10993077]- 13.
РОЗА WC. Потребность в аминокислотах взрослого человека. Nutr Abstr Rev. 1957 Jul; 27 (3): 631-47. [PubMed: 13465065]
- 14.
Бенджамин О, Лаппин С.Л. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 июля., 2022. Квашиоркор. [PubMed: 29939653]
Фенилаланин
Триллион
03
- 28 0003
Треонин
Изолейцин
Метионин
Гистидин
Лейцин
Лизин
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
- 1.
Hou Y, Yin Y, Wu G. Пищевая незаменимость «незаменимых аминокислот» для животных и людей. Exp Biol Med (Мейвуд). 2015 авг; 240(8):997-1007. [Бесплатная статья PMC: PMC4935284] [PubMed: 26041391]
- 2.
Hou Y, Wu G. Нутритивно незаменимые аминокислоты. Ад Нутр. 2018 01 ноября; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
Ридс П.
 Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]
Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]- 4.
Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии. Карр Геномикс. 2016 июнь; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 г., сен; 3 (3): 118–30. [Статья бесплатно PMC: PMC3905294] [PubMed: 24482589]
- 6.
Jood S, Kapoor AC, Singh R. Аминокислотный состав и химическая оценка качества белка злаков, пострадавших от заражения насекомыми. Растительные продукты Hum Nutr. 1995 г., сен; 48 (2): 159–67. [PubMed: 8837875]
- 7.
ЛаПелуса А., Кошик Р. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 14 ноября 2022 г. Физиология, белки. [PubMed: 32310450]
- 8.
Ву Г.
 Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]
Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]- 9.
де Конинг Т.Дж. Дефицит синтеза аминокислот. Handb Clin Neurol. 2013;113:1775-83. [PubMed: 23622400]
- 10.
Гедес Р.Л., Просдоцими Ф., Фернандес Г.Р., Моура Л.К., Рибейро Х.А., Ортега Х.М. Биосинтез аминокислот и пути ассимиляции азота: большая геномная делеция в ходе эволюции эукариот. Геномика BMC. 2011 г., 22 декабря; 12 Приложение 4 (Приложение 4): S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C. Чем меньше, тем лучше: селективные преимущества могут объяснить Потеря биосинтетических генов у бактерий. Эволюция. 2014 Сентябрь;68(9): 2559-70. [PubMed: 24910088]
- 12.
Shigenobu S, Watanabe H, Hattori M, Sakaki Y, Ishikawa H. Последовательность генома внутриклеточного бактериального симбионта тли Buchnera sp.

03
03 Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.
 Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний у здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточном количестве в определенные физиологические периоды роста, включая беременность, подростковый рост или восстановление после травмы.[9]]
Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний у здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточном количестве в определенные физиологические периоды роста, включая беременность, подростковый рост или восстановление после травмы.[9]]
Механизм
Хотя для синтеза человеческого белка требуется двадцать аминокислот, люди могут синтезировать только около половины этих необходимых строительных блоков. У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов на путях биосинтеза заменимых аминокислот. Вероятно, за удалением длинных путей, необходимых для синтеза незаменимых аминокислот, с нуля стоит эволюционное преимущество. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду для обеспечения этих строительных блоков, эти организмы могут снизить расход энергии, особенно при воспроизведении своего генетического материала.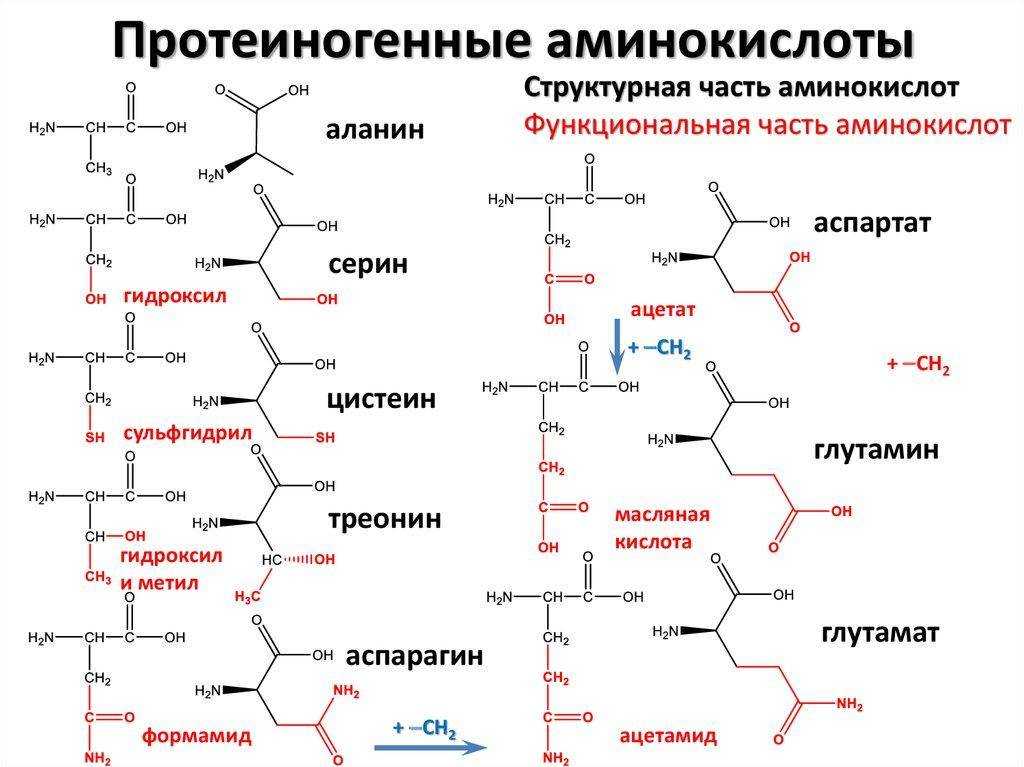 Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении основных материалов, необходимых для синтеза белка.[10][11][12]
Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении основных материалов, необходимых для синтеза белка.[10][11][12]
Клиническое значение
О классификации незаменимых и заменимых аминокислот впервые сообщили в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Роуз, 1957) показало, что человеческое тело способно поддерживать баланс азота при диете, состоящей всего из восьми аминокислот.[13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот. В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования с кормлением очищенными аминокислотами. Исследователи обнаружили, что, когда они удаляли отдельные незаменимые аминокислоты из рациона, субъекты не могли расти или оставаться в азотном балансе. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, несмотря на то, что здоровый взрослый может быть в состоянии синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для выполнения этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимая аминокислота в этих условиях. Это понятие также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут перевести организм в метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В общем, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Нахождение оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером того, что различные физиологические состояния требуют разного потребления питательных веществ.
Например, несмотря на то, что здоровый взрослый может быть в состоянии синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для выполнения этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимая аминокислота в этих условиях. Это понятие также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут перевести организм в метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В общем, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Нахождение оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером того, что различные физиологические состояния требуют разного потребления питательных веществ. Таким образом, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья.[1]
Таким образом, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья.[1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или плохой аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, усталость, слабость, задержку роста у молодых и т. д. Эти симптомы в основном вызваны отсутствием синтеза белка в организме из-за недостатка незаменимых аминокислот. Требуемое количество аминокислот необходимо для производства нейротрансмиттеров, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей с неадекватным уходом.[2]
Квашиоркор и маразм являются примерами более тяжелых клинических расстройств, вызванных недоеданием и неадекватным потреблением незаменимых аминокислот. Квашиоркор — форма недостаточности питания, характеризующаяся периферическим отеком, сухой шелушащейся кожей с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизмененным составом мышечного белка.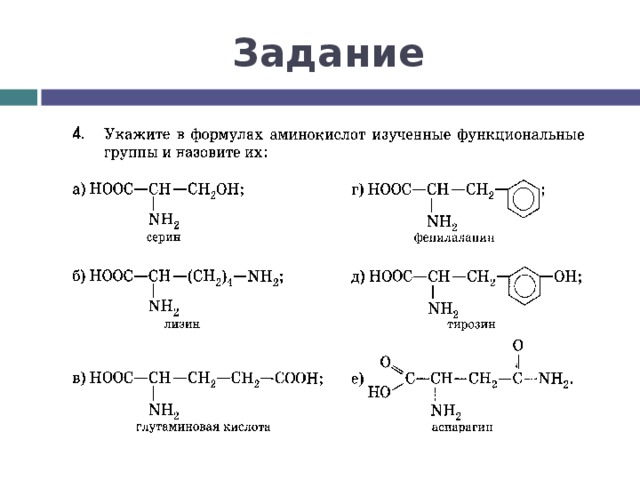 Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания , характеризующаяся истощением, вызванным недостаточным количеством белка и общим недостаточным потреблением калорий.[14]
Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания , характеризующаяся истощением, вызванным недостаточным количеством белка и общим недостаточным потреблением калорий.[14]
Контрольные вопросы
Рисунок
Общая структура аминокислоты. Предоставлено и создано Майклом Лопесом, B.S.
Ссылки
Биохимия, незаменимые аминокислоты — StatPearls
Майкл Дж. Лопес; Шамим С. Мохиуддин.
Информация об авторе и сведения о членстве
Последнее обновление: 13 марта 2023 г.
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма. Эти аминокислоты должны поступать из экзогенной пищи, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот.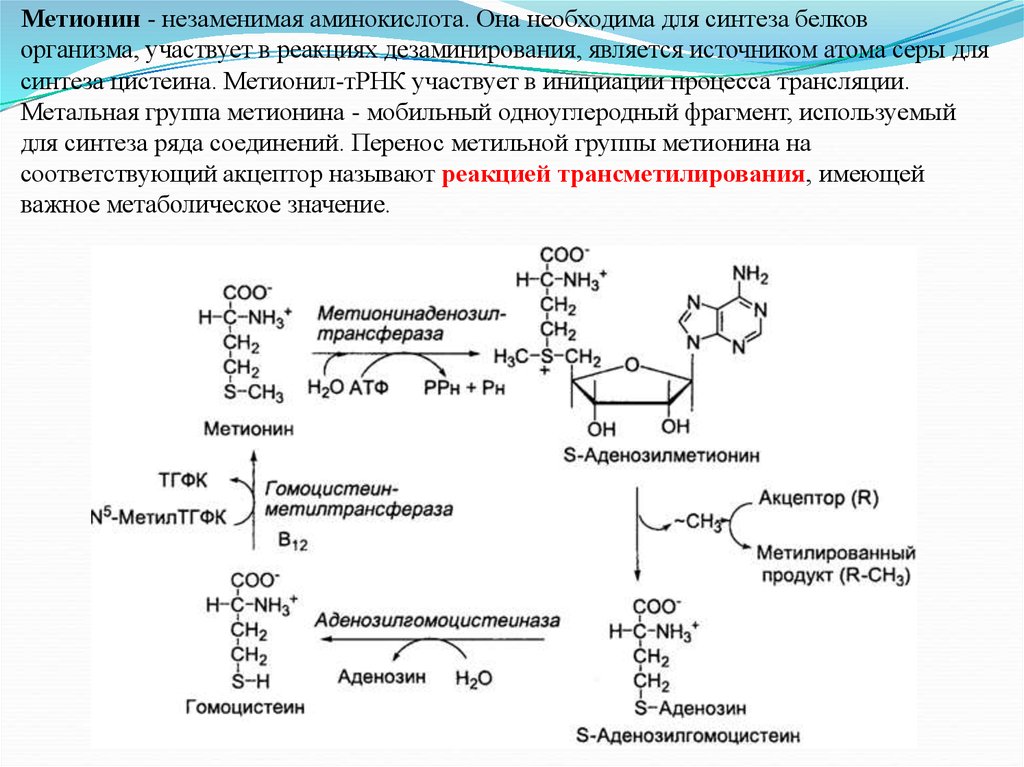 [1][2] В питании аминокислоты классифицируются как незаменимые и заменимые. Эти классификации возникли в результате ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или баланса азота даже при наличии достаточного количества альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоника PVT TIM HaLL («частный Тим Холл») — это обычно используемый способ запоминания этих аминокислот, поскольку он включает первую букву всех незаменимых аминокислот. С точки зрения питания, девять незаменимых аминокислот можно получить из одного полноценного белка. Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои.
[1][2] В питании аминокислоты классифицируются как незаменимые и заменимые. Эти классификации возникли в результате ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или баланса азота даже при наличии достаточного количества альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоника PVT TIM HaLL («частный Тим Холл») — это обычно используемый способ запоминания этих аминокислот, поскольку он включает первую букву всех незаменимых аминокислот. С точки зрения питания, девять незаменимых аминокислот можно получить из одного полноценного белка. Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои.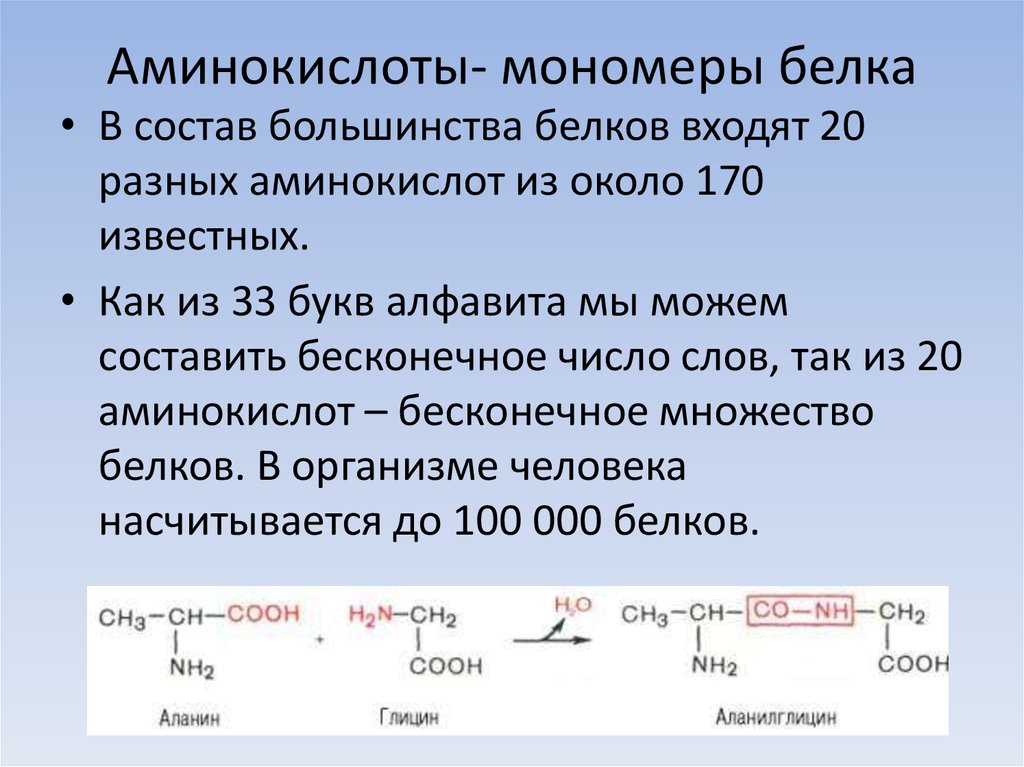 [4][5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно являются продуктами растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в наименьшем количестве в пищевом белке по сравнению с эталонным пищевым белком, таким как яичный белок. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не соответствует минимальным требованиям для человека.[6]
[4][5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно являются продуктами растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в наименьшем количестве в пищевом белке по сравнению с эталонным пищевым белком, таким как яичный белок. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не соответствует минимальным требованиям для человека.[6]
Основы
Аминокислоты являются основными строительными блоками белков и служат азотистым остовом для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота представляет собой органическое соединение, которое содержит функциональную группу как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислоты. Белки представляют собой длинные цепи или полимеры аминокислот определенного типа, известных как альфа-аминокислоты. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновой кислоты разделены только одним атомом углерода, который обычно представляет собой хиральный углерод.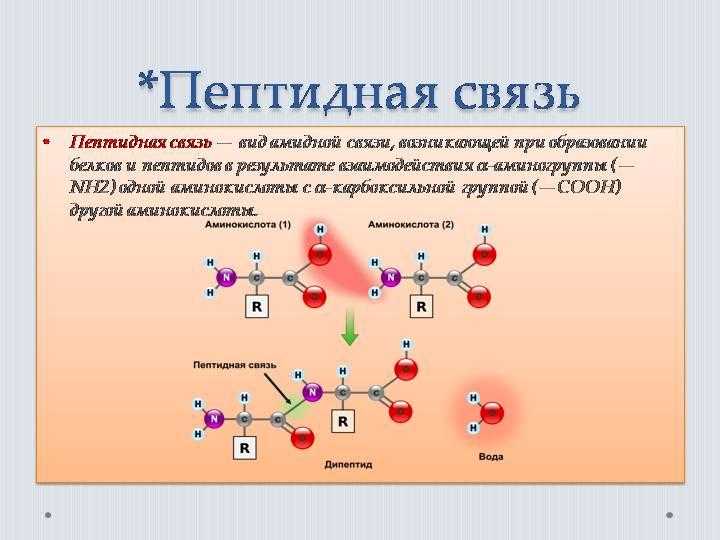 В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки.[7][8]
В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки.[7][8]
Белки представляют собой цепочки аминокислот, которые собираются посредством амидных связей, известных как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты. Затем уникальность различных белков определяется тем, какие аминокислоты они содержат, как эти аминокислоты расположены в цепи, а также дальнейшими сложными взаимодействиями цепи с самой собой и окружающей средой. Эти полимеры аминокислот способны создавать разнообразие, наблюдаемое в жизни.
В человеческом организме насчитывается около 20 000 уникальных генов, кодирующих более 100 000 уникальных белков. Хотя в природе встречаются сотни аминокислот, для производства всех белков, содержащихся в организме человека и большинства других форм жизни, требуется всего около 20 аминокислот. Все эти 20 аминокислот являются L-изомерами, альфа-аминокислотами. Все они, кроме глицина, содержат хиральный альфа-углерод.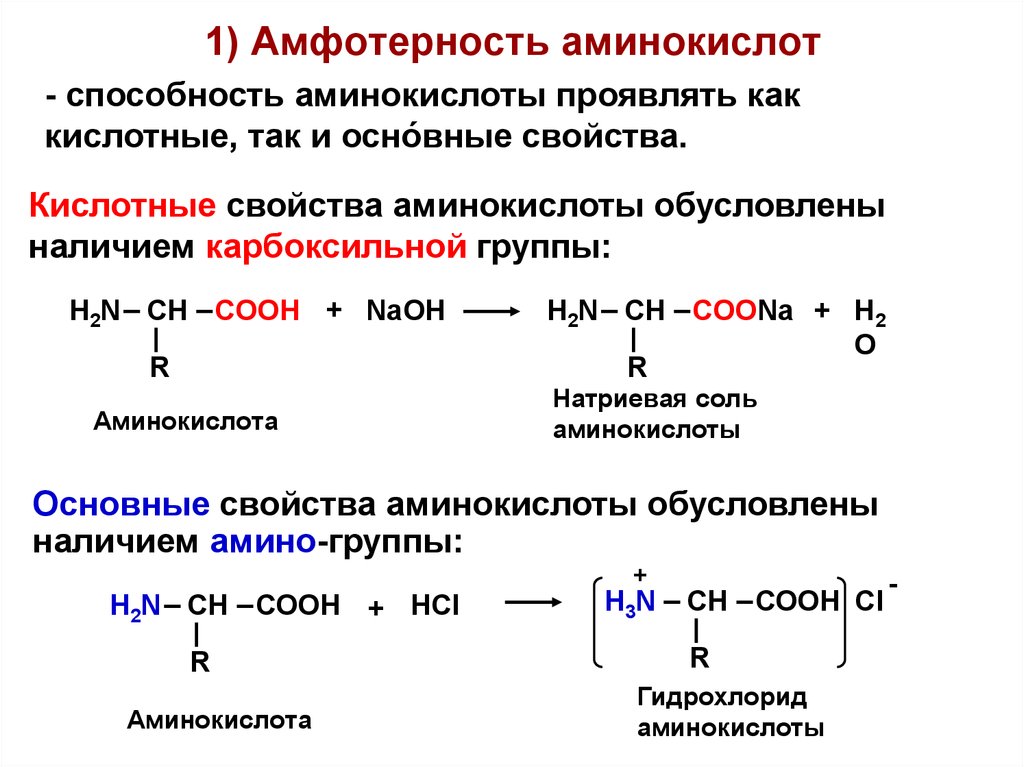 И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует отметить, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время рибосомного синтеза белка. Пирролоизин функционален в жизни; однако люди не используют пирролизин в синтезе белка. После трансляции эти 22 аминокислоты также могут быть модифицированы с помощью посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерируемые белки.[8]
И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует отметить, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время рибосомного синтеза белка. Пирролоизин функционален в жизни; однако люди не используют пирролизин в синтезе белка. После трансляции эти 22 аминокислоты также могут быть модифицированы с помощью посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерируемые белки.[8]
От 20 до 22 аминокислот, входящих в состав белков, включают:
Из этих 20 аминокислот девять незаменимых аминокислот:
03
03 Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.
 Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний у здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточном количестве в определенные физиологические периоды роста, включая беременность, подростковый рост или восстановление после травмы.[9]]
Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний у здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточном количестве в определенные физиологические периоды роста, включая беременность, подростковый рост или восстановление после травмы.[9]]
Механизм
Хотя для синтеза человеческого белка требуется двадцать аминокислот, люди могут синтезировать только около половины этих необходимых строительных блоков. У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов на путях биосинтеза заменимых аминокислот. Вероятно, за удалением длинных путей, необходимых для синтеза незаменимых аминокислот, с нуля стоит эволюционное преимущество. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду для обеспечения этих строительных блоков, эти организмы могут снизить расход энергии, особенно при воспроизведении своего генетического материала. Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении основных материалов, необходимых для синтеза белка.[10][11][12]
Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении основных материалов, необходимых для синтеза белка.[10][11][12]
Клиническое значение
О классификации незаменимых и заменимых аминокислот впервые сообщили в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Роуз, 1957) показало, что человеческое тело способно поддерживать баланс азота при диете, состоящей всего из восьми аминокислот.[13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот. В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования с кормлением очищенными аминокислотами. Исследователи обнаружили, что, когда они удаляли отдельные незаменимые аминокислоты из рациона, субъекты не могли расти или оставаться в азотном балансе. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, несмотря на то, что здоровый взрослый может быть в состоянии синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для выполнения этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимая аминокислота в этих условиях. Это понятие также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут перевести организм в метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В общем, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Нахождение оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером того, что различные физиологические состояния требуют разного потребления питательных веществ.
Например, несмотря на то, что здоровый взрослый может быть в состоянии синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для выполнения этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимая аминокислота в этих условиях. Это понятие также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут перевести организм в метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В общем, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Нахождение оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером того, что различные физиологические состояния требуют разного потребления питательных веществ. Таким образом, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья.[1]
Таким образом, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья.[1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или плохой аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, усталость, слабость, задержку роста у молодых и т. д. Эти симптомы в основном вызваны отсутствием синтеза белка в организме из-за недостатка незаменимых аминокислот. Требуемое количество аминокислот необходимо для производства нейротрансмиттеров, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей с неадекватным уходом.[2]
Квашиоркор и маразм являются примерами более тяжелых клинических расстройств, вызванных недоеданием и неадекватным потреблением незаменимых аминокислот. Квашиоркор — форма недостаточности питания, характеризующаяся периферическим отеком, сухой шелушащейся кожей с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизмененным составом мышечного белка.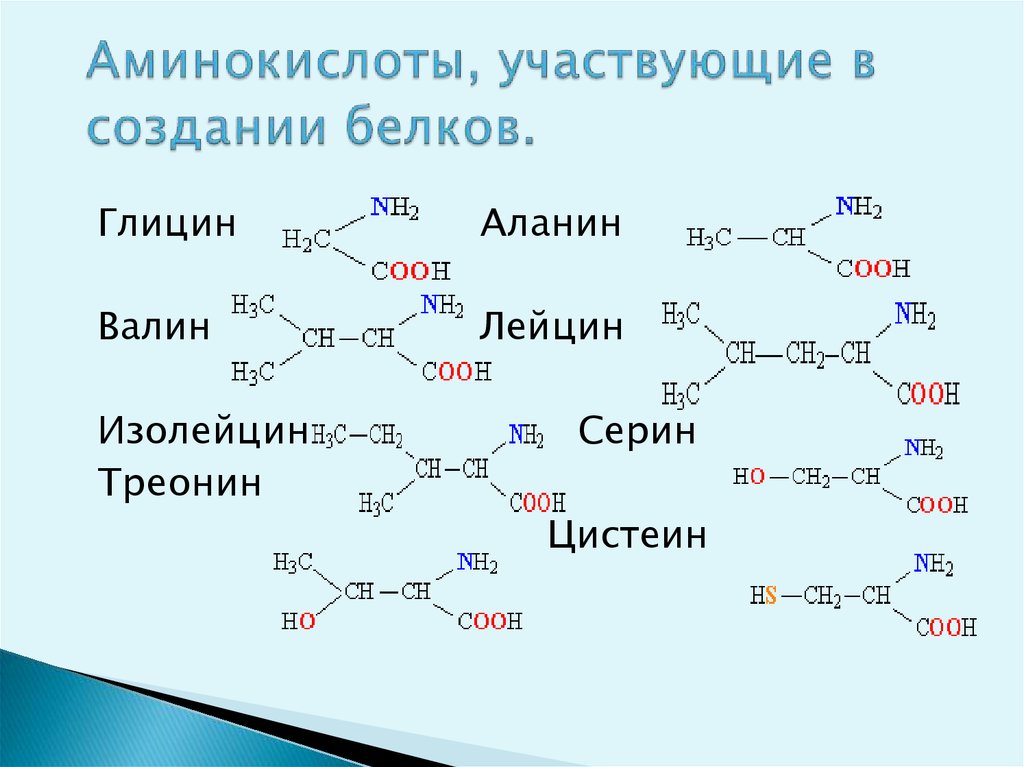 Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания , характеризующаяся истощением, вызванным недостаточным количеством белка и общим недостаточным потреблением калорий.[14]
Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания , характеризующаяся истощением, вызванным недостаточным количеством белка и общим недостаточным потреблением калорий.[14]
Контрольные вопросы
Рисунок
Общая структура аминокислоты. Предоставлено и создано Майклом Лопесом, B.S.

 Также благодаря треонину у человека вырабатывается иммунитет к тем или иным заболеваниям. Он обеспечивает здоровье зубов и соединительных тканей. Содержится в следующих продуктах: яйца, фисташки, творог, ржаная мука, рыба, курица, сыр, икра рыбная.
Также благодаря треонину у человека вырабатывается иммунитет к тем или иным заболеваниям. Он обеспечивает здоровье зубов и соединительных тканей. Содержится в следующих продуктах: яйца, фисташки, творог, ржаная мука, рыба, курица, сыр, икра рыбная.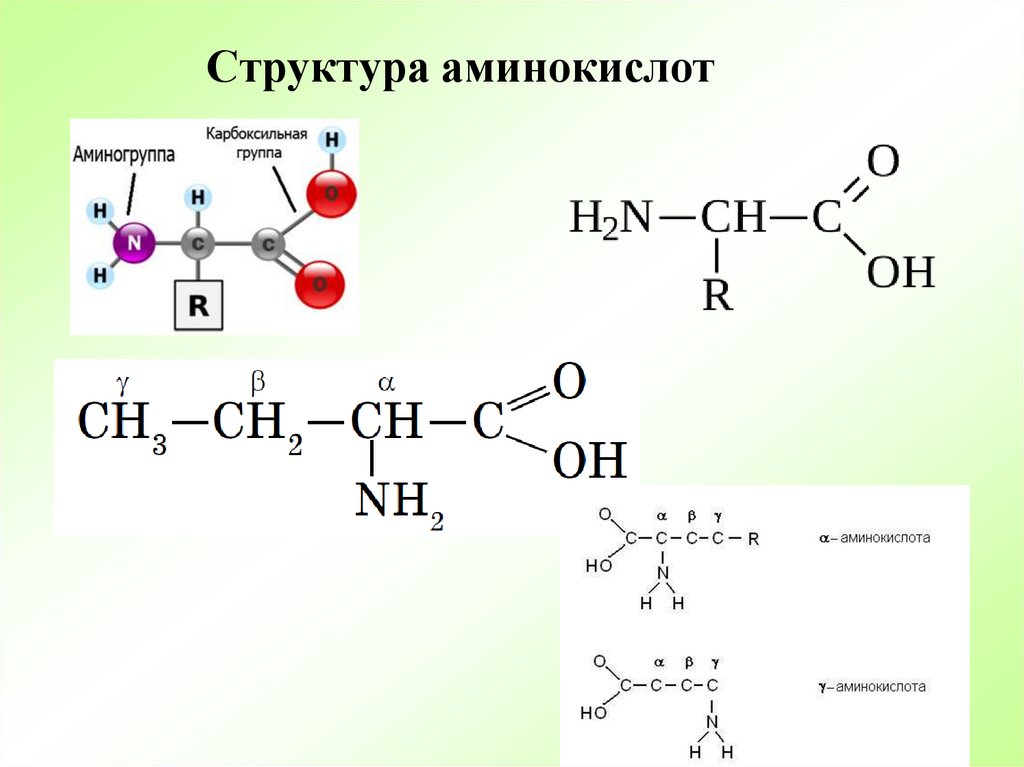
 Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]
Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060] Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]
Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095] АПС. Природа. 07 сентября 2000 г .; 407 (6800): 81-6. [PubMed: 10993077]
АПС. Природа. 07 сентября 2000 г .; 407 (6800): 81-6. [PubMed: 10993077]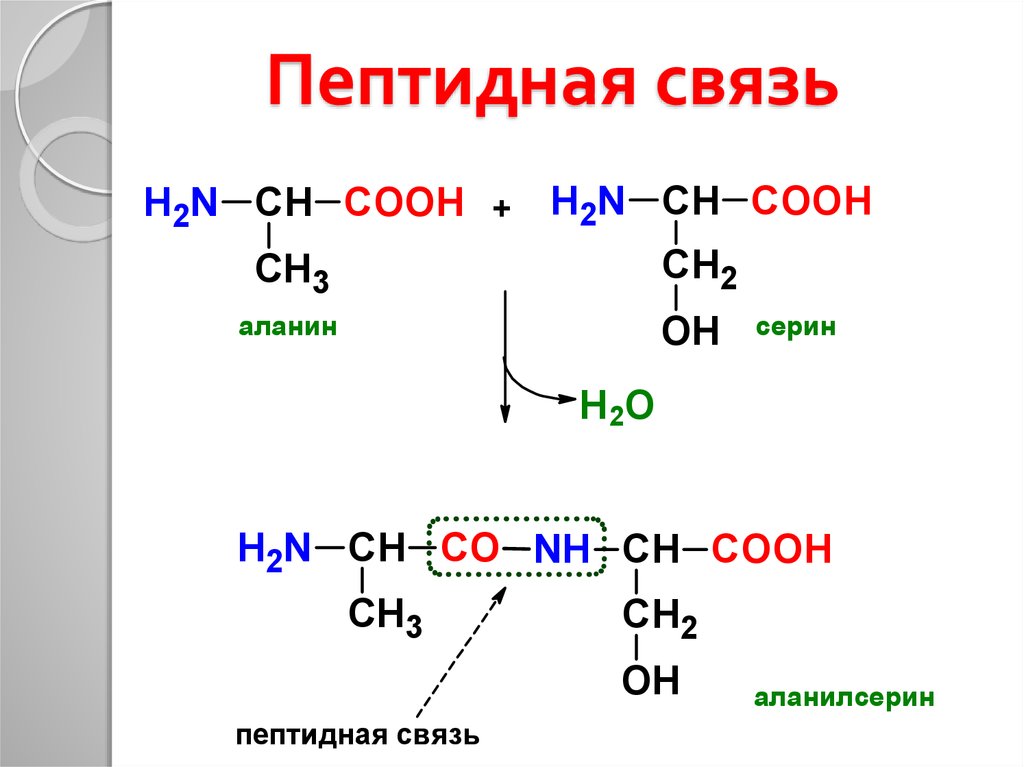 Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]
Дж. Незаменимые и незаменимые аминокислоты для человека. Дж Нутр. 2000 г., июль; 130 (7): 1835S-40S. [PubMed: 10867060]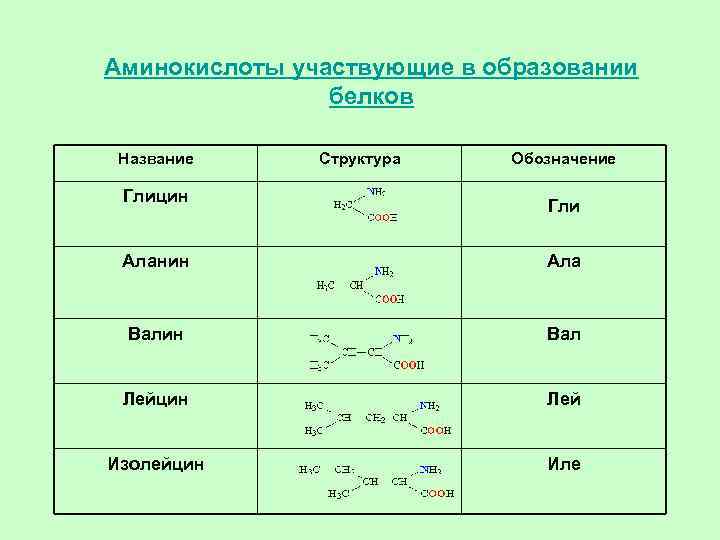 Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]
Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 май; 37(1):1-17. [PubMed: 19301095]