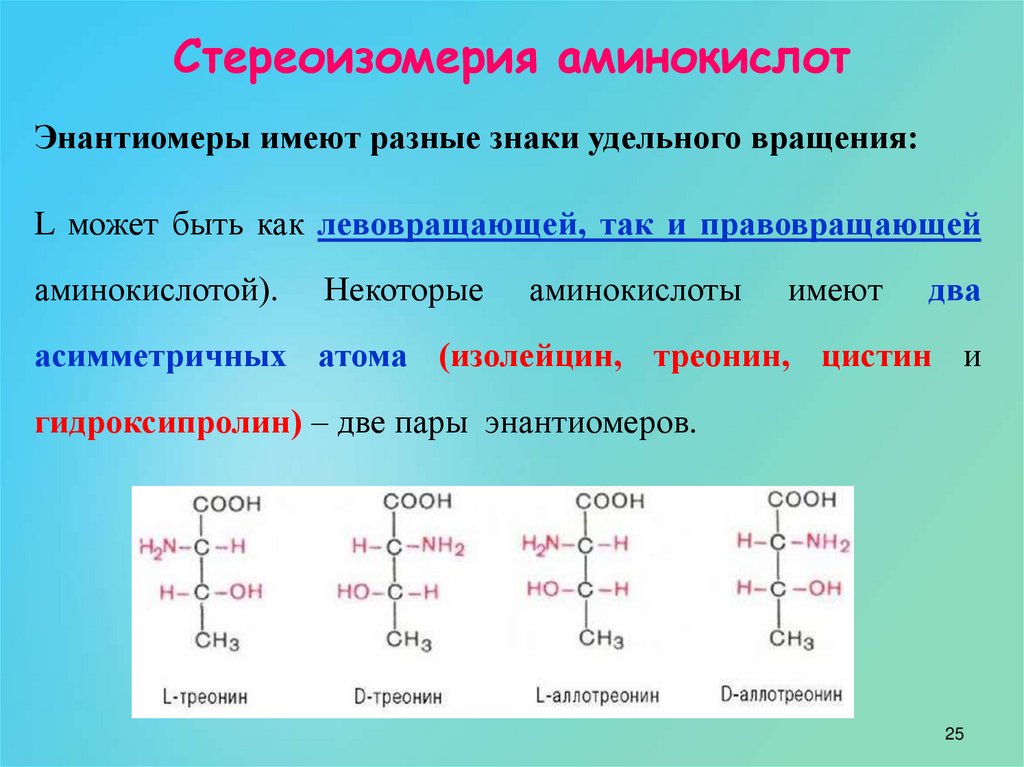
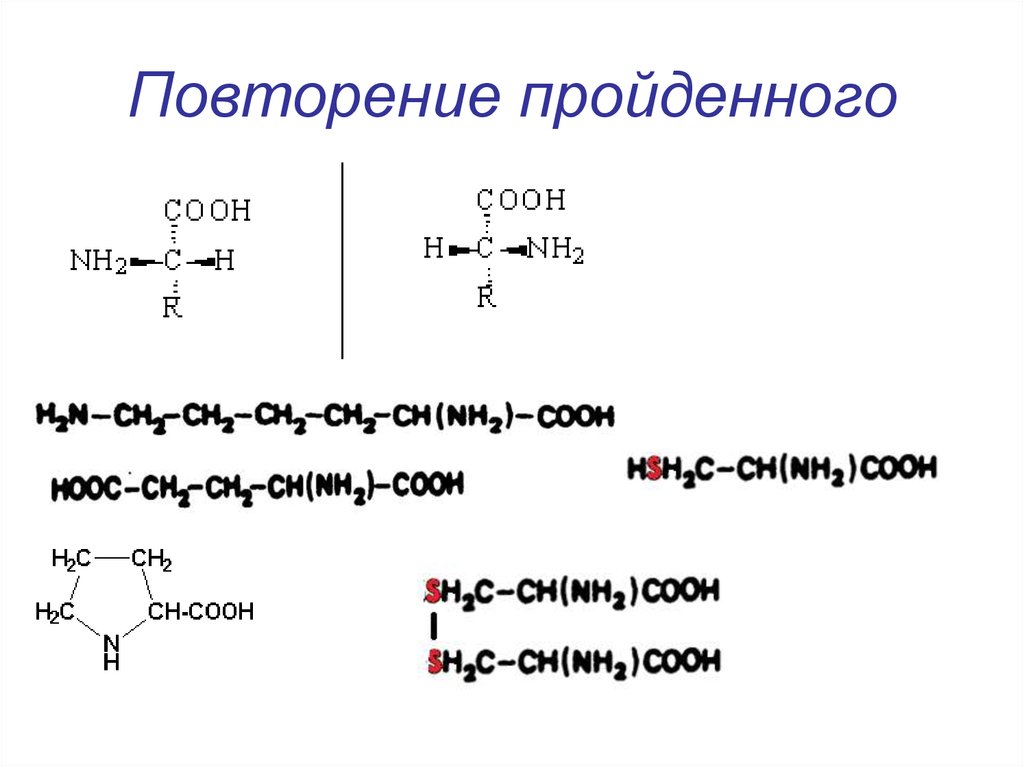
Изменяемыми частями аминокислоты является: Самостоятельная работа «Молекулярный уровень» 9 кл
Тест по теме: «Молекулярный уровень»
Откройте доступ к огромной базе готовых материалов учителя на каждый урок с возможностью удалённого управления…
СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Выбрать материалы
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока
Данная разработка позволить проверить уровень усвоения усвоения обучающихся по теме: «Молекулярный уровень»
Вопрос 1
Какое из названных химических соединений не является биополимером?
Варианты ответов
- белок
- глюкоза
- дезоксирибонуклеиновая кислота
- целлюлоза
Вопрос 2
Изменяемыми частями аминокислоты являются:
Варианты ответов
- аминогруппа и карбоксильная группа;
- радикал
- карбоксильная группа.

- радикал и карбоксильная группа.
Вопрос 3
В процессе биохимических реакций ферменты:
Варианты ответов
- ускоряют реакции, а сами при этом не изменяются;
- ускоряют реакции и изменяются в результате реакции
- замедляют реакции, не изменяясь;
- замедляют реакции, изменяясь.
Вопрос 4
Мономерами ДНК и РНК являются:
Варианты ответов
- азотистые основания;
- дезоксирибоза и рибоза;
- азотистые основания и фосфатные группы;
- нуклеотиды.

Вопрос 5
Вторичная структура белка поддерживается:
Варианты ответов
- пептидными связями;
- водородными связями;
- дисульфидными связями;
- связями между радикалами кислот;
Вопрос 6
К полимерам относятся:
Варианты ответов
- крахмал, белок, целлюлоза;
- белок, гликоген, жир;
- целлюлоза, сахароза, крахмал;
- рибоза, белок, жир.

Вопрос 7
К моносахаридам относятся:
Варианты ответов
- лактоза, глюкоза;
- дезоксирибоза, сахароза;
- глюкоза, фруктоза;
- гликоген, мальтоза.
Вопрос 8
Белковая оболочка, в которую заключен геном вируса, называется
Варианты ответов
- вирион
- капсула
- вироид
- капсид
Вопрос 9
В каком случае правильно указан состав нуклеотида ДНК
Варианты ответов
- рибоза, остаток фосфорной кислоты, тимин;
- фосфорная кислота, урацил, дезоксирибоза;
- остаток фосфорной кислоты, дезоксирибоза, аденин;
- фосфорная кислота, рибоза, гуанин.

Вопрос 10
Аминокислоты в молекуле белка соединены посредством:
Варианты ответов
- ионной связи;
- пептидной связи;
- водородной связи;
- связи между радикалами кислот.
Пройти тест
Сохранить у себя:
© 2018,
Трубникова Елена Евгеньевна
706
Амины и Аминокислоты 11 класс с ответами
Тесты по химии 11 класс. Тема: «Амины. Аминокислоты»
Правильный вариант ответа отмечен знаком +
1. Чему равно количество пептидных связей, образованных в процессе последовательного соединения трёх аминокислот?
— 0
— 4
+ 2
— 6
2. Какое из указанных веществ относится к аминам?
Какое из указанных веществ относится к аминам?
+ C2H5NHС2Н5
— C2H5NO2
— C2H5ОН
— CH3Br
3. Радикал какой аминокислоты изображен на рисунке ниже?
— аспарагина
— аланина
+ лизина
— аргинина
4. При каких условиях образуется биполярный ион аминокислоты?
— в процессе химической реакции со щелочами
+ при внутренней нейтрализации
— при реакции с кислотами
— при взаимодействии с галогеноводородами
5. Какое из соединений является гомологом пропиламина?
— изопропиламин
— фениламин
— нитропропан
+ метиламин
6. Укажите общую формулу предельных аминов:
— CnH2n+1N
+ CnH2n+3N
— CnH2n-7NH2
— CnH2nNH2
7.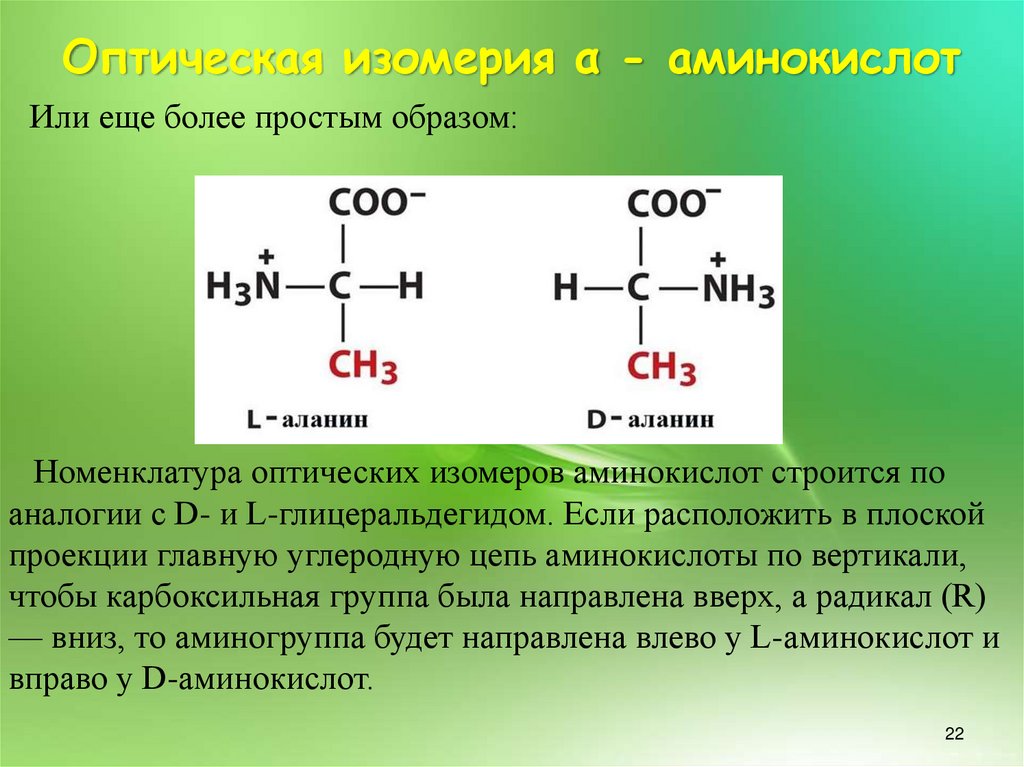 К какому ряду относятся аминокислоты, вращающие изомер вправо?
К какому ряду относятся аминокислоты, вращающие изомер вправо?
— R-ряду
— N-ряду
+ D-ряду
— L-ряду
8. Какое из утверждений об аминокислотах является ложным?
— обладают сладковатым вкусом
— это амфотерные соединения
— являются твёрдыми веществами
+ содержат в составе лишь водород и углерод
9. Продуктами взаимодействия амина с кислородом являются:
— H2O, мочевина
— N2, CO2, H2
+ CO2, H2O, N2
— H2, CO2, NO
тест 10. Аминокислотой является:
— протеин
+ фенилаланин
— интерферон
— альбумин
11. К аминам относится соединение:
12. В процессе химического взаимодействия каких веществ может образоваться пептидная связь?
— анилина с глицином
— этанола с уксусным альдегидом
— глицина с водой
+ аланина с глицином
13. Какое соединение является изомером бутиламина?
Какое соединение является изомером бутиламина?
+ диэтиламин
— нитробутан
— анилин
— аминобутановая кислота
14. Амины являются органическими производными:
— CH4
— HNO3
+ NH3
— H2O
15. Какое количество аминокислот можно отнести к незаменимым?
— 6
— 14
+ 8
— 10
16. Изменяемыми частями аминокислоты являются:
— -NH2 и -COOH
+ R
— -COOH
— R и -COOH
17. Какое из соединений относится к третичным аминам?
+ N, N-диметиланилин
— 1, 3, 5-триаминобензол
— циклобутиламин
— трипропиламин
18. С какими веществами реагирует метиламин?
— водой, оксидом азота (IV)
+ водой, соляной кислотой
— водой, аммиаком
— углекислым газом, раствором хлороводорода
19.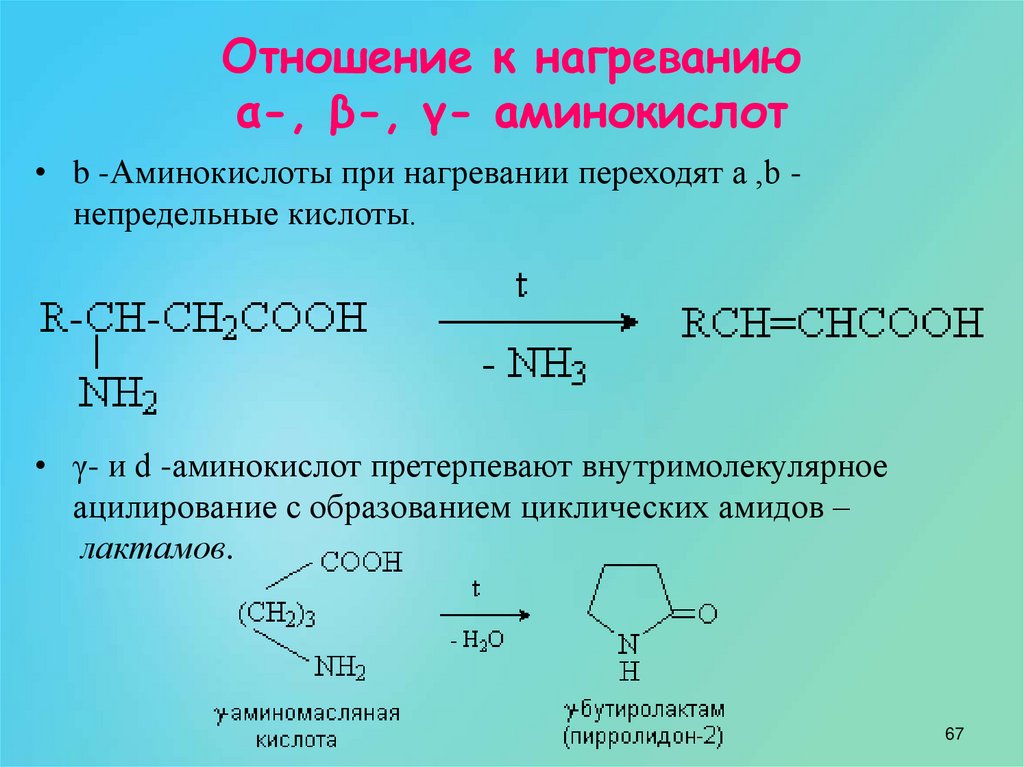 Чему равна массовая доля C в молекуле NH₂-CH₂-COOH?
Чему равна массовая доля C в молекуле NH₂-CH₂-COOH?
— 25 %
— 15 %
— 5 %
+ 32 %
тест-20. Сколько известно изомерных первичных аминов состава С3Н9N?
— 3
— 1
+ 2
— 4
21. С2Н5-NH2 – это формула:
— аминобутана
+ этиламина
— фениламина (анилина)
— нитроглицерина
22. Амины имеют свойства:
— меркаптанов
— кислот
— спиртов
+ амфотерных соединений
23. Незаменимые аминокислоты — это те, которые …
+ не могут образовываться из других аминокислот
— в молекуле которых содержатся только карбоксильные группы
— могут синтезироваться из других аминокислот
— в молекуле которых содержатся лишь аминные группы
24. С этиламином не реагирует:
— O2
+ KOH
— CH₃COOH
— H2SO4
25. Анилин (C₆H₅NH₂) добывают путём химической реакции:
Анилин (C₆H₅NH₂) добывают путём химической реакции:
+ N2 с C6H5Br
— H2O с C₆H₅NO₂
— NH3 с C₆H₅Cl
— HNO3 с C₆H₆
26. Представителем аминокислот является:
27. Условной формулой NH2–R–COOH обозначается класс:
— эфиров
+ аминокислот
— альдегидов
— аминов
28. Укажите название бесцветной жидкости маслянистой консистенции со специфическим запахом, хорошо растворимой в органических растворителях и слабо растворимой в воде:
— триметиламин
— метиламин
— этиламин
+ анилин
29. Аминокислота является структурным компонентом:
— радикалов
+ белков
— спиртов
— ферментов
тест_30. Гидролизом какого вещества можно добыть аминокислоту?
+ C4H8N2O3
— C8H6
— C8H10
— все ответы верные
4.
 3: Аминокислоты — Биология LibreTexts
3: Аминокислоты — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 8393
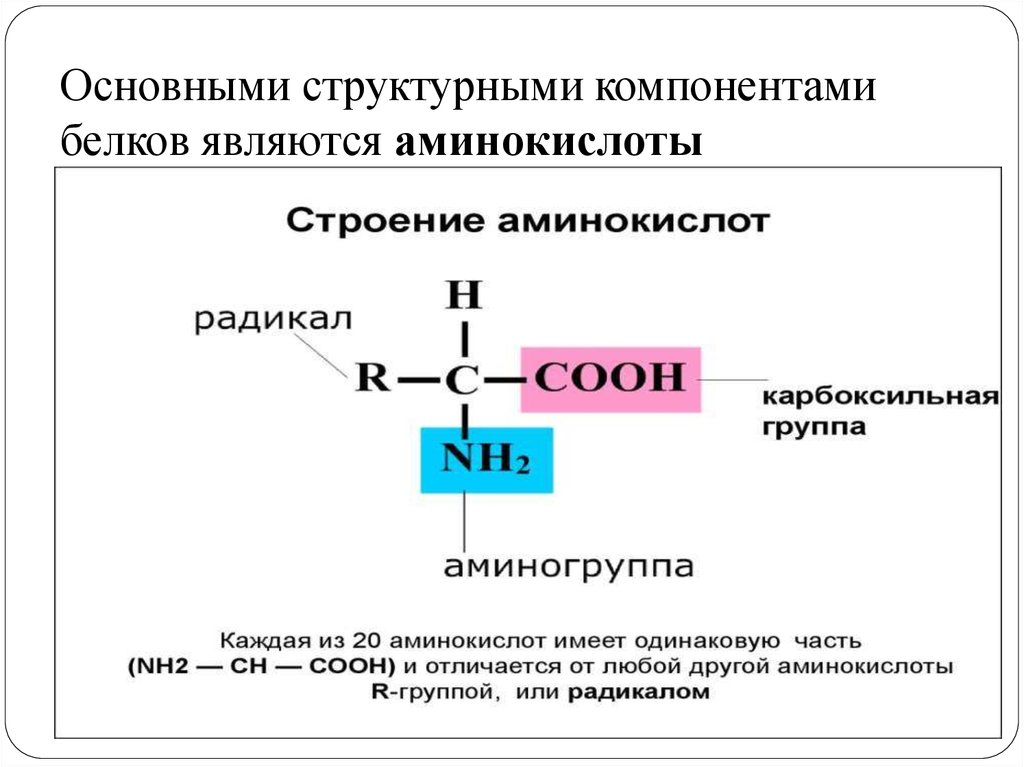
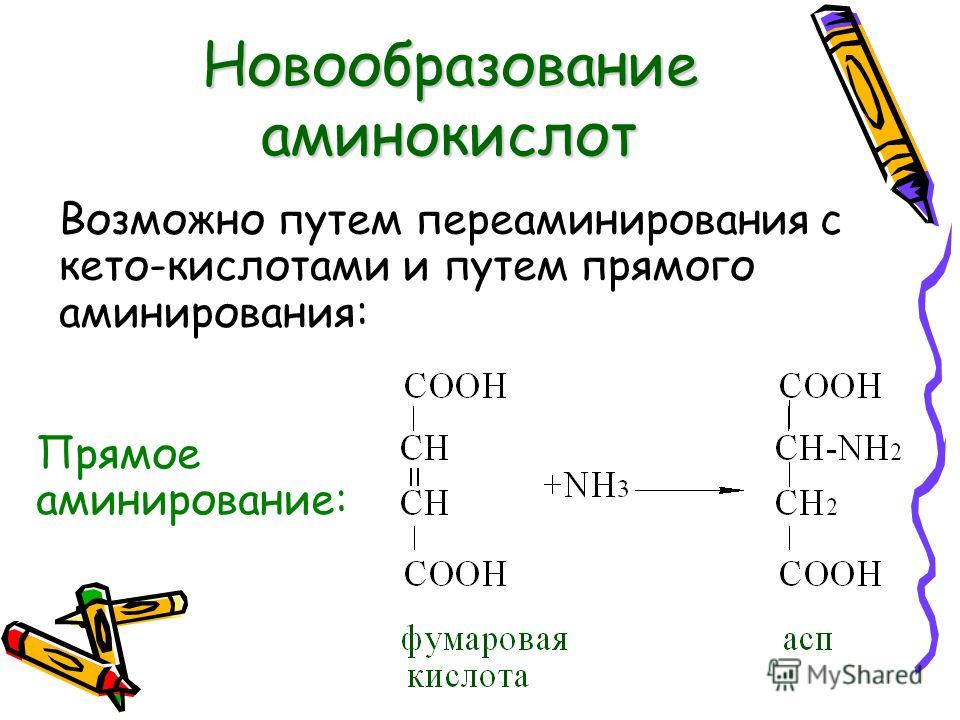
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую структуру ядра, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. Каждая аминокислота также имеет другой атом или группу атомов, связанных с альфа-углеродом, которые также известны как группа R, вариабельная группа или боковая цепь.
Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).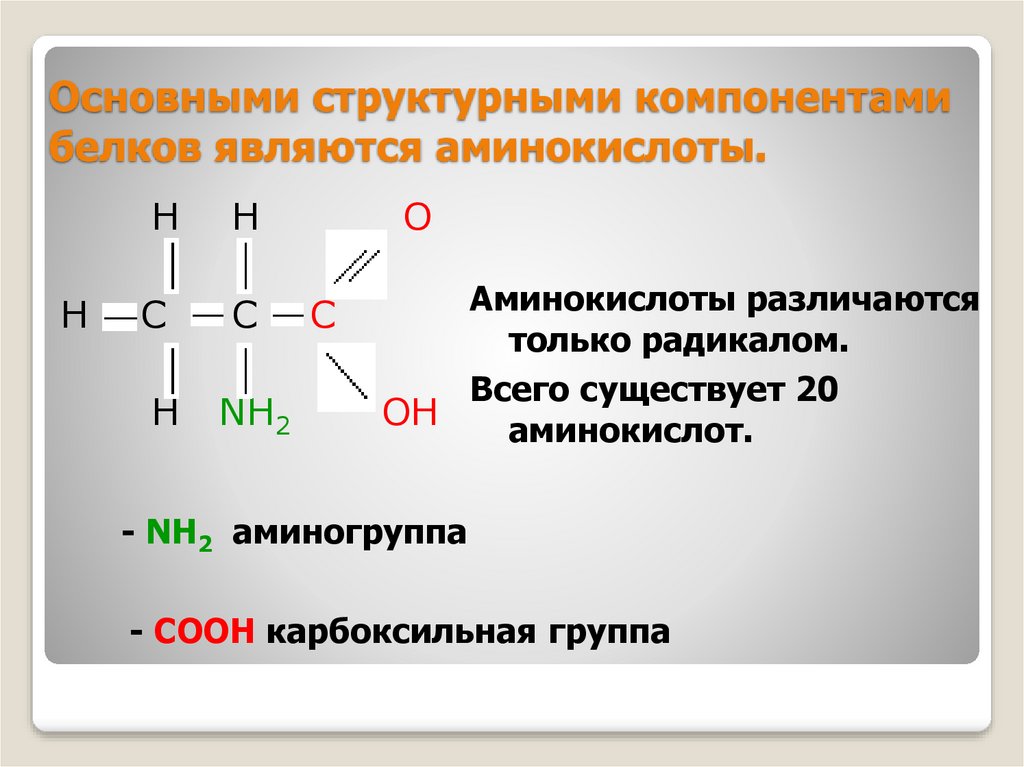
Атрибуция: Marc T. Facciotti (собственная работа)
Примечание: возможное обсуждение основу аминокислоты и ее боковую цепь (R-группу) и (b), чтобы можно было нарисовать общую аминокислоту. Убедитесь, что вы практикуете оба. Вы должны быть в состоянии воссоздать что-то вроде приведенного выше рисунка по памяти (хорошее использование вашего альбома для рисования — попрактиковаться в рисовании этой структуры, пока вы не научитесь делать это с помощью книги или Интернета).
Аминокислотная основа
Название «аминокислота» происходит от того факта, что все аминокислоты содержат в своей основе как аминогруппу, так и карбоксильную группу. В природных белках присутствует 20 распространенных аминокислот, и каждая из них имеет одинаковую основу. Скелет, если не учитывать атомы водорода, состоит из паттерна:
N-C-C
При рассмотрении цепи аминокислот всегда полезно сначала сориентироваться, найдя этот паттерн остова, начиная с N-конца (аминоконец аминокислоты). первая аминокислота) до С-конца (карбоксильный конец последней аминокислоты).
первая аминокислота) до С-конца (карбоксильный конец последней аминокислоты).
Образование пептидной связи является реакцией синтеза дегидратации. Карбоксильная группа первой аминокислоты связана с аминогруппой второй поступающей аминокислоты. При этом высвобождается молекула воды и образуется пептидная связь.
Попробуйте найти основу дипептида, образовавшегося в результате этой реакции. Искомый образец: N-C-C-N-C-C
Авторство: Marc T. Facciotti (собственная работа)
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь , которая образуется в результате реакции дегидратации-синтеза (конденсации). Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды и создавая пептидную связь.
Аминокислота R-группа
Аминокислота R-группа представляет собой термин, который относится к вариабельной группе каждой аминокислоты. Аминокислотный остов у всех аминокислот идентичен, R-группы у всех аминокислот разные. Структуру каждой аминокислоты см. на рисунке ниже.
Аминокислотный остов у всех аминокислот идентичен, R-группы у всех аминокислот разные. Структуру каждой аминокислоты см. на рисунке ниже.
В белках встречается 20 распространенных аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу. R-группы обведены бирюзовым цветом. Заряды назначены при рН ~ 6,0. Отображается полное название, трехбуквенная аббревиатура и однобуквенная аббревиатура.
Атрибуция: Marc T. Facciotti (собственная работа)
Примечание: возможное обсуждение
Давайте подумаем о важности наличия 20 различных аминокислот. Если бы вы использовали биологию для создания белков с нуля, что было бы полезно, если бы в вашем распоряжении было еще 10 различных аминокислот? Кстати, это на самом деле происходит в различных исследовательских лабораториях — почему это может быть потенциально полезно?
Каждая вариабельная группа аминокислоты придает этой аминокислоте определенные химические свойства (кислотные, основные, полярные или неполярные).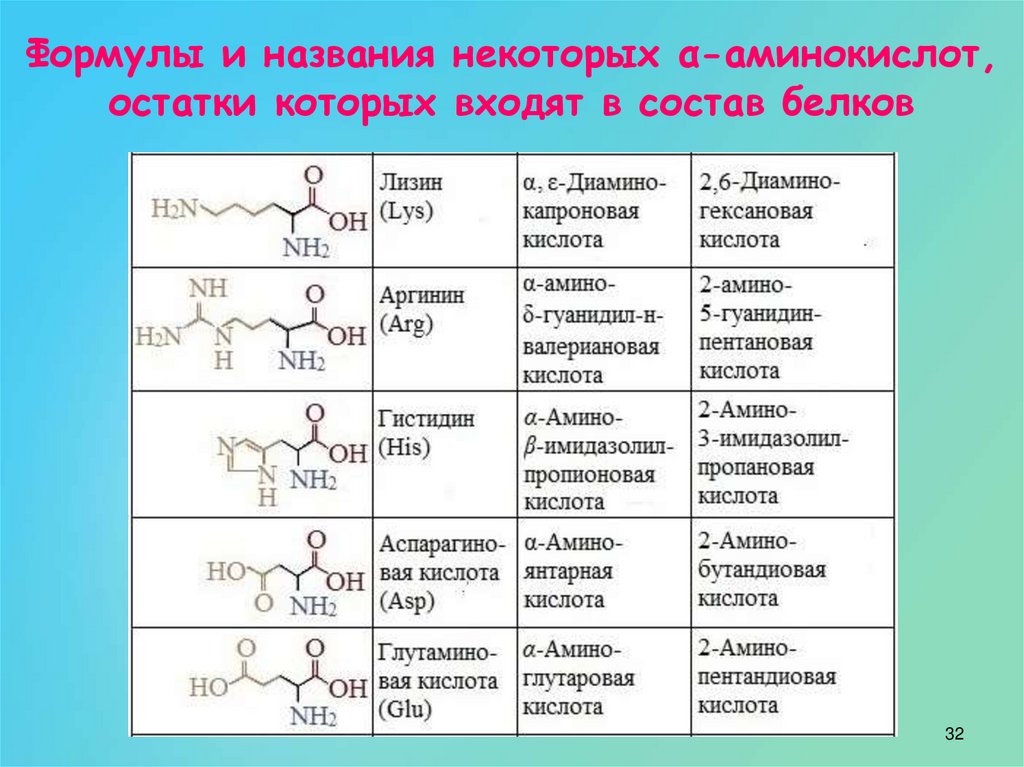 Вы уже должны быть знакомы с большинством функциональных групп R-групп. Химические свойства, связанные со всем набором отдельных функциональных групп, придают каждой R-группе аминокислот уникальный химический потенциал.
Вы уже должны быть знакомы с большинством функциональных групп R-групп. Химические свойства, связанные со всем набором отдельных функциональных групп, придают каждой R-группе аминокислот уникальный химический потенциал.
Например, аминокислоты, такие как валин, метионин и аланин, обычно неполярны или гидрофобны по своей природе, в то время как аминокислоты, такие как серин и треонин, считаются полярными и имеют гидрофильные боковые цепи.
Примечание: Практика
Используя свои знания о функциональных группах, попробуйте классифицировать каждую аминокислоту на рисунке выше как имеющую тенденцию быть полярной или неполярной. Попробуйте найти другие схемы классификации и подумайте, составьте для себя список аминокислот, которые вы бы отнесли к каждой группе. Вы также можете поискать в Интернете схемы классификации аминокислот — вы заметите, что существуют разные способы группировки этих химических веществ на основе химических свойств. Вы даже можете обнаружить, что существуют противоречивые схемы. Попробуйте подумать, почему это может быть, и примените свою химическую логику, чтобы выяснить, почему были приняты определенные схемы классификации и почему определенные аминокислоты были помещены в определенные группы.
Попробуйте подумать, почему это может быть, и примените свою химическую логику, чтобы выяснить, почему были приняты определенные схемы классификации и почему определенные аминокислоты были помещены в определенные группы.
Теги рекомендованные шаблоном: статья:тема
4.3: Аминокислоты распространяются по незаявленной лицензии и были созданы, изменены и/или курированы LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать оглавление
- нет
- Теги

Структура и функция – Аминокислоты – Введение в биохимию
«Это одно из наиболее поразительных обобщений биохимии… что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе». – Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, показанную на рис. 2.1. В центре каждой аминокислоты находится углерод, называемый , и к нему присоединены четыре группы: водород, карбоксильная группа, аминогруппа и R-группа, которую иногда называют вариабельной группой или боковой цепью. Альфа-углерод, карбоновая кислота и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственным вариабельным признаком. За исключением глицина, который имеет R-группу, состоящую из атома водорода, все аминокислоты в белках имеют четыре разные присоединенные к ним группы и, следовательно, могут существовать в двух зеркальных изомерных формах.
Обозначения, используемые в органической химии, обычно не применяются к номенклатуре аминокислот, но аналогичная система использует L и D для описания этих энантиомеров. Природа неравномерно распределила стереоизомеры аминокислот. Вместо этого, за очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и белках, имеет L-конфигурацию.
Природа неравномерно распределила стереоизомеры аминокислот. Вместо этого, за очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и белках, имеет L-конфигурацию.
Рисунок 2.1 – Общая структура аминокислот
В белках содержится 22 аминокислоты, и только 20 из них определены универсальным генетическим кодом. Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенофосфатсинтетазы. Пирролизинсодержащие белки встречаются гораздо реже и в основном приурочены к археям.
Заменимые и незаменимые
Диетологи делят аминокислоты на две группы – незаменимые аминокислоты и заменимые аминокислоты. Незаменимые аминокислоты должны быть включены в наш рацион, потому что наши клетки не могут их синтезировать. То, что необходимо, значительно варьируется от одного организма к другому и даже различается у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Незаменимые аминокислоты должны быть включены в наш рацион, потому что наши клетки не могут их синтезировать. То, что необходимо, значительно варьируется от одного организма к другому и даже различается у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получать из пищи. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 – Заменимые и незаменимые аминокислоты
Небелковые аминокислоты
В клетках также обнаружены аминокислоты, которые не входят в состав белков. Общие примеры включают орнитин и цитруллин. Оба эти соединения являются промежуточными продуктами в цикле мочевины, важном метаболическом пути.
Химия группы R
Таблица 2.2 – Категории аминокислот (на основе свойств группы R)
Аминокислоты можно классифицировать на основе химического состава их R-групп. Полезно классифицировать аминокислоты таким образом, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка. Конкретные деления на категории могут различаться, но все системы представляют собой попытки организовать и понять взаимосвязь между структурой аминокислоты и ее свойствами или поведением как части более крупной системы.
Неполярные аминокислоты
Аминокислоты этой группы включают:
- Аланин (Ala/A)
- Глицин (Gly/G)
- Изолейцин (Иле/И)
- Лейцин (лейцин/л)
- Метионин (Мет/М)
- Валин (Вал/В)
Аминокислоты этой группы имеют неполярные гидрофобные R-группы. Когда они включены в глобулярные белки, они имеют тенденцию упаковываться внутрь среди других гидрофобных групп. В белках, внедряющихся в мембраны или через них, эти аминокислоты могут ориентироваться на гидрофобные части внутренней части мембраны.
Когда они включены в глобулярные белки, они имеют тенденцию упаковываться внутрь среди других гидрофобных групп. В белках, внедряющихся в мембраны или через них, эти аминокислоты могут ориентироваться на гидрофобные части внутренней части мембраны.
Небольшие группы R здесь легче упаковываются в плотные образования. Пролин уникален тем, что имеет группу R, которая загибается назад и ковалентно связывается с основной цепью аминокислоты, создавая более жесткий элемент в белковой цепи, который уменьшает свободное движение полипептидной цепи. Кроме того, пролин может подвергаться реакциям гидроксилирования, стабилизирующим структуру белка. Это происходит в коллагене с помощью аскорбиновой кислоты (витамина С). Одним из симптомов синдрома дефицита витамина С «цинги» является снижение качества коллагена в тканях, включая кожу и десны. Это может привести к ухудшению состояния и потере зубов.
Рисунок 2.2 – Свойства боковой цепи аминокислот Википедия
Рисунок 2. 3 – Неполярные аминокислоты
3 – Неполярные аминокислоты
Кислые аминокислоты (боковые цепи карбоновой кислоты)
Аминокислоты этой группы включают:
- Аспарагиновая кислота (Asp/D)
- Глутаминовая кислота (Glu/E)
Рисунок 2.4 – Карбоксильные аминокислоты
Каждая из этих аминокислот содержит карбоксильную группу как часть вариабельной группы. При физиологических значениях pH эти группы существуют в основном в депротонированном состоянии. Их легко спутать, если они нарисованы в таком состоянии, потому что в их названия входит слово «кислота», а в структуре нет ионизируемого протона, а заряд группы R отрицательный.
Помимо своей роли в качестве строительного блока белков, глутаминовая кислота (с депротонированной формой, называемой «глутамат») является нейротрансмиттером. Он также распознается рецептором во рту, способствуя вкусовым ощущениям, описанным как «умами». Многие продукты содержат значительное количество глутамата, который распознается нашими вкусовыми рецепторами и побуждает нас есть эти вещества. Эти продукты часто содержат расщепленный белок: вареное мясо, ферментированные соусы, такие как вустерширский или соевый, тахини, бульоны и дрожжевые экстракты.
Эти продукты часто содержат расщепленный белок: вареное мясо, ферментированные соусы, такие как вустерширский или соевый, тахини, бульоны и дрожжевые экстракты.
Основные аминокислоты (азотсодержащие боковые цепи)
В эту группу аминокислот входят:
- Аргинин (Arg/R)
- Гистидин (His/H)
- Лизин (Lys/К)
Рисунок 2.5 – Аминокислоты
Вариабельная группа в каждой из этих аминокислот содержит азот, который придает группе возможность существовать в протонированном и депротонированном состояниях. Их часто называют основными, но также часто рисуют в их протонированном состоянии, которое более распространено при физиологическом pH.
Аргинин (Arg/R) интересен тем, что это незаменимая диетическая аминокислота для недоношенных детей, которые не могут ее синтезировать. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине, и для правильного заживления может потребоваться прием пищи.
Гистидин содержит азотсодержащую функциональную группу имидазола, которая имеет pKa 6. Это означает, что он может захватывать или отдавать ионы водорода в ответ на небольшие изменения pH. В белках гистидин часто играет важную роль, участвуя непосредственно в реакциях переноса ионов водорода.
Группу R лизина часто химически модифицируют, чтобы он мог образовывать необычные связи с другими химическими группами или принимать участие в специфических химических реакциях. Лизин часто добавляют в корма для животных, поскольку он является лимитирующей аминокислотой и необходим для оптимизации роста животных, выращиваемых для потребления.
Ароматические аминокислоты
Рисунок 2.6 – Ароматические аминокислоты
Аминокислоты с ароматическими боковыми цепями включают:
- Фенилаланин (Phe/F)
- Триптофан (Trp/W)
- Тирозин (Tyr/Y)
Эти аминокислоты включены в структуру белка, но также служат предшественниками в некоторых важных биохимических путях, ведущих к выработке гормонов, таких как L-Dopa и серотонин.
Гидроксиаминокислоты
Эта группа включает
- Треонин (Thr/T)
- Серин (Сер/С)
- Тирозин (уже обсуждался как ароматическая аминокислота)
Аминокислоты этой группы содержат спиртовые группы, которые могут образовывать водородные связи. В составе белковых молекул они гидрофильны и могут ориентироваться наружу в водной среде. Спиртовая группа подвергается химическим реакциям или модификациям, например, когда углеводные группы ковалентно связаны с белками.
Рисунок 2.7 – Гидроксиаминокислоты
Рисунок 2.8 – Свойства аминокислот Википедия
Другие аминокислоты
- Аспарагин (Asn/N) представляет собой полярную аминокислоту. Амид функциональной группы не является основным.
- Цистеин (Cys/C)
- Глютамин (Gln/Q)
Рисунок 2.9 – Другие аминокислоты
Цистеин, содержащий тиол. Тиолы могут реагировать друг с другом путем окисления с образованием дисульфидных связей, содержащих два ковалентно связанных атома серы. Вариабельные группы метионина в белковых цепях могут вступать в такие реакции, ковалентно связывая цепи друг с другом короткой связью. Такие дисульфидные связи или мостики ограничивают подвижность белковых цепей и способствуют формированию более определенных структур.
Вариабельные группы метионина в белковых цепях могут вступать в такие реакции, ковалентно связывая цепи друг с другом короткой связью. Такие дисульфидные связи или мостики ограничивают подвижность белковых цепей и способствуют формированию более определенных структур.
- Селеноцистеин (Sec/U) является компонентом селенопротеинов, встречающихся во всех царствах жизни. Двадцать пять белков человека содержат селеноцистеин. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы. Он не закодирован стандартным генетическим кодом.
- Пирролизин (Pyl/O) — двадцать вторая аминокислота, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами.
Ионизирующие группы
Некоторые, но не все аминокислоты имеют R-группы, способные к ионизации. Тогда заряд белка возникает из зарядов аминогруппы, карбоксильной группы и суммы зарядов ионизированных R-групп. Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.
Рисунок 2.10 – Кривая титрования аспарагиновой кислоты Изображение Пенелопы Ирвинг
Строительные полипептиды
Хотя аминокислоты выполняют в клетках и другие функции, их наиболее важная роль заключается в том, что они входят в состав белков. Белки, как мы отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, при которых карбоксильная группа одной аминокислоты присоединяется к аминогруппе следующей с потерей молекулы воды. Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много).