Из каких трех групп состоят аминокислоты: § 6. Аминокислоты как структурные элементы белков
Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
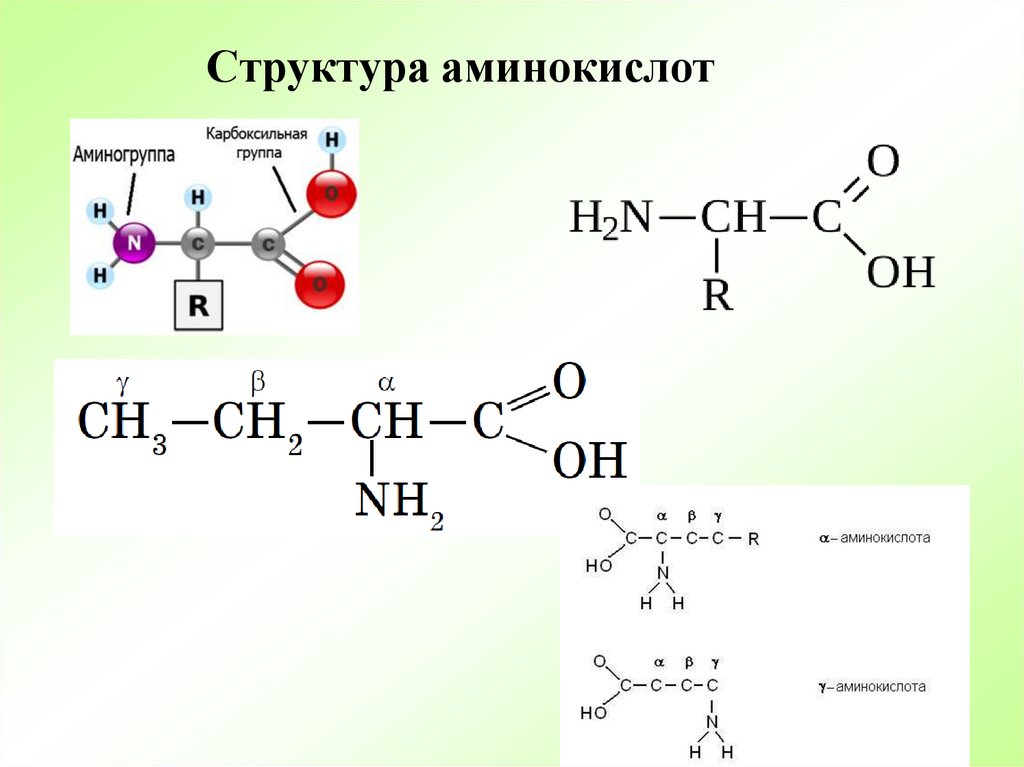
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
Заменимые аминокислоты — это те, которые организм может синтезировать самостоятельно или получить с продуктами питания. К ним относятся:
| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | орнитин | цистеин |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков — глобула (сфера или эллипс).
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.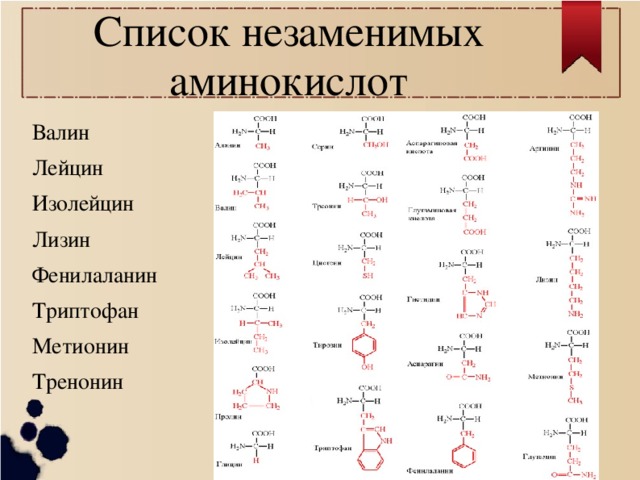
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
«Из каких химических элементов в основном состоят аминокислоты?» — Яндекс Кью
Популярное
Сообщества
ХимияХимические элементыАминокислоты
Анонимный вопрос
661Z»>5 марта 2019 ·
3,4 K
ОтветитьУточнить
Эргамин
17
Пишем о пользе Аминокислот, чистом белке и укреплении иммунитета · 12 янв 2021 · ergamin.ru
Отвечает
Александр Цандер
Аминокислоты — структурные элементы, своеобразные кирпичики из которых организм создает белок. Любая аминокислота на 16 % состоит из азота и включает в себя углерод, водород, кислород.
Если точнее, в каждой аминокислоте присутствует:
• карбоксильная группа (-СООН) — функциональная одновалентная группа из карбоновых кислот. Она отвечает за кислотные свойства органического соединения.
• аминогруппа (-NН2)- функциональная химическая одновалентная группа, по сути органический радикал из атома азота и двух — водорода.
Таким образом аминокислоты можно считать производными карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.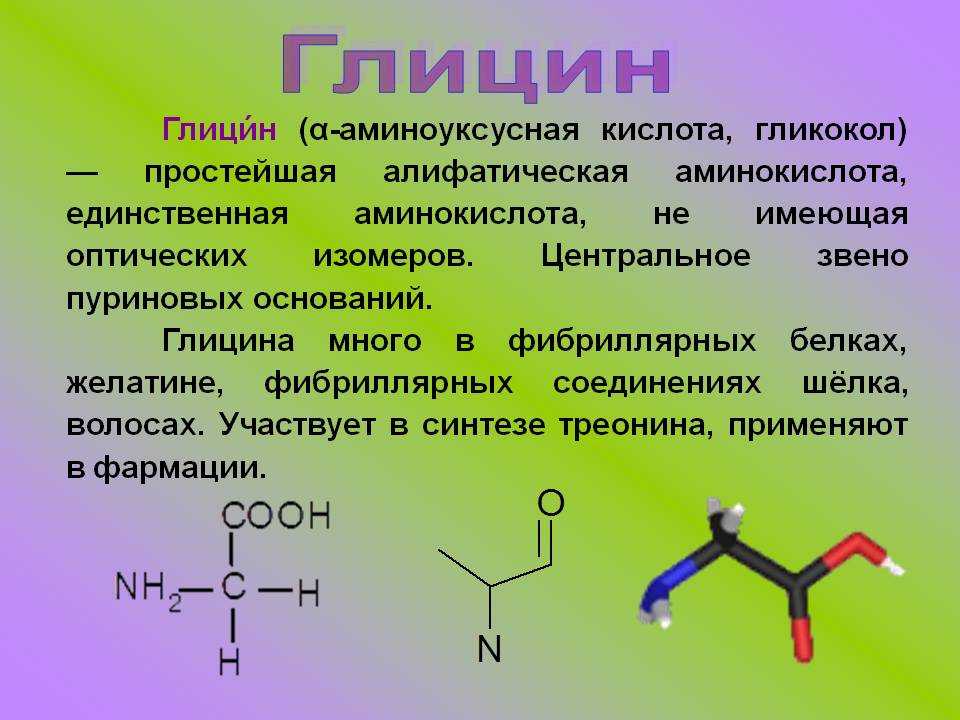
В состав некоторых аминокислот входит сера.
С уважением, Александр и команда ergamin.ru
Перейти на ergamin.ru
Максим Иванов
15 января 2021
Довольно странно утверждение «любая аминокислота на 16% состоит из азота». Поскольку аминокислоты отличаются… Читать дальше
Комментировать ответ…Комментировать…
Лия Менделеева
1,8 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 6 мар 2019 ·
mendo_him
Что такое аминокислоты? 🤯😊
Это органические соединения, в составе которых есть амминогруппа — Nh3 и карбоксильная группа — COOH
Это общий вид формулы всех аминокислот😉
R-это углеводородный радикал) Исходя из названия он образован атомами углерода С и водорода Н
Таким образом, в состав всех аминокислот входит С, Н, N, O😊 Читать далее
1 эксперт не согласен
Максим Иванов
возражает
15 января 2021
R вовсе не обязан быть углеводородным! Радикалы даже биогенных аминокислот содержат в т.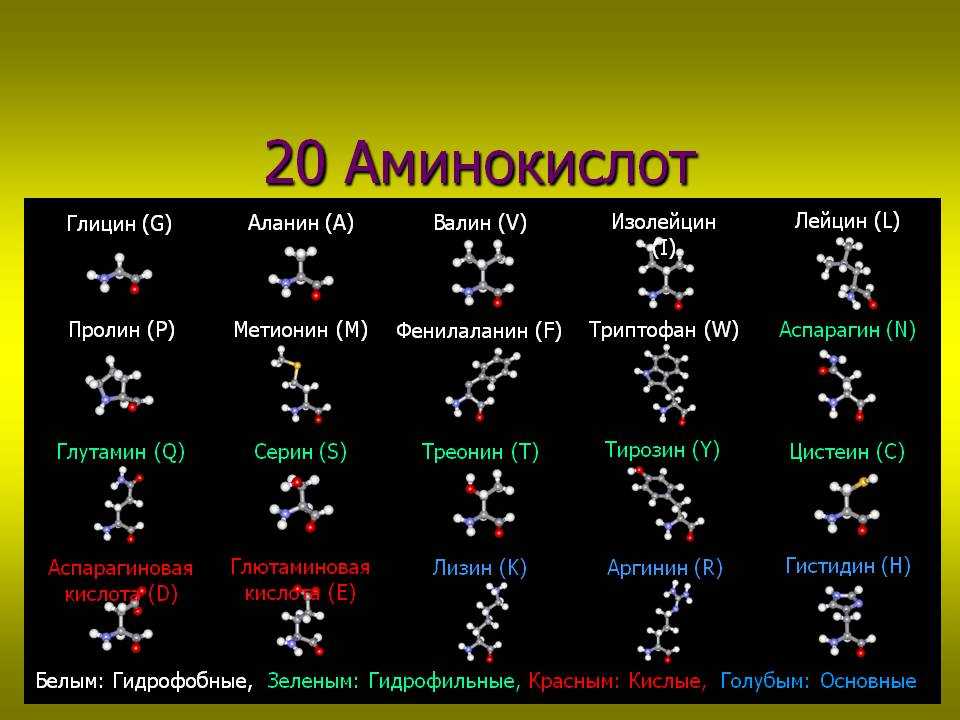 ч. амидные, аминные, гидрок… Читать дальше
ч. амидные, аминные, гидрок… Читать дальше
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
И.к. Аминокислоты Азотсодержащие аминокислоты необходимы для жизни и являются строительными блоками белков. Аминокислоты, как древние и вездесущие молекулы, были использованы эволюцией для различных целей в живых системах. Важность чтения этого раздела ограничена теми, кто хочет визуализировать структуры. 1.c.i Аминокислота Структура: Рис. 1.c.1. Общая структура а-аминокислоты. 1.c.ii Общие свойства: 1.c.iii. Пептидные связи: II.c.iv. Классификация:
Таблица 1.c.4.1: 20 стандартных аминокислот. Боковые цепи неполярных аминокислот имеют различные формы и размеры, в основном по этой классификации насчитывается девять кислот.  Незаряженные полярные боковые цепи содержат гидроксильную, амидную или тиоловую группы  Заряженные полярные боковые цепи, они заряжены положительно или отрицательно. Пять аминокислот способствуют этому типу. Боковые цепи заряжены положительно; это лизин с бутиламмониевой боковой цепью, аргинин с гуанидиновой группой и гистидин с имидазолиевой частью. 1.с.в. Номенклатура: На этом мы заканчиваем наш разговор об аминокислотах, и вам не нужно о них беспокоиться, пока не появится представление о белке. Во время трансляции генетический код в виде РНК транслируется в белковую последовательность, как на рис. Рис. 2.c.1 синтез последовательности белка из мРНК |
2.2: Структура и функция – Аминокислоты
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 7809
- Кевин Ахерн, Индира Раджагопал и Таралин Тан
- Университет штата Орегон
Источник: BiochemFFA_2_1.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.
Все белки на Земле состоят из одних и тех же 20 аминокислот. Связанные вместе в длинные цепи, называемые полипептидами, аминокислоты являются строительными блоками для огромного количества белков, присутствующих во всех живых клетках.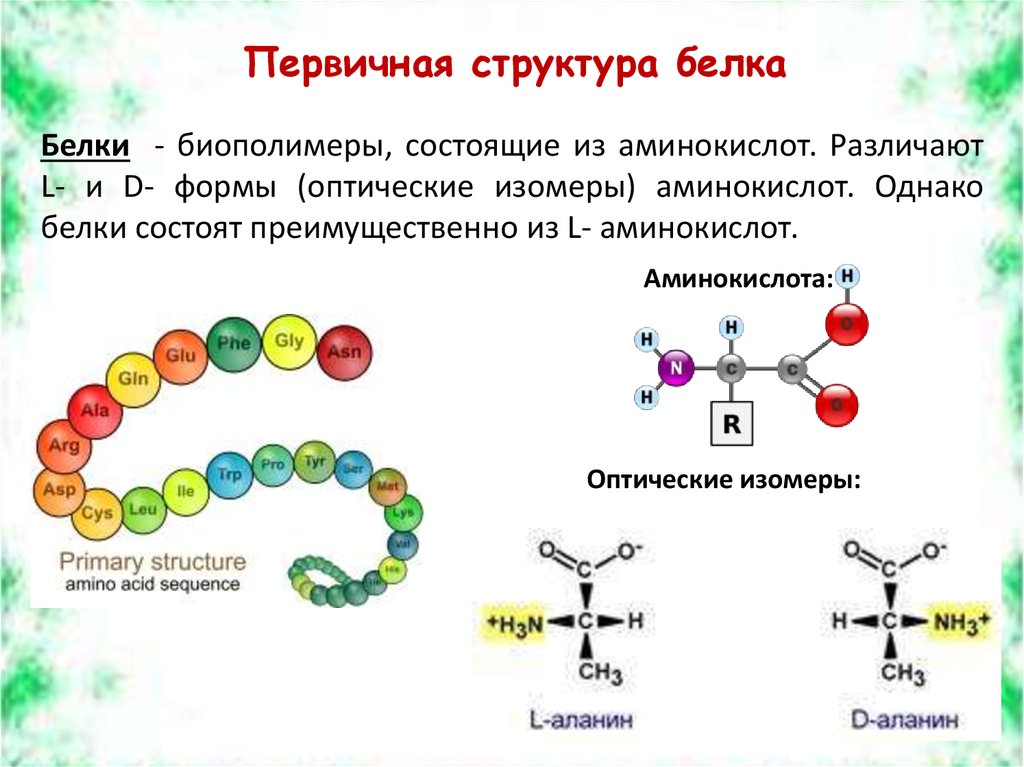
«Это одно из наиболее поразительных обобщений биохимии… что двадцать аминокислот и четыре основания, с небольшими оговорками, одинаковы во всей Природе». — Фрэнсис Крик
Все аминокислоты имеют одинаковую основную структуру, которая показана на рис. 2.1. В «центре» каждой аминокислоты находится углерод, называемый α-углеродом, и к нему присоединены четыре группы: водород, α-карбоксильная группа, α-аминогруппа и R-группа, которую иногда называют боковая цепь. α-углеродная, карбоксильная и аминогруппы являются общими для всех аминокислот, поэтому R-группа является единственной уникальной особенностью каждой аминокислоты. (Небольшим исключением из этой структуры является структура пролина, в котором конец R-группы присоединен к α-амину.) За исключением глицина, R-группа которого состоит из атома водорода, все аминокислоты в белках связаны с четырьмя различными группами и, следовательно, могут существовать в двух формах зеркального отображения, L и D.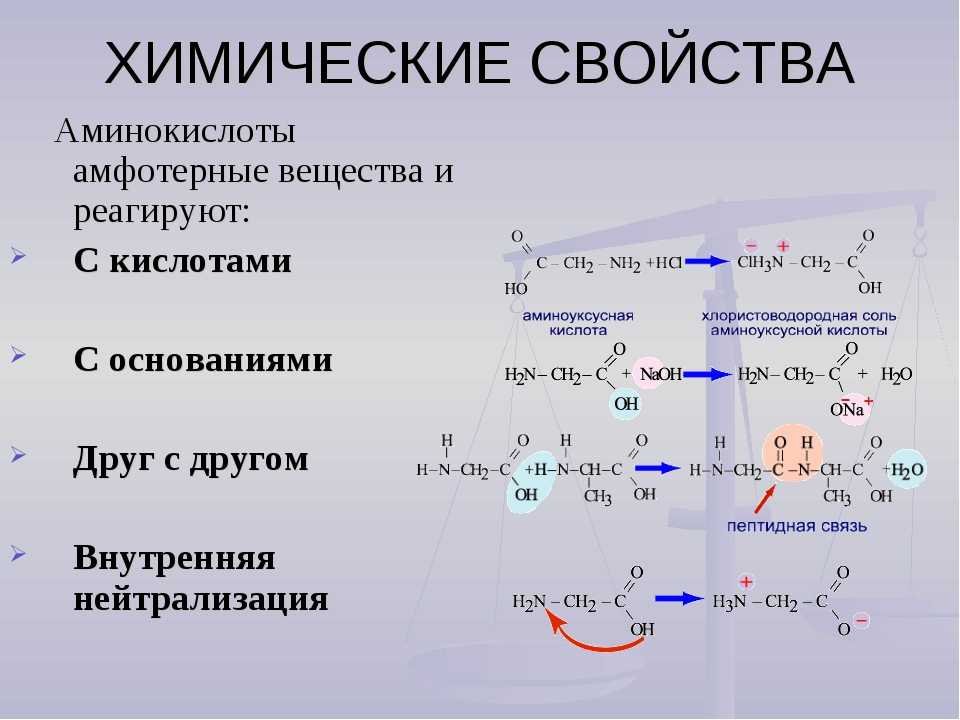 За очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и белках, имеет L-конфигурацию.
За очень небольшими исключениями, каждая аминокислота, обнаруженная в клетках и белках, имеет L-конфигурацию.
Рисунок 2.1 – Общая структура аминокислот
В белках содержится 22 аминокислоты, и только 20 из них определены универсальным генетическим кодом. Другие, селеноцистеин и пирролизин, используют тРНК, которые способны образовывать пары оснований со стоп-кодонами в мРНК во время трансляции. Когда это происходит, эти необычные аминокислоты могут быть включены в белки. Ферменты, содержащие селеноцистеин, например, включают глутатионпероксидазы, тетрайодтиронин-5′-дейодиназы, тиоредоксинредуктазы, формиатдегидрогеназы, глицинредуктазы и селенофосфатсинтетазы. Пирролизинсодержащие белки встречаются гораздо реже и в основном приурочены к археям.
Заменимые и незаменимые
Диетологи делят аминокислоты на две группы – незаменимые аминокислоты (должны быть в рационе, потому что клетки не могут их синтезировать) и заменимые аминокислоты (могут вырабатываться клетками).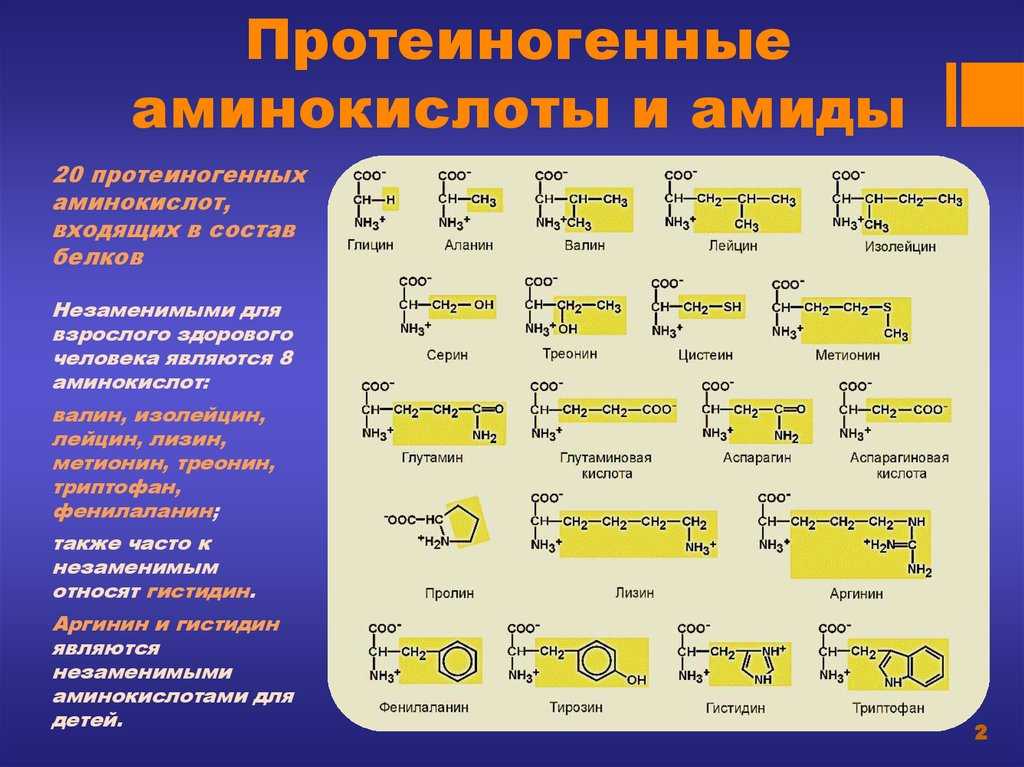 Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Эта классификация аминокислот имеет мало общего со структурой аминокислот. Незаменимые аминокислоты значительно различаются от одного организма к другому и даже различаются у людей, в зависимости от того, взрослые они или дети. В таблице 2.1 показаны незаменимые и заменимые аминокислоты в организме человека.
Некоторые аминокислоты, которые обычно не являются незаменимыми, в определенных случаях может потребоваться получать с пищей. Людям, которые не синтезируют достаточное количество аргинина, цистеина, глутамина, пролина, селеноцистеина, серина и тирозина, например, из-за болезни, могут потребоваться пищевые добавки, содержащие эти аминокислоты.
Таблица 2.1 – Заменимые и незаменимые аминокислоты
Небелковые аминокислоты
В клетках также обнаружены α-аминокислоты, которые не включены в белки. Общие из них включают орнитин и цитруллин. Оба этих соединения являются промежуточными продуктами цикла мочевины. Орнитин является метаболическим предшественником аргинина, а цитруллин может образовываться при распаде аргинина. Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин является побочным продуктом метаболизма. Иногда его используют в качестве пищевой добавки для уменьшения мышечной усталости. 9Таблица 2.2. Категории аминокислот (на основе свойств R-групп) Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы классифицируем тирозин и как ароматическую аминокислоту, и как гидроксильную аминокислоту. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка.
Последняя реакция производит оксид азота, важную сигнальную молекулу. Цитруллин является побочным продуктом метаболизма. Иногда его используют в качестве пищевой добавки для уменьшения мышечной усталости. 9Таблица 2.2. Категории аминокислот (на основе свойств R-групп) Если вы сравните группы аминокислот в разных учебниках, вы увидите разные названия категорий и (иногда) одну и ту же аминокислоту, классифицируемую разными авторами по-разному. Действительно, мы классифицируем тирозин и как ароматическую аминокислоту, и как гидроксильную аминокислоту. Полезно классифицировать аминокислоты на основе их R-групп, потому что именно эти боковые цепи придают каждой аминокислоте ее характерные свойства. Таким образом, можно ожидать, что аминокислоты с (химически) сходными боковыми группами будут функционировать сходным образом, например, во время фолдинга белка.
Неполярные аминокислоты
- Аланин (Ala/A) является одной из самых распространенных аминокислот, обнаруженных в белках, занимая второе место по распространенности после лейцина.
 D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.
D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG. - Глицин (Gly/G) представляет собой аминокислоту с самой короткой боковой цепью, имеющую R-группу, состоящую только из одного водорода. В результате глицин является единственной аминокислотой, которая не является хиральной. Его небольшая боковая цепь позволяет ему легко вписываться как в гидрофобные, так и в гидрофильные среды.
Рисунок 2.2. Свойства боковой цепи аминокислот Википедия
- Глицин определяется в генетическом коде как GGU, GGC, GGA и GGG. Для человека это несущественно.
- Изолейцин (Ile/I) представляет собой незаменимую аминокислоту, кодируемую AUU, AUC и AUA. Он имеет гидрофобную боковую цепь, а также хиральную боковую цепь.
- Лейцин (Leu/L) представляет собой аминокислоту с разветвленной цепью, гидрофобную и незаменимую. Лейцин является единственной диетической аминокислотой, которая напрямую стимулирует синтез белка в мышцах, но следует соблюдать осторожность, поскольку 1) существуют противоречивые исследования и 2) токсичность лейцина опасна, что приводит к «четырем D»: диарее, дерматиту, деменции.
 и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG. - Метионин (Met/M) является незаменимой аминокислотой, которая является одной из двух серосодержащих аминокислот, а другой является цистеин. Метионин неполярен и кодируется исключительно кодоном AUG. Это аминокислота-«инициатор» в синтезе белка, она первой включается в белковые цепи. В прокариотических клетках формилируется первый метионин в белке.
Рисунок 2.3 – Неполярные аминокислоты
- Пролин (Pro/P) – единственная аминокислота, встречающаяся в белках с R-группой, которая соединяется со своей собственной α-аминогруппой, образуя вторичный амин и кольцо. Пролин является заменимой аминокислотой и кодируется CCU, CCC, CCA и CCG. Это наименее гибкая из белковых аминокислот и, таким образом, придает конформационную жесткость, когда присутствует в белке. Присутствие пролина в белке влияет на его вторичную структуру. Это разрушитель α-спиралей и β-цепей. Пролин часто подвергается гидроксилированию в коллагене (для реакции требуется витамин С — аскорбат), что повышает конформационную стабильность белка.
 Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода.
Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода. - Валин (Val/V) — незаменимая неполярная аминокислота, синтезируемая в растениях. Это примечательно для гемоглобина, поскольку, когда он заменяет глутаминовую кислоту в положении номер шесть, он вызывает аномальную агрегацию гемоглобина в условиях низкого содержания кислорода, что приводит к серповидно-клеточной анемии. Валин кодируется в генетическом коде GUU, GUC, GUA и GUG.
Карбоксильные аминокислоты
- Аспарагиновая кислота (Asp/D) — заменимая аминокислота с карбоксильной группой в R-группе. Его легко получить переаминированием оксалоацетата. С рКа 3,9, боковая цепь аспарагиновой кислоты заряжена отрицательно при физиологическом рН. Аспарагиновая кислота определяется в генетическом коде кодонами GAU и GAC.
- Глутаминовая кислота (Glu/E), кодируемая GAA и GAG, является заменимой аминокислотой, которую легко получить путем трансаминирования α-кетоглутарата.
 Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Рисунок 2.4 – Карбоксильные аминокислоты
Аминовые аминокислоты
- Аргинин (Arg/R) представляет собой аминокислоту, которая в одних случаях является незаменимой, а в других — заменимой. Недоношенные дети не могут синтезировать аргинин. Кроме того, хирургическая травма, сепсис и ожоги увеличивают потребность в аргинине. Однако большинству людей добавки с аргинином не нужны. Боковая цепь аргинина содержит сложную группу гуанидиния с рКа более 12, что делает его положительно заряженным при клеточном рН. Он кодируется шестью кодонами — CGU, CGC, CGA, CGG, AGA и AGG.
- Гистидин (His/H) — единственная из белковых аминокислот, содержащая функциональную группу имидазола. Это незаменимая аминокислота для человека и других млекопитающих. С pKa боковой цепи, равным 6, его заряд может легко измениться при небольшом изменении pH.
 Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
Рисунок 2.5 – Аминокислоты
- Лизин (Lys/K) – незаменимая аминокислота, кодируемая AAA и AAG. Он имеет R-группу, которая может легко ионизироваться с зарядом +1 при физиологическом pH и может быть посттрансляционно модифицирована с образованием ацетиллизина, гидроксилизина и метиллизина. Он также может быть убиквитинирован, сумоилирован, неддилирован, биотинилирован, карбоксилирован и купилирован. O-гликозилирование гидроксилизина используется для пометки белков для экспорта из клетки. Лизин часто добавляют в корма для животных, поскольку он является лимитирующей аминокислотой и необходим для оптимизации роста свиней и цыплят.
Ароматические аминокислоты
Рисунок 2.6. Ароматические аминокислоты
- Фенилаланин (Phe/F) — неполярная незаменимая аминокислота, кодируемая UUU и UUC. Это метаболический предшественник тирозина.
 Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама.
Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама. - Триптофан (Trp/W) представляет собой незаменимую аминокислоту, содержащую индольную функциональную группу. Это метаболический предшественник серотонина, ниацина и (в растениях) фитогормона ауксина. Несмотря на то, что он считается снотворным, нет четких результатов исследований, указывающих на это.
- Тирозин (Tyr/Y) — заменимая аминокислота, кодируемая UAC и UAU. Он является мишенью для фосфорилирования белков тирозиновыми протеинкиназами и играет роль в процессах передачи сигналов. В дофаминергических клетках головного мозга тирозингидроксилаза превращает тирозин в L-допу, непосредственный предшественник дофамина. Дофамин, в свою очередь, является предшественником норадреналина и адреналина. Тирозин также является предшественником гормонов щитовидной железы и меланина.

Гидроксиаминокислоты
- Серин (Ser/S) — одна из трех аминокислот, имеющих R-группу с гидроксилом (остальные — треонин и тирозин). Он кодируется UCU, UCC, UCA, UGC, AGU и AGC. Будучи способной образовывать водородные связи с водой, она классифицируется как полярная аминокислота. Для человека это не принципиально. Серин является предшественником многих важных клеточных соединений, в том числе пуринов, пиримидинов, сфинголипидов, фолиевой кислоты и аминокислот глицина, цистеина и триптофана. Гидроксильная группа серина в белках является мишенью для фосфорилирования некоторыми протеинкиназами. Серин также является частью каталитической триады сериновых протеаз.
Рисунок 2.7 – Гидроксиаминокислоты
- Треонин (Thr/T) – незаменимая полярная аминокислота. Это одна из трех аминокислот, несущих гидроксильную группу (другими являются серин и тирозин), и поэтому она является мишенью для фосфорилирования в белках. Он также является мишенью для гликозилирования белков.
 Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Тирозин — см. ЗДЕСЬ.
Рисунок 2.8 – Свойства аминокислот Википедия
Другие аминокислоты
- Аспарагин (Asn/N) – заменимая аминокислота, кодируемая AAU и AAC. Его карбоксиамид в R-группе придает ему полярность. Аспарагин участвует в образовании акриламида в продуктах, приготовленных при высоких температурах (жарка во фритюре), когда он реагирует с карбонильными группами. Аспарагин может быть получен в организме из аспартата путем реакции амидирования с амином из глютамина. При распаде аспарагина образуется малат, который может окисляться в цикле лимонной кислоты.
- Цистеин (Cys/C) — единственная аминокислота с сульфгидрильной группой в боковой цепи.
 Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
Рисунок 2.9- Другие аминокислоты
- Глутамин (Gln/Q) – это аминокислота, которая обычно не является незаменимой для человека, но может быть у людей, подвергающихся интенсивным спортивным тренировкам, или с желудочно-кишечными расстройствами. Он имеет карбоксиамидную боковую цепь, которая обычно не ионизируется при физиологических pH, но придает полярность боковой цепи. Глютамин кодируется CAA и CAG и легко производится амидированием глутамата. Глютамин является наиболее распространенной аминокислотой в циркулирующей крови и одной из немногих аминокислот, которые могут преодолевать гематоэнцефалический барьер.

- Селеноцистеин (Sec/U) является компонентом селенопротеинов, встречающихся во всех царствах жизни. Он является компонентом нескольких ферментов, включая глутатионпероксидазы и тиоредоксинредуктазы. Селеноцистеин встраивается в белки по необычной схеме с участием стоп-кодона UGA. Клетки, выращенные в отсутствие селена, обрывают синтез белка на УГА. Однако, когда присутствует селен, некоторые мРНК, которые содержат последовательность вставки селеноцистеина (SECIS), вставляют селеноцистеин, когда встречается UGA. Элемент SECIS имеет характерные нуклеотидные последовательности и паттерны спаривания оснований вторичной структуры. Двадцать пять белков человека содержат селеноцистеин.
- Пирролизин (Pyl/O) представляет собой двадцать вторую аминокислоту, но редко встречается в белках. Как и селеноцистеин, он не закодирован в генетическом коде и должен быть включен необычными способами. Это происходит на стоп-кодонах UAG. Пирролизин обнаружен в метаногенных архейских организмах и по крайней мере в одной метанпродуцирующей бактерии.
 Пирролизин входит в состав ферментов, образующих метан.
Пирролизин входит в состав ферментов, образующих метан.
Ионизирующие группы
Значения pKa для боковых цепей аминокислот сильно зависят от химической среды, в которой они находятся. Например, карбоксильная группа R, обнаруженная в аспарагиновой кислоте, имеет значение pKa 3,9.в свободном состоянии в растворе, но может достигать 14 в определенных средах внутри белков, хотя это необычно и экстремально. Каждая аминокислота имеет по крайней мере одну ионизируемую аминогруппу (α-амин) и одну ионизируемую карбоксильную группу (α-карбоксил). Когда они связаны пептидной связью, они больше не ионизируются. Некоторые, но не все аминокислоты имеют R-группы, способные к ионизации. Тогда заряд белка возникает из зарядов α-аминной группы, α-карбоксильной группы. и сумма зарядов ионизированных R-групп. Титрование/ионизация аспарагиновой кислоты изображено на рис. 2.10. Ионизация (или деионизация) в структуре белка может иметь значительное влияние на общую конформацию белка и, поскольку структура связана с функцией, большое влияние на активность белка.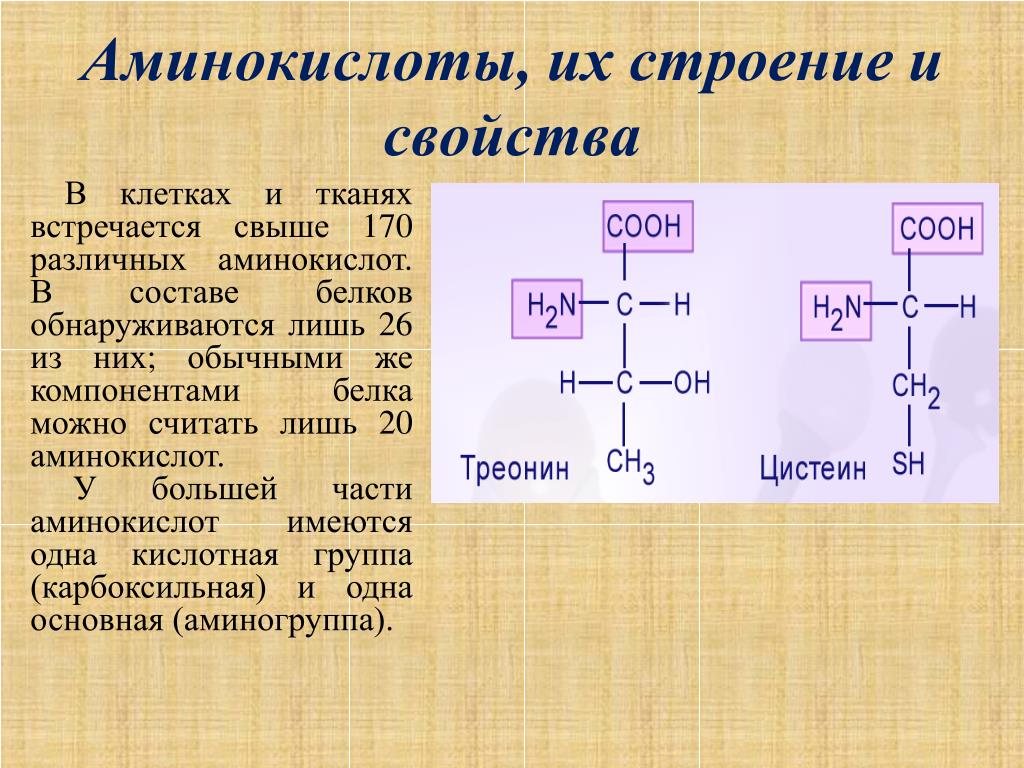
Рисунок 2.10 – Кривая титрования аспарагиновой кислоты Изображение Penelope Irving
Большинство белков имеют относительно узкие диапазоны оптимальной активности, которые обычно соответствуют среде, в которой они находятся (рисунок 2.11). Стоит отметить, что образование пептидных связей между аминокислотами приводит к удалению ионизируемых водородов как из α-аминной, так и из α-карбоксильной групп аминокислот. Таким образом, ионизация/деионизация в белке происходит только с 1) амино-конца; 2) карбоксильный конец; 3) R-группы; или 4) другие функциональные группы (такие как сульфаты или фосфаты), добавленные к аминокислотам посттрансляционно — см. ниже.
Карнитин
Не все аминокислоты в клетке входят в состав белков. Наиболее распространенные примеры включают орнитин (метаболизм аргинина), цитруллин (цикл мочевины) и карнитин (рис. 2.12). Когда жирные кислоты, предназначенные для окисления, перемещаются в митохондрии для этой цели, они проходят через внутреннюю мембрану, прикрепленную к карнитину.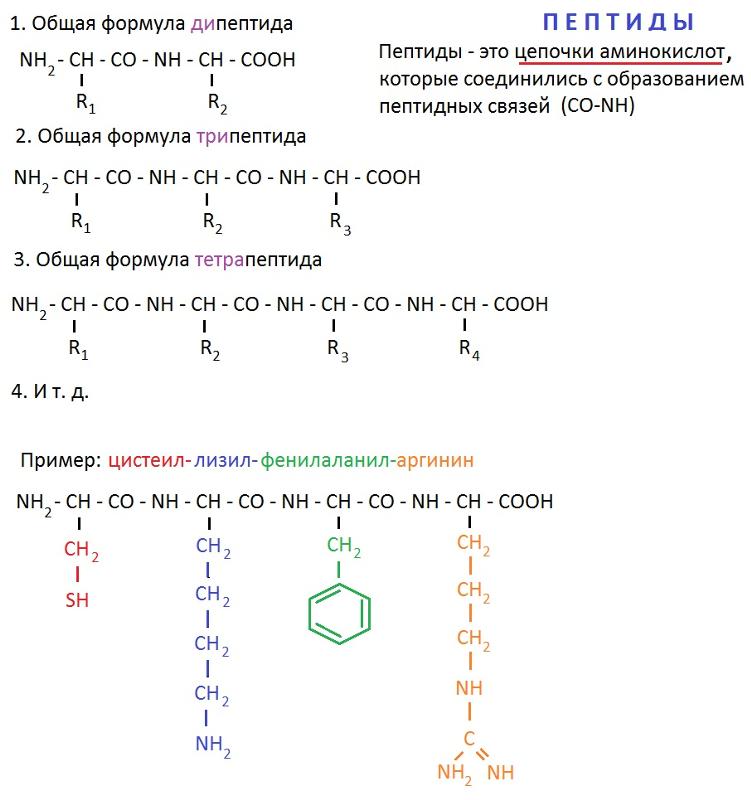 Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Из двух стереоизомерных форм L-форма является активной. Молекула синтезируется в печени из лизина и метионина.
Рисунок 2.12 – L-карнитин
Из экзогенных источников жирные кислоты должны быть активированы при попадании в цитоплазму путем присоединения к коферменту А. Часть молекулы КоА заменяется карнитином в межмембранном пространстве митохондрии в реакции, катализируемой карнитинацилтрансферазой I. В результате Молекула ацилкарнитина переносится через внутреннюю митохондриальную мембрану с помощью карнитинацилкарнитинтранслоказы, а затем в матриксе митохондрии карнитинацилтрансфераза II заменяет карнитин коферментом А (рис. 6.88).
Рисунок 2.11 – Ферментативная активность изменяется при изменении pH Изображение Aleia Kim
Катаболизм аминокислот
Мы классифицируем аминокислоты как незаменимые и заменимые в зависимости от того, может ли организм их синтезировать. Однако все аминокислоты могут расщепляться всеми организмами. На самом деле они являются источником энергии для клеток, особенно во время голодания или для людей, придерживающихся диеты с очень низким содержанием углеводов.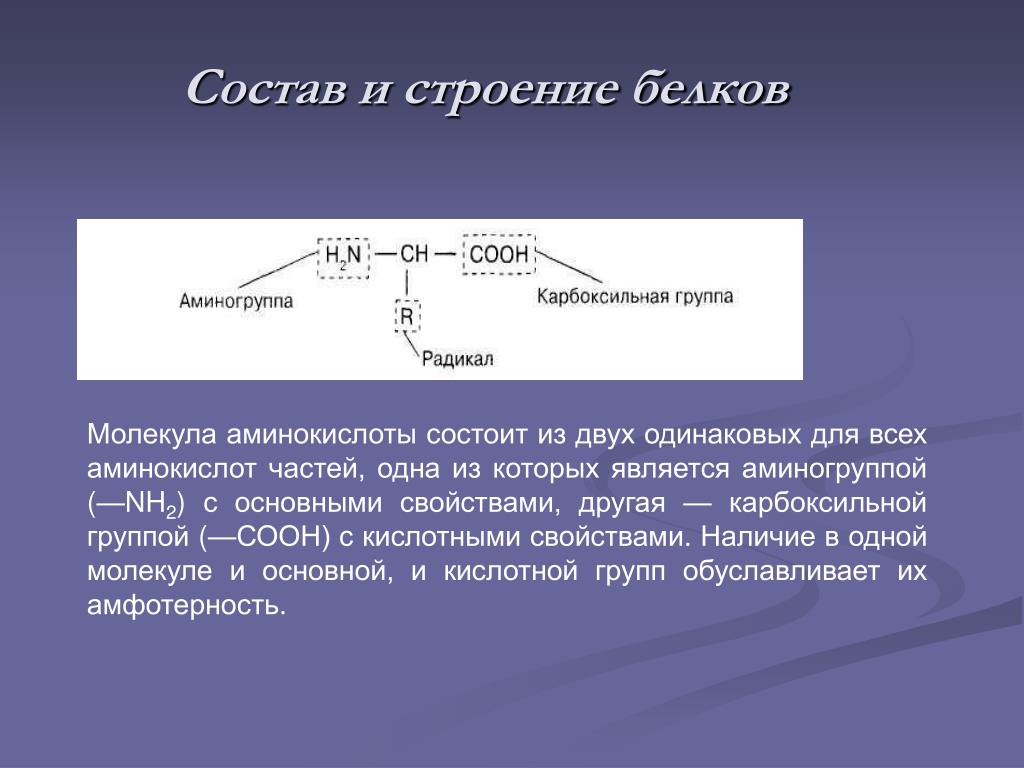 С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные продукты, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные продукты превращаются в ацетил-КоА. На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
С точки зрения распада (катаболизма) аминокислоты классифицируются как глюкогенные, если они производят промежуточные продукты, которые могут быть превращены в глюкозу, или кетогенные, если их промежуточные продукты превращаются в ацетил-КоА. На рис. 2.13 показаны метаболические судьбы катаболизма каждой из аминокислот. Обратите внимание, что некоторые аминокислоты являются одновременно глюкогенными и кетогенными.
Рисунок 2.13 – Катаболизм аминокислот. Некоторые имеют более одного пути. Изображение Пера Якобсона
Посттрансляционные модификации
После синтеза белка боковые цепи аминокислот внутри него могут быть химически модифицированы, что приводит к большему разнообразию структуры и функций (рис. 2.14). Общие изменения включают фосфорилирование гидроксильных групп серина, треонина или тирозина. Лизин, пролин и гистидин могут иметь гидроксилы, присоединенные к аминам в их R-группах. Другие модификации аминокислот в белках включают добавление жирных кислот (миристиновой кислоты или пальмитиновой кислоты), изопреноидных групп, ацетильных групп, метильных групп, йода, карбоксильных групп или сульфатов.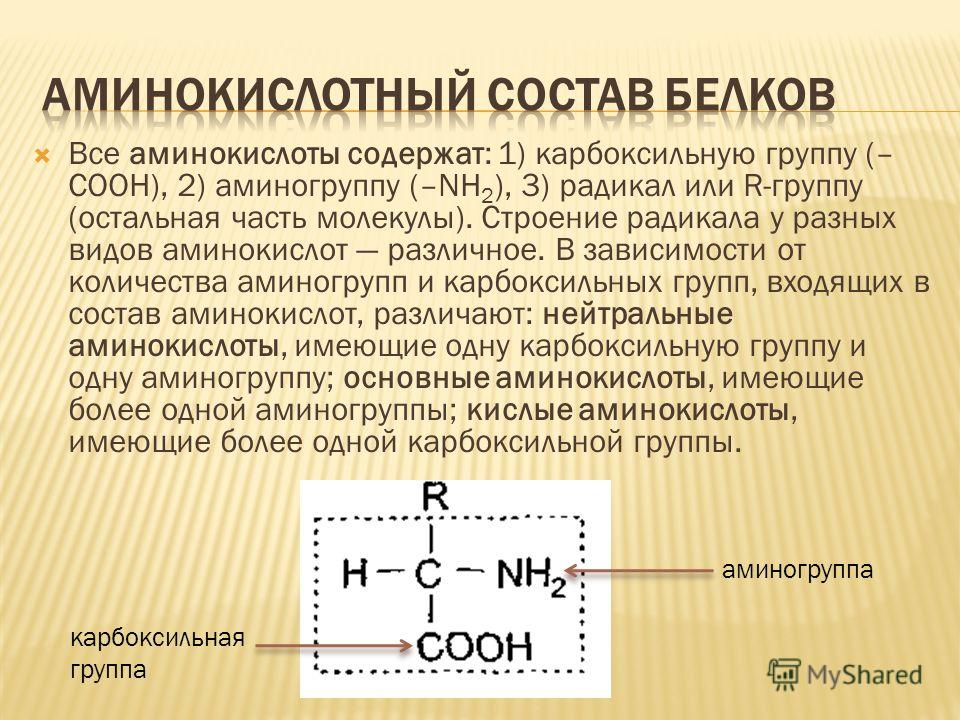 Они могут иметь эффекты ионизации (добавление фосфатов/сульфатов), деионизации (присоединение ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Они могут иметь эффекты ионизации (добавление фосфатов/сульфатов), деионизации (присоединение ацетильной группы к амину R-группы лизина) или вообще не влиять на заряд. Кроме того, N-связанные и O-связанные гликопротеины имеют углеводы, ковалентно присоединенные к боковым цепям аспарагина и треонина или серина соответственно.
Некоторые аминокислоты являются предшественниками важных соединений в организме. Примеры включают адреналин, гормоны щитовидной железы, Ldopa и дофамин (все из тирозина), серотонин (из триптофана) и гистамин (из гистидина).
Рисунок 2.14 – Посттрансляционно модифицированные аминокислоты. Модификации показаны зеленым цветом. Рисунок 2.15. Фосфорилированные аминокислоты
Строительные полипептиды
Хотя аминокислоты выполняют в клетках и другие функции, их наиболее важная роль заключается в том, что они входят в состав белков. Белки, как мы отмечали ранее, представляют собой полимеры аминокислот.
Аминокислоты связаны друг с другом пептидными связями, в которых карбоксильная группа одной аминокислоты присоединяется к аминогруппе следующей с потерей молекулы воды.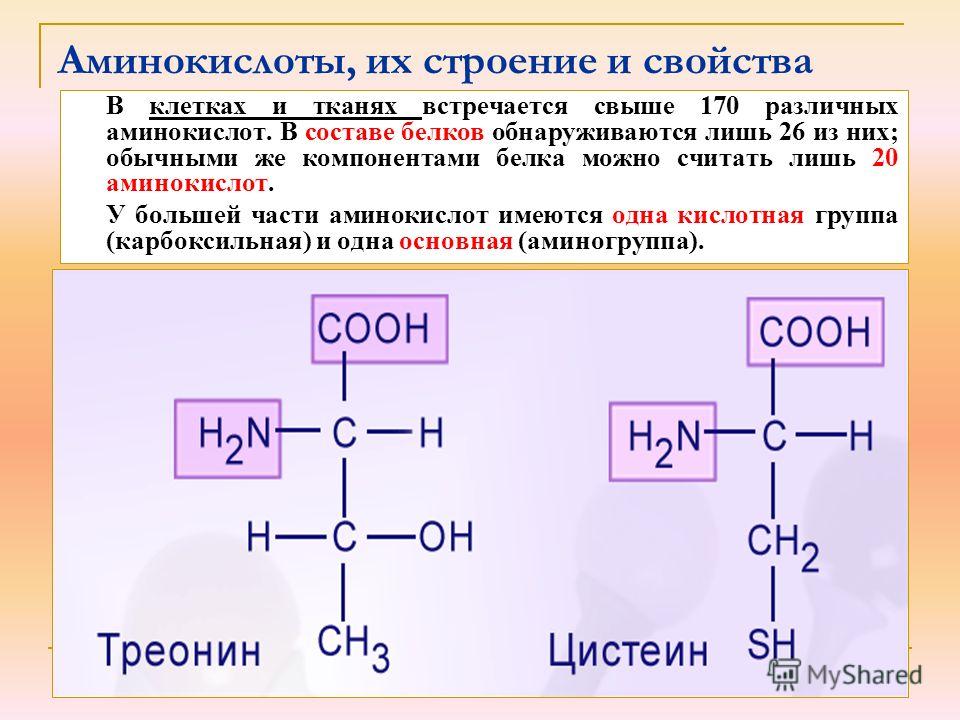 Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много). Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Дополнительные аминокислоты добавляются таким же образом путем образования пептидных связей между свободным карбоксилом на конце растущей цепи и аминогруппой следующей аминокислоты в последовательности. Цепь, состоящая всего из нескольких соединенных вместе аминокислот, называется олигопептидом (олиго=мало), а типичный белок, состоящий из многих аминокислот, называется полипептидом (поли=много). Конец пептида со свободной аминогруппой называется N-концом (для Nh3), а конец со свободным карбоксилом называется С-концом (для карбоксила).
Рис. 2.16. Формирование пептидной связи
Как мы отмечали ранее, функция зависит от структуры, и цепочка аминокислот должна складываться в определенную трехмерную форму или конформацию, чтобы сделать функциональный белок. Сворачивание полипептидов в их функциональные формы является темой следующего раздела.
Эта страница под названием 2.2: Структура и функции — Аминокислоты распространяется в соответствии с лицензией CC BY-NC-SA, ее авторами, ремиксами и/или кураторами являются Кевин Ахерн, Индира Раджагопал и Таралин Тан.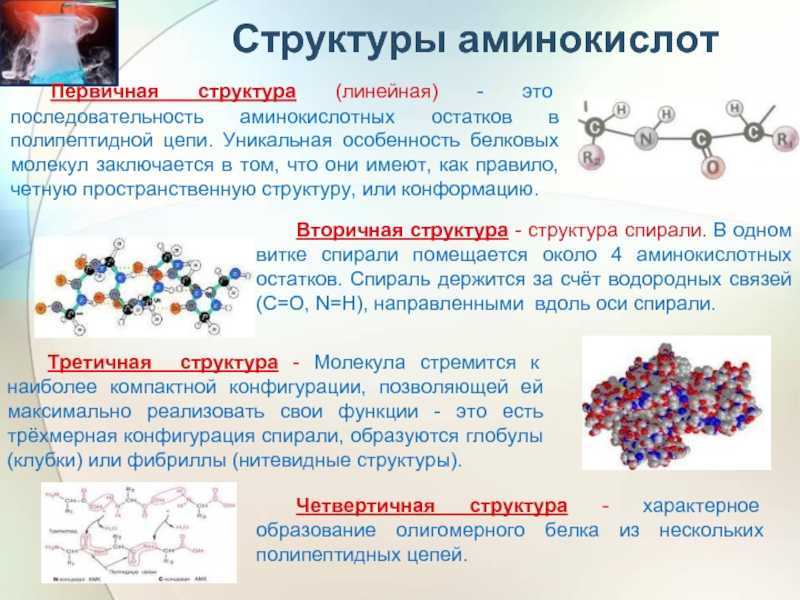

 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;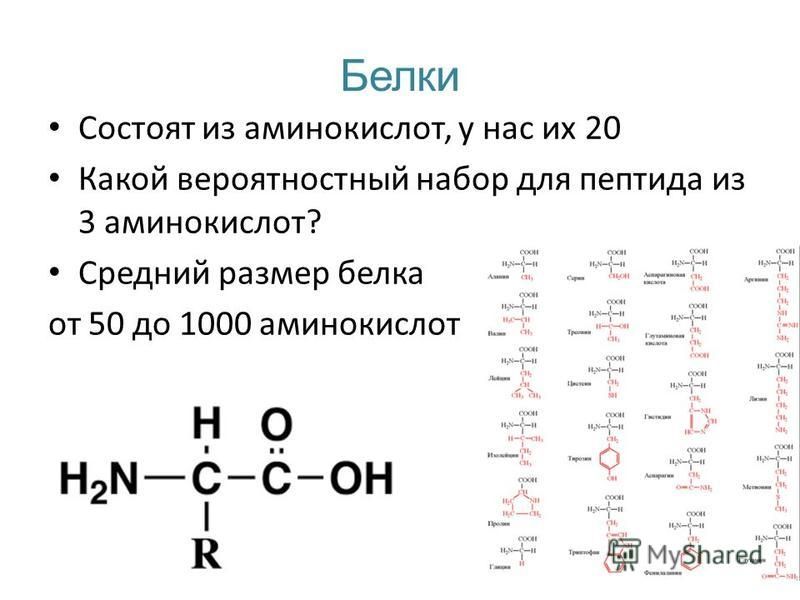 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.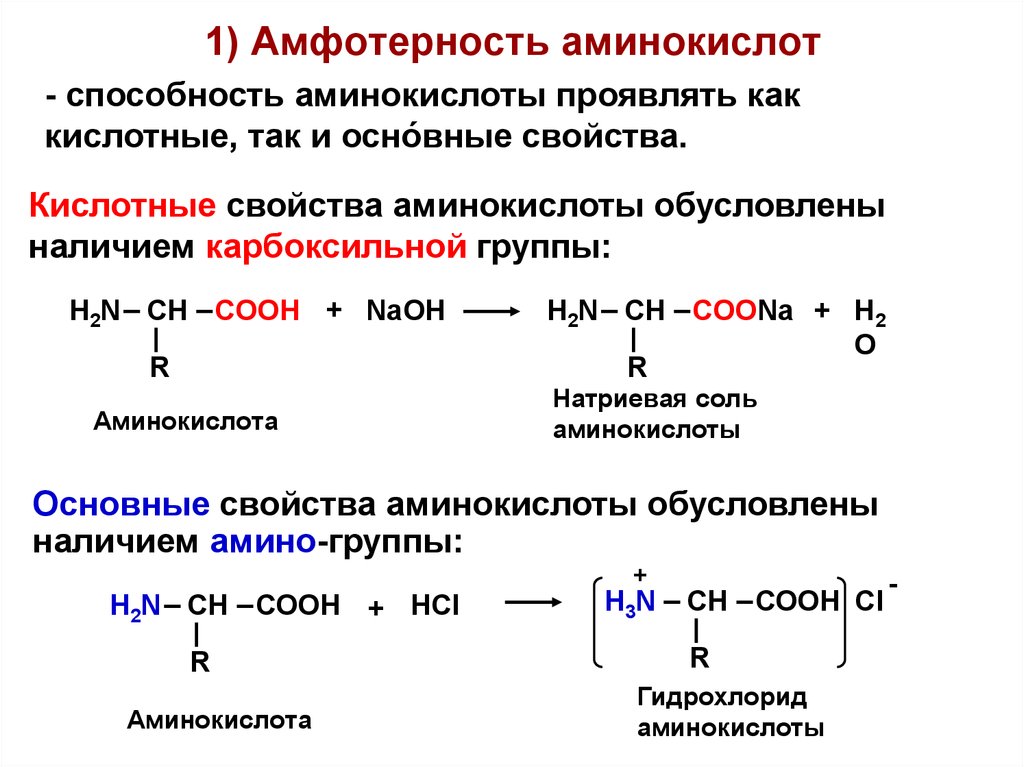 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде; Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.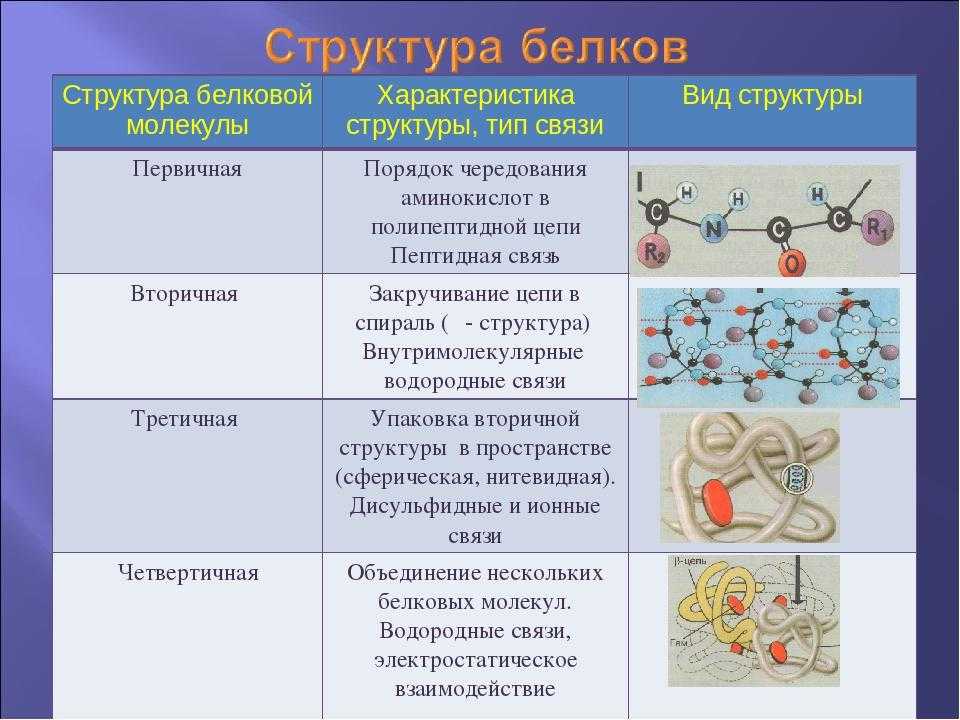 Пролин является исключением, потому что он имеет вторичную аминогруппу (-NH-), для единообразия он также рассматривается как альфа-аминокислота.
Пролин является исключением, потому что он имеет вторичную аминогруппу (-NH-), для единообразия он также рассматривается как альфа-аминокислота.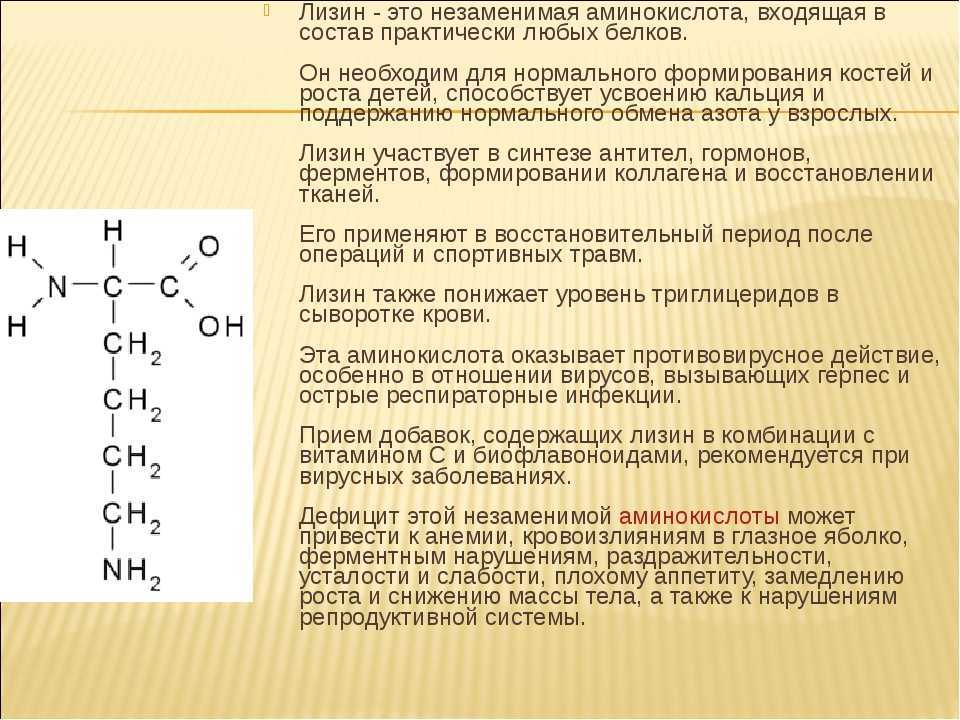 Полимеры, состоящие из двух, трех, нескольких (3-10) и многих аминокислотных звеньев, известны соответственно как дипептиды, трипептиды, олигопептиды и полипептиды, обычно их называют «пептидами».
Полимеры, состоящие из двух, трех, нескольких (3-10) и многих аминокислотных звеньев, известны соответственно как дипептиды, трипептиды, олигопептиды и полипептиды, обычно их называют «пептидами».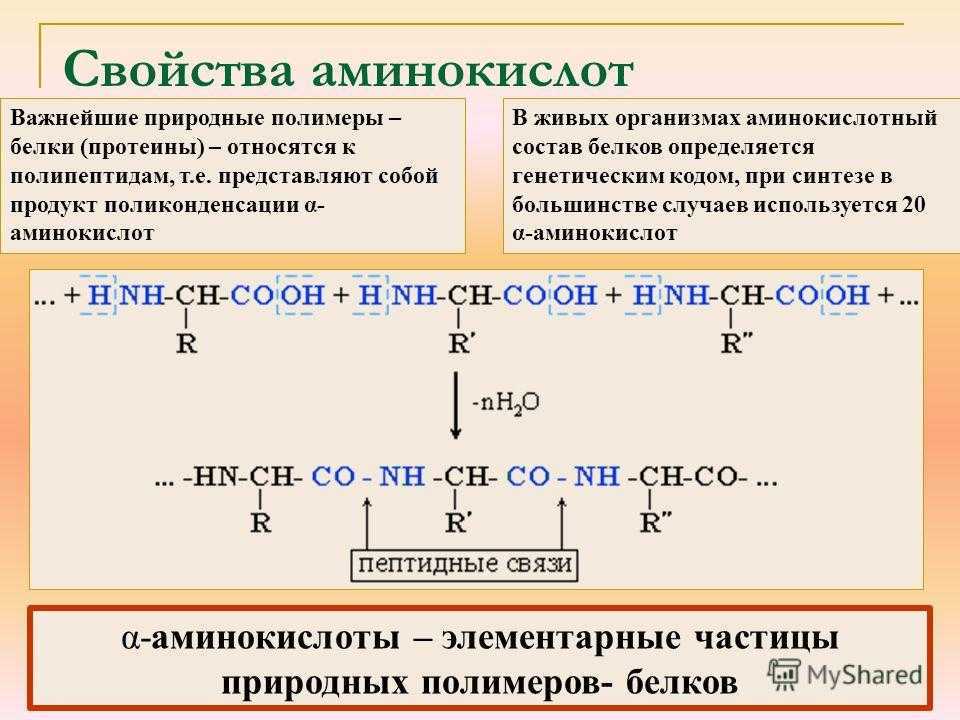
 Глицин имеет наименьшую возможную боковую цепь, атом Н. Аланин, валин, лейцин и изолейцин имеют алифатические углеводородные боковые цепи размером от метильной группы для аланина до изомерных бутильных групп для лейцина и изолейцина. Метионин имеет боковую цепь тиолового эфира, которая по многим своим физическим свойствам напоминает н-бутильную группу (С и А имеют почти одинаковую электроотрицательность, а размер S примерно равен метиленовой группе). Пролин имеет боковую группу циклического пирролидина. Фенилаланин (с его фенильной частью) и типтофан (с его индольной группой) содержат ароматические боковые группы, которые характеризуются объемностью, а также неполярностью.
Глицин имеет наименьшую возможную боковую цепь, атом Н. Аланин, валин, лейцин и изолейцин имеют алифатические углеводородные боковые цепи размером от метильной группы для аланина до изомерных бутильных групп для лейцина и изолейцина. Метионин имеет боковую цепь тиолового эфира, которая по многим своим физическим свойствам напоминает н-бутильную группу (С и А имеют почти одинаковую электроотрицательность, а размер S примерно равен метиленовой группе). Пролин имеет боковую группу циклического пирролидина. Фенилаланин (с его фенильной частью) и типтофан (с его индольной группой) содержат ароматические боковые группы, которые характеризуются объемностью, а также неполярностью. Цистеин очень уникален среди всех 20 аминокислот, потому что он имеет тиоловую группу, которая образует дисульфидную связь с другим цистеином посредством окисления.
Цистеин очень уникален среди всех 20 аминокислот, потому что он имеет тиоловую группу, которая образует дисульфидную связь с другим цистеином посредством окисления.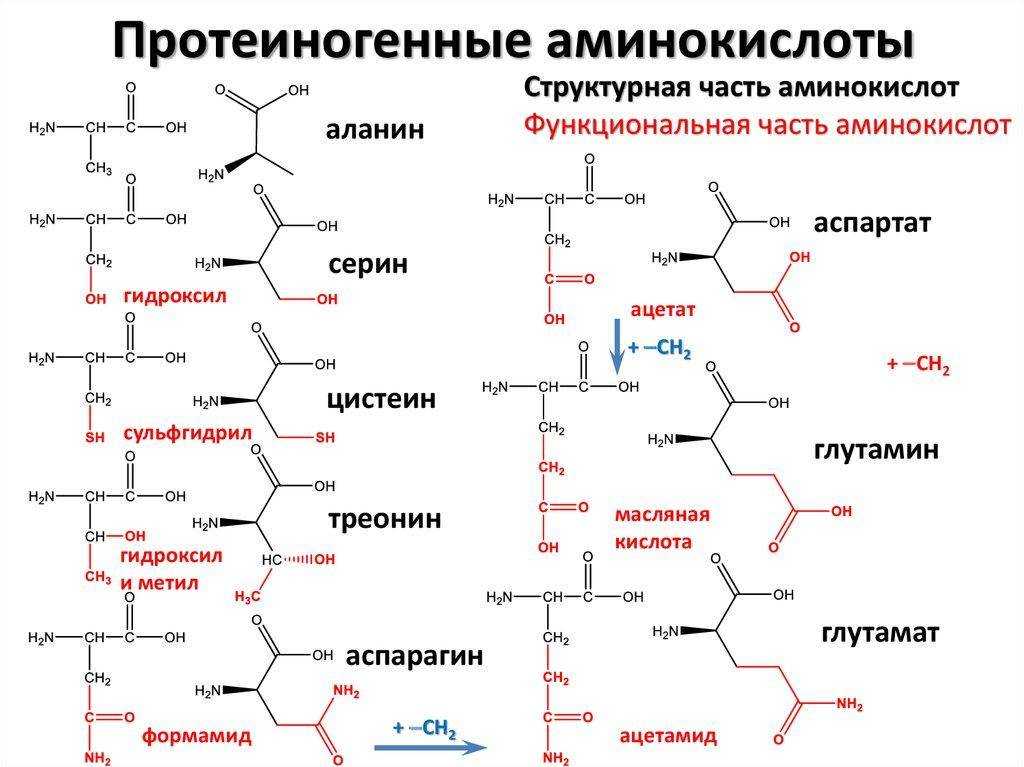 1.с.1.
1.с.1.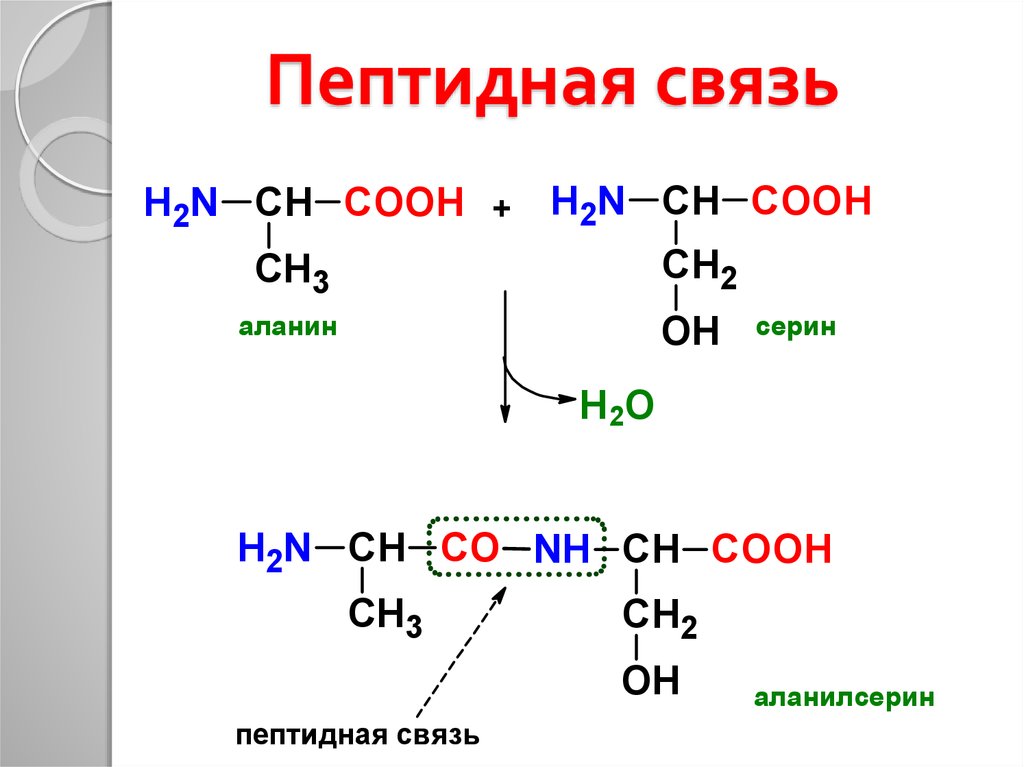 D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG.
D-форма аминокислоты также обнаружена в бактериальных клеточных стенках. Аланин не является незаменимым, так как легко синтезируется из пирувата. Он кодируется GCU, GCC, GCA и GCG. и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG.
и смерть. Лейцин кодируется шестью кодонами: UUA, UUG, CUU, CUC, CUA, CUG. Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода.
Гидроксилирование пролином фактора, индуцируемого гипоксией (HIF), служит датчиком уровня кислорода и нацеливает HIF на разрушение при избытке кислорода. Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН.
Он является нейротрансмиттером и имеет R-группу с карбоксильной группой, которая легко ионизируется (рКа = 4,1) при физиологическом рН. Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.
Протонирование кольца приводит к двум структурам NH, которые можно изобразить как две одинаково важные резонансные структуры.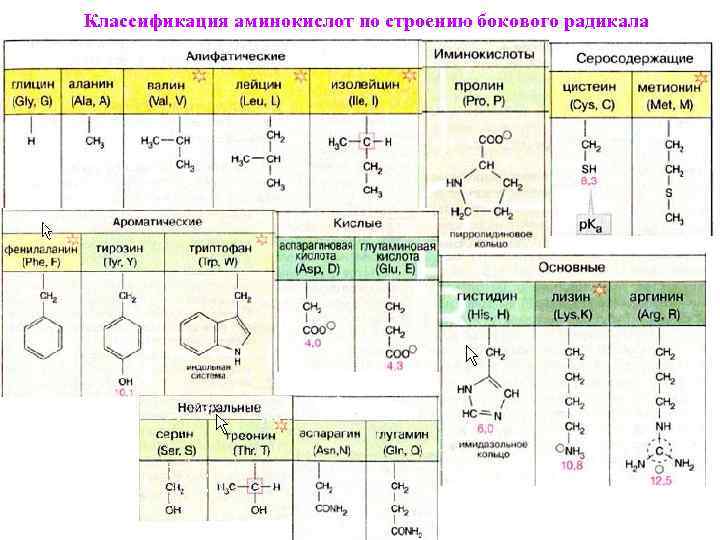 Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама.
Неспособность метаболизировать фенилаланин возникает из-за генетического заболевания, известного как фенилкетонурия. Фенилаланин является компонентом искусственного подсластителя аспартама.
 Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG.
Треониновые протеазы используют гидроксильную группу аминокислоты в своем катализе, и она является предшественником одного из путей биосинтеза глицина. В некоторых случаях он используется в качестве пролекарства для повышения уровня глицина в мозге. Треонин кодируется в генетическом коде ACU, ACC, ACA и ACG. Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
Это несущественно для большинства людей, но может быть необходимо для младенцев, пожилых людей и людей, страдающих определенными метаболическими заболеваниями. Сульфгидрильная группа цистеина легко окисляется до дисульфида при взаимодействии с другой. Помимо того, что он содержится в белках, цистеин также является компонентом трипептида глутатиона. Цистеин определяется кодонами UGU и UGC.
 Пирролизин входит в состав ферментов, образующих метан.
Пирролизин входит в состав ферментов, образующих метан.