Аминокислоты состав: свойства и состав, применение в косметике и косметологии
АМИНОКИСЛОТЫ • Большая российская энциклопедия
АМИНОКИСЛО́ТЫ, органич. соединения, содержащие карбоксильные COOH и аминогруппы NH2. Исключение составляет пролин. Обладают свойствами и кислот и оснований. В зависимости от положения аминогруппы в углеродной цепи относительно карбоксильной группы различают α-, β-, γ- и др. А. У ω-А. аминогруппа находится на конце цепи. Участвуют в обмене азотистых веществ всех организмов, являясь исходными соединениями при биосинтезе белков, пептидов, пуриновых и пиримидиновых оснований, ряда витаминов, пигментов, алкалоидов и др.
Классификация
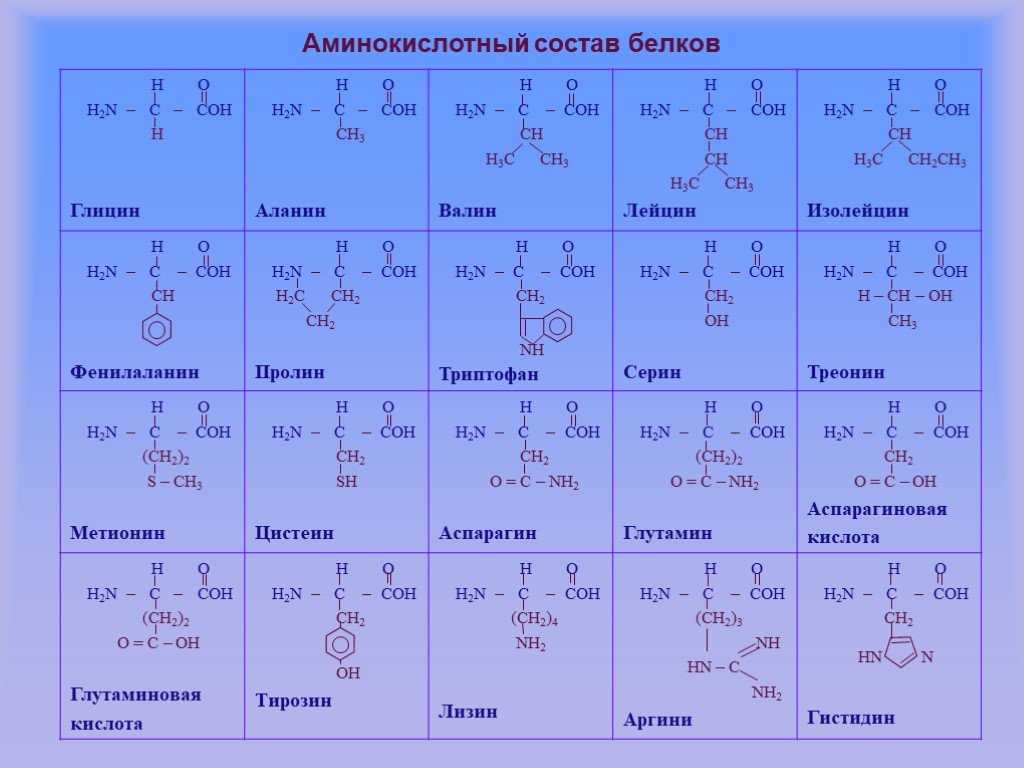
Описано свыше 150 природных А., среди которых особенно важны 20 α-А. (табл.), входящих в состав белков, кодируемых генетическим кодом; общая формула:
В зависимости от природы боковой цепи R α-А. подразделяют на две группы: А. с неполярными (гидрофобными) и А. с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина.
с полярными (гидрофильными) боковыми цепями. К 1-й группе относятся шесть А. с алифатич. боковой цепью – аланин, валин, лейцин, изолейцин, метионин, пролин и две с ароматической – фенилаланин и триптофан. Среди представителей 2-й группы боковые цепи семи А. содержат группировки, способные нести отрицат. или положит. заряд. В аспарагиновой и глутаминовой кислотах β- и γ-карбоксильные группы при рН 7,0 заряжены отрицательно. К осно́вным А. относятся лизин, аргинин и гистидин. ε-Аминогруппа лизина и гуанидиновая группировка аргинина несут положит. заряд (протонированы) в нейтральной среде, а имидазольная группировка гистидина – в кислой. В щелочных условиях отрицат. заряд могут приобретать боковые группы тирозина и цистеина. Характерной особенностью остатков цистеина является их способность в составе молекулы белка подвергаться окислению с образованием остатков цистина. А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
А. присвоены сокращённые трёхбуквенные и однобуквенные обозначения, используемые в науч. литературе. В 1986 в ряде белков архебактерий, истинных бактерий (эубактерий) и животных была обнаружена α-А. – селеноцистеин (ей присвоены символы Sec и U), в 2002 открыт пирролизин (пока обнаружен только у одного вида метанобразующих архей). Обе эти А. кодируются триплетами, которые обычно служат «стоп-кодонами» (т. е. оповещают об окончании синтеза белка на рибосомах): селеноцистеин – триплетом UGA, а пирролизин – UAG.
Селеноцистеин
Цистин
Пирролизин (где R=Ch4, Nh3 или OH)
Большая часть А., обнаруженных в тканях живых организмов, но не входящих в состав белков, могут выполнять важные функции. Так, орнитин и цитрулин участвуют в обмене веществ, в частности в синтезе мочевины у животных, 2,4-дигидрооксифенилаланин (ДОФА) образуется в качестве промежуточного продукта в ходе распада фенилаланина и тирозина в организме и является медиатором центральной нервной системы. Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин – десмозин. Помимо α-А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Кроме того, имеются А., функция которых пока не ясна. В ряде белков (уже после их синтеза на рибосомах) боковые группы А. претерпевают изменения в ходе посттрансляционной модификации. Напр., в составе молекулы коллагена пролин и лизин превращаются соответственно в 4-гидроксипролин и 5-гидроксилизин, в миозине присутствует N-метиллизин, только в эластине встречается ферментативно модифицированный лизин – десмозин. Помимо α-А. в свободном виде и в составе некоторых биологически важных пептидов, встречаются А., аминогруппа которых связана не с α-углеродным атомом. К их числу относятся β-аланин, входящий в состав пантотеновой кислоты, γ-аминомасляная кислота, играющая важную роль в функционировании нервной системы, δ-аминолевулиновая кислота, являющаяся промежуточным продуктом синтеза порфиринов.
Физические и химические свойства
А. – бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220–315 °C. В кристаллах и водных растворах при нейтральных значениях рН α-А. существуют преим. в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы , а карбоксильные группы диссоциированы (СОО—). А. являются амфолитами; ионизация их молекул зависит от рН раствора:
– бесцветные кристаллич. вещества, растворимые в воде; темп-ры плавления 220–315 °C. В кристаллах и водных растворах при нейтральных значениях рН α-А. существуют преим. в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы протонированы , а карбоксильные группы диссоциированы (СОО—). А. являются амфолитами; ионизация их молекул зависит от рН раствора:
Значения pH, при котором концентрация катионов А. равна концентрации анионов, называется изоэлектрической точкой (pI). Аминогруппа А. ионизирована в неск. меньшей степени, чем карбоксильная группа, поэтому водный раствор А. имеет слабокислый характер. Все α-А., кроме глицина, имеют асимметрический (хиральный) α-углеродный атом и существуют в виде двух энантиомеров. У изолейцина и треонина хиральными являются также и β-углеродные атомы.
За редким исключением природные α-А. относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D-ряда.
относятся к L-ряду и только в оболочках бактерий, в составе некоторых антибиотиков и в метаболитах грибов, а также в коже некоторых видов южноамериканских лягушек и корне женьшеня обнаружены А. D-ряда.
В результате взаимодействия α-аминогруппы одной А. с α-карбоксильной группой другой А. в процессе биосинтеза белка (трансляции) происходит образование пептидной связи.
Превращения аминокислот в организмах
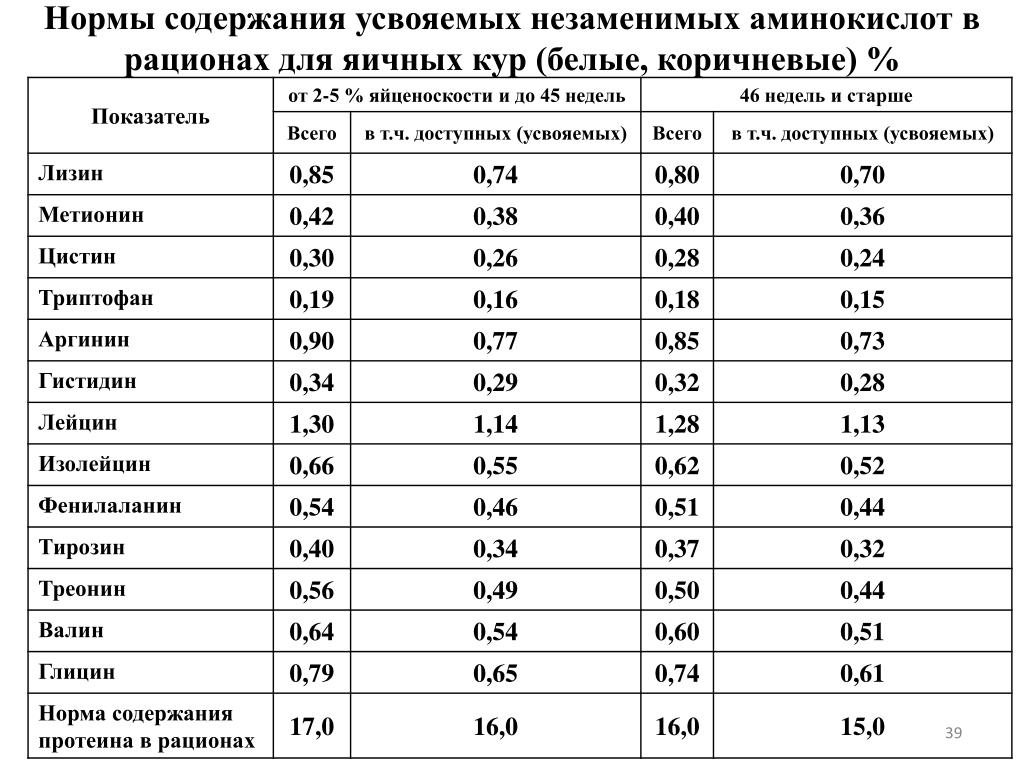
Высшие растения и хемосинтезирующие организмы все необходимые им А. синтезируют из аммониевых солей и нитратов, а также из кето- или гидроксикислот – продуктов дыхания и фотосинтеза. Человек и животные синтезируют большинство А. из обычных безазотистых продуктов обмена и аммониевого азота. Это т. н. заменимые А. Но ряд А. – незаменимых – они должны получать в готовом виде с пищей. Для человека, напр., незаменимыми А.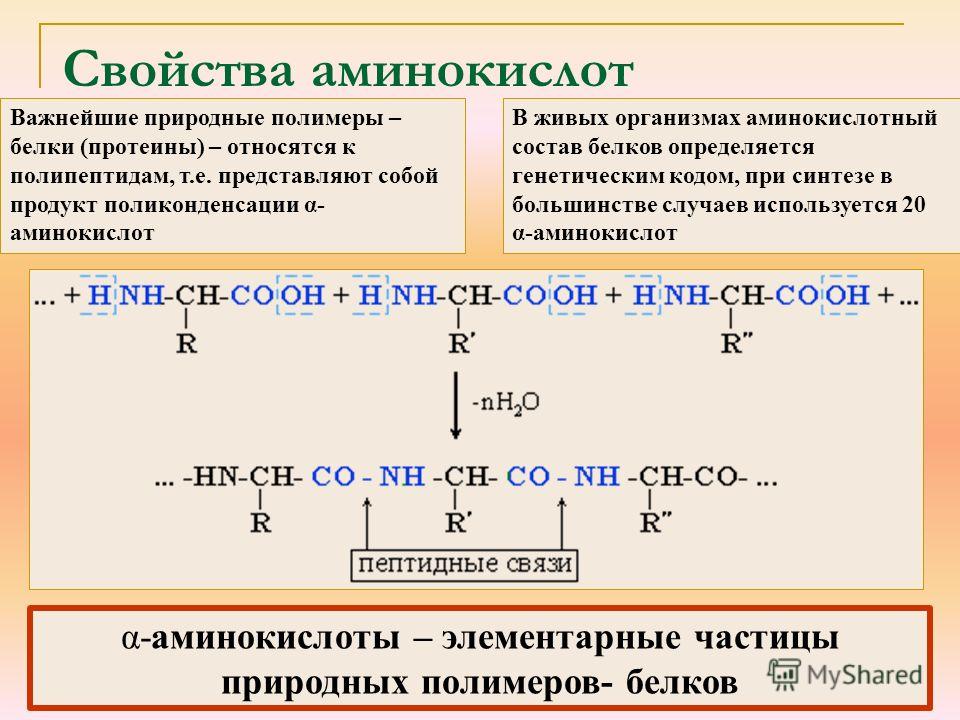 являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот – промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин – дофамина и адреналина, триптофан – серотонина, гистидин – гистамина, глутаминовая кислота – γ-аминомасляной кислоты, аргинин – оксида азота (NO).
являются валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин, а для детей также аргинин и гистидин. Недостаток в организме той или иной аминокислоты приводит к нарушению обмена веществ, замедлению роста и развития. А. участвуют в поддержании азотистого баланса в организме. Окислит. распад А. путём дезаминирования приводит к образованию кето- и гидроксикислот – промежуточных продуктов цикла трикарбоновных кислот; далее они превращаются в углеводы, новые А. и т. д. или окисляются до СО2 и Н2О с выделением энергии. У животных азот в виде аммониевых солей, мочевины или мочевой кислоты выводится из организма. У растений усвоение А. происходит т. о., что азотистые отходы практически отсутствуют. Некоторые А. являются предшественниками важных гормонов и нейромедиаторов: тирозин и фенилаланин – дофамина и адреналина, триптофан – серотонина, гистидин – гистамина, глутаминовая кислота – γ-аминомасляной кислоты, аргинин – оксида азота (NO).
Практическое использование
Таблица. Важнейшие аминокислоты, входящие в состав белков (цветом обозначены боковые цепи)
Смеси L-α-А., а также отдельные А. применяют в медицине для лечения больных с заболеваниями пищеварит. органов (гистидин, метионин), при малокровии, ожогах (метионин), нервно-психич. заболеваниях (глицин и глутаминовая кислота), при сосудистых заболеваниях головного мозга (γ-аминомасляная кислота) и т. д. Для обогащения кормов в животноводстве и лечения животных используются лизин, метионин, треонин, триптофан, в пищевой пром-сти – глутамат натрия и лизин. ω-А. и их лактамы служат для пром. произ-ва полиамидов. Ароматич. А. нашли применение в синтезе красителей и лекарственных препаратов. Некоторые L-α-А. получают микробиологич. синтезом (лизин, триптофан, треонин, глутаминовая кислота) или выделяют из гидролизатов богатых ими белков (пролин, аргинин, гистидин, глутаминовая кислота, тирозин).
Аминокислоты в плазме крови, 48 показателей (Amino Acids Analysis, Plasma, 48 parameters)
Метод определения
ВЭЖХ-МС/МС (высокоэффективная жидкостная хроматография и тандемная масс-спектрометрия).
Исследуемый материал
Плазма крови (ЭДТА)
Доступен выезд на дом
Синонимы: Aнализ крови на аминокислоты (48 аналитов).
Аminoacids, screening of 48 indicators, plasma.
Состав параметров:
Протеиногенные аминокислоты
Незаменимые глюкогенные
Аргинин (Arg)
Валин (Val)
Гистидин (His)
Метионин (Met)
Треонин (Thr)
Незаменимые кетогенные
Лейцин (Leu)
Лизин (Lys)
Незаменимые глюко-/кетогенные
Изолейцин (Ile)
Триптофан (Trp)
Фенилаланин (Phe)
Заменимые глюкогенные
Аланин (Ala)
Аспарагин (Asn)
Аспарагиновая кислота (Asp)
Глицин (Gly)
Глутамин (Gln)
Глутаминовая кислота (Glu)
Пролин (Pro)
Серин (Ser)
Таурин (Tau)
Заменимые глюко-/кетогенные
Тирозин (Tyr)
Непротеиногенные аминокислоты
Метаболиты цикла образования мочевины
Аргинин-янтарная кислота, аргининосукцинат (Ars)
Гомоцитруллин (Hci)
Орнитин (Orn)
Цитруллин (Cit)
Серосодержащие
Аденозилгомоцистеин (Agc)
Гомоцистин (Hcy)
Цистатионин (Cyst)
Цистеинсульфат (SSC)
Цистин (Cys)
Метаболиты лизина
Альфа-аминоадипиновая кислота (Aad)
Пипеколиновая кислота (PA)
Сахаропин (Sac)
Структурные компоненты коллагена
Гидроксилизин (Hly)
Гидроксипролин (Hyp)
Карнозин и его метаболиты
1-Метилгистидин (1-MH)
3-Метилгистидин (3-MH)
Ансерин (Ans)
Бета-аланин (Bal)
Карнозин (Car)
Саркозин (Sar)
Производные масляной кислоты
Альфа-аминомасляная кислота (Abu)
Бета-аминоизомасляная кислота (bAib)
Гамма-аминомасляная кислота (gAbu)
Производные аминокислот
Фосфосерин (Pse)
Фосфоэтаноламин (Pet)
Этаноламин (Eta)
Промежуточные изоформы аминокислот
Алло-изолейцин (Ail)
Ацетилтирозин (Aty)
Для детей референсные пределы в данном тесте не установлены. Возможный альтернативный вариант для детей №НБО1 Анализ спектра аминокислот и ацилкарнитинов, тандемная масс-спектрометрия, метод сухой капли крови
Возможный альтернативный вариант для детей №НБО1 Анализ спектра аминокислот и ацилкарнитинов, тандемная масс-спектрометрия, метод сухой капли крови
Краткое описание исследования «Аминокислоты в плазме крови, 48 показателей»
Аминокислоты – органические соединения, содержащие одновременно аминогруппу и карбоксильную группу. Это основные структурные единицы, из которых строятся белки. Аминокислоты участвуют в процессах жизнедеятельности организма, включая синтез нейромедиаторов и гормонов (тиреоидных, катехоламинов, серотонина, оксида азота, мелатонина), формирование клеток, рост и регенерацию тканей, поддержание мышечной массы, иммунные функции и пр. Источником аминокислот для синтеза белков организма преимущественно являются пищевые белки, которые после расщепления в кишечнике до аминокислот всасываются в кровь. Многие из них могут синтезироваться организмом, но часть (незаменимые аминокислоты) поступает только с пищей. Аминокислоты являются важными промежуточными метаболитами во многих метаболических путях – цикле мочевины для конвертации аммония в мочевину, цикле аланина для переноса азота и источников энергии из мышц в печень, образовании аммония в почках из глутамина и глутаминовой кислоты, образовании глутатиона для поддержания восстановительного потенциала внутри клеток и пр. Многие аминокислоты участвуют в реакциях конъюгации, связанных с экскреторными путями.
Многие аминокислоты участвуют в реакциях конъюгации, связанных с экскреторными путями.
В соответствии с разными принципами формируются группы аминокислот:
- По возможным источникам поступления (возможности эндогенного синтеза) – заменимые и незаменимые.
- В зависимости от того, присутствуют ли они в составе белков – протеиногенные и непротеиногенные.
- В зависимости от метаболических циклов, в которые включены аминокислоты – глюкогенные, кетогенные, смешанные глюко- и кетогенные одновременно. При распаде глюкогенных аминокислот образуются соединения-предшественники синтеза глюкозы – пируват, оксалоацетат, фосфоенолпируват; кетогенные аминокислоты окисляются до ацетил-ЅКоА, из которого синтезируются кетоновые тела, жирные кислоты и холестерин; смешанные аминокислоты, соответственно, используются в синтезе как углеводов, так и липидов.
Нарушения метаболизма аминокислот, приводящие к их дефициту или аккумуляции в биологических жидкостях, проявляются симптомами разной степени тяжести, которые зависят от специфики и степени нарушений – угрожающие жизни критические состояния, задержка роста и развития, неврологическая симптоматика, нарушения пищеварения, дерматологические проявления и пр. Своевременное выявление и лечение таких нарушений, включая использование специфической диеты, позволяет поддержать баланс аминокислот.
Своевременное выявление и лечение таких нарушений, включая использование специфической диеты, позволяет поддержать баланс аминокислот.
Приобретенные расстройства метаболизма аминокислот возможны при эндокринных нарушениях, патологии печени, неврологических расстройствах, недостаточном питании, нарушениях обмена веществ, онкологических заболеваниях, почечной недостаточности, ожогах.
С какой целью выполняют исследования «Аминокислоты в плазме крови, 48 показателей»
Расширенная оценка уровня аминокислот плазмы может быть использована в обследованиях для оценки состояния здоровья при различных приобретенных расстройствах и контроле проводимой терапии.
Что может повлиять на результат исследования «Аминокислоты в плазме крови, 48 показателей»
Несоблюдение правил подготовки к исследованию может повлиять на результат.
Аминокислотный состав — Proteopedia, жизнь в 3D
Из Proteopedia
Перейти к: навигация, поиск
Аминокислотный состав белка относится к процентному содержанию каждой аминокислоты в последовательности этого белка.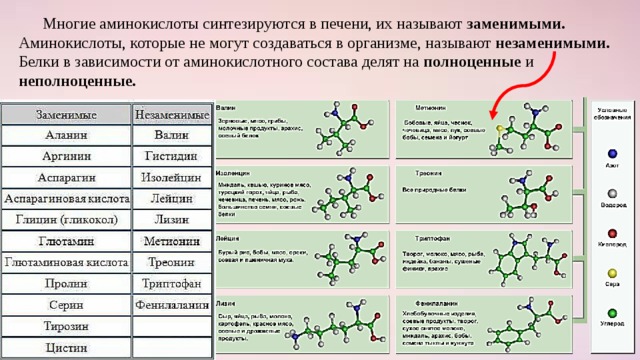 Процент, иногда называемый мольным процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Процент, иногда называемый мольным процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Содержимое
|
Пример
В качестве примера приведен аминокислотный состав ацетилхолинэстеразы Torpedo californica (тихоокеанский электрический скат), структура которого 2ace. Последовательность канонической изоформы имеет длину 586. В ее зрелой форме сигнальный пептид удаляется с амино-конца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537 с таким составом:
Эта гистограмма состава была создана с помощью калькулятора состава/молекулярного веса Protein Information Resource (PIR).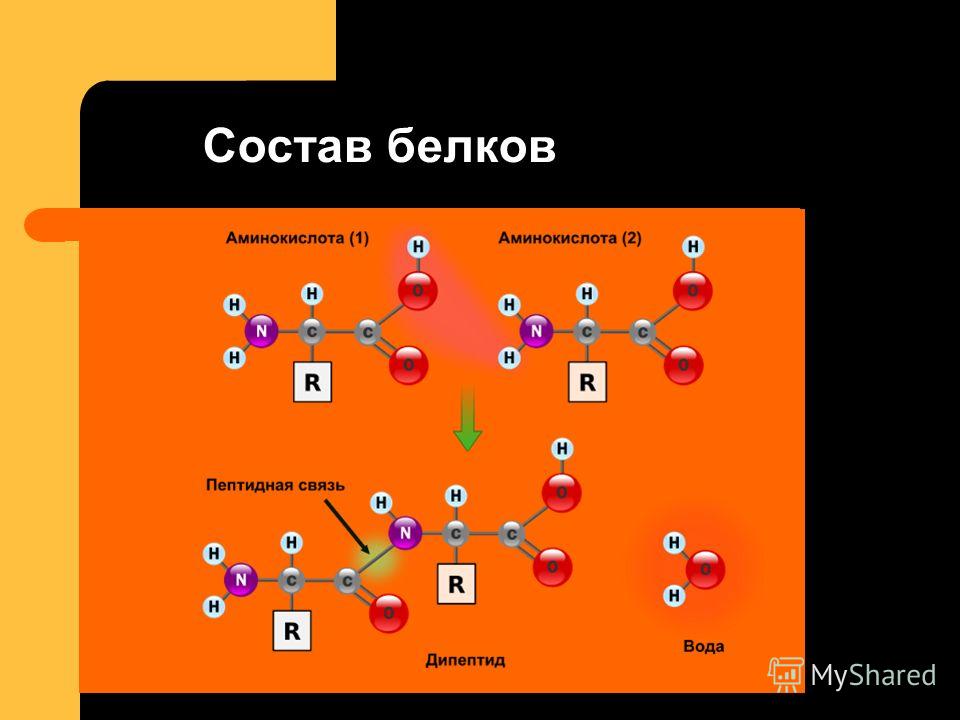 Белковые последовательности легко получить на UniProt.Org или просмотреть запись PDB в FirstGlance в Jmol и щелкнуть последовательности. Вы можете выровнять геномную полноразмерную последовательность из UniProt с экспериментально кристаллизованной последовательностью. Вот инструкции. Белковые последовательности легко получить на UniProt.Org или просмотреть запись PDB в FirstGlance в Jmol и щелкнуть последовательности. Вы можете выровнять геномную полноразмерную последовательность из UniProt с экспериментально кристаллизованной последовательностью. Вот инструкции. |
Средние составы
Средние составы были рассчитаны для большого количества белков из различных таксонов. Они сведены в таблицу, которую можно загрузить с помощью таблицы amino-acid-composition.xlsx.zip. Обнадеживает согласие между таблицами, составленными в 1993, 1998 и 2008 годах (цитаты приведены в электронной таблице).
Вышеупомянутые проценты были определены для нескольких тысяч последовательностей различных белков длиной 200 остатков, с идентичностью последовательностей менее 50% [1] . Эти данные включены в приведенную выше электронную таблицу.
Детерминанты аминокислотного состава
GC-содержание генома организма является сильнейшим детерминантом аминокислотного состава на уровне генома.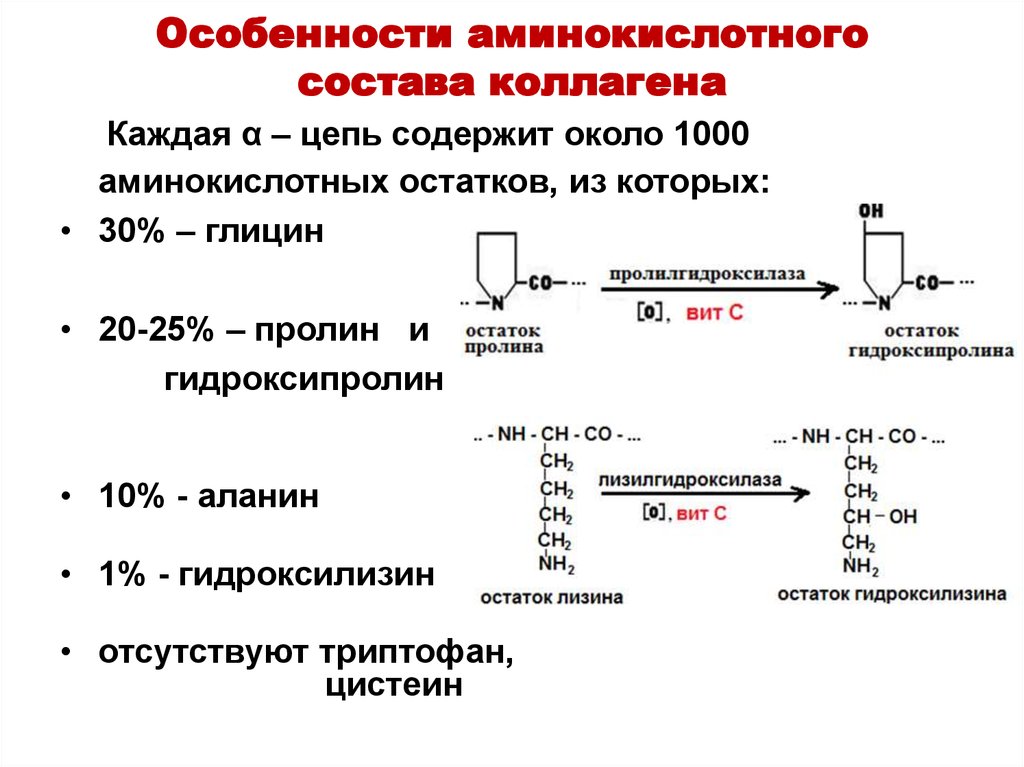 [2] [3] [4] .
[2] [3] [4] .
Другие, более слабые воздействия:
- Температуры роста (мезофилия/термофилия/гипертермофилия). У термофилов больше глутаминовой кислоты (с уменьшением глутамина), а также больше лизина и аргинина [2] . Вероятно, это связано с большим количеством солевых мостиков в белках термофилов, которые, как полагают, способствуют термостабильности [5] .
- Длина цепи . Белки термофилов в среднем короче, чем у мезофилов. Средние длины 283 и 340 соответственно [2] . Исследование около 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
- Увеличиваются по длине, достигают плато: Ala, Asp, Glu, Gly, Pro, Val; меньшее увеличение для Gln и Thr.
- Уменьшаются с длиной: Cys, Phe, His, Ile, Lys, Met, Asn, Ser.
- Leu и Tyr самые высокие в коротких и длинных цепях и реже в белках среднего размера.
- Пики Arg в белках среднего размера.

- Trp постоянна и составляет около 1,4% для длин 75-200.
- Линкеры по сравнению с доменами : Линкеры между доменами имеют больше полярных остатков, тогда как компактные домены имеют больше гидрофобных остатков [3] .
- Среда обитания : Окружающая среда, в которой живет организм, оказывает незначительное влияние на средний состав его белков [4] .
- Композиционная изменчивость ранжирует археи > бактерии > эукариоты [3] .
Калькуляторы состава
- Калькулятор состава/молекулярного веса Protein Information Resource (PIR) создает очень полезную гистограмму (см. пример выше), но не предоставляет готовую таблицу для электронных таблиц.
- EMBOSS-PepStats EMBL-EBI создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, , отсортированные по однобуквенным кодам .

| Импорт данных композиции в Excel: Скопируйте только столбцы данных, вставьте в текстовый редактор и сохраните в обычный текстовый файл. В Excel в существующей (возможно, пустой) электронной таблице Файл, Импорт, Текст. Отметьте 3 параметра разделителя: Tab, Space, рассматривать последовательные разделители как один. Приступить к импорту. |
- ProtParam ExPASy создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, , отсортированные по трехбуквенным кодам . Он также предлагает вывод CSV, альтернативный формат, понятный электронным таблицам.
Ссылки
- ↑ 1,0 1,1 Каруго О. Аминокислотный состав и размер белка. Белковая наука. 2008 Декабрь; 17 (12): 2187-91. doi: 10.1110/ps.037762.108. Epub 2008, 9 сентября. PMID: 18780815 doi: http://dx.doi.org/10.1110/ps.037762.108
- ↑ 2.
 0 2.1 2.2 Текая Ф., Ерамян Э., Дуджон Б. Аминокислотный состав геномов, образ жизни организмов и эволюционные тенденции: глобальная картина с анализом соответствия. Ген. 2002 4 сентября; 297(1-2):51-60. doi: 10.1016/s0378-1119(02)00871-5. PMID: 12384285 doi: http://dx.doi.org/10.1016/s0378-1119(02)00871-5
0 2.1 2.2 Текая Ф., Ерамян Э., Дуджон Б. Аминокислотный состав геномов, образ жизни организмов и эволюционные тенденции: глобальная картина с анализом соответствия. Ген. 2002 4 сентября; 297(1-2):51-60. doi: 10.1016/s0378-1119(02)00871-5. PMID: 12384285 doi: http://dx.doi.org/10.1016/s0378-1119(02)00871-5 - ↑ 3,0 3,1 3,2 Брюн Д., Андраде-Наварро М.А., Майер П. Сравнение аминокислотного состава доменов и линкеров в масштабах всего протеома. Примечания BMC Res. 2018 9 февраля; 11 (1): 117. doi: 10.1186/s13104-018-3221-0. PMID: 29426365 doi: http://dx.doi.org/10.1186/s13104-018-3221-0
- ↑ 4.0 4.1 Moura A, Savageau MA, Alves R. Признаки относительного аминокислотного состава организмов и окружающей среды. ПЛОС Один. 2013 25 октября; 8 (10): e77319. doi: 10.1371/journal.pone.0077319., eCollection 2013. PMID: 24204807 doi: http://dx.doi.org/10.1371/journal.pone.0077319
- ↑ Чан Ч, Ю Т, Вонг К.
 Б. Стабилизация солевого мостика повышает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. ПЛОС Один. 2011;6(6):e21624. Epub 2011 Jun 24. PMID:21720566 doi:10.1371/journal.pone.0021624
Б. Стабилизация солевого мостика повышает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. ПЛОС Один. 2011;6(6):e21624. Epub 2011 Jun 24. PMID:21720566 doi:10.1371/journal.pone.0021624
Страница Proteopedia Авторы и редакторы
(что это?)
Эрик Марц
Аминокислотный состав — Протеопедия, жизнь в 3D
Из Протеопедии
Перейти к: навигация, поиск
Аминокислотный состав белка относится к процентному содержанию каждой аминокислоты в последовательности этого белка. Процент, иногда называемый мольным процентом, рассчитывается для каждой из 22 стандартных аминокислот как количество этой аминокислоты, деленное на общее количество аминокислот в белковой цепи или молекуле.
Содержимое
|
Пример
В качестве примера приведен аминокислотный состав ацетилхолинэстеразы Torpedo californica (тихоокеанский электрический скат), структура которого 2ace. Последовательность канонической изоформы имеет длину 586. В ее зрелой форме сигнальный пептид удаляется с амино-конца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537 с таким составом:
Последовательность канонической изоформы имеет длину 586. В ее зрелой форме сигнальный пептид удаляется с амино-конца, а пропептид удаляется с карбокси-конца, оставляя зрелую длину 537 с таким составом:
| Эта гистограмма состава была создана с помощью калькулятора состава/молекулярного веса Protein Information Resource (PIR). Белковые последовательности легко получить на UniProt.Org или просмотреть запись PDB в FirstGlance в Jmol и щелкнуть последовательности. Вы можете выровнять геномную полноразмерную последовательность из UniProt с экспериментально кристаллизованной последовательностью. Вот инструкции. |
Средние составы
Средние составы были рассчитаны для большого количества белков из различных таксонов. Они сведены в таблицу, которую можно загрузить с помощью таблицы amino-acid-composition.xlsx.zip. Обнадеживает согласие между таблицами, составленными в 1993, 1998 и 2008 годах (цитаты приведены в электронной таблице).
Вышеупомянутые проценты были определены для нескольких тысяч последовательностей различных белков длиной 200 остатков, с идентичностью последовательностей менее 50% [1] . Эти данные включены в приведенную выше электронную таблицу.
Детерминанты аминокислотного состава
GC-содержание генома организма является сильнейшим детерминантом аминокислотного состава на уровне генома. [2] [3] [4] .
Другие, более слабые воздействия:
- Температуры роста (мезофилия/термофилия/гипертермофилия). У термофилов больше глутаминовой кислоты (с уменьшением глутамина), а также больше лизина и аргинина [2] . Вероятно, это связано с большим количеством солевых мостиков в белках термофилов, которые, как полагают, способствуют термостабильности [5] .
- Длина цепи . Белки термофилов в среднем короче, чем у мезофилов. Средние длины 283 и 340 соответственно [2] .
 Исследование около 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
Исследование около 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:- Увеличиваются по длине, достигают плато: Ala, Asp, Glu, Gly, Pro, Val; меньшее увеличение для Gln и Thr.
- Уменьшаются с длиной: Cys, Phe, His, Ile, Lys, Met, Asn, Ser.
- Leu и Tyr самые высокие в коротких и длинных цепях и реже в белках среднего размера.
- Пики Arg в белках среднего размера.
- Trp постоянна и составляет около 1,4% для длин 75-200.
- Линкеры по сравнению с доменами : Линкеры между доменами имеют больше полярных остатков, тогда как компактные домены имеют больше гидрофобных остатков [3] .
- Среда обитания : Окружающая среда, в которой живет организм, оказывает незначительное влияние на средний состав его белков [4] .
- Композиционная изменчивость ранжирует археи > бактерии > эукариоты [3] .
Калькуляторы состава
- Калькулятор состава/молекулярного веса Protein Information Resource (PIR) создает очень полезную гистограмму (см.
 пример выше), но не предоставляет готовую таблицу для электронных таблиц.
пример выше), но не предоставляет готовую таблицу для электронных таблиц.
- EMBOSS-PepStats EMBL-EBI создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, , отсортированные по однобуквенным кодам .
| Импорт данных композиции в Excel: Скопируйте только столбцы данных, вставьте в текстовый редактор и сохраните в обычный текстовый файл. В Excel в существующей (возможно, пустой) электронной таблице Файл, Импорт, Текст. Отметьте 3 параметра разделителя: Tab, Space, рассматривать последовательные разделители как один. Приступить к импорту. |
- ProtParam ExPASy создает таблицу, которую легко импортировать в электронную таблицу. В таблице есть как однобуквенные, так и трехбуквенные сокращения аминокислот, , отсортированные по трехбуквенным кодам . Он также предлагает вывод CSV, альтернативный формат, понятный электронным таблицам.

Ссылки
- ↑ 1,0 1,1 Каруго О. Аминокислотный состав и размер белка. Белковая наука. 2008 Декабрь; 17 (12): 2187-91. doi: 10.1110/ps.037762.108. Epub 2008, 9 сентября. PMID: 18780815 doi: http://dx.doi.org/10.1110/ps.037762.108
- ↑ 2.0 2.1 2.2 Текая Ф., Ерамян Э., Дуджон Б. Аминокислотный состав геномов, образ жизни организмов и эволюционные тенденции: глобальная картина с анализом соответствия. Ген. 2002 4 сентября; 297(1-2):51-60. doi: 10.1016/s0378-1119(02)00871-5. PMID: 12384285 doi: http://dx.doi.org/10.1016/s0378-1119(02)00871-5
- ↑ 3,0 3,1 3,2 Брюн Д., Андраде-Наварро М.А., Майер П. Сравнение аминокислотного состава доменов и линкеров в масштабах всего протеома. Примечания BMC Res. 2018 9 февраля; 11 (1): 117. doi: 10.1186/s13104-018-3221-0. PMID: 29426365 doi: http://dx.doi.org/10.1186/s13104-018-3221-0
- ↑ 4.0 4.



 0 2.1 2.2 Текая Ф., Ерамян Э., Дуджон Б. Аминокислотный состав геномов, образ жизни организмов и эволюционные тенденции: глобальная картина с анализом соответствия. Ген. 2002 4 сентября; 297(1-2):51-60. doi: 10.1016/s0378-1119(02)00871-5. PMID: 12384285 doi: http://dx.doi.org/10.1016/s0378-1119(02)00871-5
0 2.1 2.2 Текая Ф., Ерамян Э., Дуджон Б. Аминокислотный состав геномов, образ жизни организмов и эволюционные тенденции: глобальная картина с анализом соответствия. Ген. 2002 4 сентября; 297(1-2):51-60. doi: 10.1016/s0378-1119(02)00871-5. PMID: 12384285 doi: http://dx.doi.org/10.1016/s0378-1119(02)00871-5 Б. Стабилизация солевого мостика повышает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. ПЛОС Один. 2011;6(6):e21624. Epub 2011 Jun 24. PMID:21720566 doi:10.1371/journal.pone.0021624
Б. Стабилизация солевого мостика повышает термостабильность белка за счет уменьшения изменения теплоемкости при разворачивании. ПЛОС Один. 2011;6(6):e21624. Epub 2011 Jun 24. PMID:21720566 doi:10.1371/journal.pone.0021624 Исследование около 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу:
Исследование около 550 000 белков длиной 50-200 аминокислот [1] пришло к выводу: пример выше), но не предоставляет готовую таблицу для электронных таблиц.
пример выше), но не предоставляет готовую таблицу для электронных таблиц.