Сигнальная функция белки: Свойства и функции белков
Сигнальная функция
Сигнальная
функция белков —
способность белков служить сигнальными
веществами, передавая сигналы между
клетками, тканями, о́рганами и организмами.
Часто сигнальную функцию объединяют с
регуляторной, так как многие внутриклеточные
регуляторные белки тоже осуществляют
передачу сигналов.
Сигнальную
функцию выполняют белки-гормоны, цитокины, факторы
роста и
др.
Рецепторная
функция
Эта
функция заключается в избирательном
связывании гормонов, биологически
активных веществ и медиаторов на
поверхности мембран или внутри клеток.
Транспортная
функция
Только
белки осуществляют перенос веществ в
крови,
например, липопротеины (перенос
жира), гемоглобин (транспорт
кислорода), трансферрин (транспорт
железа). Белки транспортируют в крови
катионы кальция, магния, железа, меди и
другие ионы.Транспорт веществ через
мембраны осуществляют
белки — Na+,К+-АТ, Са2+-АТФаза , глюкозные
транспортеры.
Резервная
функция
В
качестве примера депонированного белка
можно привести производство и накопление
в яйце яичного
альбумина.
У
животных и человека таких специализированных
депо нет, но при длительном голодании
используются белки мышц,
лимфоидных органов, эпителиальных
тканей и печени.
Сократительная
функция
Существует
ряд внутриклеточных белков, предназначенных
для изменения формы клетки и движения
самой клетки или ее органелл
(тубулин, актин, миозин).
Защитная
функция
Защитную
функцию, предупреждая инфекционный
процесс и сохраняя устойчивость
организма, выполняют иммуноглобулины крови,
факторы системы комплемента, пропердин,
при повреждении тканей работают белки
свертывающей системы крови
— например, фибриноген, протромбин,
антигемофильный глобулин. Механическую защиту
и поддержку клеток осуществляют протеогликаны.
К
данной функции также можно отнести
поддержание постоянства коллоидно-осмотического
давления крови,
интерстиция и внутриклеточных пространств,
а также иные функции белков
крови.
Миозин
— моторный белок
Целый
класс моторных
белков обеспечивает
движения организма, например, сокращение
мышц, в том числе локомоцию (миозин),
перемещение клеток внутри организма
(например, амебоидное движениелейкоцитов),
движение ресничек и жгутиков,
а также активный и направленный
внутриклеточный транспорт (кинезин, динеин).
Динеины и кинезины проводят транспортировку
молекул вдоль микротрубочек с
использованием гидролиза АТФ в
качестве источника энергии. Динеины
переносят молекулы и органоиды из
периферических частей клетки по
направлению к центросоме,
кинезины — в противоположном
направлении. Динеины также отвечают за
движение ресничек и жгутиков
эукариот. Цитоплазматические варианты
миозина могут принимать участие в
транспорте молекул и органоидов по
микрофиламентам.
Роль
белков в обмене веществ.
Обмен
Белков
Потребность
в белке определяется
минимальным количеством пищевого
белка, который будет уравновешивать
потери организмом азота, при сохранении
энергетического баланса. Белки находятся
в состоянии непрерывного обмена и
обновления. В организме здорового
взрослого человека количество распавшегося
за сутки белка равно количеству вновь
синтезированного. Животные существа
могут усваивать азот только в составе
аминокислот, поступающих в организм
с белками пищи.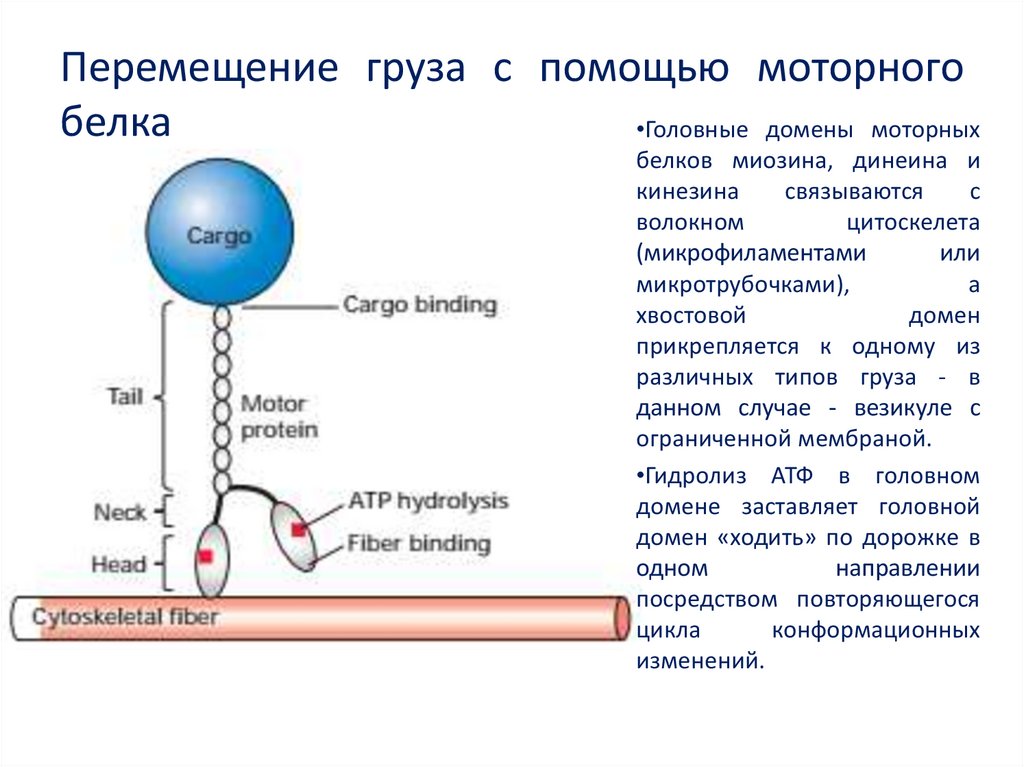 Десять аминокислот из
Десять аминокислот из
20 (валин, лейцин, изолейцин, лизин,
метионин, триптофан, треонин, фенилаланин,
аргинин и гистидин) в случае их
недостаточного поступления с пищей
не может быть синтезирована в организме.
Эти аминокислоты называют незаменимыми. Другие
десять аминокислот (заменимые) не менее
важны для жизнедеятельности, чем
незаменимые, но в случае недостаточного
поступления с пищей заменимых аминокислот
они могут синтезироваться в организме.
Важным фактором обмена белков организма
является повторное
использование (реутилизация) аминокислот,
образовавшихся при распаде одних
белковых молекул, для синтеза
других.
Из
аминокислот, источниками которых
являются белки пищи, и аминокислот,
образующихся в организме, синтезируются
свойственные ему белковые
молекулы,пептидные гормоны, коэнзимы.
В этом заключается пластическая роль
белков пищи.
Скорость
распада и обновления белков организма
различна. Полупериод распада гормонов
пептидной природы составляет минуты
или часы, белков плазмы крови и печени
около 10 суток, белков мышц около 180 суток.
В среднем белки организма человека
обновляются за 80 суток. О суммарном
количестве белка, подвергшегося распаду
за сутки, судят по количеству азота,
выводимого из организма человека. В
белке содержится около 16% азота или в
100 г белка — 16 г азота. Таким образом,
выделение организмом 1 г азота
соответствует распаду 6,25 г белка. За
сутки из организма взрослого человека
выделяется около 3,7 г азота. Из этих
данных следует, что масса белка,
подвергшегося за сутки полному разрушению
составляет 3,7 х 6,25 = 23 г или 0,028-0,075 г
азота на 1 кг массы тела в сутки (коэффициент
изнашивания по Рубнеру).
Если
количество азота, поступающего в организм
с пищей, равно количеству азота выводимого
из организма, принято считать, что
организм находится в состоянии азотистого
равновесия. В случаях, когда в организм
поступает азота больше, чем его выделяется,
говорят о положительном
азотистом балансе (задержка,
ретенция азота). Такие состояния
бывают при увеличении массы мышечной
ткани, в период роста организма,
беременности, выздоровления после
тяжелого истощающего заболевания.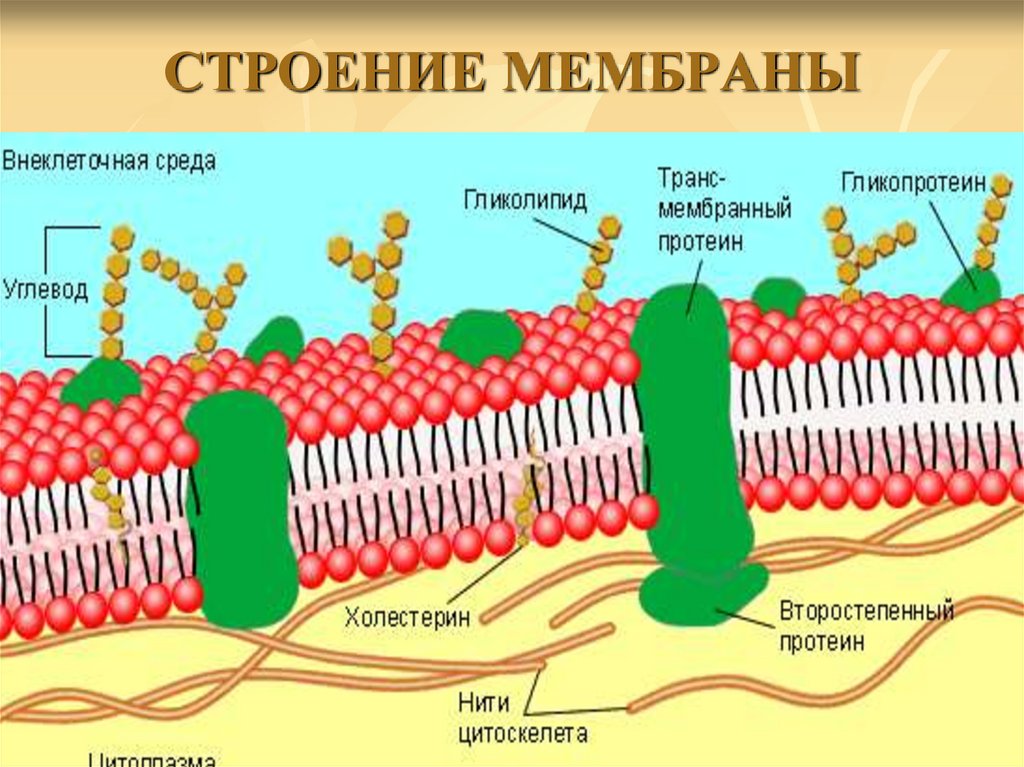
Состояние,
при котором количество выводимого из
организма азота превышает его поступление
в организм, называют отрицательным азотистым
балансом. Оно
имеет место при питании неполноценными
белками, когда в организм не поступают
какие-либо из незаменимых аминокислот,
при белковом голодании или при полном
голодании.
Белки,
использующиеся в организме в первую
очередь в качестве пластических веществ,
в процессе их разрушения освобождают
энергию для синтеза АТФ и
образования тепла.
Основные функции белков в организме, их свойства и роль
Поможем понять и полюбить химию
Начать учиться
Генетическая информация о структуре и функциях всех белков в организме передается нам от родителей с помощью специальных белков. К тому же эти вещества определяют структуру и форму клетки, обеспечивают узнавание и связывание различных молекул, а также катализ и регуляцию химических реакций, протекающих в наших телах.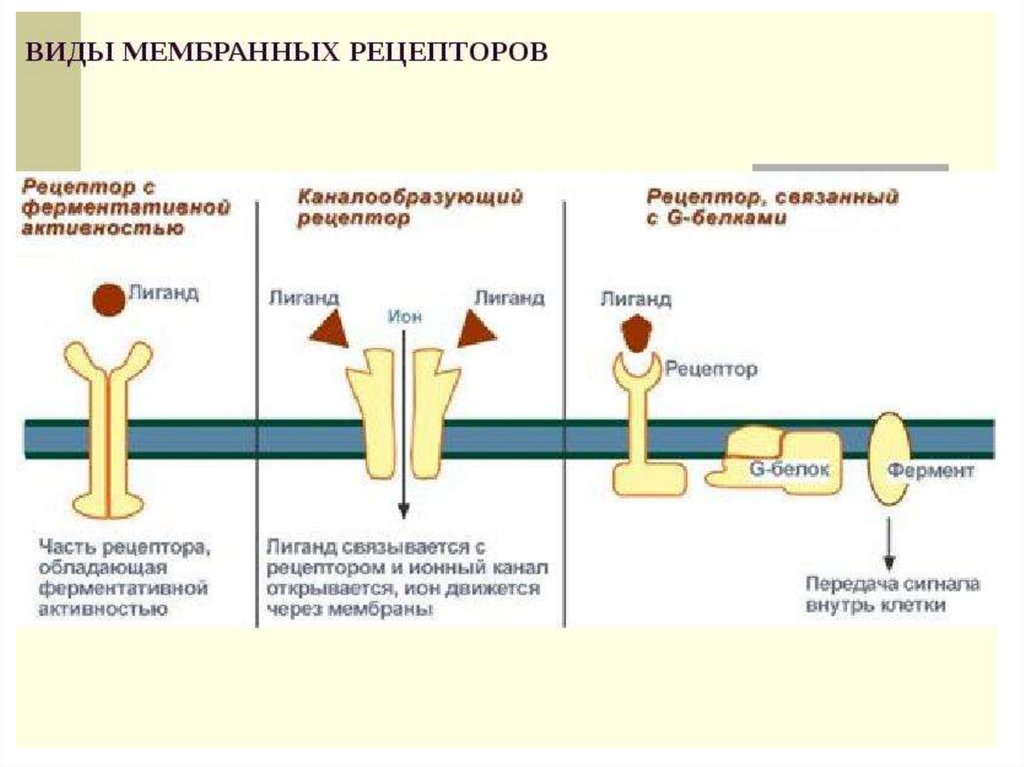 И это все еще неполный список функций белков в организме человека!
И это все еще неполный список функций белков в организме человека!
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
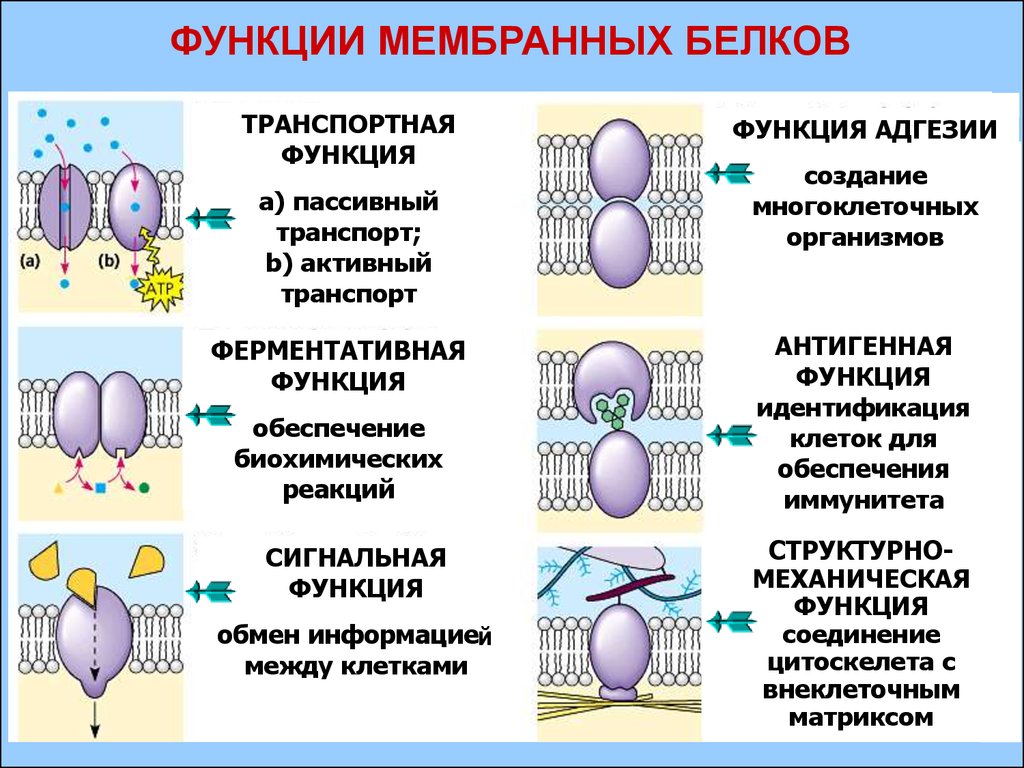
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия.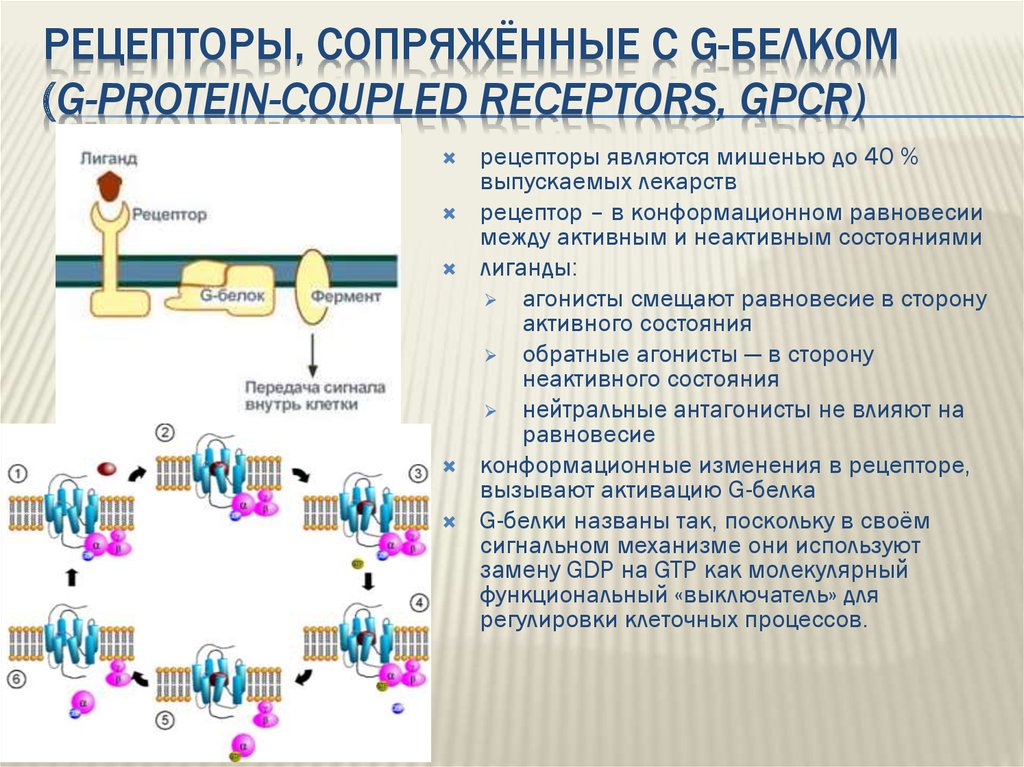 При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот.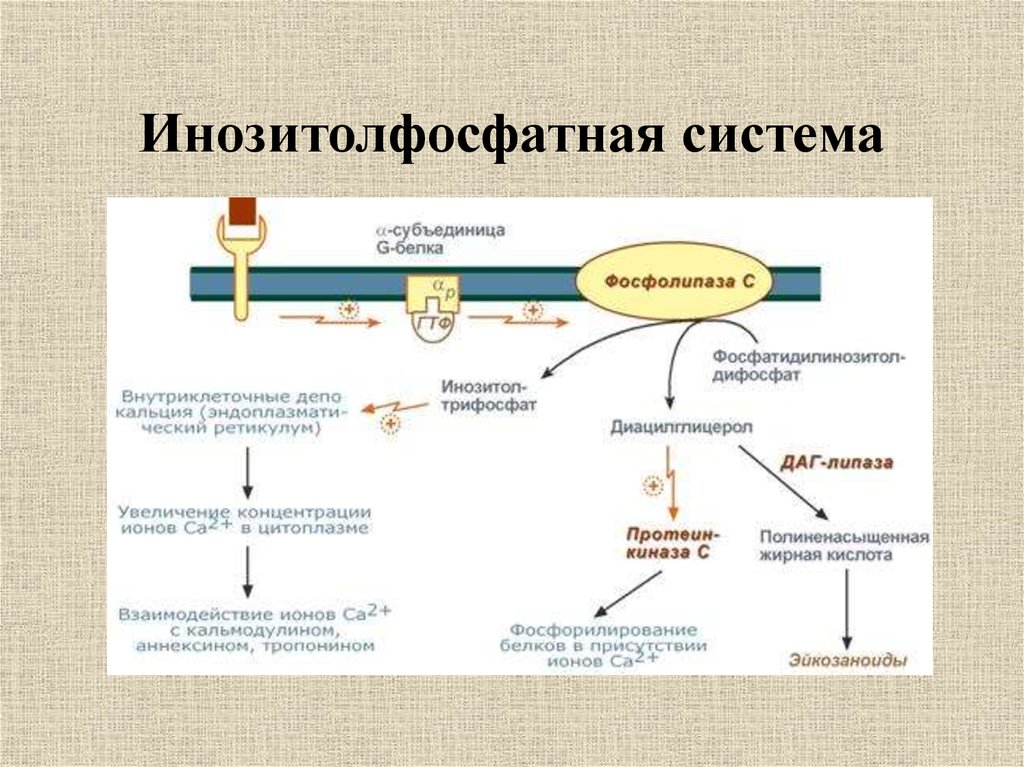 Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.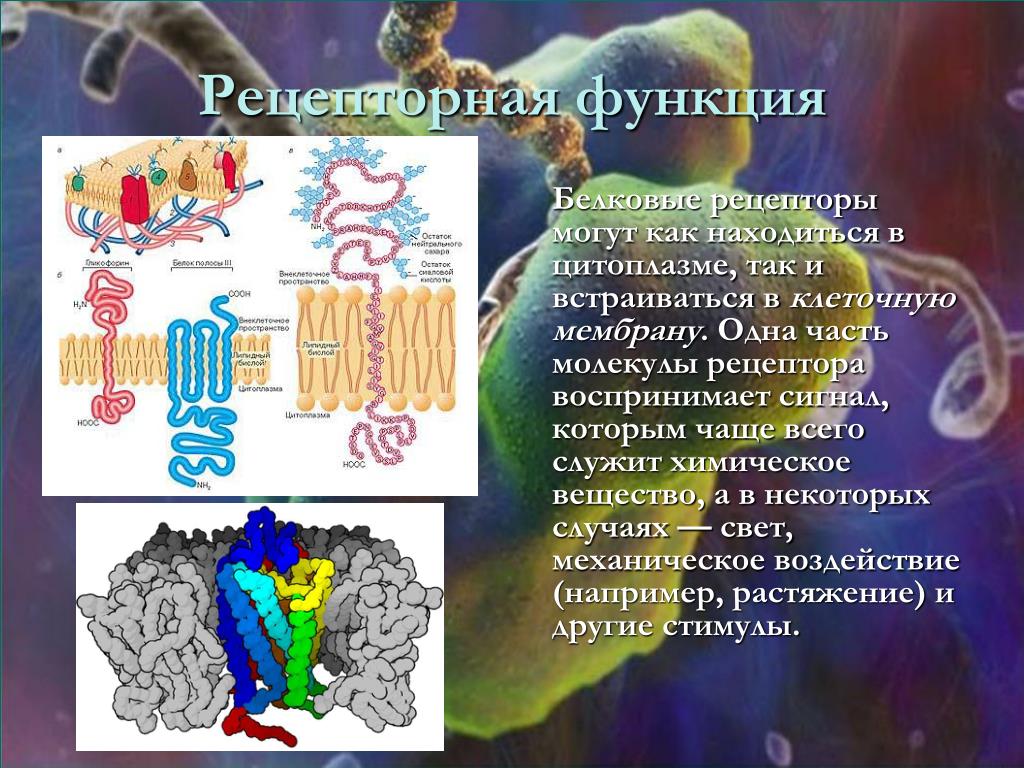
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
обратимая денатурация:
необратимая денатурация:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
Какая из структур белка является самой прочной?
Первичная
Вторичная
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регуляторную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
Ковалентной неполярной
При гидролизе белка получается (получаются).
 ..
..Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart.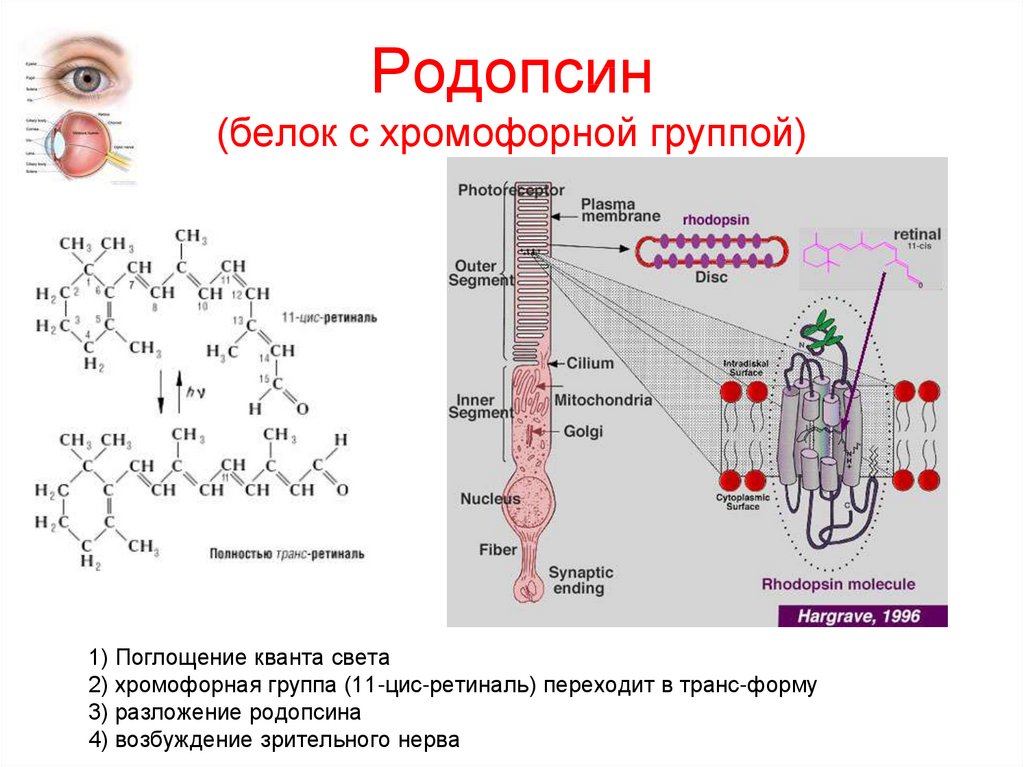 Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Ответы на вопросы
a
b
c
a
c
Ксения Боброва
К предыдущей статье
Алканы
К следующей статье
Реакции обмена и химические уравнения для них
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Передача сигналов через рецепторы, сопряженные с G-белком
1. Redhead CR, Palme K. Гены передачи сигнала растениями. Crit Rev Plant Sci. 1996; 15: 425–454. [Google Scholar]
Redhead CR, Palme K. Гены передачи сигнала растениями. Crit Rev Plant Sci. 1996; 15: 425–454. [Google Scholar]
2. Махаджан С., Тутея Н. Стрессы от холода, засоления и засухи: обзор. Арх Биохим Биофиз. 2005; 444: 139–158. [PubMed] [Google Scholar]
3. Тутея Н. Механизмы солеустойчивости растений. Мет Энзимол. 2007; 428:419–438. [PubMed] [Google Scholar]
4. Тревавас А.Дж., Малхо Р. Восприятие сигналов и трансдукция: происхождение фенотипа. Растительная клетка. 1997;9:1181–1195. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Hucho F, Buchner K. Передача сигналов и протеинкиназы: долгий путь от плазматической мембраны до ядра. Натурвиссеншафтен. 1997; 84: 281–290. [PubMed] [Google Scholar]
6. Темпл Б.Р., Джонс А.М., Джулиано Р.Л. Растительный гетеротримерный G-белковый комплекс. Annu Rev Plant Biol. 2007; 58: 249–266. [PubMed] [Google Scholar]
7. Тутея Н, Сопоры С.К. Передача сигналов растениями при стрессе: рецепторы, связанные с G-белком, гетеротримерные G-белки и связывание сигнала через фосфолипазы. Поведение сигналов растений. 2008;3:79–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Поведение сигналов растений. 2008;3:79–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Strader CD, Fong TM, Tota MR, Underwood D, Dixon RA. Структура и функция рецепторов, связанных с G-белком. Анну Рев Биохим. 1994; 63: 101–132. [PubMed] [Google Scholar]
9. Shorr RGL, Lefkowitz RJ, Caron MG. Очистка β-адренорецепторов. Идентификация гормонсвязывающей субъединицы. Дж. Биол. Хим. 1981; 256: 5820–5826. [PubMed] [Google Scholar]
10. Bockaert J, Pin JP. Молекулярная переделка рецепторов, связанных с G-белком: эволюционный успех. EMBO J. 1999;18:1723–1729. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Hamm HE. Как активируются рецепторы, связанные с G-белками. Proc Natl Acad Sci USA. 2001;98:4819–4821. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Hamm H. Многоликая передача сигналов G-белка. Дж. Биол. Хим. 1966; 273: 669–672. [PubMed] [Google Scholar]
13. Gilman AG. G-белки и двойной контроль аденилатциклазы. Клетка. 1984; 36: 577–579. [PubMed] [Google Scholar]
1984; 36: 577–579. [PubMed] [Google Scholar]
14. Gilman AG. G-белки: преобразователь сигналов, генерируемых рецептором. Анну Рев Биохим. 1987;56:615–649. [PubMed] [Google Scholar]
15. Logothetis DE, Kurachi Y, Galper J, Neer EJ, Clapham DE. Субъединицы βγ ГТФ-связывающих белков активируют мускариновый канал K + в сердце. Природа. 1987; 325: 321–326. [PubMed] [Google Scholar]
16. Ford CE, Skiba NP, Bae H, Daaka Y, Reuveny E, Shekter LR, et al. Молекулярные основы взаимодействия βγ-субъединиц G-белка с эффекторами. Наука. 1998; 280:1271–1273. [PubMed] [Google Scholar]
17. Rondard P, Iiri T, Srinivasan S, Meng E, Fujita T, Bourne HR. Альфа-субъединица мутантного G-белка, активируемая Gbetagamma: модель активации рецептора. Proc Natl Acad Sci USA. 2001;98:6150–6155. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Gentles A, Karlin S. Почему человеческие рецепторы, связанные с G-белком, преимущественно не имеют интронов? Тенденции в Gen. 1999; 15: 47–48. [PubMed] [Google Scholar]
1999; 15: 47–48. [PubMed] [Google Scholar]
19. Болдуин Дж.М. Структура и функция рецепторов, связанных с G-белками. Curr Opin Cell Biol. 1994; 6: 180–190. [PubMed] [Google Scholar]
20. Pingret J, Journet E, Barker DG. Передача сигналов фактора Rhizobium Nod: свидетельство механизма трансдукции, опосредованного G-белком. Растительная клетка. 1998;10:659–671. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Pao CS, Barker BL, Benovic JL. Роль амино-конца рецепторной киназы 2, связанной с G-белком, в фосфорилировании рецептора. Биохимия. 2009 (в печати) [бесплатная статья PMC] [PubMed] [Google Scholar]
22. Scheerer P, Park JH, Hildebrand PW, Kim YJ, Krauss N, Choe HW, et al. Кристаллическая структура опсина в конформации, взаимодействующей с G-белком. Природа. 2008; 455:497–502. [PubMed] [Google Scholar]
23. Park JH, Scheerer P, Hofmann KP, Choe HW, Ernst OP. Кристаллическая структура безлигандного рецептора опсина, связанного с G-белком. Природа. 2008 г. www.nature.com/doifinder/10.1038/nature07063. [PubMed] [Академия Google]
2008 г. www.nature.com/doifinder/10.1038/nature07063. [PubMed] [Академия Google]
24. Schoneberg T., Schulz A., Gudermann T. Структурная основа функции и дисфункции рецептора, связанного с G-белком, при заболеваниях человека. Rev Physiol Biochem Pharmacol. 2002; 144:143–227. [PubMed] [Google Scholar]
25. Fredriksson R, Schioth HB. Репертуар рецепторов, связанных с G-белком, в полностью секвенированных геномах. Мол Фармакол. 2005; 67: 1414–1425. [PubMed] [Google Scholar]
26. Бай М. Димеризация рецепторов, связанных с G-белком: роль в передаче сигнала. Сотовая связь 2004; 16: 175–186. [PubMed] [Академия Google]
27. Misra S, Wu Y, Venkataraman G, Sopory S, Tuteja N. Гетеротримерный комплекс G-белка и рецептор, связанный с G-белком, из бобовых ( Pisum sativum ): роль в засолении, тепловом стрессе и кросс- поговорите с Phospholipase C. Plant J. 2007; 51: 656–669. [PubMed] [Google Scholar]
28. Гукин Т.Е., Ким Дж., Ассманн С.М. Полная протеомная идентификация рецепторов растений-кандидатов, связанных с G-белком, у арабидопсиса, риса и тополя: компьютерный прогноз и связывание белков in vivo. Геном биол. 2008;9:120. doi: 10.1186/gb-2008-97-r120. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Геном биол. 2008;9:120. doi: 10.1186/gb-2008-97-r120. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Колаковский Л.Ф., младший «GCRDb: база данных рецепторов, связанных с G-белком», Receptor Channel. 1994; 2:1–7. [PubMed] [Google Scholar]
30. Патель Т.Б. Одиночные трансмембранные охватывающие гетеротримерные рецепторы, связанные с G-белком, и их сигнальные каскады. Pharmacol Rev. 2004; 56:371–385. [PubMed] [Google Scholar]
31. Папасайкас П.К., Багос П.Г., Литоу З.И., Промпонас В.Я., Хамодракас С.Ю. PRED-GPCR: сервер распознавания GPCR и классификации семейств. Нуклеиновые Кислоты Res. 2004; 32: 380–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Гао QB, Ван ZZ. Классификация рецепторов, связанных с G-белком, на четырех уровнях. Белок Eng Des Sel. 2006; 19: 511–516. [PubMed] [Google Scholar]
33. Vohra S, Chintapalli SV, Illingworth CJ, Reeves PJ, Mullineaux PM, Clark HS, et al. Вычислительные исследования GPCR семейства A и семейства B. Биохим Сок Транс. 2007; 35: 749–754. [PubMed] [Google Scholar]
Биохим Сок Транс. 2007; 35: 749–754. [PubMed] [Google Scholar]
34. Гангал Р., Кумар К.К. Методология сокращенного алфавитного мотива для аннотации GPCR. J Biomol Struct Dyn. 2007;25:299–310. [PubMed] [Google Scholar]
35. Chen JG, Willard FS, Huang J, Liang J, Chasse SA, Jones AM, Siderovski DP. Семитрансмембранный белок RGS, который модулирует пролиферацию растительных клеток. Наука. 2003; 301:1728–1731. [PubMed] [Google Scholar]
36. Johnston CA, Taylor JP, Gao Y, Kimple AJ, Grigston JC, Chen JG, et al. Ускорение ГТФазы как шаг, ограничивающий скорость передачи сигналов сахара, связанной с G-белком арабидопсиса. Proc Natl Acad Sci USA. 2007; 104:17317–17322. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Plakidou-Dymock S, Dymock D, Hooley R. Семь трансмембранных рецепторов высших растений, влияющих на чувствительность к цитокининам. Карр Биол. 1998; 8: 315–324. [PubMed] [Google Scholar]
38. Colucci G, Apone F, Alyeshmerni N, Chalmers D, Chrispeels MJ. GCR1, предполагаемый ген рецептора, связанного с G-белком арабидопсиса, регулируется клеточным циклом, и его сверхэкспрессия отменяет состояние покоя семян и сокращает время до цветения. Proc Natl Acad Sci USA. 2002; 99: 4736–4741. [Бесплатная статья PMC] [PubMed] [Google Scholar]
GCR1, предполагаемый ген рецептора, связанного с G-белком арабидопсиса, регулируется клеточным циклом, и его сверхэкспрессия отменяет состояние покоя семян и сокращает время до цветения. Proc Natl Acad Sci USA. 2002; 99: 4736–4741. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Apone F, Alyeshmerni N, Wiens K, Chalmers D, Chrispeels MJ, Colucci G. Рецептор GCR1, связанный с G-белком, регулирует синтез ДНК посредством активации фосфатидилинозитол-специфической фосфолипазы C. Plant Physiol. 2003; 133: 571–579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Warpeha KM, Upadhyay S, Yeh J, Adamiak J, Hawkins SI, Lapik YR, et al. Сигнальная цепь GCR1, GPA1, PRN1, NF-Y опосредует реакцию арабидопсиса как на синий свет, так и на реакцию абсцизовой кислоты. Завод Физиол. 2007;143:1590–1600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Морияма Э.Н., Строуп П.К., Опия С.О., Чен З., Джонс А.М. Изучение генома Arabidopsis thaliana для семи сильно расходящихся трансмембранных рецепторов.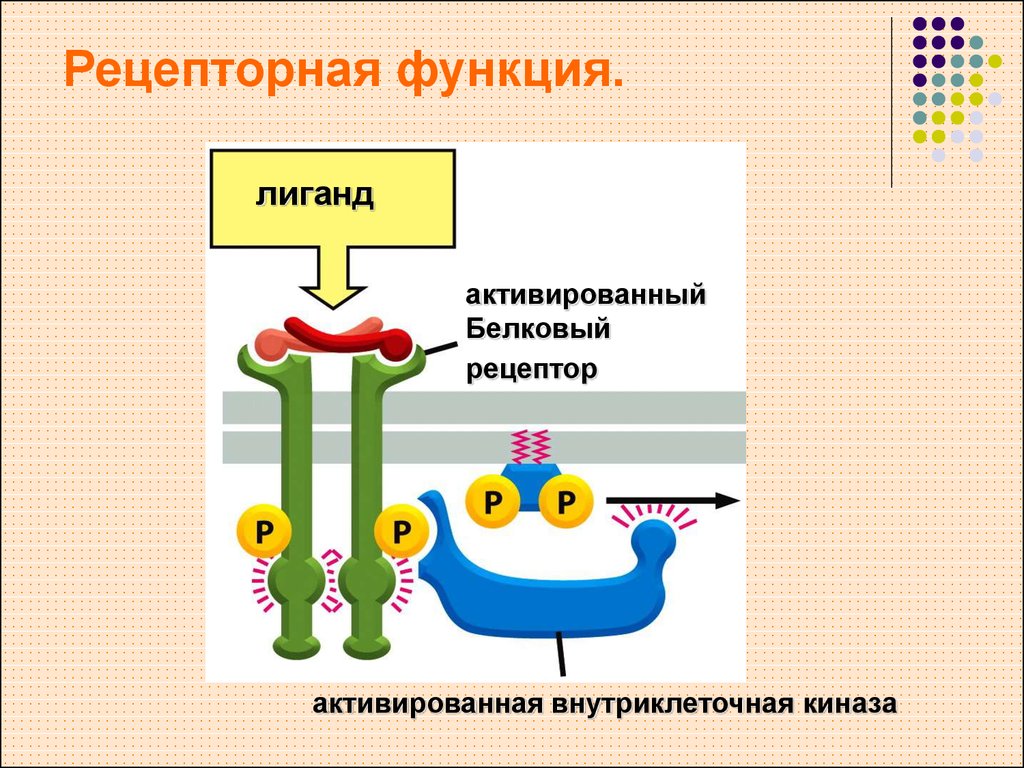 Геном биол. 2006; 7:96. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Геном биол. 2006; 7:96. [Статья бесплатно PMC] [PubMed] [Google Scholar]
42. Йозефссон Л.Г., Раск Л. Клонирование предполагаемого рецептора, связанного с G-белком, из Arabidopsis thaliana . Евр Дж Биохим. 1997; 249:415–420. [PubMed] [Google Scholar]
43. Pandey S, Assmann SA. Предполагаемый рецептор GCR1, связанный с G-белком арабидопсиса, взаимодействует с α-субъединицей GPA1 G-белка и регулирует передачу сигналов абсцизовой кислоты. Растительная клетка. 2004; 16:1616–1632. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Перфус-Барбеох Л., Джонс А.М., Ассманн С.М. Функция гетеротримерного G-белка растений: выводы из арабидопсиса и мутантов риса. Curr Opin Plant Biol. 2004; 7: 719–731. [PubMed] [Google Scholar]
45. Kato C, Mizutani T, Tamaki H, Kumagai H, Kamiya T, Hirobe A, et al. Характеристика гетеротримерных комплексов G-белка в плазматической мембране риса. Плант Дж. 2004; 38: 320–331. [PubMed] [Google Scholar]
46. Zhao J, Wang X. Фосфолипаза Dα1 арабидопсиса взаимодействует с α-субъединицей гетеротримерного G-белка посредством мотива, аналогичного мотиву DRY в рецепторах, связанных с G-белком. Дж. Биол. Хим. 2004;279: 1794–1800. [PubMed] [Google Scholar]
Фосфолипаза Dα1 арабидопсиса взаимодействует с α-субъединицей гетеротримерного G-белка посредством мотива, аналогичного мотиву DRY в рецепторах, связанных с G-белком. Дж. Биол. Хим. 2004;279: 1794–1800. [PubMed] [Google Scholar]
47. Чен Дж. Г., Пандей С., Хуанг Дж., Алонсо Дж. М., Экер Дж. Р., Ассманн С. М., Джонс А. М. GCR1 может действовать независимо от гетеротримерного G-белка в ответ на брассиностероиды и гиббереллины при прорастании семян арабидопсиса. Завод Физиол. 2004; 135:907–915. [Статья бесплатно PMC] [PubMed] [Google Scholar]
48. Liu X, Yue Y, Li B, Nie Y, Li W, Wu WH, Ma L. Рецептор, связанный с белком G, представляет собой рецептор плазматической мембраны растения. гормон абсцизовая кислота. Наука. 2007; 315:1676–1677. [PubMed] [Академия Google]
49. Сантнер А., Эстель М. Последние достижения и новые тенденции в передаче сигналов растительных гормонов. Природа. 2009; 450:1071–1078. [PubMed] [Google Scholar]
50. Gao Y, Zeng Q, Guo J, Cheng J, Ellis BE, Chen JG. Генетическая характеристика не выявила никакой роли описанного рецептора АБК, GCR2, в контроле АБК прорастания семян и раннего развития проростков арабидопсиса. Плант Дж. 2007; 52: 1001–1013. [PubMed] [Google Scholar]
Генетическая характеристика не выявила никакой роли описанного рецептора АБК, GCR2, в контроле АБК прорастания семян и раннего развития проростков арабидопсиса. Плант Дж. 2007; 52: 1001–1013. [PubMed] [Google Scholar]
51. Guo J, Zeng Q, Emami M, Ellis BE, Chen JG. Семейство генов GCR2 не требуется для АБК-контроля прорастания семян и раннего развития проростков арабидопсиса. ПЛОС Один. 2008;3:2982. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Trusov Y, Rookes JE, Tilbrook K, Chakravorty D, Mason MG, Anderson D, et al. Гамма-субъединицы гетеротримерного G-белка обеспечивают функциональную селективность в передаче сигналов димера Gбета-гамма у арабидопсиса. Растительная клетка. 2007;19:1235–1250. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Бактаватсалам Д., Бразилл Д., Гомер Р.Х., Эйхингер Л., Риверо Ф., Ногель А.А. «Рецептор, связанный с G-белком, с липидкиназным доменом участвует в восприятии клеточной плотности» Curr Biol. 2007;17:892–897. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
54. Park PS-H, Palczewski K. Диверсификация репертуара рецепторов, связанных с G-белком, путем олигомеризации. Proc Natl Acad Sci USA. 2005; 102:8793–8794. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Pandey S, Nelson DC, Assmann SM. Два новых G-белка GPCR-типа являются рецепторами абсцизовой кислоты у арабидопсиса. Клетка. 2009; 136:21–23. [PubMed] [Google Scholar]
Передача сигналов G-белка — Вселенная
Гетеротримерные комплексы G-белка состоят из 3 субъединиц, включая α-субъединицу, которая действует как основной сигнальный медиатор и чье активное состояние регулируется рекрутированием и гидролизом GTP (гуанозин-5′-трифосфат). Существует также димер β- и γ-субъединиц, которые образуют неразрывный комплекс с различными сигнальными способностями.
В зависимости от субъединицы Gα, участвующей в комплексе, наиболее известные G-белки классифицируются как Gi, Gs или Gq. Они сигнализируют по разным путям. Белки Gq зависят от ферментов семейства фосфолипаз C (PLC), в то время как белки Gs и Gi соответственно стимулируют и ингибируют аденилатциклазу (AC) и, таким образом, воздействуют на количество цитозольного цАМФ.
Белки Gq зависят от ферментов семейства фосфолипаз C (PLC), в то время как белки Gs и Gi соответственно стимулируют и ингибируют аденилатциклазу (AC) и, таким образом, воздействуют на количество цитозольного цАМФ.
Сигнальные пути GPCR, активируемые каноническим лигандом и предвзятым лигандом
Эта веб-страница предназначена для того, чтобы помочь вам понять вселенную передачи сигналов G-белка и разобраться в различиях и особенностях рецепторов, связанных с Gs и Gi, и рецепторов, связанных с Gq. Мы разработали готовую к использованию тестовую панель для мониторинга сигнальных путей GPCR (вторичный мессенджер, фосфопротеины и факторы транскрипции), чтобы помочь вам в ваших исследованиях.
PerkinElmer предлагает наборы HTRF ® и LANCE ® Ultra™, соответствующие вашим исследовательским потребностям: набор cAMP Gi, динамический набор cAMP Gs, набор cAMP Gs HiRange, LANCE ® Ultra™ набор цАМФ, набор IP-One Gq и анализ связывания GTP Gi.
Руководства
Получите эти 4 руководства, чтобы овладеть искусством оптимизации анализа цАМФ!
Загрузить
Руководства
Получите эти 2 руководства, чтобы овладеть искусством оптимизации анализов IP-One!
Загрузить
Руководства
Получите эти 2 руководства, чтобы овладеть искусством оптимизации анализа связывания GTP!
Скачать
Gs- и Gi-связанные рецепторы
Циклический АМФ (циклический аденозин-3’,5’-монофосфат, или просто цАМФ) является одним из наиболее важных внутриклеточных медиаторов GPCR. Во многих типах клеток продукция цАМФ часто является результатом регуляции аденилатциклазы субъединицей Gα гетеротримерных G-белков. Связанные с газом GPCR положительно стимулируют активность аденилатциклазы, что приводит к увеличению клеточного цАМФ. Gαi-связанные GPCR приводят к негативной регуляции аденилатциклазы и, таким образом, к снижению продукции цАМФ.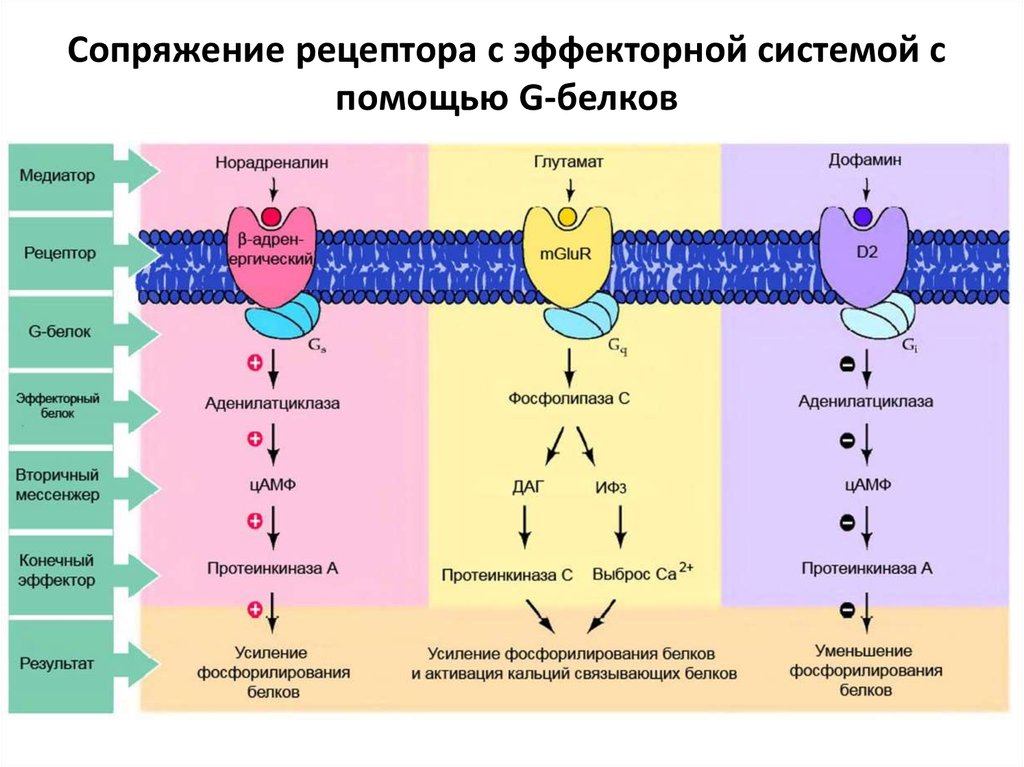
HTRF ® cAMP Gi kit
HTRF ® cAMP Gs kit
Как проводить анализ cAMP HTRF
Посмотрите это видео, чтобы узнать об использовании оптимизированного, не требующего промывки, HTRF® с добавлением и чтением Набор для анализа цАМФ для мониторинга активации GPCR.
Мы ведем вас к успеху
Вы никогда не заблудитесь с нашими уважаемыми руководствами по цАМФ. Ученые Cisbio много лет работали с многочисленными GPCR, связанными с Gαi и Gαs, чтобы разработать подробный набор рекомендаций, кратко изложенных в руководстве. Тысячи исследователей GPCR уже загрузили свою копию этого ценного справочника!
Загрузить руководства
GTPγS – анализ связывания GTP
Гуанозин 5’- (тригидродифосфат), или GTPγS, является стабильным аналогом (гидролизуемым или негидролизуемым) GTP и обладает различными физиологическими свойствами, такими как стимуляция белков, связывающих гуаниновые нуклеотиды.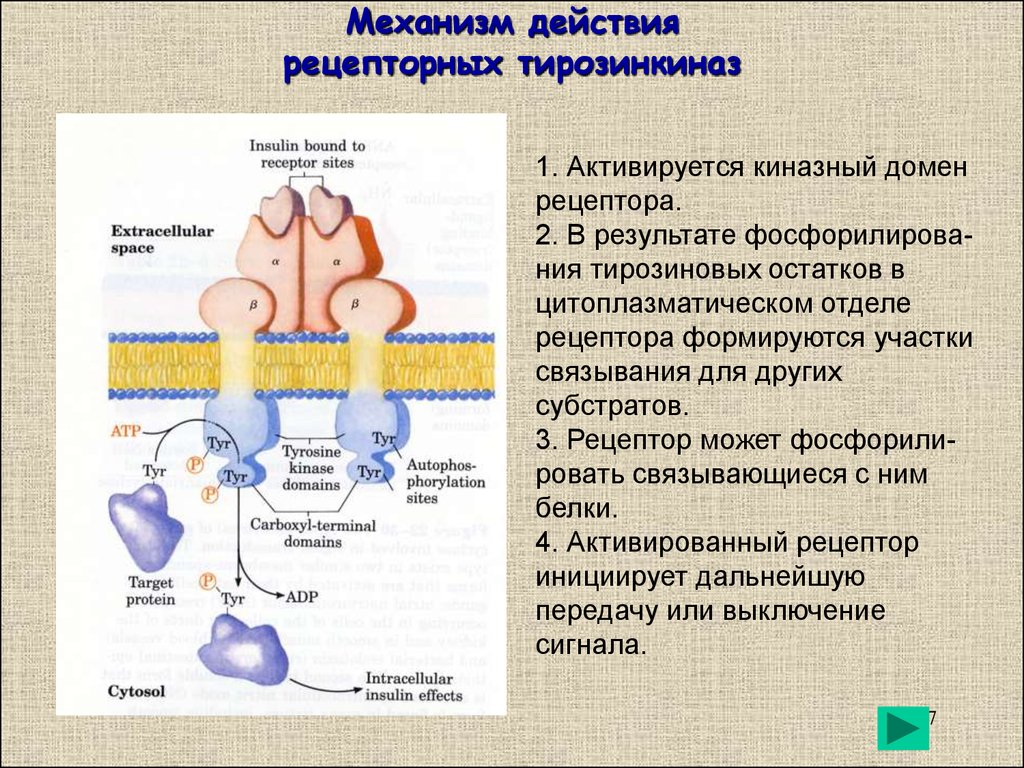
Анализ связывания GTP измеряет уровень активации G-белка после занятия агонистом GPCR путем определения связывания негидролизуемого аналога GTPγS с субъединицами G α. Таким образом, тест измеряет функциональное последствие занятости рецептора в одном из первых событий, опосредованных рецептором.0003
Этот простой анализ позволяет лучше понять современные фармакологические вопросы, включая роль вспомогательных белков в передаче сигналов, конститутивную активность рецептора GPCR и специфическую передачу сигналов агониста.
Активация GPCR приводит к обмену нуклеотидов GDP/GTP на белке Gα субъединица и связывание аналога Eu-GTP. Обнаружение обеспечивается добавлением антитела d2 анти-Gi. Добавление антагониста конкурирует со связыванием агониста в ортостерическом сайте GPCR и, таким образом, инактивирует G-белок. Eu-GTP диссоциирует, что приводит к исчезновению сигнала FRET.
Получите эти 2 руководства, чтобы овладеть искусством оптимизации анализов связывания GTP!
Получите руководства
Gq-связанные рецепторы
Gq-связанные GPCR стимулируют PLC-β, который катализирует гидролиз фосфатидилинозитол-4,5-бисфосфата (PIP2) до IP3 и диацилглицерола (DAG). IP3 связывается с рецепторами IP3 на эндоплазматическом ретикулуме (ER) и индуцирует высвобождение кальция. PLC-β способствует терминации сигнальных комплексов Gq-GPCR, стимулируя гидролиз GTP связанного с GTP Gq.
IP3 связывается с рецепторами IP3 на эндоплазматическом ретикулуме (ER) и индуцирует высвобождение кальция. PLC-β способствует терминации сигнальных комплексов Gq-GPCR, стимулируя гидролиз GTP связанного с GTP Gq.
Высвобождение кальция исторически использовалось для измерения активности Gq, несмотря на его ограничения. Будучи повсеместно вовлеченным в клеточный метаболизм, кальций связан с несколькими механизмами, независимыми от G-белка, что делает его неспецифичным (проницаемые для Са2+ белки, Са2+-насосы и Са2+-переносчики). Строго регулируемая природа кальция также делает его временным аналитом в клетках, что препятствует анализу равновесия и дает погрешность в некоторых фармакологических исследованиях, в частности, при правильном скрининге и характеристике классов лигандов.
Являясь продуктом деградации Gq-зависимого IP-3, IP-1 является специфическим показателем и позволяет проводить истинные равновесные анализы, которые обеспечивают как специфичность сигнала, так и точные фармакологические исследования всех классов соединений. Он измеряет только IP1, продуцируемый исключительно действием фермента фосфолипазы (PLC) и опосредованный GPCR.
Он измеряет только IP1, продуцируемый исключительно действием фермента фосфолипазы (PLC) и опосредованный GPCR.
PerkinElmer предлагает инновационный подход с IP-One, однородным, нерадиоактивным накоплением инозитол-фосфата для передачи сигналов Gαq. Было показано, что этот набор обладает превосходными преимуществами по сравнению с традиционными тестами, что делает его идеальным инструментом для ваших исследований.
Сигнальные пути рецептора, связанные с Gq, и связанный с ними поток кальция и поток кальция, не связанный с Gq.
IP-One, лучшая альтернатива анализам потока кальция
Платформа Cisbio включает IP-One, уникальный неизотопный анализ и лучшую альтернативу анализам потока кальция. IP-One специально измеряет уровни IP-1 в клетках. За последнее десятилетие IP-One неоднократно демонстрировал свою эффективность для обнаружения и/или описания новых соединений, нацеленных на GPCR, связанный с Gαq. Узнайте о многих преимуществах IP-One, посмотрев этот короткий видеоролик.
Готовы узнать больше? Вся необходимая информация об IP-One теперь доступна в одной удобной электронной книге. В этом документе подробно рассматриваются уникальные преимущества анализа накопления IP-One по сравнению с технологиями Calcium Flux.
Руководство
Основное руководство по сигнализации Gq
Загрузить сейчас
Руководства
Быстрый путь к успешной оптимизации анализа Gαq
Загрузить сейчас
Никогда не растеряйтесь с нашим знаменитым руководством по IP-One. В течение многих лет ученые Cisbio работали со многими GPCR, связанными с Gαq, чтобы разработать набор рекомендаций, кратко изложенных в руководстве. Вы найдете все рекомендации и поддержку, необходимые для правильного проведения эксперимента с первого раза.
Направляющие
Полное руководство по освоению анализов Gs и Gi GPCR
Путеводители
Полное руководство по основным тестам Gq
Направляющие
Что должен знать каждый ученый GPCR об IP-One
Направляющие
Понимание GPCR — ключ к улучшению DD
.
Путеводители
Указания и рекомендации по анализу GPCR 2-го м…
Видео
IP-One, новое измерение в сигнализации Gq
Направляющие
Молекулярные основы нейровоспаления и нейродегенерации…
Инфографика
Нейродегенерация и основные связанные с ней заболевания
Направляющие
Фармакология GPCR
Указания по применению
Улучшить поиск лекарств при воспалительных заболеваниях кишечника с.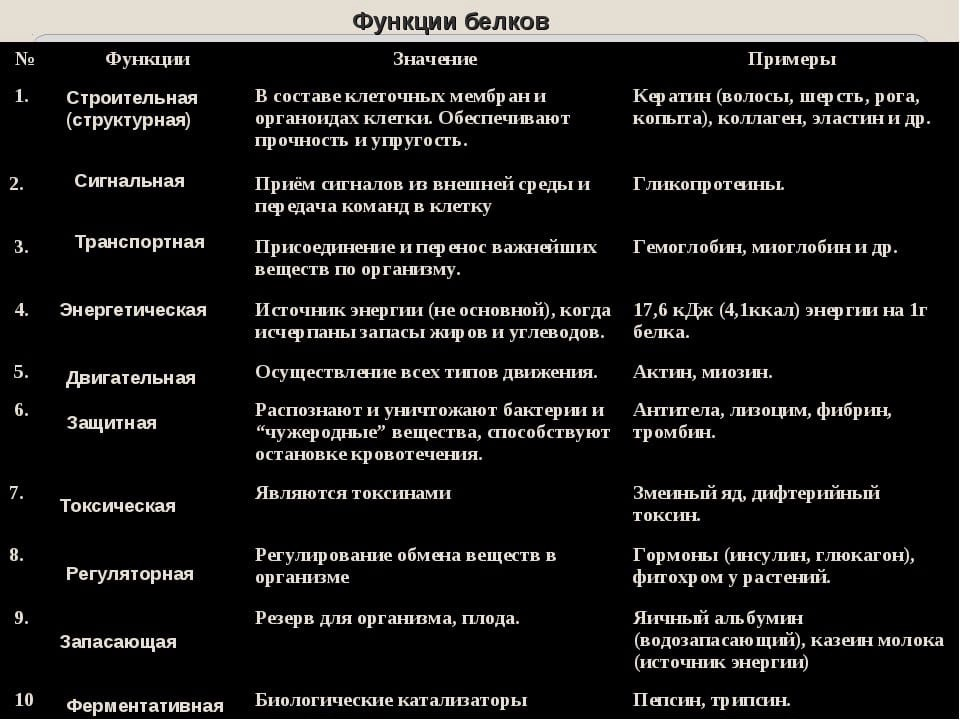 ..
..
Замечания по применению
Изучение вклада GPCR в анти- и профибро…
Указания по применению
Три подхода к поиску лекарств от рассеянного склероза
Направляющие
Анализ связывания GTP: гиды агонистов и антагонистов Gαi
Замечания по применению
Идентификация соединений GPCR и фармакологическая характеристика.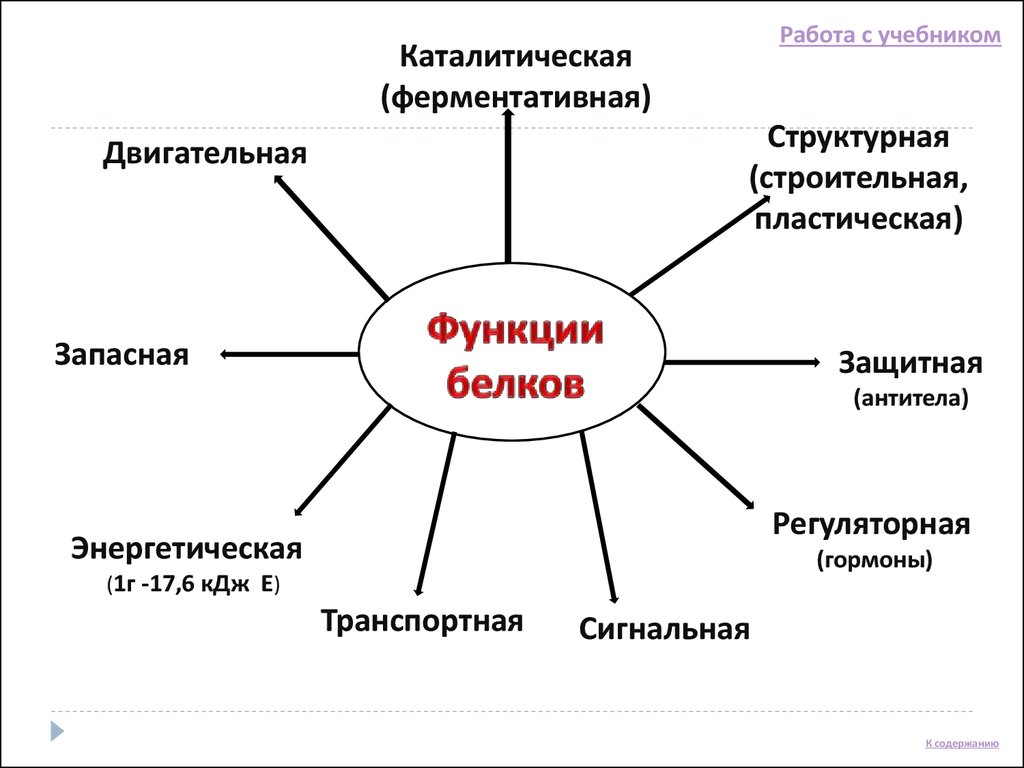

 ..
..