Холестерин в чем содержится: Чем опасен холестерин? | Сургутская городская клиническая поликлиника № 4
Чем опасен холестерин? | Сургутская городская клиническая поликлиника № 4
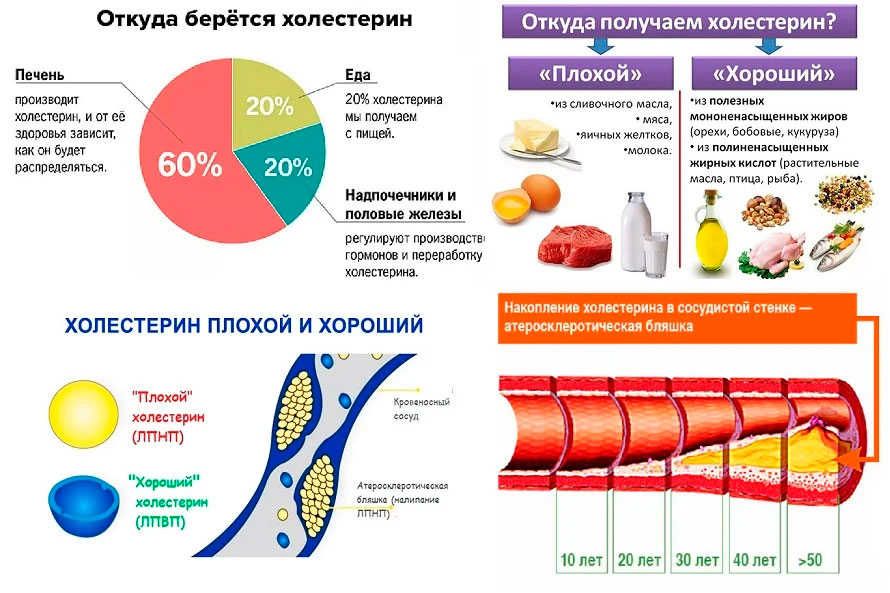
Холестерин представляет собой вещество мягкой, воскообразной консистенции, он является строительным материалом для клеточных оболочек-мембран всех клеток организма, его много в нервной ткани, холестерин необходим дл образования многих гормонов, он важен для метаболизма (обмена веществ) жирорастворимых витаминов, включая витамины A, D, E, K. В печени вырабатывается 80% всего холестерина, а остальное поступает с пищей.
В каких продуктах содержится холестерин?
Холестерин содержится в яйцах, молочных продуктах, мясе и в мясе птицы. Яичные желтки и мясные субпродукты (печень, почки и т.д.) отличаются особо высоким содержанием холестерина. Рыба обычно содержит меньше холестерина, чем другие виды мяса, но некоторые моллюски, такие как креветки, раки, рыбья икра также характеризуются высоким содержанием холестерина.
Чем опасен холестерин?
Для нормальной работы всех организмов и систем холестерин необходим, но его избыток откладывается на внутренней стенке кровеносных сосудов. Вокруг этих отложений разрастается рубцовая ткань, формируются отложения кальция. Так образуется атеросклеротическая бляшка, которая сужает просвет сосуда, снижает кровоток, а присоединение тромба ведёт к его закупорке.
Вокруг этих отложений разрастается рубцовая ткань, формируются отложения кальция. Так образуется атеросклеротическая бляшка, которая сужает просвет сосуда, снижает кровоток, а присоединение тромба ведёт к его закупорке.
Каждый человек старше 20 лет должен знать свой уровень холестерина.
Какой уровень холестерина крови безопасен для здоровья?
Оптимальный уровень общего холестерина (ХС) должен быть менее 5,0 ммоль/л (200мг/дл).
Что необходимо делать для снижения холестерина крови?
- Будьте физически активны.
- Ограничьте потребление продуктов с высоким содержанием холестерина (жирные сорта мяса, мясные субпродукты, яйца, сливочное масло, твёрдые сыры, сливки, мороженое, рыбья икра, креветки, кальмары).
- Употребляете продукты, богатые клетчаткой (овсяные отруби, овсяные хлопья, коричневый рис и бобовые).
- Замените сливочное масло растительным.
- Ешьте больше продуктов, богатых жирными кислотами, (льняное масло, ядра грецкого ореха, сёмга, форель, корюшка, сардина, скумбрия, палтус, сельдь).

- Ешьте фрукты и овощи. Каждый приём пищи начинайте с овощного салата.
- Выбирайте нежирные белковые продукты – соя, рыба, курица без кожи, очень постное мясо и обезжиренные или 1%-2% молочные продукты.
- Ограничьте количество готовых хлебобулочных изделий (например, пончики, печенье и крекеры), которые вы едите.
- Ограничьте количество жареной пищи. Используйте запекание, тушение, приготовление на пару.
- Держитесь подальше от фаст-фудов.
Если через 6-8 недель диеты снижение уровня общего холестерина не наблюдается, то обратитесь к терапевту. Возможно, врач порекомендует лекарства для снижения холестерина и других жиров крови. Однако стоит помнить, что лекарства лишь дополняют и усиливают действие правильно составленной диеты!
Таблица содержания холестерина в продуктах
Поделиться
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Холестерин в крови | Johns Hopkins Medicine
Факты о холестерине
Холестерин — это жироподобное воскообразное вещество, которое помогает вашему организму вырабатывать клеточные мембраны, многие гормоны и витамин D. Холестерин в вашей крови поступает из двух источников: продуктов, которые вы едите и твоя печень. Ваша печень производит весь холестерин, в котором нуждается ваше тело.
Холестерин в вашей крови поступает из двух источников: продуктов, которые вы едите и твоя печень. Ваша печень производит весь холестерин, в котором нуждается ваше тело.
Холестерин и другие жиры переносятся кровью в виде сферических частиц, называемых липопротеинами. Двумя наиболее известными липопротеинами являются липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
| Что такое холестерин ЛПНП (липопротеин низкой плотности)? | Что такое холестерин ЛПВП (липопротеины высокой плотности)? |
|---|---|
ЛПНП («плохой») холестерин может способствовать образованию бляшек в артериях (атеросклерозу). Это связано с повышенным риском сердечного приступа и инсульта. Вы хотите, чтобы уровень ЛПНП был ниже 70 миллиграммов на децилитр (мг/дл). Вот что помогает:
| ЛПВП означает липопротеины высокой плотности. Уровни ЛПВП должны быть около 50 мг/дл. Некоторые люди могут повысить ЛПВП с помощью:
Другим могут понадобиться лекарства, чтобы поднять ЛПВП до полезного уровня, и им следует разработать план лечения вместе с поставщиком медицинских услуг. |
Проверка уровня холестерина в крови
Проверка уровня холестерина — это общий анализ жиров в крови. Скрининг помогает определить риск сердечно-сосудистых заболеваний. Важно иметь так называемый полный липидный профиль, чтобы показать фактические уровни каждого типа жира в крови: ЛПНП, ЛПВП, триглицеридов и других. Поговорите со своим лечащим врачом о том, когда делать этот тест.
Скрининг помогает определить риск сердечно-сосудистых заболеваний. Важно иметь так называемый полный липидный профиль, чтобы показать фактические уровни каждого типа жира в крови: ЛПНП, ЛПВП, триглицеридов и других. Поговорите со своим лечащим врачом о том, когда делать этот тест.
Что такое нормальный уровень холестерина в крови?
Для людей с бляшками в артериях или с другими факторами риска сердечно-сосудистых заболеваний врачи рекомендуют идеальный уровень ЛПНП значительно ниже 70 мг/дл. Людям без факторов риска, у которых уровень ЛПНП составляет 190 мг/дл или выше, рекомендуется снизить этот уровень до уровня ниже 100 мг/дл. Людям в возрасте от 40 до 75 лет, живущим с диабетом и у которых уровень ЛПНП составляет 70 или выше, могут потребоваться лекарства.
Какие существуют методы лечения высокого уровня холестерина?
Лечение может включать:
Устранение факторов риска. Некоторые факторы риска, которые можно изменить, включают малоподвижный образ жизни и неправильное питание.

Средства, снижающие уровень холестерина. Лекарства используются для снижения содержания жиров в крови, особенно холестерина ЛПНП. Статины представляют собой группу лекарств, которые могут это сделать. Двумя наиболее эффективными типами являются аторвастатин и розувастатин. Другими препаратами, снижающими уровень холестерина, являются эзетимиб и PCSK9.ингибиторы.
Статистика холестерина
По данным Американской кардиологической ассоциации (AHA), около 95 миллионов взрослых американцев имеют общий уровень холестерина в крови 200 мг/дл и выше.
Из них около 28,5 миллионов взрослых американцев имеют уровень 240 или выше.
Высокий уровень холестерина в раннем возрасте может играть роль в развитии атеросклероза во взрослом возрасте.
Что такое триглицериды?
Триглицериды — еще один класс жиров, присутствующих в кровотоке. Основная часть жировой ткани вашего тела находится в форме триглицеридов.
Уровни триглицеридов и сердечные заболевания
Связь между триглицеридами и сердечными заболеваниями изучается. Но многие люди с высоким уровнем триглицеридов также имеют другие факторы риска, такие как высокий уровень ЛПНП или низкий уровень ЛПВП.
Что вызывает повышение уровня триглицеридов?
Высокий уровень триглицеридов может быть вызван такими заболеваниями, как диабет, гипотиреоз, заболевания почек или печени. Диетические причины высокого уровня триглицеридов могут включать употребление большого количества алкоголя и употребление в пищу продуктов, содержащих холестерин, насыщенные жиры и трансжиры.
Биохимия, холестерин — StatPearls — Книжная полка NCBI
Мика Крейг; Шива Нага С. Яррарапу; Манджари Димри.
Информация об авторе и организациях
Последнее обновление: 15 августа 2022 г.
Введение
Холестерин является структурным компонентом клеточных мембран и служит строительным блоком для синтеза различных стероидных гормонов, витамина D и желчных кислот. Помимо своей структурной роли, обеспечивающей стабильность и текучесть, холестерин также играет решающую роль в регулировании функции клеток.[1][2][3]
Помимо своей структурной роли, обеспечивающей стабильность и текучесть, холестерин также играет решающую роль в регулировании функции клеток.[1][2][3]
Холестерин представляет собой соединение из 27 атомов углерода с уникальной структурой с углеводородным хвостом, центральным стерольным ядром, состоящим из четырех углеводородных колец, и гидроксильной группой. Центральное стерольное ядро или кольцо характерно для всех стероидных гормонов. Углеводородный хвост и центральное кольцо неполярны и поэтому не смешиваются с водой. Поэтому холестерин (липид) упаковывается вместе с апопротеинами (белком) для того, чтобы проходить через кровообращение в виде липопротеина.
Основы
Люди могут синтезировать холестерин de novo, а также получать его из пищи. Синтез De Novo происходит в печени и кишечнике, на каждый орган приходится ~ 10% общего холестерина в организме. Пищевые триглицериды и холестерин упаковываются вместе с белками Аро в печени, прежде чем высвобождаются в кровоток в виде липопротеинов очень низкой плотности (ЛПОНП). Упаковка холестерина вместе с белком Аро имеет важное значение, поскольку гидрофобная природа холестерина делает невозможным транспортировку через кровь. ЛПОНП содержат триглицериды, холестерин и фосфолипиды. Деградация триглицеридов в ЛПОНП приводит к образованию более мелких липопротеинов низкой плотности (ЛПНП), богатых холестерином.[4] Богатые холестерином липопротеины низкой плотности (ЛПНП) перемещаются по кровотоку. Они доставляются в периферические ткани, где ЛПНП распознаются рецепторами ЛПНП на клеточных мембранах и подвергаются эндоцитозу посредством эндоцитоза, опосредованного рецепторами.[5] Помимо ЛПНП, липопротеины высокой плотности (ЛПВП) переносят холестерин из периферических тканей в печень по механизму обратного транспорта, чтобы избавиться от любого избытка холестерина.[6]
Упаковка холестерина вместе с белком Аро имеет важное значение, поскольку гидрофобная природа холестерина делает невозможным транспортировку через кровь. ЛПОНП содержат триглицериды, холестерин и фосфолипиды. Деградация триглицеридов в ЛПОНП приводит к образованию более мелких липопротеинов низкой плотности (ЛПНП), богатых холестерином.[4] Богатые холестерином липопротеины низкой плотности (ЛПНП) перемещаются по кровотоку. Они доставляются в периферические ткани, где ЛПНП распознаются рецепторами ЛПНП на клеточных мембранах и подвергаются эндоцитозу посредством эндоцитоза, опосредованного рецепторами.[5] Помимо ЛПНП, липопротеины высокой плотности (ЛПВП) переносят холестерин из периферических тканей в печень по механизму обратного транспорта, чтобы избавиться от любого избытка холестерина.[6]
Сотовый уровень
Хотя все клетки могут синтезировать холестерин в небольшой степени, печень является основным местом синтеза холестерина. Синтез холестерина происходит в цитоплазме печени и требует ферментов в цитоплазме и гладком эндоплазматическом ретикулуме (ГЭР). Первый этап биосинтеза холестерина включает конденсацию 2 молекул ацетил-КоА с образованием ацетоацетил-КоА. Затем цитозольный фермент ГМГ-КоА-синтаза добавляет третью молекулу ацетил-КоА к ацетоацетил-КоА, образуя шестиуглеродное соединение, называемое 3-гидрокси-3-метилглутарилкоэнзимом А (ГМГ-КоА). Изофермент HMG-CoA-синтазы в митохондриях катализирует реакцию ограничения скорости кетогенеза. ГМГ-КоА-редуктаза, регуляторный фермент гладкого ЭР, катализирует следующий этап, который восстанавливает ГМГ-КоА до мевалоната. Синтез мевалоната является ключевым ограничивающим скорость этапом в синтезе холестерина. Ряд реакций превращает мевалонат в 3-изопентенилпирофосфат, фарнезилпирофосфат, сквален и ланостерол. Затем ланостерол проходит еще один этап19.-этапный процесс, связанный с ER, для окончательного синтеза холестерина. Конечная стадия катализируется 7-дегидрохолестеролредуктазой, которая превращает 7-дегидрохолестерол в холестерин.[7]
Первый этап биосинтеза холестерина включает конденсацию 2 молекул ацетил-КоА с образованием ацетоацетил-КоА. Затем цитозольный фермент ГМГ-КоА-синтаза добавляет третью молекулу ацетил-КоА к ацетоацетил-КоА, образуя шестиуглеродное соединение, называемое 3-гидрокси-3-метилглутарилкоэнзимом А (ГМГ-КоА). Изофермент HMG-CoA-синтазы в митохондриях катализирует реакцию ограничения скорости кетогенеза. ГМГ-КоА-редуктаза, регуляторный фермент гладкого ЭР, катализирует следующий этап, который восстанавливает ГМГ-КоА до мевалоната. Синтез мевалоната является ключевым ограничивающим скорость этапом в синтезе холестерина. Ряд реакций превращает мевалонат в 3-изопентенилпирофосфат, фарнезилпирофосфат, сквален и ланостерол. Затем ланостерол проходит еще один этап19.-этапный процесс, связанный с ER, для окончательного синтеза холестерина. Конечная стадия катализируется 7-дегидрохолестеролредуктазой, которая превращает 7-дегидрохолестерол в холестерин.[7]
Молекулярный уровень
Синтез холестерина регулируется модулированием ГМГ-КоА-редуктазы с помощью различных механизмов.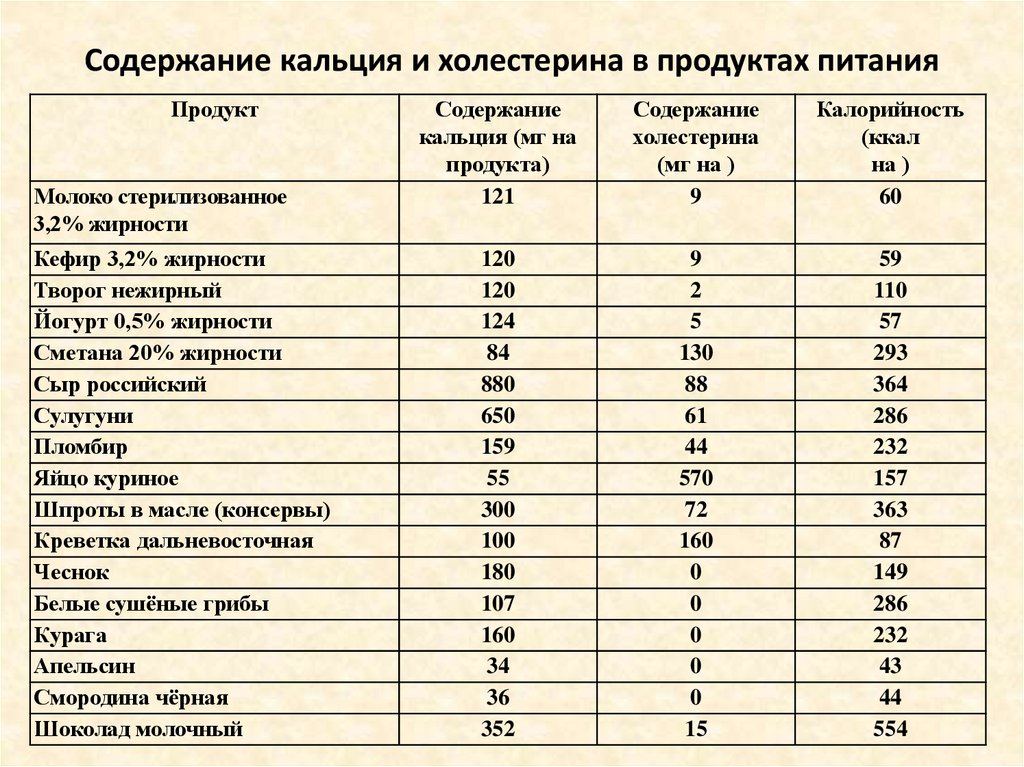 К ним относятся ковалентная модификация ферментов, ингибирование аллостерической обратной связи, влияющее на скорость реакции, гормональный контроль и транскрипционный контроль экспрессии генов.
К ним относятся ковалентная модификация ферментов, ингибирование аллостерической обратной связи, влияющее на скорость реакции, гормональный контроль и транскрипционный контроль экспрессии генов.
ГМГ-КоА-редуктаза регулируется ковалентно за счет действия аденозинмонофосфата (АМФ)-активируемой протеинкиназы (АМФК) и фосфопротеинфосфатазы, которые переключают фермент между дефосфорилированным (активным) и фосфорилированным (неактивным) состоянием. Когда доступно много холестерина, высокие уровни вызывают ингибирование обратной связи, чтобы снизить активность ГМГ-КоА-редуктазы. В состоянии сытости, при наличии достаточного количества субстрата, инсулин и тироксин вызывают активацию фермента. Контррегуляторным гормоном для кортизола, глюкокортикоидов и инсулина является глюкагон, обладающий ингибирующим действием.
Транскрипционный контроль экспрессии генов — еще один важный механизм, регулирующий ГМГ-КоА-редуктазу. Это включает в себя специальные факторы транскрипции, известные как белки, регулирующие связывание стеролов, которые присутствуют в мембранах ER. В клетках с пониженным содержанием холестерина SREBP транспортируются в комплекс Гольджи, где они подвергаются процессингу с высвобождением активного фрагмента, который проникает в ядро, чтобы связать SRE (стериновый регуляторный элемент) и активировать транскрипцию генов, кодирующих ГМГ-КоА-редуктазу и другие ферменты, участвующие в биосинтезе холестерина. Когда уровни холестерина в клетках высоки, транспорт SREBP к комплексу Гольджи блокируется, поскольку фермент связывается с другим набором белков, которые остаются в ER, называемыми «insigs» (инсулиновые сигнальные белки). Это предотвращает протеолитическое высвобождение активного фрагмента SREBP из мембран ER. Поскольку фрагмент недоступен для связывания SRE в ядре, транскрипция генов-мишеней больше не происходит, и ГМГ-КоА-редуктаза не активируется. [8]
В клетках с пониженным содержанием холестерина SREBP транспортируются в комплекс Гольджи, где они подвергаются процессингу с высвобождением активного фрагмента, который проникает в ядро, чтобы связать SRE (стериновый регуляторный элемент) и активировать транскрипцию генов, кодирующих ГМГ-КоА-редуктазу и другие ферменты, участвующие в биосинтезе холестерина. Когда уровни холестерина в клетках высоки, транспорт SREBP к комплексу Гольджи блокируется, поскольку фермент связывается с другим набором белков, которые остаются в ER, называемыми «insigs» (инсулиновые сигнальные белки). Это предотвращает протеолитическое высвобождение активного фрагмента SREBP из мембран ER. Поскольку фрагмент недоступен для связывания SRE в ядре, транскрипция генов-мишеней больше не происходит, и ГМГ-КоА-редуктаза не активируется. [8]
Функция
Холестерин выполняет несколько биологических функций и необходим для успешного клеточного гомеостаза. Он действует как предшественник желчных кислот, способствует синтезу стероидов и витамина D и играет центральную роль в поддержании жесткости и текучести клеточных мембран. [9]
[9]
Все классы стероидных гормонов, глюкокортикоидов, минералокортикоидов и половых гормонов являются производными холестерина. Синтез происходит в плаценте и яичниках (эстрогены и прогестины), яичках (тестостерон) и коре надпочечников (кортизол, альдостерон и андрогены). Начальная реакция ограничения скорости превращает холестерин в прегненолон, который затем окисляется и изомеризуется в прогестерон. Далее он модифицируется в ЭР и митохондриях в результате различных реакций гидроксилирования на другие стероидные гормоны (кортизол, андрогены и альдостерон). Альдостерон действует преимущественно на почечные канальцы, стимулируя выведение калия и поглощение натрия и воды. Его конечным эффектом является повышение артериального давления. Кортизол позволяет организму справляться со стрессом и реагировать на него за счет его влияния на промежуточный метаболизм, другими словами, усиление глюконеогенеза, воспалительных и иммунных реакций. Андрогены, особенно тестостерон, эстрогены и прогестины, отвечают за половую дифференцировку, либидо, сперматогенез и продукцию фолликулов яичниками.
Витамин D3 (холекальциферол) из кожи или пищи подвергается гидроксилированию с помощью 25-альфа-гидроксилазы с образованием 25-гидроксихолекальциферола (кальцидиола) в печени из жирорастворимых соединений с 4-кольцевой холестериновой цепью. Затем он дополнительно гидроксилируется 1-альфа-гидроксилазой до активной формы 1,25-дигидроксихолекальциферола (кальцитриола) в почках. Витамин D играет неотъемлемую роль в терминальной дифференцировке гипертрофированных хондроцитов, последующей кальцификации костного матрикса. Кроме того, он играет важную роль в гомеостазе кальция, помогает мобилизовать кальций из костей и стимулировать всасывание в кишечнике и реабсорбцию в почках.[10]
Желчь представляет собой водянистую смесь как неорганических, так и органических соединений, из которых фосфатидилхолин и конъюгированные желчные соли/кислоты являются наиболее важными в количественном отношении. Каждый день печенью секретируется от 15 до 30 граммов желчных солей/кислот, но в результате реабсорбции желчи с калом ежедневно теряется только около 0,5 грамма. В результате, чтобы возместить потерянное количество, примерно 0,5 грамма в день синтезируется из холестерина в печени. Холестерин включен в качестве основы в синтез желчных кислот, сложный многоступенчатый процесс с участием многих органелл. Этот синтез достигает 2 целей. Во-первых, он позволяет организму выводить холестерин из организма, поскольку физиологически невозможно расщепить его, и позволяет переваривать липиды посредством эмульгирования и последующего расщепления ферментами поджелудочной железы.
В результате, чтобы возместить потерянное количество, примерно 0,5 грамма в день синтезируется из холестерина в печени. Холестерин включен в качестве основы в синтез желчных кислот, сложный многоступенчатый процесс с участием многих органелл. Этот синтез достигает 2 целей. Во-первых, он позволяет организму выводить холестерин из организма, поскольку физиологически невозможно расщепить его, и позволяет переваривать липиды посредством эмульгирования и последующего расщепления ферментами поджелудочной железы.
Клиническое значение
Хотя холестерин жизненно важен для функционирования наших клеток, его повышенный уровень может вызвать серьезные проблемы. Кроме того, он связан со многими генетическими заболеваниями, такими как желчнокаменная болезнь, а также является мишенью для многих терапевтических фармакологических препаратов.
Желчнокаменная болезнь
Образование камней в желчном пузыре происходит при дефиците желчных солей или избытке холестерина, секретируемого в желчь. Другими словами, когда печень секретирует холестерин, должен быть надлежащий баланс желчных солей, холестерина и фосфолипидов, поскольку дисбаланс вызывает осаждение холестерина. При патологических состояниях гиперхолестеринемии часто образуются камни в желчном пузыре, приводящие к холециститу или даже восходящему холангиту. Понимание этой неустойчивой взаимосвязи привело к изобретению двух важных типов антигиперлипидемических препаратов: смол, связывающих желчные кислоты (холестирамин/колестипол/колесевелам) и ингибиторов абсорбции холестерина (эзетимиб). Первый действует, блокируя реабсорбцию желчных кислот в тонком кишечнике, что затем заставляет печень синтезировать больше желчных кислот, чтобы использовать в процессе избыток холестерина, тем самым снижая уровень холестерина в сыворотке. Эзетимиб действует аналогичным образом, блокируя всасывание холестерина в тощекишечных энтероцитах, позволяя организму принимать избыток холестерина и снова выделять его в желчь. Интересно отметить, что фибраты, другой класс антигиперлипидемических препаратов, могут вызывать желчнокаменную болезнь.
Другими словами, когда печень секретирует холестерин, должен быть надлежащий баланс желчных солей, холестерина и фосфолипидов, поскольку дисбаланс вызывает осаждение холестерина. При патологических состояниях гиперхолестеринемии часто образуются камни в желчном пузыре, приводящие к холециститу или даже восходящему холангиту. Понимание этой неустойчивой взаимосвязи привело к изобретению двух важных типов антигиперлипидемических препаратов: смол, связывающих желчные кислоты (холестирамин/колестипол/колесевелам) и ингибиторов абсорбции холестерина (эзетимиб). Первый действует, блокируя реабсорбцию желчных кислот в тонком кишечнике, что затем заставляет печень синтезировать больше желчных кислот, чтобы использовать в процессе избыток холестерина, тем самым снижая уровень холестерина в сыворотке. Эзетимиб действует аналогичным образом, блокируя всасывание холестерина в тощекишечных энтероцитах, позволяя организму принимать избыток холестерина и снова выделять его в желчь. Интересно отметить, что фибраты, другой класс антигиперлипидемических препаратов, могут вызывать желчнокаменную болезнь. Это происходит просто за счет экскреции холестерина в желчь, и, как упоминалось ранее, если в желчи имеется избыток холестерина, он выпадает в осадок и образует камни.[11]
Это происходит просто за счет экскреции холестерина в желчь, и, как упоминалось ранее, если в желчи имеется избыток холестерина, он выпадает в осадок и образует камни.[11]
Статины
Это важный класс одобренных FDA препаратов, используемых для лечения гиперлипидемии и гиперхолестеринемии. Статины являются обратимыми конкурентными ингибиторами ГМГ-КоА-редуктазы, фермента, ограничивающего скорость синтеза холестерина. Они являются структурными аналогами HMG-CoA, субстрата для редуктазы HMG-CoA. Их действие опосредовано транскрипционным контролем экспрессии генов с помощью SREBP и повышением уровня рецепторов ЛПНП на клетках для облегчения удаления избытка ЛПНП. Когда уровень холестерина в сыворотке слишком высок, можно использовать статины, чтобы остановить синтез de novo в печени.[12]
Атеросклероз
Это результат повышенного уровня циркулирующих липопротеинов ЛПНП. ЛПНП обычно называют «плохими» липопротеинами, поскольку они несут очень высокую концентрацию холестерина. Когда уровни ЛПНП патологически высоки, ЛПНП откладываются в артериальной стенке и окисляются. Макрофаги поглощают эти окисленные частицы ЛПНП, что приводит к их трансформации, которая выглядит как пена, отсюда и название «пенистые» клетки. Сбор оксЛПНП макрофагами запускает активацию цитокинов, факторов роста, лейкоцитов и неоваскуляризацию, а также пролиферацию гладкомышечных клеток. Это приводит к образованию жировых полос и, в конечном итоге, вызывает образование атеросклеротических бляшек и, как следствие, ишемическую болезнь сердца.[13]
Когда уровни ЛПНП патологически высоки, ЛПНП откладываются в артериальной стенке и окисляются. Макрофаги поглощают эти окисленные частицы ЛПНП, что приводит к их трансформации, которая выглядит как пена, отсюда и название «пенистые» клетки. Сбор оксЛПНП макрофагами запускает активацию цитокинов, факторов роста, лейкоцитов и неоваскуляризацию, а также пролиферацию гладкомышечных клеток. Это приводит к образованию жировых полос и, в конечном итоге, вызывает образование атеросклеротических бляшек и, как следствие, ишемическую болезнь сердца.[13]
Семейная гиперхолестеринемия
Это наследственное заболевание обусловлено мутациями в определенных генах, таких как ApoB, LDLR, LDLARP1 или PCSK9, и вызывает семейную гиперхолестеринемию. Наиболее распространенным дефектом является мутация рецептора ЛПНП, при которой ЛПНП больше не может выводить ЛПНП из кровотока. Это приводит к высокому уровню холестерина в крови, который может откладываться в кровеносных сосудах, накапливаться и вызывать уплотнение артерий. Если не лечить, избыточное накопление может вызвать ишемическую болезнь сердца.
Если не лечить, избыточное накопление может вызвать ишемическую болезнь сердца.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Рахмати-Ахмадабад С., Брум Д.Р., Ганбари-Ниаки А., Ширвани Х. Влияние упражнений на обратный транспорт холестерина: систематизированный описательный обзор исследований на животных. Жизнь наук. 2019 01 мая; 224:139-148. [PubMed: 30922848]
- 2.
Plat J, Baumgartner S, Vanmierlo T, Lütjohann D, Calkins KL, Burrin DG, Guthrie G, Thijs C, Te Velde AA, Vreugdenhil ACE, Sverdlov R, Гарссен Дж, Воутерс К., Траутвайн Э.А., Вольфс Т.Г., ван Горп С., Малдер М.Т., Риксен Н.П., Гроен А.К., Менсинк Р.П. Растительные стеролы и станолы в области здоровья и болезней: «Последствия развития человека в растительной среде?». Прог Липид Рез. 2019Апр;74:87-102. [PubMed: 30822462]
- 3.

Дин X, Чжан В, Ли С, Ян Х. Роль метаболизма холестерина при раке. Am J Рак Res. 2019;9(2):219-227. [Бесплатная статья PMC: PMC6405981] [PubMed: 30906624]
- 4.
Kawano Y, Cohen DE. Механизмы накопления триглицеридов в печени при неалкогольной жировой болезни печени. J Гастроэнтерол. 2013 Апрель; 48 (4): 434-41. [Бесплатная статья PMC: PMC3633701] [PubMed: 23397118]
- 5.
Гольдштейн Дж.Л., Андерсон Р.Г., Браун М.С. Рецептор-опосредованный эндоцитоз и клеточное поглощение липопротеинов низкой плотности. Сиба нашел симптом. 1982;(92):77-95. [PubMed: 6129958]
- 6.
Ouimet M, Barrett TJ, Fisher EA. ЛПВП и обратный транспорт холестерина. Цирк рез. 2019 10 мая; 124(10):1505-1518. [Статья PMC бесплатно: PMC6813799] [PubMed: 31071007]
- 7.
Groen AK, Bloks VW, Verkade H, Kuipers F. Взаимодействие между печенью и кишечником в контроле холестерина и энергетического гомеостаза.
 Мол Аспекты Мед. 2014 июнь;37:77-88. [В паблике: 24560594]
Мол Аспекты Мед. 2014 июнь;37:77-88. [В паблике: 24560594]- 8.
Иштван Э.С., Дейзенхофер Дж. Структурный механизм ингибирования статинами редуктазы ГМГ-КоА. Наука. 2001 г., 11 мая; 292 (5519): 1160-4. [PubMed: 11349148]
- 9.
Луо Дж., Ян Х., Сонг Б.Л. Механизмы и регуляция гомеостаза холестерина. Nat Rev Mol Cell Biol. 2020 апр;21(4):225-245. [PubMed: 31848472]
- 10.
Хассан А.Б., Хозайен Р.Ф., Алотаиби Р.А., Тайем Ю.И. Терапевтические и поддерживающие режимы приема витамина D3 у здоровых взрослых: систематический обзор. Cell Mol Biol (Нуази-ле-гранд). 2018 30 ноября; 64(14):8-14. [В паблике: 30511630]
- 11.
Ламмерт Ф., Гурусами К., Ко К.В., Микель Дж.Ф., Мендес-Санчес Н., Портинкаса П., ван Эрпекум К.Дж., ван Лаарховен К.Дж., Ван Д.К. Желчные камни. Праймеры Nat Rev Dis. 2016 28 апреля; 2:16024. [PubMed: 27121416]
- 12.
Валанти Э.К., Далакура-Карагкуни К.



 7 мг
7 мг



 Мол Аспекты Мед. 2014 июнь;37:77-88. [В паблике: 24560594]
Мол Аспекты Мед. 2014 июнь;37:77-88. [В паблике: 24560594]