Гормон роста научно: Гормон роста человека (соматотропин) | Научно-технологический центр «Биоинвест»
Возможности медикаментозной коррекции недостатка гормона роста у взрослых | #09/01
Каковы основные причины соматотропной недостаточности у взрослых?
Каковы ее клинические проявления?
Какие методы лабораторно подтверждают диагноз?
Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с целью заместительной гормональной терапии у взрослых. У детей история медикаментозной коррекции низкорослости насчитывает около тридцати лет, ко взрослым же лечение с использованием биосинтетических препаратов ГР впервые было применено около десяти лет назад. В течение многих лет с целью терапии использовался ГР, получаемый из гипофизарных экстрактов, однако в 1985 году, когда были описаны четыре случая болезни Крейтцфельдта — Якоба у реципиентов гипофизарного ГР, использование последнего было запрещено. Это послужило отправной точкой для начала работ по производству биосинтетического ГР [2].
Использование ГР у детей и произошедший параллельно научный прорыв в отношении диагностирования дефицита гормона роста у взрослых привели к появлению в клинической эндокринологии новой нозологии и, соответственно, новых методов обследования и лечения. Ни один конгресс или симпозиум, проходящий в настоящее время, не обходится без докладов, посвященных проблемам диагностики дефицита ГР (ДГР) у взрослых, выявлению нарушений, сопровождающих заболевание, и принципам подбора терапии.
Ни один конгресс или симпозиум, проходящий в настоящее время, не обходится без докладов, посвященных проблемам диагностики дефицита ГР (ДГР) у взрослых, выявлению нарушений, сопровождающих заболевание, и принципам подбора терапии.
Для того чтобы создать более точное представление о спектре нарушений, развивающихся на фоне соматотропной недостаточности, необходимо кратко напомнить о структуре ГР, механизмах его секреции и влиянии на органы и системы. ГР, синтезируемый соматотрофами передней доли гипофиза, относится к особому семейству пептидных гормонов, в состав которого кроме ГР входят пролактин (ПРЛ) и плацентарный соматомаммотропин человека (СМЧ). Секреция ГР находится под контролем двух гипоталамических гормонов: соматостатина или соматотропин-ингибирующего фактора (СИФ), который оказывает блокирующее действие на синтез и секрецию соматотрофами ГР. Соматотропин — рилизинг гормон (СРГ) — оказывает стимулирующее действие на соматотрофы, что проявляется увеличением продукции ГР.
Как многие гормоны, ГР синтезируется в определенном импульсном режиме, пики секреции приходятся на 22.00 и 4.00 часа.
Несмотря на существование специфических рецепторов ГР, его действие осуществляется посредством специфических факторов, аналогичных по своей структуре инсулину: инсулиноподобного ростового фактора I (ИФР-I) и инсулиноподобного ростового фактора II (ИФР-II). ИФР-I, действуя через собственные рецепторы, оказывает ростовые эффекты преимущественно в постэмбриональном онтогенезе организма. Действие ИФР-II проявляется преимущественно в процессе эмбриогенеза.
Многочисленные исследования, результаты которых публикуются в современных медицинских изданиях, красноречиво свидетельствуют о наличии серьезных нарушений в соматическом и психологическом статусе пациентов с декомпенсированной недостаточностью гормона роста. Эти нарушения характеризуются изменением соотношения жировая/мышечная ткань в сторону снижения удельного веса последней, увеличения удельного веса жировой ткани и сопровождаются висцеральным отложением последней.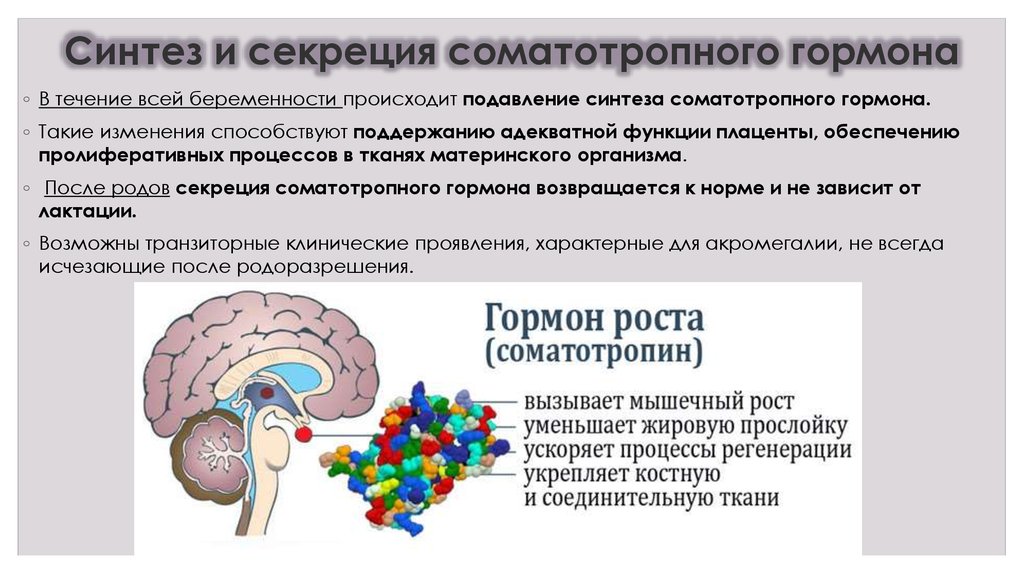 При проведении денситометрии обнаруживается снижение плотности костной ткани (МПК). Scacchi at al отметили обратно пропорциональную зависимость между индексом массы тела (ИМТ) и периодом полужизни ГР, а также амплитудой секреции ГР. Процент содержания жировой ткани находился в обратной зависимости от интегрального показателя концентрации ГР, определяемого в течение 24 часов.
При проведении денситометрии обнаруживается снижение плотности костной ткани (МПК). Scacchi at al отметили обратно пропорциональную зависимость между индексом массы тела (ИМТ) и периодом полужизни ГР, а также амплитудой секреции ГР. Процент содержания жировой ткани находился в обратной зависимости от интегрального показателя концентрации ГР, определяемого в течение 24 часов.
Со стороны метаболических нарушений необходимо выделить снижение толерантности к углеводам при проведении инсулинтолерантного теста, увеличение продукции инсулина, проинсулина, повышение содержания триглицеридов плазмы крови, липопротеидов низкой и очень низкой плотности [3].
Не до конца изучено влияние недостаточности ГР на увеличение риска развития сердечно-сосудистых заболеваний, однако при ретроспективном исследовании 333 пациентов с гипопитуитаризмом выявлено, что в течение 22 лет случаи кардиоваскулярной смерти встречались в два раза чаще по сравнению с группой контроля. При проведении эхокардиографии исследователи обнаруживали снижение массы левого желудочка, уменьшение толщины перегородки и задней стенки желудочков, а также снижение фракции выброса левого желудочка.
Еще сравнительно недавно проблема дефицита ГР у взрослых не находила отражения в исследованиях эндокринологов, хотя вопросы, связанные с недостаточностью секреторной функции гипофиза, возникали с того времени, когда были впервые описаны пациентки с синдромом Шиена (Шихана). Данная патология обусловлена развитием инфарктов и кровоизлияний в раннем послеродовом периоде и характеризуется развитием пангипопитуитаризма. Долгие годы пациентки получали заместительную гормональную терапию глюкокортикоидами, тиреоидными гормонами, половыми стероидами, однако при этом продолжали предъявлять неспецифические жалобы на повышенную утомляемость, слабость, немотивированное увеличение массы тела. При попытке исследовать уровень гормонов сыворотки крови с целью выяснения степени компенсации имеющихся нарушений патологических отклонений обнаружено не было, а сниженному уровню ГР не придавали значения. В дальнейшем многочисленные клинические и лабораторные исследования продемонстрировали, что снижение секреции ГР в организме взрослого человека приводит к целому ряду нарушений, которые остаются незамеченными и не имеют такой яркой клинической окраски, как, например, гиперсекреция ГР и развивающаяся вследствие этого акромегалия.
Перечислим причины развития соматотропной недостаточности у взрослых
- оперативные вмешательства по поводу аденом гипофиза: пролактином, соматотропином, тиреотропином, кортикотропином, нефункционирующих аденом гипофиза;
- лучевая терапия на область турецкого седла;
- удаление краниофарингиом и эндоселлярных кист;
- травматическое поражение срединных структур головного мозга;
- синдром Шиена.
Количество пациентов, подвергшихся тем или иным вмешательствам на селлярной области, растет год от года, и связано это с повышением разрешающей способности диагностических методов, используемых при обследовании больных, и расширением лечебных возможностей современной медицины. Исходя из этого можно прогнозировать, что количество пациентов, нуждающихся в проведении скринингового обследования ДГР, будет увеличиваться год от года. Современная фармакология, в свою очередь, располагает целым спектром препаратов, призванных компенсировать соматотропную недостаточность; ниже приводится перечень средств, имеющихся на сегодняшний день в отечественной аптечной сети.
- Гентропин — Pharmacia, США.
- Хуматорп — Eli Lilly, США.
- Сайзен — Ares-Serono, Швеция.
- Нордитропин — Novo Nordisk, Дания.
«Золотым стандартом» в диагностике ДГР у взрослых справедливо считается инсулинотолерантный тест. Необходимо оговориться, что его проведение возможно только после компенсации вторичного гипотиреоза и вторичного гипокортицизма, в противном случае результаты теста могут быть недостоверными.
В рамках исследования, проведенного в клинике эндокринологии ММА им. И. М. Сеченова и посвященного изучению целесообразности назначения препарата генноинженерного гормона роста взрослым, была обследована группа больных с подозрением на наличие соматотропной недостаточности.
В группу вошли 15 человек в возрасте от 15 до 45 лет: 12 женщин (80%) и трое мужчин (20%). Девять женщин (60%) были прооперированы по поводу макропролактином гипофиза, трое мужчин (20%) и трое женщин (20%) подверглись оперативному вмешательству по поводу краниофарингиомы гипофиза, у одного мужчины (6,7%) при проведении МРТ выявлена агенезия гипофиза. Среди всех обследованных пациентов задержка роста зафиксирована у троих мужчин (20%) в возрасте 16, 21 и 27 лет, оценка роста у них проводилась с использованием таблицы «Перцентильный график роста для мальчиков». У первого пациента рост был равен 148 см, при оценке перцентильных значений величина стандартного отклонения (SDS) составила –3,5. Рост второго и третьего пациентов был равен 145 и 152 см соответственно, но в связи с невозможностью оценить величину SDS исходя из паспортного возраста последняя была рассчитана исходя из костного. В первом случае паспортный возраст ровнялся 13-14 годам и SDS –2, во втором случае костный возраст соответствовал 16 годам и SDS –3. Структура эндокринных заболеваний, выявленных у пациентов с подозрением на соматотропную недостаточность, отражена в табл. 2.
Среди всех обследованных пациентов задержка роста зафиксирована у троих мужчин (20%) в возрасте 16, 21 и 27 лет, оценка роста у них проводилась с использованием таблицы «Перцентильный график роста для мальчиков». У первого пациента рост был равен 148 см, при оценке перцентильных значений величина стандартного отклонения (SDS) составила –3,5. Рост второго и третьего пациентов был равен 145 и 152 см соответственно, но в связи с невозможностью оценить величину SDS исходя из паспортного возраста последняя была рассчитана исходя из костного. В первом случае паспортный возраст ровнялся 13-14 годам и SDS –2, во втором случае костный возраст соответствовал 16 годам и SDS –3. Структура эндокринных заболеваний, выявленных у пациентов с подозрением на соматотропную недостаточность, отражена в табл. 2.
| Регуляция секреции гормона роста |
Перед проведением провокационных тестов, направленных на диагностику соматотропной недостаточности, всем пациентам был проведен комплекс лабораторно-диагностических мероприятий для уточнения соматического и гормонального статуса пациентов.
Большинство пациентов получали заместительную гормональную терапию по поводу вторичного гипотиреоза, вторичной надпочечниковой недостаточности, несахарного диабета; у всех было проведено скрининговое исследование концентрации свободного Т4, пролактина, ЛГ, ФСГ, эстрадиола с целью коррекции доз получаемых препаратов.
Исследование соматического статуса предусматривало определение следующих показателей: расчет индекса массы тела (ИМТ), вычисление отношения объем талии/объем бедер (ОТ/ОБ), определение уровня глюкозы, холестерина, триглицеридов, ЛПНП, ЛНВП, АЛТ, АСТ. Проводилось ЭКГ и измерение артериального давления с целью исключения патологии со стороны сердечно-сосудистой системы.
Для оценки качества жизни пациентов с рассматриваемой патологией использовался опросник, разработанный специально для пациентов с дефицитом ГР — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов, на которые необходимо было ответить «да» или «нет». Каждый положительный ответ оценивался в один балл; чем больше оказывалась полученная в результате сумма, тем ниже показатель качества жизни.
Каждый положительный ответ оценивался в один балл; чем больше оказывалась полученная в результате сумма, тем ниже показатель качества жизни.
В ходе обследования были получены следующие результаты.
Нормальные показатели ИМТ (18<ИМТ<25) были выявлены у семи пациентов (46,6%), избыток массы тела (25<ИМТ<30) — у троих (20%), ожирение (ИМТ>30) диагностировано у четырех человек (26,7%). У одного пациента наряду с задержкой роста был выявлен дефицит массы тела, ИМТ составил 15,9 (6,7%). У одной пациентки (6,7%) обнаружен сахарный диабет II типа. Признаки висцерального ожирения выявлены у четырех пациенток (26,7%).
При обследовании у шести пациенток обнаружено повышение гликемии натощак, которое составило 7,025 ± 0,12 ммоль/л; показатели гликемии у 11 пациентов были в пределах нормы и варьировали от 3,6 до 5,5 ммоль/л. Для исключения возможных нарушений углеводного обмена: тощаковой гипергликемии, нарушения толерантности к углеводам, сахарного диабета, гиперинсулинемии всем пациентам был проведен оральный глюкозотолерантный тест с 75 г глюкозы. При определении гликемии через 2 часа после приема 75 г глюкозы последняя составила 6,6 ± 0,14 ммоль/л. Сахарный диабет был выявлен у одной пациентки (гликемия 11,9 ммоль/л), еще у двоих пациентов определено нарушение толерантности к углеводам (гликемия 8,3 и 9,0 ммоль/л). При исследовании уровня С-пептида сыворотки крови были получены следующие результаты: базальная гиперинсулинемия (>2,5 нг/мл) обнаружена у пяти пациентов (3,33%) и составила 3,89 ± 0,1 нг/мл. Более чем двукратное увеличение концентрации С-пептида через 120 минут после стимуляции отмечено у девяти пациентов (60%) и составило 10,5 ± 0,4 нг/мл. При оценке липидного обмена гиперхолестеринемия выявлена у десяти пациентов (66,6%), гипертриглицеридемия обнаружена у семи пациентов (46,6%).
При определении гликемии через 2 часа после приема 75 г глюкозы последняя составила 6,6 ± 0,14 ммоль/л. Сахарный диабет был выявлен у одной пациентки (гликемия 11,9 ммоль/л), еще у двоих пациентов определено нарушение толерантности к углеводам (гликемия 8,3 и 9,0 ммоль/л). При исследовании уровня С-пептида сыворотки крови были получены следующие результаты: базальная гиперинсулинемия (>2,5 нг/мл) обнаружена у пяти пациентов (3,33%) и составила 3,89 ± 0,1 нг/мл. Более чем двукратное увеличение концентрации С-пептида через 120 минут после стимуляции отмечено у девяти пациентов (60%) и составило 10,5 ± 0,4 нг/мл. При оценке липидного обмена гиперхолестеринемия выявлена у десяти пациентов (66,6%), гипертриглицеридемия обнаружена у семи пациентов (46,6%).
Всем пациентам был проведен инсулинотолерантный тест с целью подтверждения дефицита гормона роста. В условиях стационара пациентам внутривенно вводился инсулин короткого действия: Humulin R или Actrapid HM, из расчета 0,1 ЕД/кг [1]. Исходно через каждые 15 минут в дальнейшем пациентам проводилось определение гликемии в капиллярной крови и забор крови для последующего выявления уровня гормона роста в сыворотке крови.
Исходно через каждые 15 минут в дальнейшем пациентам проводилось определение гликемии в капиллярной крови и забор крови для последующего выявления уровня гормона роста в сыворотке крови.
В ответ на инсулин-индуцированную гипогликемию у 12 обследованных (80%) концентрация ГР не превысила 5 нг/мл, а составила в среднем 0,76 ± 0,013 нг/мл. У троих на фоне гипогликемии было зарегистрировано повышение уровня ГР до 30,78 ± 0,45 нг/мл.
По результатам проведенного теста девяти пациентам была назначена терапия генотропином (Pharmacia&Upjohn). Двое пациентов с задержкой роста получают препарат в настоящее время, у семи человек завершился шестимесячный курс терапии. При расчете дозы препарата использовались рекомендации Janssen и соавт., дозировка генотропина определялась из расчета 0,018 МЕ/кг для шести пациентов, а для трех пациентов с задержкой роста доза была вычислена из расчета 0,1 МЕ/кг [2].
Спустя 6 месяцев после начала терапии все пациенты прошли повторное обследование. Сколько-нибудь значимых изменений ИМТ отмечено не было, показатель ОТ/ОБ снизился у пяти человек, у двоих он остался на прежнем уровне. У троих пациентов выявлено некоторое снижение концентрации холестерина, составившее 8,4, 9,7 и 26,6% от первоначального уровня. У троих пациентов не определено каких-либо изменений, у одного пациента выявлено повышение концентрации холестерина на 17% от исходного. По показателям содержания триглицеридов выявлены следующие данные: у четверых пациентов снижение ТГ составило 56,4, 47,2, 3,7 и 6,3% от исходного. В одном случае динамики отмечено не было, а у двоих человек зафиксировано повышение концентрации ТГ, составившее 68 и 92% от исходного уровня. Снижение уровня ТГ и холестерина на фоне терапии генотропином подтверждается данными зарубежных исследователей, демонстрирующих нормализацию показателей липидного обмена на фоне заместительной терапии.
Сколько-нибудь значимых изменений ИМТ отмечено не было, показатель ОТ/ОБ снизился у пяти человек, у двоих он остался на прежнем уровне. У троих пациентов выявлено некоторое снижение концентрации холестерина, составившее 8,4, 9,7 и 26,6% от первоначального уровня. У троих пациентов не определено каких-либо изменений, у одного пациента выявлено повышение концентрации холестерина на 17% от исходного. По показателям содержания триглицеридов выявлены следующие данные: у четверых пациентов снижение ТГ составило 56,4, 47,2, 3,7 и 6,3% от исходного. В одном случае динамики отмечено не было, а у двоих человек зафиксировано повышение концентрации ТГ, составившее 68 и 92% от исходного уровня. Снижение уровня ТГ и холестерина на фоне терапии генотропином подтверждается данными зарубежных исследователей, демонстрирующих нормализацию показателей липидного обмена на фоне заместительной терапии.
Перед началом терапии средний показатель качества жизни составил 12,5 балла, а на последней неделе терапии он снизился до 8,9 балла (необходимо отметить, что, по данным Holmes и соавт. , у здоровых пациентов, обследованных в Швеции, он составляет 3,7).
, у здоровых пациентов, обследованных в Швеции, он составляет 3,7).
Пациент с задержкой роста за 6 месяцев лечения вырос на 5 см, и его рост на момент окончания терапии составил 157 см.
Среди зафиксированных пациентами побочных эффектов чаще всего встречались: отеки, артралгии и миалгии, которые развивались на 3-6-й неделе терапии; о них сообщили четверо пациентов. Аналогичные данные демонстрируют и зарубежные исследователи, проводившие наблюдения за более многочисленными группами пациентов, получавших ГР.
По результатам проведенного исследования можно сделать следующие выводы.
- При обследовании группы пациентов, оперированных по поводу объемных образований селлярной области, в 80% случаев было подтверждено наличие соматотропной недостаточности.
- При оценке ИМТ и ОТ/ОБ ожирение зафиксировано у 33,4% обследованных, избыток массы тела — у 25%. Признаки висцерального ожирения выявлены у четырех пациентов (33,4%).

- У больных с дефицитом ГР нарушения углеводного обмена: сахарный диабет, тощаковая гипергликемия, нарушение толерантности к углеводам выявлены в 74,9% случаев. Базальная гиперинсулинемия выявлена у 41,6% обследованных, более чем двукратное повышение концентрации С-пептида регистрировалось в 75% случаев.
- Гиперхолестеринемия обнаружена у большинства обследованных (83,3%), гипертриглицеридемия выявлена в 58,3% случаев. Через 6 месяцев терапии генотропином снижение уровня холестерина от исходного обнаружено у 42,8%. У 51,4% пациентов зарегистрировано снижение содержания триглицеридов.
- При оценке показателей качества жизни было достоверно выявлено улучшение его; средний балл до начала терапии составлял 12,5, на фоне лечения он снизился до 8,9 балла.
Литература
1. Алгоритмы диагностики и лечения болезней эндокринной системы/ Под ред. И. И. Дедова, 1997.
2. Дедов И. И., Тюльпаков А. Н., Петеркова В. А. Соматотропная недостаточность, 1998.
3. Monson J. P. Growth Hormone Therapy. Oxf, 1999. Р. 93-103.
Эффективность и безопасность применения рекомбинантного гормона роста у детей с идиопатической низкорослостью
Причинами отставания ребенка в росте могут быть хронические системные заболевания, эндокринопатии, недостаточность питания, хромосомные нарушения и др. Однако, несмотря на все расширяющиеся диагностические возможности, в большинстве случаев причину отставания определить так и не удается. Идиопатическая низкорослость представляет собой не определенную нозологию или диагноз, а собирательное понятие, включающее все случаи отставания в росте (как патологию, так и варианты нормального развития), при котором исключены все возможные причины. Проблема ее диагностики и лечения является предметом постоянных споров и дискуссий. В 2008 г. был опубликован международный консенсус по диагностике и тактике ведения идиопатической низкорослости, созданный в результате совместной работы трех научных обществ: общества по изучению гормона роста, общества педиатров-эндокринологов им. Лоусона Вилкинса (США) и Европейского общества педиатров-эндокринологов [1]. Основные положения этого документа, включая современную классификацию, а также рекомендации по диагностике и подробное обсуждение ростостимулирующей терапии, описаны нами ранее [2].
Лоусона Вилкинса (США) и Европейского общества педиатров-эндокринологов [1]. Основные положения этого документа, включая современную классификацию, а также рекомендации по диагностике и подробное обсуждение ростостимулирующей терапии, описаны нами ранее [2].
Настоящая работа отражает собственный двухлетний опыт применения рекомбинантного гормона роста (рГР) у детей с идиопатической низкорослостью с оценкой ее эффективности и безопасности, а также анализом факторов, влияющих на эффективность терапии.
Материал и методы
Группа обследуемых включала 93 пациента с идиопатической низкорослостью, наблюдавшихся в ЭНЦ в период с 2005 по 2009 г. Критериями включения были: рост менее –2 SDS, возраст от 3 до 12 лет, костный возраст до 10 лет, допубертатный статус, нормальные длина и масса тела при рождении (> –2 SD соответственно сроку гестации), отсутствие диспропорций телосложения, отсутствие хронических системных заболеваний и пороков развития, нормальный кариотип (у девочек), отсутствие синдромальной патологии, отсутствие недостаточности питания, исключение дефицита соматотропного гормона (СТГ) (пик выброса СТГ на стимуляции > 10 нг/мл). Исследование было одобрено локальным этическим комитетом. У родителей всех пациентов было получено информированное согласие на участие в исследовании.
Исследование было одобрено локальным этическим комитетом. У родителей всех пациентов было получено информированное согласие на участие в исследовании.
Лечение включало ежедневные подкожные инъекции рГР («Нордитропин-НордиЛет», «Сайзен», «Растан») в вечернее время (20—22 ч). Для изучения зависимости эффективности терапии от получаемой дозы все пациенты были разделены на 3 группы: 1-я — рГР в дозе 0,033 мг/кг/сут, 2-я — в дозе 0,05 мг/кг/сут и 3-я — контрольная (без терапии). Повторные визиты проводились через 6, 12, 18 и 24 мес лечения. Эффективность терапии оценивалась по изменению скорости роста (в см/год и в SDS), динамике SDS роста (ΔSDS роста), а также по динамике костного созревания и прогнозируемого роста. Безопасность терапии оценивалась по изменению уровня инсулиноподобного фактора роста 1 (ИФР 1), показателей углеводного (глюкоза, инсулин, HbA1c), липидного (холестерин, ЛПВП, ЛПНП, триглицериды), фосфорно-кальциевого (ионизированный кальций, фосфор, щелочная фосфатаза) обмена, а также показателей функции печени (АлАТ, АсАТ, общий белок), почек (креатинин, мочевина) и щитовидной железы (свободный Т4, ТТГ).
Рост детей измерялся с помощью механического ростомера (Harpender stadiometer, Holtain Ltd, UK) с точностью до 0,1 см. Параметры физического развития (рост, скорость роста), выраженные в SDS, оценивали по британским стандартам [3]. Пропорциональность телосложения оценивали, вычисляя отношение роста сидя к общему росту по стандартам [4]. Оценка длины и массы тела при рождении проводилась по стандартам [5].
Целевой (генетически прогнозируемый) рост рассчитывался по формуле: (рост отца+рост матери±13 см)/2. Классификация идиопатической низкорослости на семейную и несемейную формы проводилась на основе международного консенсуса [6, 7]. Диагноз «семейной низкорослости» выставлялся при наличии низкорослых родственников (рост менее –1,5 SDS, что у мужчин составляет менее 165 см, у женщин — менее 154 см).
Костный возраст оценивался по методу Greulich—Pyle [8]. Динамика костного созревания оценивалась как изменение костного возраста за определенный период времени (1 и 2 года). Прогнозируемый рост рассчитывался по методу Bayley—Pinneau [8].
Прогнозируемый рост рассчитывался по методу Bayley—Pinneau [8].
Стадия пубертата оценивалась по методу Tanner [9], размер яичек у мальчиков определялся с помощью орхидометра Prader. Допубертатным состоянием считались размер яичек менее 4 мл у мальчиков и стадия развития молочных желез B1 у девочек.
У всех детей был исключен СТГ-дефицит с помощью одной (клонидин) или двух (клонидин, инсулин) стимуляционных проб с максимальным выбросом хотя бы на одной из проб более 10 нг/мл.
Уровень ИФР-1 в крови измеряли с помощью коммерческого набора методом РИА. SDS ИФР-1 рассчитывали по методу Lőfqvist [10] по формуле: (Y-Y’)/SE, где Y — log значений ИФР-1 пациента, Y’ — log средних значений ИФР-1 для данного хронологического возраста и пола, SE=0,1373. Для допубертатных мальчиков (до 14 лет) и девочек (до 8 лет) Y’=1,8010+(0,0325×возраст), для допубертатных девочек (от 9 до 14 лет) Y’=1,8010+(0,0325×возраст)+(0,0089×возраст).
Статистический анализ полученных результатов проводили с помощью пакета статистических программ Statistica 6. 0. Данные приведены в виде M±SD (min—max), где M — среднее арифметическое, SD — стандартное отклонение, min — минимальное значение, max — максимальное значение. Количественные данные проверяли на нормальность распределения с помощью теста Шапиро—Уилка. При анализе параметрических данных использовали Т-тест, при непараметрическом распределении для анализа различий данных применялись критерий Вилкоксона для связанных групп и критерий Манна—Уитни для несвязанных групп. Достоверным считался уровень значимости p<0,05. Выявление корреляционной зависимости проводилось с помощью коэффициента ранговой корреляции Спирмена.
0. Данные приведены в виде M±SD (min—max), где M — среднее арифметическое, SD — стандартное отклонение, min — минимальное значение, max — максимальное значение. Количественные данные проверяли на нормальность распределения с помощью теста Шапиро—Уилка. При анализе параметрических данных использовали Т-тест, при непараметрическом распределении для анализа различий данных применялись критерий Вилкоксона для связанных групп и критерий Манна—Уитни для несвязанных групп. Достоверным считался уровень значимости p<0,05. Выявление корреляционной зависимости проводилось с помощью коэффициента ранговой корреляции Спирмена.
Результаты и обсуждение
Исходные характеристики. Исходные характеристики пациентов, включенных в исследование, представлены в табл. 1. Средний хронологический возраст на момент начала терапии составлял 8,1±2,7 года (3,4—12 года), костный возраст — 5,1±2,5 года (1,5 года — 10 лет). На момент начала и окончания исследования все дети находились в допубертатном состоянии. Большинство детей имели выраженное отставание в росте (средний SDS роста (–)2,96±0,65) и низкую скорость роста (средний SDS скорости роста (–)1,54±1,39). Процентное соотношение семейных и несемейных вариантов во всех группах было примерно равным 1:1. Средний SDS ИФР-1 равнялся (–)1,58±1,44 (–4,69—2,09). Группы статистически не отличались по хронологическому и костному возрасту, степени отставания в росте (SDS роста), скорости роста (абсолютной и SDS), семейному анамнезу (целевому росту, росту отца и матери), прогнозируемому росту (по Bayley—Pinneau), уровням СТГ (базальному и стимулированному) и ИФР-1.
Большинство детей имели выраженное отставание в росте (средний SDS роста (–)2,96±0,65) и низкую скорость роста (средний SDS скорости роста (–)1,54±1,39). Процентное соотношение семейных и несемейных вариантов во всех группах было примерно равным 1:1. Средний SDS ИФР-1 равнялся (–)1,58±1,44 (–4,69—2,09). Группы статистически не отличались по хронологическому и костному возрасту, степени отставания в росте (SDS роста), скорости роста (абсолютной и SDS), семейному анамнезу (целевому росту, росту отца и матери), прогнозируемому росту (по Bayley—Pinneau), уровням СТГ (базальному и стимулированному) и ИФР-1.
Анализ эффективности терапии. Эффективность терапии оценивалась по изменению скорости роста (в см/год и в SDS), а также по динамике SDS роста (ΔSDS роста) (табл. 2, 3, 4; рис. 1).Рисунок 1. Динамика абсолютной (см/год) и относительной (SDS) скорости роста, а также улучшение ростовых показателей (ΔSDS роста) на фоне терапии рГР.
В группах, получавших лечение, отмечалось статистически значимое увеличение абсолютной и относительной скорости роста (по сравнению как с исходными значениями, так с контрольной группой). В среднем скорость роста на 1-м году лечения повысилась с 4,5±1,2 до 7,9±1,5 (в 1-й группе) и до 9,1±1,5 см/год (во 2-й). На 2-м году терапии отмечалось небольшое снижение темпов роста (7,1±1,4 и 7,9±1,6 см/год соответственно). Тем не менее скорость роста была больше исходной и в группе контроля. В контрольной группе на протяжении 2 лет наблюдения скорость роста достоверно не изменилась.
В среднем скорость роста на 1-м году лечения повысилась с 4,5±1,2 до 7,9±1,5 (в 1-й группе) и до 9,1±1,5 см/год (во 2-й). На 2-м году терапии отмечалось небольшое снижение темпов роста (7,1±1,4 и 7,9±1,6 см/год соответственно). Тем не менее скорость роста была больше исходной и в группе контроля. В контрольной группе на протяжении 2 лет наблюдения скорость роста достоверно не изменилась.
Увеличение скорости роста способствовало уменьшению степени отставания в росте. Суммарная прибавка SDS роста (ΔSDS роста) за 1 год терапии составила 0,56±0,28 (в 1-й группе) и 0,71±0,22 (во 2-й). За 2 года лечения суммарная ΔSDS роста составила 0,94±0,29 и 1,06±0,67 соответственно. В группе контроля степень отставания в росте не улучшилась (–0,04±0,20 за 1 год и 0,01±0,28 за 2 года).
Результатом терапии стало достижение нормального роста (> –2 SDS) у 21% детей через 6 мес лечения, у 30% через 1 год и у 37% через 2 года лечения. В то же время в контрольной группе нормализации роста не наблюдалось ни у одного ребенка (рис. 2).Рисунок 2. Нормализация роста у детей с идиопатической низкорослостью на фоне терапии рГР.
2).Рисунок 2. Нормализация роста у детей с идиопатической низкорослостью на фоне терапии рГР.
Факторы, влияющие на эффективность терапии. Оценивали следующие возможные факторы, влияющие на эффективность терапии рГР у детей с идиопатической низкорослостью: доза рГР, возраст начала лечения, исходный уровень ИФР-1 и семейный анамнез.
Лечение у детей, получавших более высокую дозу рГР, было более эффективно. Однако в силу большой гетерогенности идиопатической низкорослости полученные различия между группами были не всегда достоверны. Корреляционная зависимость эффективности терапии от дозы рГР наблюдалась только при анализе абсолютной скорости роста через 1 год лечения (r=0,32, p=0,043; n=41). В обеих группах, независимо от получаемой дозы препарата, отмечался большой диапазон ответа на лечение (от высокой эффективности до полной нечувствительности).
Возраст начала лечения оказался более важным прогностическим фактором (рис. 3).Рисунок 3. Факторы, влияющие на эффективность терапии рГР у детей с идиопатической низкорослостью. Обратная корреляционная зависимость скорости роста от возраста начала терапии (а), а также ΔSDS роста от возраста начала терапии (б). Так, наблюдалась его обратная корреляционная связь с ΔSDS роста через 6 мес (r=–0,50, p=0,00024; n=56), 12 мес (r=–0,45, p=0,0029; n=41), 18 мес (r=–0,68, p=0,0013; n=24) и 24 мес терапии (r=–0,51, p=0,032; n=18).
Обратная корреляционная зависимость скорости роста от возраста начала терапии (а), а также ΔSDS роста от возраста начала терапии (б). Так, наблюдалась его обратная корреляционная связь с ΔSDS роста через 6 мес (r=–0,50, p=0,00024; n=56), 12 мес (r=–0,45, p=0,0029; n=41), 18 мес (r=–0,68, p=0,0013; n=24) и 24 мес терапии (r=–0,51, p=0,032; n=18).
Достоверных данных о влиянии исходного уровня ИФР-1 на эффективность терапии получено не было, вероятно, из-за большой гетерогенности идиопатической низкорослости.
При проведении корреляционного анализа какой-либо зависимости эффективности лечения от наличия или отсутствия отягощенного семейного анамнеза (SDS целевого роста) не получено. Эффективность лечения у детей с семейной и несемейной формами низкорослости достоверно не различалась.
Влияние терапии рГР на темпы костного созревания и ростовой прогноз. Сравнивали динамику костного созревания у 35 детей на лечении (25 детей получали рГР в дозе 0,033 мг/кг/сут и 10 детей — 0,05 мг/кг/сут) и 6 детей без терапии. На момент начала терапии костный возраст составлял в среднем 5,1±2,5 года (1,5—10 лет) и 7,3±2,6 года (3—12 лет) на момент прекращения. Все дети на момент окончания лечения оставались допубертатными.
На момент начала терапии костный возраст составлял в среднем 5,1±2,5 года (1,5—10 лет) и 7,3±2,6 года (3—12 лет) на момент прекращения. Все дети на момент окончания лечения оставались допубертатными.
На 1-м году терапии ускорение костного созревания (в 1,5—2 раза) наблюдалось у 10 детей (0,033 мг/кг/сут — n=7; 0,05 мг/кг/сут — n=3), у 25 детей темпы костного созревания не изменились (0,033 мг/кг/сут — n=18; 0,05 мг/кг/сут — n=7). Интересно, что в группе контроля из 6 детей темпы костного созревания не изменились у 5 детей (у 1 ребенка наблюдалось ускорение костного созревания в 1,5 раза).
Зависимости темпов костного созревания от получаемой дозы препарата выявлено не было. Однако выявлена корреляционная зависимость динамики костного созревания от степени отставания в росте (r=0,37, p=0,03; n=35), исходного хронологического (r=0,46, p=0,005; n=35) и костного возраста (r=0,35, p=0,038; n=35) (рис. 4, а—в).Рисунок 4. Корреляционная зависимость темпов костного созревания от SDS роста до лечения (а) исходных паспортного (б) и костного возраста (в), а также динамика прогнозируемого роста (по Bayley—Pinneau) на фоне терапии рГР (г).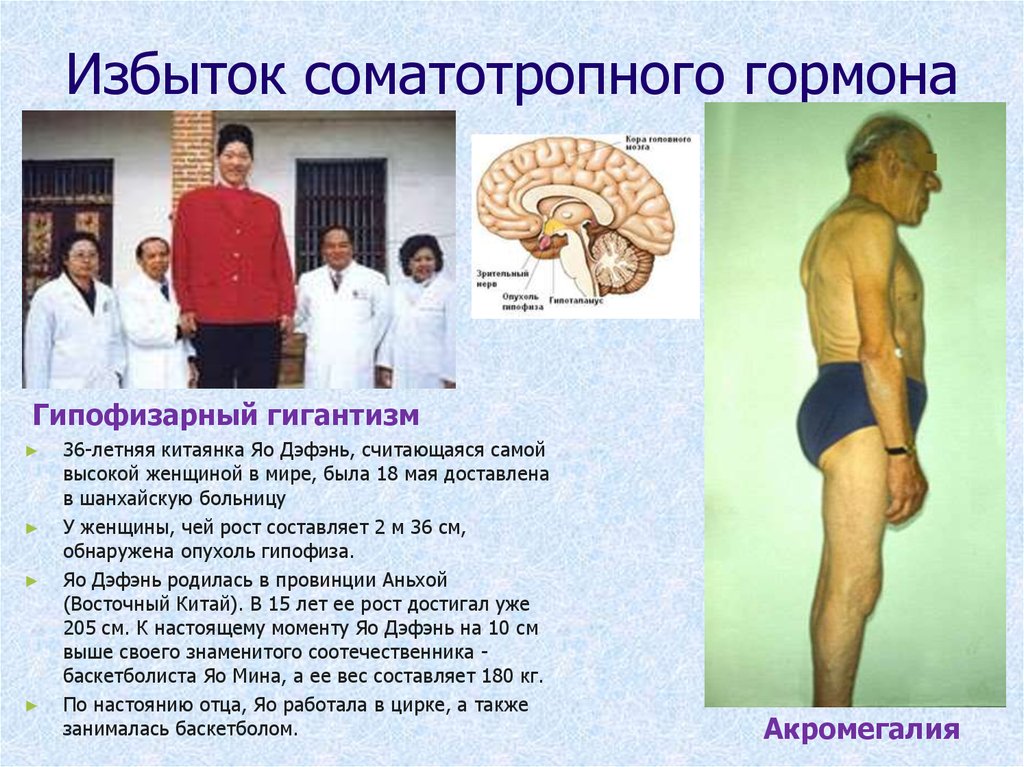 Таким образом, ускорение костного созревания наблюдалось у детей старшего возраста и с меньшей степенью отставания в росте.
Таким образом, ускорение костного созревания наблюдалось у детей старшего возраста и с меньшей степенью отставания в росте.
При анализе динамики прогнозируемого роста (по методу Bayley—Pinneau) в группе из 21 ребенка выявлена тенденция к его улучшению через 1 год лечения (p=0,074; n=12) и достоверное улучшение ростового прогноза через 2 года терапии (p=0,025; n=5) (рис. 4, г).
Динамика уровня ИФР-1 на фоне лечения. На фоне терапии рГР отмечалось достоверное увеличение уровня ИФР-1 в крови (рис. 5).Рисунок 5. Динамика уровня ИФР-1 (SDS) на фоне терапии рГР. При этом средний уровень ИФР-1 на протяжении всей терапии находился в пределах нормальных значений. Интересно, что не отмечалось зависимости между степенью увеличения ИФР-1 и дозой рГР, хотя средние показатели SDS ИФР-1 у детей, получавших рГР в дозе 0,05 мг/кг/сут, были несколько больше (статистически незначимо) (табл. 5). Корреляционной взаимосвязи уровня ИФР-1 на терапии и эффективности лечения (скорость роста, SDS скорости роста, ΔSDS роста) получено не было.
Динамика биохимических параметров. Динамика биохимических параметров, изучавшихся на фоне лечения, приведена в табл. 6.
На фоне терапии рГР не отмечалось достоверного изменения показателей липидного обмена (холестерин, ЛПВП, ЛПНП, триглицериды, индекс атерогенности), а также параметров функции печени (АлАТ, АсАТ, общий белок). Показатели функции щитовидной железы (свободный Т4, ТТГ), а также функции почек (креатинин, мочевина) на фоне лечения также оставались стабильно нормальными (данные не представлены).
При анализе показателей углеводного обмена не выявлено значимых изменений уровня глюкозы, инсулина и индекса Каро. Вместе с тем необходимо отметить, что средние значения этих показателей на терапии были выше исходных, оставаясь в пределах нормальных значений. На фоне лечения выявлено повышение среднего уровня HbA1c с 5,3 до 5,5% на 1-м году и до 5,4% на 2-м году терапии, однако достоверные отличия получены лишь на 1-м году лечения (p=0,024; n=24). Повышение уровня HbA1c выше нормы наблюдалось у 2 детей, получавших рГР в дозе 0,033 мг/кг/сут в течение 6 мес. У 1 мальчика HbA1c повысился с 5,3 до 6,1%, еще у 1 — с 5,6 до 6,4 (норма до 6,0). При этом у обоих детей гликемия натощак, а также результаты орального глюкозотолерантного теста были в пределах нормы. У первого ребенка терапия была продолжена в той же дозе, и через 6 мес уровень HbA1c самостоятельно снизился до 5,9%. У второго ребенка терапия была прекращена и через 6 мес после этого наблюдалось снижение HbA1c до 5,9%.
Повышение уровня HbA1c выше нормы наблюдалось у 2 детей, получавших рГР в дозе 0,033 мг/кг/сут в течение 6 мес. У 1 мальчика HbA1c повысился с 5,3 до 6,1%, еще у 1 — с 5,6 до 6,4 (норма до 6,0). При этом у обоих детей гликемия натощак, а также результаты орального глюкозотолерантного теста были в пределах нормы. У первого ребенка терапия была продолжена в той же дозе, и через 6 мес уровень HbA1c самостоятельно снизился до 5,9%. У второго ребенка терапия была прекращена и через 6 мес после этого наблюдалось снижение HbA1c до 5,9%.
При анализе состояния фосфорно-кальциевого обмена на фоне лечения выявлено достоверное увеличение уровней щелочной фосфатазы и фосфора. В то же время уровень ионизированного кальция практически не изменился, его достоверное снижение в пределах нормальных значений (с 1,15±0,06 до 1,12±0,04 ммоль/л) выявлено лишь через 6 мес терапии (p=0,025; n=24).
В последнее время с расширением показаний к терапии ГР при состояниях, не сопровождающихся СТГ-дефицитом, встал вопрос и о его применении при идиопатической низкорослости.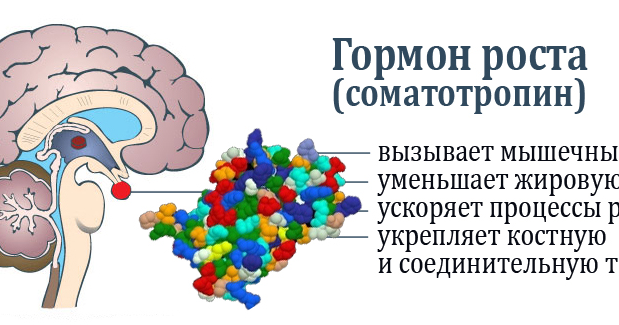 На данный момент накоплено много данных об эффективности и безопасности лечения ГР детей с идиопатической низкорослостью [11—25]. Однако в нашей стране до настоящего времени проведено лишь одно подобное исследование, оценивающее эффективность терапии ГР в расчетной дозе 12 МЕ/м2/нед (примерно 0,05 мг/кг/сут) в течение 3—6 мес у 29 детей с семейной низкорослостью, из которых лишь 20 детей закончили 6-месячный курс [26]. Наше исследование является более длительным (2-летним), дозозависимым, проводимым на фоне длительного мониторинга биохимических параметров.
На данный момент накоплено много данных об эффективности и безопасности лечения ГР детей с идиопатической низкорослостью [11—25]. Однако в нашей стране до настоящего времени проведено лишь одно подобное исследование, оценивающее эффективность терапии ГР в расчетной дозе 12 МЕ/м2/нед (примерно 0,05 мг/кг/сут) в течение 3—6 мес у 29 детей с семейной низкорослостью, из которых лишь 20 детей закончили 6-месячный курс [26]. Наше исследование является более длительным (2-летним), дозозависимым, проводимым на фоне длительного мониторинга биохимических параметров.
Предполагается, что при идиопатической низкорослости снижена чувствительность к собственному СТГ. Парциальная резистентность к СТГ преодолевается добавлением экзогенного ГР в заместительных дозах (плюс частично подавленная собственная спонтанная секреция СТГ) [27]. Ранее было показано, что у большинства детей увеличение скорости роста происходит даже на заместительной дозе (0,033 мг/кг/сут), но оно значительно выше на больших дозах. В то же время чрезмерно большие дозы (0,07 мг/кг/сут и выше) приводят к быстрому прогрессированию костного созревания и сводят на нет эффективность терапии [7, 22, 28].
В то же время чрезмерно большие дозы (0,07 мг/кг/сут и выше) приводят к быстрому прогрессированию костного созревания и сводят на нет эффективность терапии [7, 22, 28].
Наши результаты аналогичны зарубежным данным [11—13, 16, 22, 29]. Лечение рГР в течение 6—24 мес в расчетных дозах 0,033 и 0,05 мг/кг/сут детей с идиопатической низкорослостью сопровождалось повышением скорости роста и улучшением (или даже нормализацией в течение столь короткого промежутка времени) ростовых показателей. Было обнаружено, что главными факторами, определяющими эффект лечения, являются возраст начала терапии и получаемая доза.
Большая эффективность терапии у детей младшего возраста, наблюдаемая нами, показана и другими авторами [11—13, 16, 22, 29]. В то же время при начавшемся пубертате эффективность терапии значительно снижается. В связи с этим в соответствии с международным консенсусом 2008 г. рекомендуется более раннее начало ростостимулирующей терапии, оптимальным возрастом считается период от 5 лет до раннего пубертата [1].
Лечение детей, получавших более высокую дозу гормона роста, было более эффективно. Однако, полученные различия между группами, были не всегда достоверны. Корреляционная зависимость эффективности терапии от дозы рГР наблюдалась нами только при анализе абсолютной скорости роста через 1 год лечения (r=0,32, p=0,043; n=41). Возможной причиной этого является большая вариабельность клинического эффекта, наблюдаемая у разных детей, в совокупности со сравнительно небольшим объемом столь гетерогенной выборки. В любом случае дозозависимый эффект лечения не вызывает сомнений. Оптимальной дозой для лечения идиопатической низкорослости считается 0,05 мг/кг/сут [1].
Нами не было выявлено какой-либо корреляционной связи между исходным уровнем ИФР-1 и эффективностью лечения. По данным международного консенсуса 2008 г., сниженный/нормальный уровень ИФР-1 не является показанием (или противопоказанием) к назначению терапии гормоном роста при идиопатической низкорослости [1].
Эффективность лечения у детей с семейной и несемейной формами низкорослости в нашем исследовании достоверно не отличалась. Некоторые авторы указывают на связь между ростовым эффектом и семейным анамнезом [29]. В то же время подразделение низкорослости на формы в зависимости от отягощенной наследственности не приводит к различной тактике лечения (в вопросе о назначении терапии и выборе дозы) у таких пациентов [1].
Некоторые авторы указывают на связь между ростовым эффектом и семейным анамнезом [29]. В то же время подразделение низкорослости на формы в зависимости от отягощенной наследственности не приводит к различной тактике лечения (в вопросе о назначении терапии и выборе дозы) у таких пациентов [1].
При анализе влияния терапии рГР на темпы костного созревания нами были получены противоречивые данные. Часть детей (10 из 35), получавших рГР, демонстрировала ускорение костного созревания (в 1,5—2 раза), у остальных 25 подобного феномена не наблюдалось. В то же время из 6 детей, не получавших лечение, у 1 ребенка также наблюдалось ускорение костного созревания в 1,5 раза. Зависимости темпов костного созревания от получаемой дозы препарата выявлено не было. Однако выявлена корреляционная зависимость динамики костного созревания от степени отставания в росте, исходного хронологического и костного возраста. Таким образом, ускорение костного созревания наблюдалось у детей старшего возраста и с меньшей степенью отставания в росте.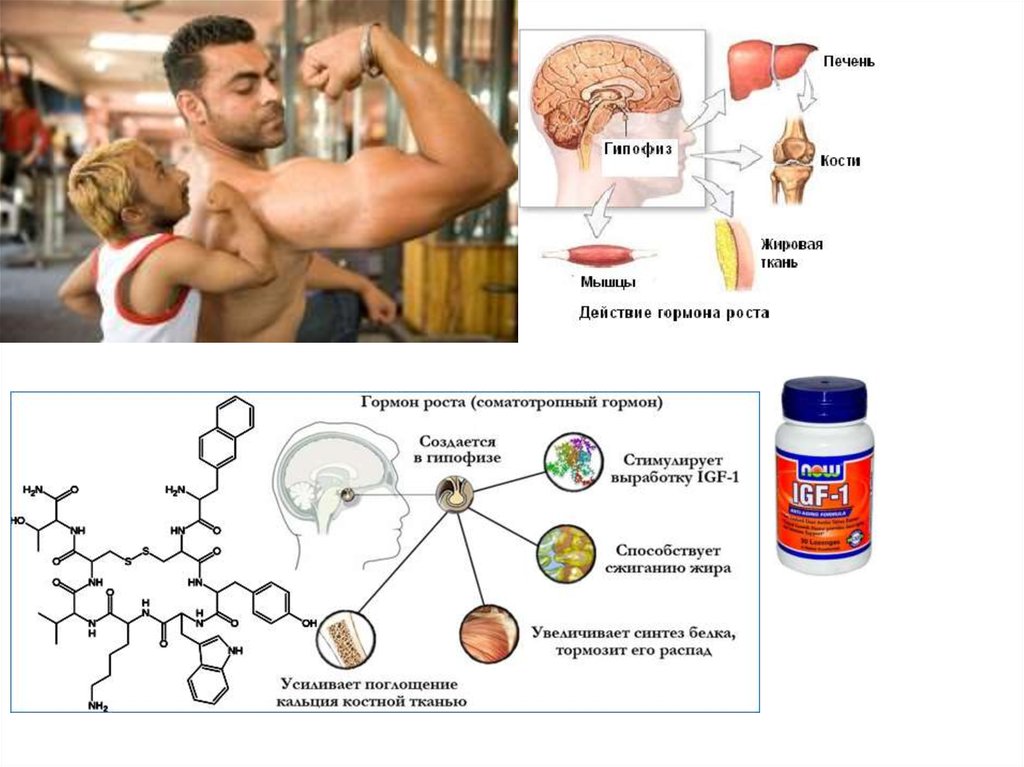 Зависит ли прогрессирование от наличия или отсутствия терапии, неизвестно. Возможно, на индивидуальное прогрессирование костного возраста влияют другие факторы. Кроме того, необходимо отметить, что ускорение темпов костного созревания само по себе не может говорить об ухудшении ростового прогноза, так как оно не коррелирует с прогнозируемым ростом. Более того, нами наблюдалось улучшение ростового прогноза, рассчитанное по методу Bayley—Pinneau, на фоне лечения. Так или иначе, для изучения влияния терапии на конечный рост необходимо проведение длительных исследований.
Зависит ли прогрессирование от наличия или отсутствия терапии, неизвестно. Возможно, на индивидуальное прогрессирование костного возраста влияют другие факторы. Кроме того, необходимо отметить, что ускорение темпов костного созревания само по себе не может говорить об ухудшении ростового прогноза, так как оно не коррелирует с прогнозируемым ростом. Более того, нами наблюдалось улучшение ростового прогноза, рассчитанное по методу Bayley—Pinneau, на фоне лечения. Так или иначе, для изучения влияния терапии на конечный рост необходимо проведение длительных исследований.
Безопасность терапии рГР при идиопатической низкорослости показана во многих исследованиях [18, 21, 23]. Частота побочных эффектов встречается при этом не чаще, а по некоторым данным даже реже, чем при лечении СТГ-дефицита [21]. Однако ввиду возможности их возникновения на фоне терапии нами проводился тщательный мониторинг биохимических показателей. При этом не наблюдалось нарушений со стороны липидного обмена, функции печени, почек и щитовидной железы. Показатели углеводного обмена на фоне терапии оставались в пределах нормальных значений (глюкоза, инсулин, гликированный гемоглобин). Повышение уровня гликированного гемоглобина, наблюдаемое нами у 2 детей, не сопровождалось нарушением толерантности к глюкозе и возникновением инсулинорезистентности и снизилось до нормы через 6 мес в одном случае самостоятельно, в другом — после прекращения лечения.
Показатели углеводного обмена на фоне терапии оставались в пределах нормальных значений (глюкоза, инсулин, гликированный гемоглобин). Повышение уровня гликированного гемоглобина, наблюдаемое нами у 2 детей, не сопровождалось нарушением толерантности к глюкозе и возникновением инсулинорезистентности и снизилось до нормы через 6 мес в одном случае самостоятельно, в другом — после прекращения лечения.
Наблюдаемое на фоне лечения увеличение уровня щелочной фосфатазы в 1,5 раза происходит, вероятно, за счет увеличения ее костной фракции и является показателем ремоделирования костной ткани, а не патологического процесса [30, 31].
Результаты нашего исследования показывают эффективность и безопасность применения рГР у детей с идиопатической низкорослостью в течение 2-летнего срока. Несомненно, для оценки влияния терапии на конечный рост необходимо проведение длительного многолетнего исследования. Но даже сравнительно кратковременная (в течение 1—2 лет) терапия рГР детей даже при выраженном отставании в росте приводит к улучшению роста в подавляющем большинстве случаев и нормализации роста в 30—37% случаев, что не может положительно не отразиться на психологическом состоянии детей (повышение самооценки, снижение уровня стрессов в результате переживаний по поводу низкорослости).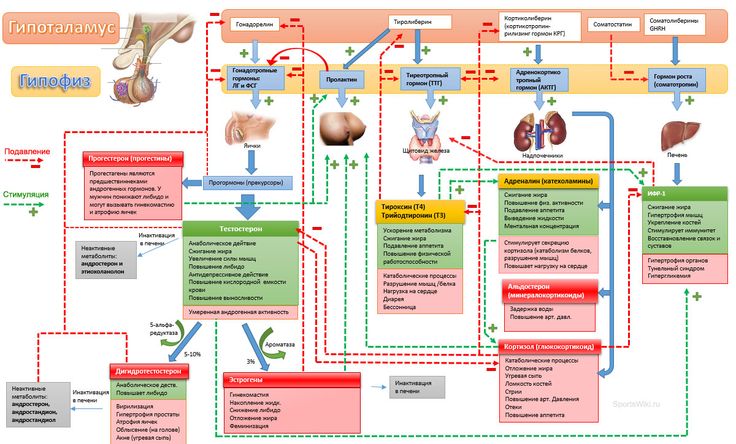 Хотя надо признать, что для доказательства улучшения качества жизни требуется проведение полноценного исследования с углубленной объективной оценкой психологических параметров.
Хотя надо признать, что для доказательства улучшения качества жизни требуется проведение полноценного исследования с углубленной объективной оценкой психологических параметров.
Выводы
1. Ростостимулирующая терапия рГР у детей с идиопатической низкорослостью в расчетных дозах 0,033—0,05 мг/кг/сут значительно повышает скорость роста и улучшает ростовые показатели.
2. Больший эффект наблюдается при применении больших доз, однако ростовой ответ очень вариабелен (от высокой эффективности до полной резистентности).
3. В связи с большей эффективностью лечения у детей младшего возраста рекомендуется как можно более раннее начало ростостимулирующей терапии.
4. Темпы костного созревания при применении рГР в дозе 0,033—0,05 мг/кг/сут зависят не от расчетной дозы, а от возраста начала терапии и степени отставания в росте.
5. Лечение рГР в дозе 0,033—0,05 мг/кг/сут безопасно, однако требует постоянного мониторинга биохимических показателей.
Физиология, Гормон роста – StatPearls
Джошуа Э. Бринкман; Мухаммед Али Тарик; Логан Ливитт; Сандип Шарма.
Информация об авторе и организациях
Последнее обновление: 8 мая 2022 года. железа. Как следует из названия, ученые изначально обнаружили, что он отвечает за регуляцию роста в детстве. Тем не менее, исследования показали, что гормон роста также отвечает за регуляцию многих других основных метаболических функций организма и действует как реагент острофазового стресса.[1][2]
Сотовый уровень
Гормон роста человека вырабатывается передней долей гипофиза головного мозга в ацидофильных соматотрофных клетках. Его производство жестко регулируется несколькими сложными механизмами обратной связи в ответ на стресс, физические упражнения, питание, сон и сам гормон роста. Основными факторами регуляции являются гормон роста, высвобождающий гормон роста (GHRH), вырабатываемый в гипоталамусе, соматостатин, вырабатываемый в различных тканях по всему телу, и грелин, вырабатываемый в желудочно-кишечном тракте.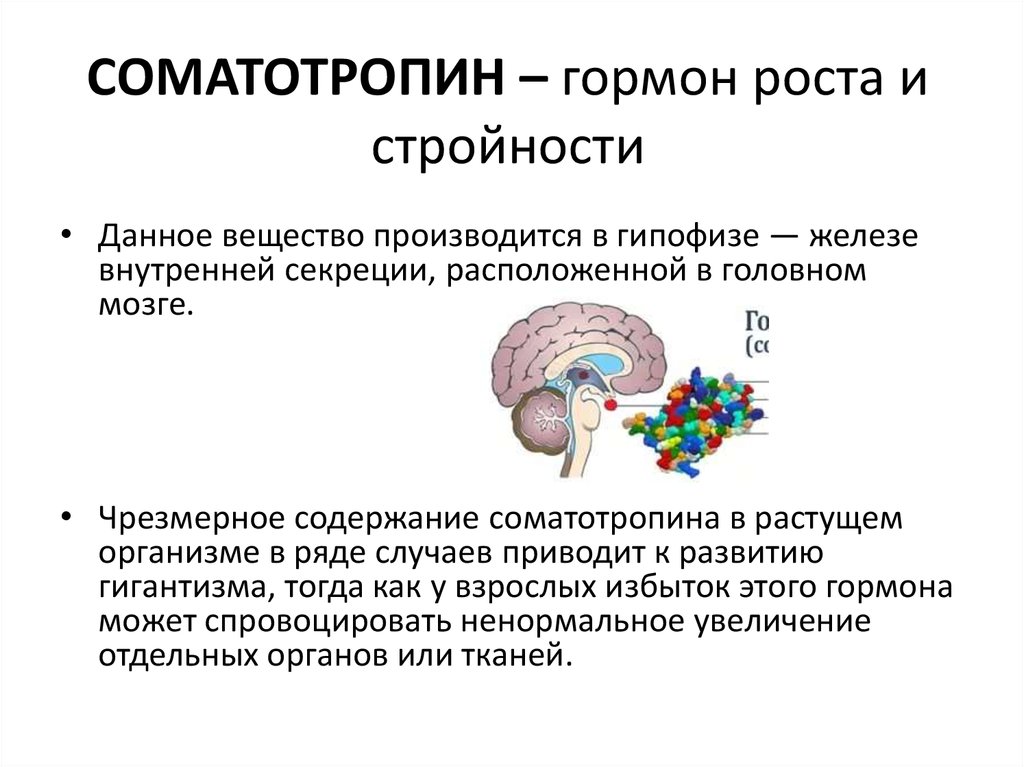 Функции GHRH способствуют производству и высвобождению гормона роста. Соматостатин ингибирует высвобождение GHRH, а также реакцию высвобождения гормона роста на стимул GHRH и усиливает гипогликемию. Грелин — это гормон, вырабатываемый желудком как часть реакции на голод. Функционально реакция грелина защищает от гипогликемии. При повышенном уровне грелин связывается с соматотрофами, чтобы стимулировать секрецию гормона роста. Инсулиноподобный фактор роста-1 также ингибирует гормон роста как путем прямого ингибирования высвобождения соматотропного гормона роста, так и косвенно, путем синергетического увеличения высвобождения соматостатина. Кроме того, гормон роста отрицательно влияет на гипоталамус, тем самым снижая выработку гормона роста. Чистый эффект этого регулирующего механизма приводит к пульсирующему выбросу гормона роста в кровоток, который меняется ежечасно. Как правило, уровень гормона роста будет повышаться в детстве, достигать максимального уровня в период полового созревания и впоследствии снижаться с возрастом.
Функции GHRH способствуют производству и высвобождению гормона роста. Соматостатин ингибирует высвобождение GHRH, а также реакцию высвобождения гормона роста на стимул GHRH и усиливает гипогликемию. Грелин — это гормон, вырабатываемый желудком как часть реакции на голод. Функционально реакция грелина защищает от гипогликемии. При повышенном уровне грелин связывается с соматотрофами, чтобы стимулировать секрецию гормона роста. Инсулиноподобный фактор роста-1 также ингибирует гормон роста как путем прямого ингибирования высвобождения соматотропного гормона роста, так и косвенно, путем синергетического увеличения высвобождения соматостатина. Кроме того, гормон роста отрицательно влияет на гипоталамус, тем самым снижая выработку гормона роста. Чистый эффект этого регулирующего механизма приводит к пульсирующему выбросу гормона роста в кровоток, который меняется ежечасно. Как правило, уровень гормона роста будет повышаться в детстве, достигать максимального уровня в период полового созревания и впоследствии снижаться с возрастом.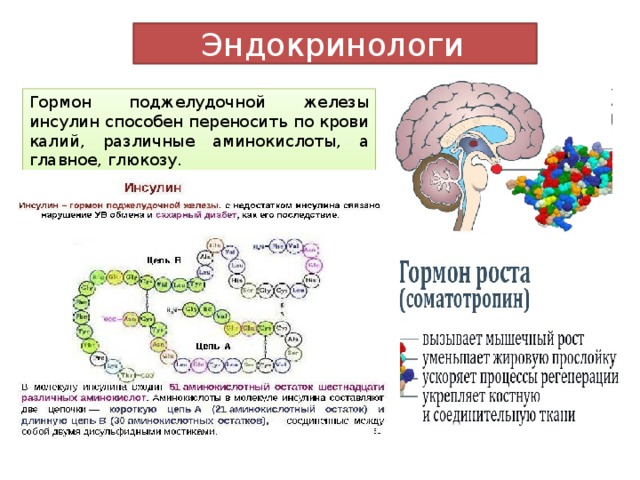 [3][4][5]
[3][4][5]
Функция
Гормон роста имеет два механизма действия: прямое действие и косвенное действие. Прямое воздействие гормона роста на организм заключается в его воздействии на связывание с клетками-мишенями для стимуляции ответа. Косвенные эффекты проявляются в первую очередь действием инсулиноподобного фактора роста-1, который гепатоциты преимущественно секретируют в ответ на повышенное связывание гормона роста с поверхностными рецепторами. После активации Янус-активирующие тирозинкиназы (JAK) 1 и 2 будут связываться со латентными цитоплазматическими факторами транскрипции STAT1, STAT3 и STAT5 и транспортироваться в ядро, вызывая усиление транскрипции и метаболизма генов с образованием инсулиноподобного фактора роста-1. для выпуска в обращение. Затем инсулиноподобный фактор роста-1 оказывает влияние на рост и метаболизм периферических тканей. Эффекты гормона роста можно рассматривать как комбинированный эффект как гормона роста, так и инсулиноподобного фактора роста-1.
Рост
Гормон роста вызывает рост почти во всех тканях и органах тела. Тем не менее, он наиболее известен своим стимулирующим рост действием на хрящи и кости, особенно в подростковом возрасте. Хондроциты и остеобласты получают сигналы для увеличения репликации и, таким образом, позволяют увеличиваться в размерах за счет активации HGH киназ митоген-активированного белка (MAP), обозначаемых как ERK (киназы, регулируемые внеклеточными сигналами) 1 и 2 клеточных сигнальных путей. Активация этого внутриклеточного сигнального каскада фосфорилирования приводит к каскаду активации белков, что приводит к увеличению транскрипции генов пораженных клеток и, в конечном счете, вызывает усиление репликации генов и рост клеток.
Инсулиноподобный фактор роста-1 связывается со своим рецептором, IGF-1R, на клеточной поверхности и активирует опосредованный тирозинкиназой внутриклеточный сигнальный путь, который фосфорилирует различные белки внутриклеточно, что приводит к усилению метаболизма, анаболизма, клеточной репликации и деления. Кроме того, он ингибирует апоптоз клетки, тем самым продлевая срок жизни существующих клеток. Конечным результатом является стимулирование роста тканей и создание гипергликемической среды в организме.
Кроме того, он ингибирует апоптоз клетки, тем самым продлевая срок жизни существующих клеток. Конечным результатом является стимулирование роста тканей и создание гипергликемической среды в организме.
Метаболические эффекты
Гормон роста влияет на обмен веществ, прежде всего, за счет усиления выработки инсулиноподобного фактора роста-1 и его последующего воздействия на периферические клетки. Происходящая активация внутриклеточной сигнализации, как указывалось выше, оказывает существенное влияние и на основные метаболические функции тканей органов. В общем, клетки входят в состояние анаболического белка с повышенным поглощением аминокислот, синтезом белка и снижением катаболизма белков. Жиры перерабатываются и потребляются путем стимуляции расщепления и окисления триглицеридов в адипоцитах. Кроме того, гормон роста подавляет способность инсулина стимулировать поглощение глюкозы в периферических тканях и вызывает повышенную скорость глюконеогенеза в печени, что приводит к общему гипергликемическому состоянию.
Связанное тестирование
Из-за пульсирующего характера уровней гормона роста в крови обычные измерения уровня гормона роста в сыворотке практически бесполезны, поскольку значения могут варьироваться от неопределяемых до чрезвычайно высоких в зависимости от стрессовых факторов и условий окружающей среды. Если клиницист подозревает дефицит гормона роста, лучше всего оценить уровни инсулиноподобного фактора роста I и инсулиноподобного фактора роста, связывающего белок-3, и выполнить тесты стимуляции гормона роста.
В тесте стимуляции гормона роста пациент голодает в течение ночи, а утром добавляется фармакологическая провокация L-допой, клонидином, пропранололом, глюкагоном, аргинином или вызванной инсулином гипогликемией. Затем ежечасно оценивают уровни гормона роста в сыворотке крови на предмет реакции на повышенный уровень гормонов. Таким образом, неспособность этого теста повысить уровень гормона роста указывает на дефицит гормона роста.][10]
Клиническое значение
Гормон роста чрезвычайно важен для модуляции роста в подростковом возрасте. Следовательно, серьезные отклонения в регуляции гормона роста могут привести к дефектам роста. Гиперсекреция гормона роста приводит к гигантизму или акромегалии, тогда как дефицит гормона роста приводит к дефициту роста у детей и синдрому дефицита гормона роста у взрослых.
Следовательно, серьезные отклонения в регуляции гормона роста могут привести к дефектам роста. Гиперсекреция гормона роста приводит к гигантизму или акромегалии, тогда как дефицит гормона роста приводит к дефициту роста у детей и синдрому дефицита гормона роста у взрослых.
Акромегалия
Акромегалия обычно возникает в результате аденомы гипофиза, секретирующей гормон роста, с началом после закрытия эпифизарных пластинок роста, как правило, во взрослом возрасте. Следовательно, рост костей в первую очередь затрагивает плоские кости, такие как череп, нижняя челюсть, грудина, руки и ноги. Часто предъявляемые жалобы связаны с тем, что шапки или перчатки больше не подходят из-за отека рук и головы. Поскольку заболевание связано с образованием гипофиза, гипопитуитаризм может также развиться с вторичными нарушениями репродуктивной функции и зрительными симптомами. В дополнение к росту костей наблюдается рост миокарда, приводящий к бивентрикулярной концентрической гипертрофии и последующей сердечной недостаточности при более позднем заболевании.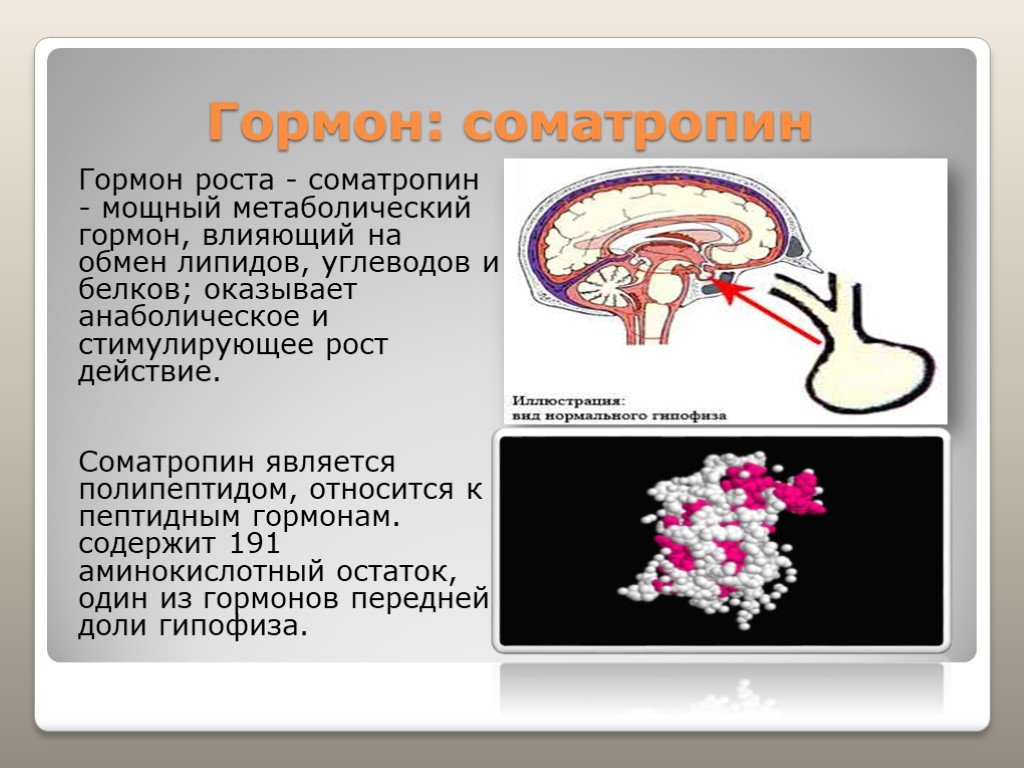 Поскольку гормон роста противодействует действию инсулина на метаболизм глюкозы и липидов, сахарный диабет 2 типа и гиперлипидемия тесно связаны с этим заболеванием. Лечение состоит из хирургического вмешательства и лучевой терапии, направленной на лежащую в основе аденому, а также симптоматического облегчения вторичных эффектов гормона роста, как указано выше.
Поскольку гормон роста противодействует действию инсулина на метаболизм глюкозы и липидов, сахарный диабет 2 типа и гиперлипидемия тесно связаны с этим заболеванием. Лечение состоит из хирургического вмешательства и лучевой терапии, направленной на лежащую в основе аденому, а также симптоматического облегчения вторичных эффектов гормона роста, как указано выше.
Гигантизм
Это заболевание очень похоже на акромегалию во всех аспектах, за исключением того, что основная аденома гипофиза развивается до закрытия эпифиза длинных костей. Следовательно, рост кости происходит в длинных костях, таких как большеберцовая, малоберцовая, бедренная, плечевая, лучевая и локтевая кости. Поскольку эпифизарное закрытие происходит до наступления взрослой жизни, это заболевание обычно начинается у детей. Органные и метаболические воздействия аналогичны акромегалии.
Дефицит гормона роста
У детей наиболее часто встречается идиопатический дефицит гормона роста. Дефицит гормона роста у взрослых обычно представляет собой совокупность дефицитов гипофиза. Инициирующим событием обычно является аденома гипофиза, скорее всего, пролактинома. Однако причиной могут быть другие методы лечения, такие как лучевая терапия или хирургическое вмешательство. Начало в детском возрасте связано со снижением роста всех структур скелета, что приводит к карликовости. Дефицит гормона роста, возникающий у взрослых, диагностировать труднее, поскольку он не имеет единого патогномоничного признака. Обычно у взрослых наблюдается уменьшение скелетных мышц и увеличение жировой массы во внутренних тканях, а также снижение плотности и ремоделирования кости, что приводит к остеопорозу. Преобладают дислипидемия и резистентность к инсулину, которые приводят к вторичной сердечно-сосудистой дисфункции, депрессивному настроению, повышенной тревожности и упадку сил.[11][12][13]
Дефицит гормона роста у взрослых обычно представляет собой совокупность дефицитов гипофиза. Инициирующим событием обычно является аденома гипофиза, скорее всего, пролактинома. Однако причиной могут быть другие методы лечения, такие как лучевая терапия или хирургическое вмешательство. Начало в детском возрасте связано со снижением роста всех структур скелета, что приводит к карликовости. Дефицит гормона роста, возникающий у взрослых, диагностировать труднее, поскольку он не имеет единого патогномоничного признака. Обычно у взрослых наблюдается уменьшение скелетных мышц и увеличение жировой массы во внутренних тканях, а также снижение плотности и ремоделирования кости, что приводит к остеопорозу. Преобладают дислипидемия и резистентность к инсулину, которые приводят к вторичной сердечно-сосудистой дисфункции, депрессивному настроению, повышенной тревожности и упадку сил.[11][12][13]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Ссылки
- 1.
Baltaci AK, Mogulkoc R, Baltaci SB. Обзор: Роль цинка в эндокринной системе. Пак Дж Фарм Наук. 2019 Январь; 32 (1): 231-239. [PubMed: 30772815]
- 2.
Вандеркуур Дж. А., Бутч Э. Р., Уотерс С. Б., Пессин Дж. Э., Гуан К. Л., Картер-Су С. Сигнальные молекулы, участвующие в соединении рецептора гормона роста с активацией митоген-активируемой протеинкиназы. Эндокринология. 1997 октября; 138 (10): 4301-7. [PubMed: 9322943]
- 3.
Синдром Биндера Г. Нунана, сигнальный путь Ras-MAPK и низкорослость. Горм Рез. 2009 Апрель; 71 Приложение 2: 64-70. [PubMed: 19407499]
- 4.
Al Aboud AM, Zito PM. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 октября 2022 г. Алопеция. [PubMed: 30844205]
- 5.
Хан Ю., Лиман Д.В., Уотлинг Д., Роджерс Н.К., Гронер Б., Керр И.
 М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]
М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]- 6.
Аюк Дж., Шеппард М.С. Гормон роста и его нарушения. Postgrad Med J. 2006 Jan; 82 (963): 24-30. [Статья бесплатно PMC: PMC2563724] [PubMed: 16397076]
- 7.
Lanes R, Hurtado E. Пероральный клонидин — эффективный агент, высвобождающий гормон роста, у субъектов препубертатного возраста. J Педиатр. 1982 г., май; 100 (5): 710-4. [PubMed: 7040621]
- 8.
Стимуляция секреции гормона роста леводопа-пропранолол у детей и подростков. Педиатрия. 1975 августа; 56 (2): 262-6. [PubMed: 169508]
- 9.
Mitchell ML, Byrne MJ, Sanchez Y, Sawin CT. Выявление дефицита гормона роста. N Engl J Med. 1970 05 марта; 282 (10): 539-41. [PubMed: 5413105]
- 10.
Mullis PE. Генетика GHRH, GHRH-рецептора, GH и GH-рецептора: его влияние на фармакогенетику.
 Best Pract Res Clin Endocrinol Metab. 2011 Февраль; 25 (1): 25-41. [PubMed: 21396573]
Best Pract Res Clin Endocrinol Metab. 2011 Февраль; 25 (1): 25-41. [PubMed: 21396573]- 11.
Gehmert S, Sadat S, Song YH, Yan Y, Alt E. Антиапоптотический эффект IGF-1 на тканевые резидентные стволовые клетки опосредуется зависимой от PI3-киназы секрецией. высвобождение родственного белка 2 (Sfrp2). Biochem Biophys Res Commun. 2008 г., 11 июля; 371 (4): 752-5. [В паблике: 18466761]
- 12.
Merimee TJ, Rabinowtitz D, Fineberg SE. Высвобождение гормона роста человека, инициируемое аргинином. Факторы, модифицирующие реакцию у нормального человека. N Engl J Med. 1969 26 июня; 280 (26): 1434-8. [PubMed: 5786514]
- 13.
Hartman ML, Veldhuis JD, Thorner MO. Нормальный контроль секреции гормона роста. Горм Рез. 1993;40(1-3):37-47. [PubMed: 8300049]
Физиология, Гормон роста — StatPearls
Джошуа Э. Бринкман; Мухаммед Али Тарик; Логан Ливитт; Сандип Шарма.
Информация об авторе и сведения о членстве
Последнее обновление: 8 мая 2022 г.
Введение
Гормон роста человека (HGH), также известный как соматотропин, представляет собой одноцепочечный полипептид из 191 аминокислоты, продуцируемый соматотропными клетками передней доли гипофиза. железа. Как следует из названия, ученые изначально обнаружили, что он отвечает за регуляцию роста в детстве. Тем не менее, исследования показали, что гормон роста также отвечает за регуляцию многих других основных метаболических функций организма и действует как реагент острофазового стресса.[1][2]
Сотовый уровень
Гормон роста человека вырабатывается передней долей гипофиза головного мозга в ацидофильных соматотрофных клетках. Его производство жестко регулируется несколькими сложными механизмами обратной связи в ответ на стресс, физические упражнения, питание, сон и сам гормон роста. Основными факторами регуляции являются гормон роста, высвобождающий гормон роста (GHRH), вырабатываемый в гипоталамусе, соматостатин, вырабатываемый в различных тканях по всему телу, и грелин, вырабатываемый в желудочно-кишечном тракте.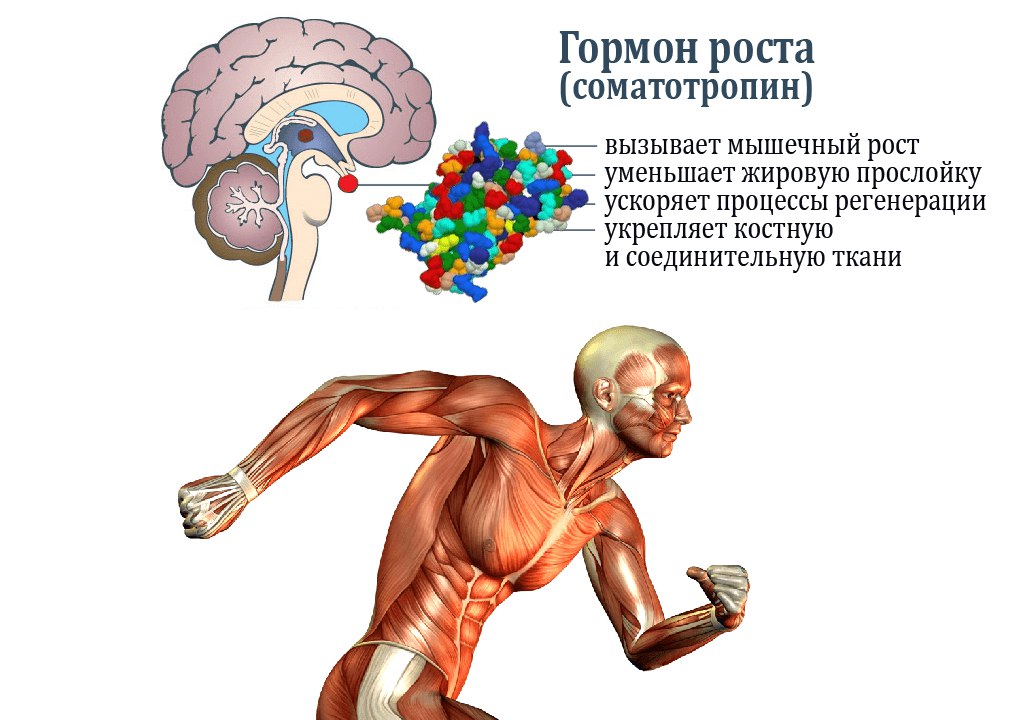 Функции GHRH способствуют производству и высвобождению гормона роста. Соматостатин ингибирует высвобождение GHRH, а также реакцию высвобождения гормона роста на стимул GHRH и усиливает гипогликемию. Грелин — это гормон, вырабатываемый желудком как часть реакции на голод. Функционально реакция грелина защищает от гипогликемии. При повышенном уровне грелин связывается с соматотрофами, чтобы стимулировать секрецию гормона роста. Инсулиноподобный фактор роста-1 также ингибирует гормон роста как путем прямого ингибирования высвобождения соматотропного гормона роста, так и косвенно, путем синергетического увеличения высвобождения соматостатина. Кроме того, гормон роста отрицательно влияет на гипоталамус, тем самым снижая выработку гормона роста. Чистый эффект этого регулирующего механизма приводит к пульсирующему выбросу гормона роста в кровоток, который меняется ежечасно. Как правило, уровень гормона роста будет повышаться в детстве, достигать максимального уровня в период полового созревания и впоследствии снижаться с возрастом.
Функции GHRH способствуют производству и высвобождению гормона роста. Соматостатин ингибирует высвобождение GHRH, а также реакцию высвобождения гормона роста на стимул GHRH и усиливает гипогликемию. Грелин — это гормон, вырабатываемый желудком как часть реакции на голод. Функционально реакция грелина защищает от гипогликемии. При повышенном уровне грелин связывается с соматотрофами, чтобы стимулировать секрецию гормона роста. Инсулиноподобный фактор роста-1 также ингибирует гормон роста как путем прямого ингибирования высвобождения соматотропного гормона роста, так и косвенно, путем синергетического увеличения высвобождения соматостатина. Кроме того, гормон роста отрицательно влияет на гипоталамус, тем самым снижая выработку гормона роста. Чистый эффект этого регулирующего механизма приводит к пульсирующему выбросу гормона роста в кровоток, который меняется ежечасно. Как правило, уровень гормона роста будет повышаться в детстве, достигать максимального уровня в период полового созревания и впоследствии снижаться с возрастом.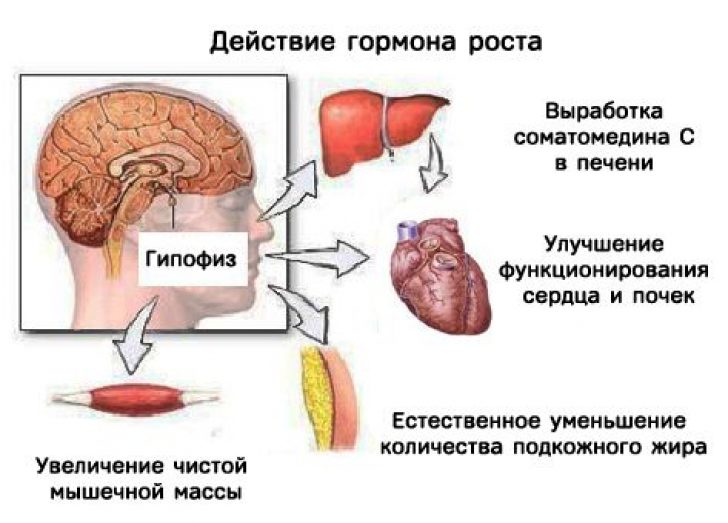 [3][4][5]
[3][4][5]
Функция
Гормон роста имеет два механизма действия: прямое действие и косвенное действие. Прямое воздействие гормона роста на организм заключается в его воздействии на связывание с клетками-мишенями для стимуляции ответа. Косвенные эффекты проявляются в первую очередь действием инсулиноподобного фактора роста-1, который гепатоциты преимущественно секретируют в ответ на повышенное связывание гормона роста с поверхностными рецепторами. После активации Янус-активирующие тирозинкиназы (JAK) 1 и 2 будут связываться со латентными цитоплазматическими факторами транскрипции STAT1, STAT3 и STAT5 и транспортироваться в ядро, вызывая усиление транскрипции и метаболизма генов с образованием инсулиноподобного фактора роста-1. для выпуска в обращение. Затем инсулиноподобный фактор роста-1 оказывает влияние на рост и метаболизм периферических тканей. Эффекты гормона роста можно рассматривать как комбинированный эффект как гормона роста, так и инсулиноподобного фактора роста-1.
Рост
Гормон роста вызывает рост почти во всех тканях и органах тела. Тем не менее, он наиболее известен своим стимулирующим рост действием на хрящи и кости, особенно в подростковом возрасте. Хондроциты и остеобласты получают сигналы для увеличения репликации и, таким образом, позволяют увеличиваться в размерах за счет активации HGH киназ митоген-активированного белка (MAP), обозначаемых как ERK (киназы, регулируемые внеклеточными сигналами) 1 и 2 клеточных сигнальных путей. Активация этого внутриклеточного сигнального каскада фосфорилирования приводит к каскаду активации белков, что приводит к увеличению транскрипции генов пораженных клеток и, в конечном счете, вызывает усиление репликации генов и рост клеток.
Инсулиноподобный фактор роста-1 связывается со своим рецептором, IGF-1R, на клеточной поверхности и активирует опосредованный тирозинкиназой внутриклеточный сигнальный путь, который фосфорилирует различные белки внутриклеточно, что приводит к усилению метаболизма, анаболизма, клеточной репликации и деления. Кроме того, он ингибирует апоптоз клетки, тем самым продлевая срок жизни существующих клеток. Конечным результатом является стимулирование роста тканей и создание гипергликемической среды в организме.
Кроме того, он ингибирует апоптоз клетки, тем самым продлевая срок жизни существующих клеток. Конечным результатом является стимулирование роста тканей и создание гипергликемической среды в организме.
Метаболические эффекты
Гормон роста влияет на обмен веществ, прежде всего, за счет усиления выработки инсулиноподобного фактора роста-1 и его последующего воздействия на периферические клетки. Происходящая активация внутриклеточной сигнализации, как указывалось выше, оказывает существенное влияние и на основные метаболические функции тканей органов. В общем, клетки входят в состояние анаболического белка с повышенным поглощением аминокислот, синтезом белка и снижением катаболизма белков. Жиры перерабатываются и потребляются путем стимуляции расщепления и окисления триглицеридов в адипоцитах. Кроме того, гормон роста подавляет способность инсулина стимулировать поглощение глюкозы в периферических тканях и вызывает повышенную скорость глюконеогенеза в печени, что приводит к общему гипергликемическому состоянию.
Связанное тестирование
Из-за пульсирующего характера уровней гормона роста в крови обычные измерения уровня гормона роста в сыворотке практически бесполезны, поскольку значения могут варьироваться от неопределяемых до чрезвычайно высоких в зависимости от стрессовых факторов и условий окружающей среды. Если клиницист подозревает дефицит гормона роста, лучше всего оценить уровни инсулиноподобного фактора роста I и инсулиноподобного фактора роста, связывающего белок-3, и выполнить тесты стимуляции гормона роста.
В тесте стимуляции гормона роста пациент голодает в течение ночи, а утром добавляется фармакологическая провокация L-допой, клонидином, пропранололом, глюкагоном, аргинином или вызванной инсулином гипогликемией. Затем ежечасно оценивают уровни гормона роста в сыворотке крови на предмет реакции на повышенный уровень гормонов. Таким образом, неспособность этого теста повысить уровень гормона роста указывает на дефицит гормона роста.][10]
Клиническое значение
Гормон роста чрезвычайно важен для модуляции роста в подростковом возрасте. Следовательно, серьезные отклонения в регуляции гормона роста могут привести к дефектам роста. Гиперсекреция гормона роста приводит к гигантизму или акромегалии, тогда как дефицит гормона роста приводит к дефициту роста у детей и синдрому дефицита гормона роста у взрослых.
Следовательно, серьезные отклонения в регуляции гормона роста могут привести к дефектам роста. Гиперсекреция гормона роста приводит к гигантизму или акромегалии, тогда как дефицит гормона роста приводит к дефициту роста у детей и синдрому дефицита гормона роста у взрослых.
Акромегалия
Акромегалия обычно возникает в результате аденомы гипофиза, секретирующей гормон роста, с началом после закрытия эпифизарных пластинок роста, как правило, во взрослом возрасте. Следовательно, рост костей в первую очередь затрагивает плоские кости, такие как череп, нижняя челюсть, грудина, руки и ноги. Часто предъявляемые жалобы связаны с тем, что шапки или перчатки больше не подходят из-за отека рук и головы. Поскольку заболевание связано с образованием гипофиза, гипопитуитаризм может также развиться с вторичными нарушениями репродуктивной функции и зрительными симптомами. В дополнение к росту костей наблюдается рост миокарда, приводящий к бивентрикулярной концентрической гипертрофии и последующей сердечной недостаточности при более позднем заболевании. Поскольку гормон роста противодействует действию инсулина на метаболизм глюкозы и липидов, сахарный диабет 2 типа и гиперлипидемия тесно связаны с этим заболеванием. Лечение состоит из хирургического вмешательства и лучевой терапии, направленной на лежащую в основе аденому, а также симптоматического облегчения вторичных эффектов гормона роста, как указано выше.
Поскольку гормон роста противодействует действию инсулина на метаболизм глюкозы и липидов, сахарный диабет 2 типа и гиперлипидемия тесно связаны с этим заболеванием. Лечение состоит из хирургического вмешательства и лучевой терапии, направленной на лежащую в основе аденому, а также симптоматического облегчения вторичных эффектов гормона роста, как указано выше.
Гигантизм
Это заболевание очень похоже на акромегалию во всех аспектах, за исключением того, что основная аденома гипофиза развивается до закрытия эпифиза длинных костей. Следовательно, рост кости происходит в длинных костях, таких как большеберцовая, малоберцовая, бедренная, плечевая, лучевая и локтевая кости. Поскольку эпифизарное закрытие происходит до наступления взрослой жизни, это заболевание обычно начинается у детей. Органные и метаболические воздействия аналогичны акромегалии.
Дефицит гормона роста
У детей наиболее часто встречается идиопатический дефицит гормона роста. Дефицит гормона роста у взрослых обычно представляет собой совокупность дефицитов гипофиза. Инициирующим событием обычно является аденома гипофиза, скорее всего, пролактинома. Однако причиной могут быть другие методы лечения, такие как лучевая терапия или хирургическое вмешательство. Начало в детском возрасте связано со снижением роста всех структур скелета, что приводит к карликовости. Дефицит гормона роста, возникающий у взрослых, диагностировать труднее, поскольку он не имеет единого патогномоничного признака. Обычно у взрослых наблюдается уменьшение скелетных мышц и увеличение жировой массы во внутренних тканях, а также снижение плотности и ремоделирования кости, что приводит к остеопорозу. Преобладают дислипидемия и резистентность к инсулину, которые приводят к вторичной сердечно-сосудистой дисфункции, депрессивному настроению, повышенной тревожности и упадку сил.[11][12][13]
Дефицит гормона роста у взрослых обычно представляет собой совокупность дефицитов гипофиза. Инициирующим событием обычно является аденома гипофиза, скорее всего, пролактинома. Однако причиной могут быть другие методы лечения, такие как лучевая терапия или хирургическое вмешательство. Начало в детском возрасте связано со снижением роста всех структур скелета, что приводит к карликовости. Дефицит гормона роста, возникающий у взрослых, диагностировать труднее, поскольку он не имеет единого патогномоничного признака. Обычно у взрослых наблюдается уменьшение скелетных мышц и увеличение жировой массы во внутренних тканях, а также снижение плотности и ремоделирования кости, что приводит к остеопорозу. Преобладают дислипидемия и резистентность к инсулину, которые приводят к вторичной сердечно-сосудистой дисфункции, депрессивному настроению, повышенной тревожности и упадку сил.[11][12][13]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Ссылки
- 1.
Baltaci AK, Mogulkoc R, Baltaci SB. Обзор: Роль цинка в эндокринной системе. Пак Дж Фарм Наук. 2019 Январь; 32 (1): 231-239. [PubMed: 30772815]
- 2.
Вандеркуур Дж. А., Бутч Э. Р., Уотерс С. Б., Пессин Дж. Э., Гуан К. Л., Картер-Су С. Сигнальные молекулы, участвующие в соединении рецептора гормона роста с активацией митоген-активируемой протеинкиназы. Эндокринология. 1997 октября; 138 (10): 4301-7. [PubMed: 9322943]
- 3.
Синдром Биндера Г. Нунана, сигнальный путь Ras-MAPK и низкорослость. Горм Рез. 2009 Апрель; 71 Приложение 2: 64-70. [PubMed: 19407499]
- 4.
Al Aboud AM, Zito PM. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 октября 2022 г. Алопеция. [PubMed: 30844205]
- 5.
Хан Ю., Лиман Д.В., Уотлинг Д., Роджерс Н.К., Гронер Б., Керр И.
 М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]
М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]- 6.
Аюк Дж., Шеппард М.С. Гормон роста и его нарушения. Postgrad Med J. 2006 Jan; 82 (963): 24-30. [Статья бесплатно PMC: PMC2563724] [PubMed: 16397076]
- 7.
Lanes R, Hurtado E. Пероральный клонидин — эффективный агент, высвобождающий гормон роста, у субъектов препубертатного возраста. J Педиатр. 1982 г., май; 100 (5): 710-4. [PubMed: 7040621]
- 8.
Стимуляция секреции гормона роста леводопа-пропранолол у детей и подростков. Педиатрия. 1975 августа; 56 (2): 262-6. [PubMed: 169508]
- 9.
Mitchell ML, Byrne MJ, Sanchez Y, Sawin CT. Выявление дефицита гормона роста. N Engl J Med. 1970 05 марта; 282 (10): 539-41. [PubMed: 5413105]
- 10.
Mullis PE. Генетика GHRH, GHRH-рецептора, GH и GH-рецептора: его влияние на фармакогенетику.




 М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]
М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469] Best Pract Res Clin Endocrinol Metab. 2011 Февраль; 25 (1): 25-41. [PubMed: 21396573]
Best Pract Res Clin Endocrinol Metab. 2011 Февраль; 25 (1): 25-41. [PubMed: 21396573]
 М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]
М., Вуд В.И., Старк Г.Р. Участие белков JAK и STAT в индуцированной гормоном роста передаче сигналов. Дж. Биол. Хим. 1996 марта 08; 271 (10): 5947-52. [PubMed: 8621469]