Донаторы оксида азота: Донаторы оксида азота (нитраты), L-аргинин, или ингибиторы синтазы оксида азота при остром инсульте
Альтернативные органическим нитратам доноры оксида азота. Сиднонимины в лечении пациентов с кардиоваскулярной патологией
Резюме. В статье рассмотрены преимущества и ограничения терапии органическими нитратами, а также потенциальные возможности применения альтернативных им доноров оксида азота, в частности производного сиднонимина — молсидомина — у пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью.
Роль оксида азота в кардиоваскулярном гомеостазе
В настоящее время установлена решающая роль эндотелия в регуляции сосудистой функции, а также прямая корреляционная взаимосвязь между риском возникновения сердечно-сосудистых событий и дисфункцией эндотелия (ДЭ) в различных когортах пациентов (Березин А.Е., 2010). Являясь основным регулятором сосудистого гомеостаза, эндотелий контролирует тонус сосудов, поддерживая баланс между вазодилатацией и вазоконстрикцией, а также процессы пролиферации и миграции гладкомышечных клеток, тромбообразования, фибринолиза и многие другие (Задионченко В. С. и соавт., 2002). ДЭ приводит к нарушению этого равновесия и повреждению стенки артерий, являясь ключевым патогенетическим компонентом ишемической болезни сердца (ИБС) и ранним свидетельством атеросклероза уже в доклинической его стадии, предшествующим ангиографическим и ультразвуковым подтверждениям наличия атеросклеротической бляшки (Herman A.G., Moncada S., 2005).
С. и соавт., 2002). ДЭ приводит к нарушению этого равновесия и повреждению стенки артерий, являясь ключевым патогенетическим компонентом ишемической болезни сердца (ИБС) и ранним свидетельством атеросклероза уже в доклинической его стадии, предшествующим ангиографическим и ультразвуковым подтверждениям наличия атеросклеротической бляшки (Herman A.G., Moncada S., 2005).
Основной причиной ДЭ у пациентов с коронарным атеросклерозом является нарушение образования или активности эндотелийзависимого релаксирующего фактора — оксида азота (nitric oxide — NO) — вазодилатирующей субстанции, высвобождаемой эндотелиальными клетками сосудов. В физиологических условиях NO постоянно вовлечен в адаптацию сосудистой системы к повышенным метаболическим потребностям, физическим нагрузкам (Задионченко В.С. и соавт., 2002) и обеспечивает регуляцию тонуса сосудов и антикоагулянтных свойств крови, оказывает влияние на адгезию лейкоцитов, пролиферацию гладкомышечных клеток сосудов и апоптоз (Коваленко В. Н. (ред.), 2008). Основные эффекты NO представлены в таблице.
Н. (ред.), 2008). Основные эффекты NO представлены в таблице.
Таблица. Роль NO в кардиоваскулярном гомеостазе (Задионченко В.С. и соавт., 2002)
| Функция NO | Эффекты NO |
|---|---|
| Расслабление гладкомышечных клеток | Вазодилатация, снижение общего периферического сопротивления сосудов |
| Ингибирование пролиферации и миграции гладкомышечных клеток | Торможение ремоделирования сосудов |
| Ингибирование адгезии и миграции моноцитов | Антиатерогенный, противовоспалительный |
| Торможение адгезии и агрегации тромбоцитов | Антиагрегационный |
| Антиоксидантное действие | Антиатерогенный |
Снижение биологической доступности NO для эндотелиоцитов негативно отражается на вазодилатирующей способности сосудов и вносит важный вклад в прогрессирование многих кардиоваскулярных заболеваний, в частности ИБС и сердечной недостаточности (СН) (Березин А. Е., 2010). В связи с этим неотъемлемой частью терапии пациентов с данной патологией является применение доноров NO (органических нитратов, сиднониминов).
Е., 2010). В связи с этим неотъемлемой частью терапии пациентов с данной патологией является применение доноров NO (органических нитратов, сиднониминов).
Органические нитраты: преимущества и ограничения применения
Благодаря снижению потребности миокарда в кислороде и увеличению притока крови к ишемизированной области органические нитраты (глицерола тринитрат (нитроглицерин), изосорбида динитрат и его природный активный метаболит изосорбида-5-мононитрат) сохраняют свои позиции среди основных антиангинальных лекарственных средств. Основным эффекторным субстратом нитратов является NO, что обусловливает их способность частично восполнять его недостаток у пациентов с ИБС (Аронов Д.М., Лупанов В.П., 2005).
Являясь пролекарствами, нитраты становятся активными после ряда метаболических превращений. Внутри гладкомышечной клетки сосуда они взаимодействуют с сульфгидрильными (тиоловыми, -SH) группами эндогенных нитратных рецепторов, в результате чего происходит высвобождение NO. Последний активирует растворимую гуанилатциклазу, что приводит к повышению образования циклического гуанозинмонофосфата (цГМФ) в гладкомышечных клетках и тромбоцитах и далее — к снижению содержания внутриклеточной концентрации ионизированного кальция, расслаблению гладких мышц сосудов и вазодилатации, а также торможению активности тромбоцитов и макрофагов (Задионченко В.С. и соавт., 2002; Окороков А.Н., 2002; Аронов Д.М., Лупанов В.П., 2005).
Последний активирует растворимую гуанилатциклазу, что приводит к повышению образования циклического гуанозинмонофосфата (цГМФ) в гладкомышечных клетках и тромбоцитах и далее — к снижению содержания внутриклеточной концентрации ионизированного кальция, расслаблению гладких мышц сосудов и вазодилатации, а также торможению активности тромбоцитов и макрофагов (Задионченко В.С. и соавт., 2002; Окороков А.Н., 2002; Аронов Д.М., Лупанов В.П., 2005).
При применении в низких дозах нитропрепараты вызывают расширение преимущественно сосудов венозного русла, что приводит к депонированию крови в венах и снижению преднагрузки на сердце, давления в камерах сердца (в частности конечно-диастолического давления в полости левого желудочка), систолического напряжения его стенок. Вследствие этого потребность миокарда в кислороде снижается, а его перфузия улучшается, особенно в субэндокардиальных отделах. При применении в высоких дозах нитропрепараты влияют преимущественно на крупные артерии, включая коронарные сосуды сердца. Селективная дилатация именно крупных коронарных сосудов является важнейшим фактором оптимизации миокардиального кровотока в ишемизированных зонах (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
Селективная дилатация именно крупных коронарных сосудов является важнейшим фактором оптимизации миокардиального кровотока в ишемизированных зонах (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
Наряду с вазодилатацией нитраты обладают антитромбоцитарной и антитромботической активностью, проявляющейся в снижении агрегации тромбоцитов, их адгезии и дисперсии образующихся скоплений тромбоцитов (Мельник М.В., 2009).
Высокая антиангинальная эффективность позволяет применять органические нитраты практически при всех формах ИБС, в том числе стабильной стенокардии напряжения. При этом значительно уменьшается количество приступов стенокардии, повышается толерантность к физической нагрузке. Однако следует отметить, что применение нитратов показано далеко не всем пациентам с ИБС. Так, у около 10% больных стабильной стенокардией применение нитратов неэффективно и еще у 10% — сопровождается развитием побочных эффектов, требующих их отмены (Коваленко В. Н. (ред.), 2008).
Н. (ред.), 2008).
Проблема толерантности к нитратам и пути ее преодоления
Основным ограничением, связанным с непрерывным применением нитратов, является развитие толерантности к ним, проявляющейся в снижении или полном исчезновении терапевтического эффекта у значительной части пациентов. Например, эффективность лечения при постоянном применении изосорбида динитрата в дозе 10–20 мг 4 раза в сутки в течение 1 мес остается стабильной лишь у 10–15%, значительно снижается — у 60–70% и сопровождается полной потерей антиангинального эффекта у 10–15% пациентов со стабильной стенокардией (Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010). Обычно толерантность развивается при длительном, регулярном и частом применении нитратов, особенно в высоких дозах. В некоторых случаях возможно возникновение толерантности после применения лишь нескольких доз нитратов.
В настоящее время установлено, что постоянно высокий уровень нитратов в крови приводит к насыщению их рецепторов в гладких мышцах сосудов, снижению количества доступных SH-групп, обеспечивающих ферментативное превращение молекул нитратов в NO, в связи с чем реактивность сосудов и вазодилатирующий эффект препаратов снижаются (Окороков А. Н., 2002). Свободнорадикальная гипотеза предполагает, что толерантность к нитратам обусловлена повышением продукции эндотелием сосудов супероксидного аниона, инактивирующего высвобождение NO из органических нитратов, что приводит к утрате способности реагировать на лечение (Herman A.G., Moncada S., 2005). В настоящее время существуют четкие доказательства негативного влияния нитратов на функционирование NO-синтазы (NOS) — фермента, отвечающего за эндотелиальный контроль сосудистого тонуса. В экспериментах in vitro установлено повышение экспрессии NOS при сниженной ее активности в течение продолжительной терапии нитроглицерином, ассоциированное с повышением образования супероксидного аниона (Бабушкина А.В., 2011).
Н., 2002). Свободнорадикальная гипотеза предполагает, что толерантность к нитратам обусловлена повышением продукции эндотелием сосудов супероксидного аниона, инактивирующего высвобождение NO из органических нитратов, что приводит к утрате способности реагировать на лечение (Herman A.G., Moncada S., 2005). В настоящее время существуют четкие доказательства негативного влияния нитратов на функционирование NO-синтазы (NOS) — фермента, отвечающего за эндотелиальный контроль сосудистого тонуса. В экспериментах in vitro установлено повышение экспрессии NOS при сниженной ее активности в течение продолжительной терапии нитроглицерином, ассоциированное с повышением образования супероксидного аниона (Бабушкина А.В., 2011).
Следует отметить, что толерантность к нитратам соответствует всем критериям ДЭ. В ряде рандомизированных клинических исследований показано, что продолжительный прием нитроглицерина ухудшает эндотелийзависимую вазодилатацию у пациентов с ИБС и здоровых лиц как в коронарной, так и периферической артериальной циркуляции (Бабушкина А. В., 2011).
В., 2011).
В течение нескольких последних десятилетий очевидная клиническая значимость данного феномена поддерживает неугасающий интерес к подробному изучению механизмов, лежащих в его основе, и активному поиску наиболее эффективных путей решения проблемы.
Установлено, что применение нитратов в более высоких дозах эффективно лишь в течение нескольких дней, после чего толерантность возобновляется (Окороков А.Н., 2002). Предотвратить снижение терапевтического эффекта нитратов удается путем прерывистого их применения — обеспечения ежедневных безнитратных периодов продолжительностью 8–12 ч/сут (как правило, в ночное время). Однако в этот период не исключено развитие у пациентов спазма коронарных артерий в результате синдрома отмены (рикошетная стенокардия) (Fox K. et al., 2006; Коваленко В.Н. (ред.), 2008; Лутай М.І. та співавт., 2010).
Альтернативные доноры оксида азота. Молсидомин
В качестве альтернативы или дополнения к терапии органическими нитратами рассматривают производные сиднонимина, наиболее изученным представителем которых является молсидомин. Разработанные в Японии, первоначально они были предложены в качестве антигипертензивных средств (Lablanche J.M. et al., 1997). В странах Европы их применяют для лечения больных со стабильной стенокардией с 70-х годов XX в. (Herman A.G., Moncada S., 2005).
Разработанные в Японии, первоначально они были предложены в качестве антигипертензивных средств (Lablanche J.M. et al., 1997). В странах Европы их применяют для лечения больных со стабильной стенокардией с 70-х годов XX в. (Herman A.G., Moncada S., 2005).
Отметим, что производные сиднонимина обладают уникальной способностью к реализации вазодилатирующего потенциала за счет реверсии ДЭ фактически при любом исходном уровне продукции NO, а также при высокой активности супрессантов его синтеза (Березин А.Е., 2010).
Основной механизм антиангинального действия молсидомина заключается в уменьшении преднагрузки на серце и благоприятном влиянии на метаболизм миокарда, в результате чего его потребность в кислороде резко снижается. Молсидомин снижает венозное давление, конечное диастолическое давление в желудочках и давление в легочной артерии, расширяет крупные коронарные артерии, а также улучшает коллатеральное кровообращение при атеросклерозе коронарных сосудов (Компендиум 2010 — лекарственные препараты, 2010).
После приема внутрь молсидомин метаболизируется в печени, превращаясь в фармакологически активное производное SIN-1, из которого неэнзимным путем образуется нестойкое соединение SIN-1А, содержащее свободную фармакологически активную группу NO и разлагающееся в крови и тканях до фармакологически неактивного SIN-1С (Компендиум 2010 — лекарственные препараты, 2010). Самопроизвольное отщепление NO в процессе этих превращений, аналогично действию органических нитратов, последовательно приводит к расслаблению гладких мышц сосудов и вазодилатации (Kmieć M., Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010).
В то же время молекулярный механизм вазодилатирующего действия сиднониминов имеет немаловажное отличие от соответствующего механизма действия нитратов: отсутствие предварительного взаимодействия с SH-группами для активации цГМФ (Бабушкина А.В., 2011). В связи с этой особенностью молсидомина клинически значимая толерантность к нему не развивается (Компендиум 2010 — лекарственные препараты, 2010).
У пациентов с ангиографически подтвержденной ИБС во время продолжительной (в течение 4 нед) терапии молсидомином в дозе 4 мг 3 раза в сутки per os при повышении работоспособности и лучшей переносимости пациентами физической нагрузки развития толерантности не выявлено (Jansen W. et al., 1987).
SIN-1 сохраняет вазодилатирующую активность даже у пациентов с доказанной толерантностью к органическим нитратам, что является отражением протекторного влияния препарата в отношении сосудистого эндотелия. Его внутривенное или интракоронарное введение оказывает быстрый вазодилатирующий эффект, не сопровождающийся синдромом обкрадывания (Березин А.Е., 2010).
Результаты повторной коронарной ангиографии в нескольких проекциях до и через 2 мин после внутрикоронарного введения SIN-1 в дозе 1 мг, а также до и после второй инъекции 60 мин позднее показали увеличение среднего диаметра 44 нормальных сегментов левой коронарной артерии на 12% (р<0,001) непосредственно после введения SIN-1, и на 8% — спустя 60 мин (Serruys P. W. et al., 1987).
W. et al., 1987).
В рандомизированном двойном слепом плацебо-контролируемом исследовании применение у пациентов с ИБС молсидомина per os в дозе 12 мг/сут в течение 48 ч увеличило на 60% поток-опосредованную дилатацию (flow-mediated dilation) сосудов после первого приема препарата (Herman A.G., Moncada S., 2005).
Результаты клинических испытаний подтверждают лучшую переносимость молсидомина по сравнению с нитроглицерином при одинаково выраженной эффективности обоих препаратов у пациентов с острым инфарктом миокарда и нестабильной стенокардией (Kmieć M., Ochmański W., 1998).
В двойном слепом перекрестном сравнении с плацебо молсидомин в дозе 2 мг 3 раза в сутки снижал частоту приступов стенокардии и применения нитроглицерина в таблетках у пациентов со стабильной стенокардией, а во время нагрузочного тестирования на тредмиле показал статистически значимое уменьшение депрессии сегмента ST на электрокардиограмме (ЭКГ) в течение около 6 ч. Исследователи пришли к выводу, что действие молсидомина в предотвращении симптомов стенокардии подобно таковому нитроглицерина, однако его эффект более продолжителен (Majid P. A., 1980).
A., 1980).
Терапия молсидомином снижала частоту эпизодов стенокардии, а также необходимость сублингвального применения изосорбида динитрата у пациентов со стабильной стенокардией по сравнению с плацебо (Messin R. et al., 2005; Ben-Dor I., Battler A., 2007).
Сопоставимый антиишемический эффект препаратов молсидомина и изосорбида динитрата с замедленным высвобождением показан при их кратковременном применении в дозе 8 и 40 мг 3 раза в сутки соответственно у пациентов с ИБС и стабильной стенокардией (Wagner F. et al., 1991). Эффективность и продолжительность антиангинального действия пролонгированных форм этих препаратов в дозе 8 и 20 мг соответственно оценены в серии симптом-ограниченных тестовых упражнений у пациентов со стенокардией напряжения до начала лечения и через 1, 4 и 8 ч после применения препаратов или плацебо. Через 1 ч после приема молсидомина отмечено значительно более позднее появление и меньшая выраженность признаков ишемии на ЭКГ. Кроме того, период, свободный от приступов стенокардии, увеличился. Через 4 ч оба препарата значительно задерживали появление стенокардии и депрессии сегмента ST (Ruano J. et al., 1988).
Через 4 ч оба препарата значительно задерживали появление стенокардии и депрессии сегмента ST (Ruano J. et al., 1988).
R. Messin и соаторы (1998) в многоцентровом рандомизированном двойном слепом перекрестном плацебо-контролируемом исследовании сравнивали эффективность применения изосорбида динитрата, обычной (в дозе 4 мг 3 раза в сутки) и пролонгированной (в дозе 8 мг 2 раза в сутки) формы молсидомина в течение 6 нед у 90 пациентов со стабильной стенокардией. Отмечено значительное повышение работоспособности по сравнению с исходным уровнем и плацебо до 8 и 12 ч после применения обычной и ретардной формы молсидомина соответственно, а также значительное уменьшение депрессии сегмента ST на ЭКГ. Эти эффекты оставались значительно выраженными после 6 нед лечения, а частота приступов стенокардии и необходимости в сублингвальном приеме нитратов значительно снизились. Однако в целом результаты показали, что ретардная форма уменьшает выраженность ишемии миокарда более эффективно, имеет более продолжительный эффект в отношении толерантности к физической нагрузке, поддерживаемый на высоком уровне после 6-недельного лечения.
У пациентов с тяжелой ИБС проведено исследование гемодинамического эффекта разовой дозы молсидомина внутривенно во время приступа стенокардии, индуцированного ходьбой, и после введения молсидомина — во время ходьбы на скорость, провоцирующей развитие приступа. Приступов стенокардии, а также существенных изменений систолического артериального давления после введения молсидомина не последовало, конечно-диастолическое давление левого желудочка резко снизилось, показатели коронарного кровотока и потребления кислорода миокардом превысили контрольные уровни на 38 и 33% соответственно (при 58,3% во время приступа стенокардии) (Crexells C. et al., 1985).
В двойном слепом перекрестном клиническом испытании с фиксированными дозами сравнивали антиангинальную эффективность молсидомина и пропранолола у пациентов с умеренно выраженной стабильной стенокардией и объективными признаками коронарного атеросклероза. Частота приступов стенокардии во время лечения молсидомином статистически не отличалась от таковой при терапии пропранололом, оба препарата повышали толерантность к физической нагрузке, а нежелательные эффекты были незначительными. Несмотря на то что пропранолол показал бо`льшую эффективность в снижении потребности пациентов в нитроглицерине, молсидомин был рекомендован в качестве эффективного антиангинального средства и полезного дополнения к уже применяющимся с этой целью препаратам (Balakumaran K. et al., 1983). Аналогичная точка зрения высказана H. Schmutzler (1985), описавшем терапевтический эффект молсидомина и более низкую частоту побочных эффектов в сравнении с нитратами.
Несмотря на то что пропранолол показал бо`льшую эффективность в снижении потребности пациентов в нитроглицерине, молсидомин был рекомендован в качестве эффективного антиангинального средства и полезного дополнения к уже применяющимся с этой целью препаратам (Balakumaran K. et al., 1983). Аналогичная точка зрения высказана H. Schmutzler (1985), описавшем терапевтический эффект молсидомина и более низкую частоту побочных эффектов в сравнении с нитратами.
В проспективном многоцентровом рандомизированном испытании ACCORD (Angioplastic Coronaire Corvasal Diltiazem) (1997) изучено влияние внутривенного введения SIN-1 с последующим применением молсидомина/дилтиазема per os в течение 6 мес на просвет коронарных артерий и прогноз у 700 пациентов со стабильной стенокардией, перенесших избирательную перкутанную транслюминальную коронарную ангиопластику (Percutaneous Transluminal Cardiac Angioplasty — PTCA). Результаты показали, что при отсутствии влияния на прогноз, SIN-1 и молсидомин в большей степени увеличивали просвет коронарных артерий и снижали частоту рестенозов по сравнению с дилтиаземом (Lablanche J. M. et al., 1997).
M. et al., 1997).
Антитромбоцитарные свойства молсидомина и его активного метаболита SIN-1A изучены в результате применения per os у здоровых добровольцев и внутривенно — у пациентов с инфарктом миокарда (Wautier J.L. et al., 1989), а также в сравнении с аналогичными свойствами изосорбида-5-мононитрата и плацебо у здоровых добровольцев (Drummer C. et al., 1991). Агрегация тромбоцитов ex vivo измерена у них до и через 30 и 60 мин после приема 4 мг молсидомина/20 мг изосорбида-5-мононитрата/плацебо. В отличие от изосорбида-5- мононитрата, через 30 и 60 мин после применения молсидомина отмечено значительное (на 100 и 120% соответственно) повышение пороговых доз фактора активации тромбоцитов (рlatelet-activating factor — PAF), вызывавших их необратимую агрегацию, и значительное снижение кривых агрегации (р<0,01).
Применение молсидомина оказывает благоприятный эффект у пациентов с гипертонической болезнью (Kmieć M., Ochmański W., 1998). В двойном слепом контролируемом испытании J. Milei и соавторов (1980) отмечено дозозависимое антигипертензивное действие терапии молсидомином в течение 1 мес. Разовая доза препарата 4 мг существенно снижала систолическое, диастолическое и среднее артериальное давление у пациентов с артериальной гипертензией в течение около 8 ч. У пациентов с ИБС однократный прием молсидомина в дозе 4 мг снижал среднее артериальное давление в покое на 12%, при субмаксимальной физической нагрузке — на 8% (Jansen W. et al., 1987).
Milei и соавторов (1980) отмечено дозозависимое антигипертензивное действие терапии молсидомином в течение 1 мес. Разовая доза препарата 4 мг существенно снижала систолическое, диастолическое и среднее артериальное давление у пациентов с артериальной гипертензией в течение около 8 ч. У пациентов с ИБС однократный прием молсидомина в дозе 4 мг снижал среднее артериальное давление в покое на 12%, при субмаксимальной физической нагрузке — на 8% (Jansen W. et al., 1987).
Предполагают также, что метаболит молсидомина SIN-1С обладает иммуномодулирующими свойствами, что может благоприятно влиять на течение иммунных процессов в очаге некроза при инфаркте миокарда (Мельник М.В., 2009).
Как и органические нитраты, сиднонимины эффективны у пациентов с хронической СН, обусловленной ишемической кардиомиопатией, дилатационной кардиомиопатией, а также при легочной гипертензии у пациентов с хронической обструктивной болезнью легких и застойной СН (Kmieć M., Ochmański W., 1998; Компендиум 2010 — лекарственные препараты, 2010). У пациентов с застойной СН возможно применение молсидомина в качестве дополнения к терапии ингибиторами ангиотензинпревращающего фермента (АПФ), диуретиками, сердечными гликозидами, блокаторами β-адренорецепторов в случаях ее недостаточной эффективности (Мельник М.В., 2009).
У пациентов с застойной СН возможно применение молсидомина в качестве дополнения к терапии ингибиторами ангиотензинпревращающего фермента (АПФ), диуретиками, сердечными гликозидами, блокаторами β-адренорецепторов в случаях ее недостаточной эффективности (Мельник М.В., 2009).
В исследовании А. Spring и соавторов (1998) отмечено значительное (с 33,8 до 44,8%; р<0,05) увеличение фракции выброса левого желудочка после 3 мес терапии молсидомином в дозе 2 мг 3 раза в сутки с сохранением предшествующего лечения (ингибиторы АПФ, диуретики и сердечные гликозиды) у 30 пациентов с хронической СН III и IV функционального класса по NYHA (New York Heart Association).
Таким образом, перечисленные свойства молсидомина позволяют применять его при ИБС — для профилактики приступов стенокардии (особенно у пациентов пожилого возраста и при индивидуальной непереносимости нитратов), а также в составе комбинированной терапии хронической СН. Уменьшение количества приступов стенокардии в течение суток вплоть до полного их устранения на фоне терапии молсидомином дает возможность пациентам сохранять не только повседневную, но и во многих случаях профессиональную активность, если она не связана с тяжелым физическим трудом, а положительная динамика физического и психологического статуса способствует существенному улучшению качества их жизни.
Литература
І.Б. Щербак
Резюме. У статті розглянуто переваги та обмеження терапії органічними нітратами, а також потенціальні можливості застосування альтернативних їм донорів оксиду азоту, а саме похідного сидноніміну — молсидоміну — у пацієнтів з ішемічною хворобою серця та хронічною серцевою недостатністю.
Ключові слова: ішемічна хвороба серця, хронічна серцева недостатність, стенокардія, антиангінальна терапія, органічні нітрати, дисфункція ендотелію,оксид азоту, толерантність до нітратів, молсидомін, Сиднофарм.
I.B. Shcherbak
Summary. The article discusses the advantages and limitations of organic nitrates therapy, as well as the potential use of alternative donors of nitric oxide, in particular sidnonimine derivate — molsidomin — in patients with coronary heart disease and chronic heart failure.
Key words: coronary heart disease, chronic heart failure, angina, antianginal therapy, organic nitrates, endothelial dysfunction, nitric oxide, nitrate tolerance, molsidominе, Sydnopharm.
от механизма действия к фармакологическим эффектам при цереброваскулярных заболеваниях
Впервые о роли эндотелия в регуляции сосудистого тонуса было заявлено в статье R. Furchott и J. Zawadzki, опубликованной в журнале «Nature» в 1980 г. [1], что привело к началу изучения свойств оксида азота (NO) — эндотелиального фактора релаксации, который является уникальным биологическим медиатором, вовлеченным во множество физиологических и патофизиологических процессов. В организме существует три основные формы: нейтрально заряженный относительно стабильный радикал — NO•, нитроксил-анион — NO–, ион нитрозония — NO+, обладающие различными свойствами и биологической активностью [2].
По химической структуре NO — это лабильная газообразная субстанция, высвобождаемая эндотелиальными клетками во время катаболизма L-аргинина при активном участии NO-синтазы (NOS) [3]. Синтезированный NO стимулирует растворимую гуанилатциклазу, что ведет к образованию циклического гуанозинмонофосфата (цГМФ), который реализует свое действие на клетках-мишенях. По механизму отрицательной обратной связи NO влияет на активность NOS [4].
По механизму отрицательной обратной связи NO влияет на активность NOS [4].
NOS является семейством гемопротеиновых ферментов, различающихся по аминокислотной последовательности белковой части молекулы и механизмам, которые регулируют их активность [5]. Основная биологическая роль NOS заключается в синтезе NO клеточными популяциями, из которых наиболее изученными являются эндотелий кровеносных сосудов, нейроны и макрофаги.
В зависимости от типа клеток выделены три основные изоформы NOS: эндотелиальная (eNOS), нейрональная (nNOS) и индуцибельная (iNOS). При этом eNOS и nNOS постоянно присутствуют в цитоплазме клеток, а iNOS появляется при воздействии определенных факторов (например, провоспалительных медиаторов) [6]. Таким образом, NO обладает рядом уникальных свойств: способностью синтезироваться в случае необходимости различными клеточными популяциями и оказывать наряду с паракринным действием дистантное [7].
NO имеет решающее значение в регуляции мозгового кровообращения. Снижение его уровня в эндотелии церебральных сосудов под влиянием тех или иных факторов вызывает существенные изменения их функций и системы кровообращения в целом. Например, снижение эффектов эндотелийзависимых вазодилататоров и повышение вазоконстрикторных влияний, рост артериального давления, нарушения системной и регионарной гемодинамики, увеличение экспрессии адгезивных молекул эндотелия, адгезию и агрегацию тромбоцитов к сосудистой стенке и т. д. [8].
Снижение его уровня в эндотелии церебральных сосудов под влиянием тех или иных факторов вызывает существенные изменения их функций и системы кровообращения в целом. Например, снижение эффектов эндотелийзависимых вазодилататоров и повышение вазоконстрикторных влияний, рост артериального давления, нарушения системной и регионарной гемодинамики, увеличение экспрессии адгезивных молекул эндотелия, адгезию и агрегацию тромбоцитов к сосудистой стенке и т. д. [8].
Физиологическая роль NO в центральной нервной системе сводится не только к вазодилатирующему действию, но и к участию в межнейрональных синаптических контактах. Обладая нейротрансмиттерной активностью, NO синтезируется при возбуждении нейронов в ответ на поступление ионов Са2+, затем проникает в соседние клетки, активирует синтез цГМФ и изменяет электрогенез нейронов [9].
В патологических условиях, например при церебральной ишемии, наблюдается взаимодействие между циклами NO и супероксида (O2–), которые взаимосвязаны и развиваются одновременно [10]. Описывая взаимодействие этих циклов, важно выделить их роль в компенсаторно-приспособительных реакциях организма и подчеркнуть универсальные механизмы регуляции физиологических функций и метаболических процессов в клетках.
Описывая взаимодействие этих циклов, важно выделить их роль в компенсаторно-приспособительных реакциях организма и подчеркнуть универсальные механизмы регуляции физиологических функций и метаболических процессов в клетках.
Активные формы кислорода (АФК) и азота (АФА) являются свободными радикалами (супероксидный анион (O2•–), гидроксильный радикал (ОH•), оксид азота (NO•) и липидные радикалы (R•, RО•, RОО•)) [11]. Существенную роль в патологических процессах играют АФА и их метаболиты [12]. К АФА, помимо NO•, NO–, NO+, относят пероксинитрит (ONOO—), диоксид азота (NO2•), нитрит анион (NO2–).
NО и его метаболиты обладают прооксидантными свойствами [13], вызывают перекисное окисление фосфолипидов и белков митохондриальных мембран, приводя к высвобождению в цитозоль апоптогенных факторов. Ведущая роль принадлежит ONOO–, который характеризуется способностью легко проникать через клеточные мембраны, повреждая эндотелиоциты и увеличивая агрегацию тромбоцитов. Токсическое действие ONOO– связано с его концентрацией: при низких содержаниях реализуется цитопротективное свойство, при высоких — деструктивное, приводящее к перекисному окислению липидов [14].
Токсическое действие ONOO– связано с его концентрацией: при низких содержаниях реализуется цитопротективное свойство, при высоких — деструктивное, приводящее к перекисному окислению липидов [14].
В противовес АФК и АФА с прооксидантными эффектами в организме существует система антиоксидантной биологической защиты, ключевым ферментом которой является супероксиддисмутаза (SOD), преимущественно митохондриальная и цитоплазматическая изоформы (Mn-SOD и Cu-Zn-SOD) [15]. В присутствии высокой концентрации NO• SOD может образовывать ОNОO–, который способен ингибировать Cu-Zn-SOD и Mn-SOD. ОNОO– с помощью нитритредуктаз может восстанавливаться в NО. В результате нитритредуктазных реакций отмечается снижение концентраций токсичных форм азота [16]. Антиоксидантное действие NO связано с ингибированием ионами Fe3+ оксидантных реакций. В физиологических концентрациях NO связывается со свободными и входящими в состав гема ионами Fe2+ и ингибирует разложение перекисей (реакция Фентона).
Таким образом, существующие взаимосвязи и взаимозависимости прооксидантных и антиоксидантных систем реализуют свое действие при участии NО, O2– и их метаболитов.
Прямые эффекты NO преобладают в организме при физиологических условиях, когда NO в низких концентрациях синтезируется nNOS и еNOS для реализации регуляторной и сигнальной функций. Непрямое действие NO опосредуется через реактивные формы и проявляется при увеличении его синтеза, связанного с индукцией iNOS, которая наблюдается при воспалительных процессах различной этиологии и играет важную роль в патофизиологических механизмах церебральной ишемии, инсульта и других цереброваскулярных заболеваний [17].
Роль NO в механизмах уменьшения нейронального повреждения при гипоксии не однозначна. В ответ на гипоксию увеличивается содержание nNOS и iNOS, а количество eNOS в сосудах головного мозга снижается вследствие увеличения продукции АФК [18]. В дальнейшем на ранней стадии воспаления под действием провоспалительных медиаторов продолжается стимуляция продукции NO с участием nNOS. Параллельно усиливается активность еNOS, что вызывает расслабление гладкомышечных клеток сосудов и увеличение сосудистой проницаемости, способствуя экссудации жидкости. В развитие поздней фазы воспаления вносит вклад только NO, продуцируемый с помощью iNOS. На данной стадии воспалительного процесса NO стимулирует синтез и высвобождение провоспалительных цитокинов, которые запускают миграцию макрофагов в очаг воспаления [19—22].
Параллельно усиливается активность еNOS, что вызывает расслабление гладкомышечных клеток сосудов и увеличение сосудистой проницаемости, способствуя экссудации жидкости. В развитие поздней фазы воспаления вносит вклад только NO, продуцируемый с помощью iNOS. На данной стадии воспалительного процесса NO стимулирует синтез и высвобождение провоспалительных цитокинов, которые запускают миграцию макрофагов в очаг воспаления [19—22].
Каскад патологических реакций, наблюдаемых при недостаточности мозгового кровообращения, многообразен и сложен, а его реализация осуществляется на молекулярном и функциональном уровнях. Особая роль принадлежит циклам NO и O2–, взаимодействие которых обусловливает направленность реакций. NO в зависимости от системы окислительного метаболизма может стимулировать окисление, являясь мощным прооксидантом, и обладать антиоксидантной активностью за счет образования метаболитов. Про- и антиоксидантные эффекты NO имеют важное значение в развитии механизмов ишемического поражения головного мозга.
В основе патогенетических механизмов недостаточности мозгового кровообращения лежит «ишемический каскад» реакций [23], включающий снижение мозгового кровотока, который приводит к нарастанию глутаматной эксайтотоксичности, накоплению Са2+ и лактатацидозу, что способствует активации протеолиза, возникновению и прогрессированию оксидантного стресса, экспрессии генов раннего реагирования с развитием депрессии пластических белков и снижению энергетических процессов, вызывающих гибель клетки [24—26].
Главная роль в формировании патологических реакций при цереброваскулярной недостаточности, развивающейся на фоне атеросклеротического поражения магистральных артерий головы и артериальной гипертензии, принадлежит сосудистой системе. Атеросклеротический процесс вызывает изменения мозгового кровообращения, приводит к стенозированию и окклюзии магистральных артерий головы, ухудшает возможности коллатерального перераспределения крови, увеличивает мозговое периферическое сосудистое сопротивление, снижает церебральную перфузию, вызывает кислородное и энергетическое голодание нейронов. Поражение сосудов головного мозга при артериальной гипертензии включает целый комплекс нарушений: извитость и стеноз сонных и позвоночных артерий, утолщение комплекса интима—медиа, изменения цереброваскулярной реактивности [27].
Поражение сосудов головного мозга при артериальной гипертензии включает целый комплекс нарушений: извитость и стеноз сонных и позвоночных артерий, утолщение комплекса интима—медиа, изменения цереброваскулярной реактивности [27].
Объединяющим звеном в патогенезе атеросклероза и артериальной гипертензии является эндотелиальная дисфункция (ЭД), которая характеризуется дисбалансом медиаторов, вырабатываемых эндотелиоцитами или проявляющих свою активность на поверхности эндотелия [28]. ЭД следует рассматривать в качестве предиктора развития цереброваскулярных расстройств [29].
Имеется расхождение в терминологии хронической цереброваскулярной болезни (ХЦВБ). В современной литературе описание данной патологии ассоциировано с сосудистыми когнитивными расстройствами [30]. В отечественной неврологии ХЦВБ является распространенным диагнозом и, согласно статистике, встречается в 75% случаев всех цереброваскулярных заболеваний [31, 32]. Столь высокий процент объясняется «маскировкой» тревожных и депрессивных расстройств, первичных головных болей, периферической вестибулопатии, болезни Альцгеймера симптомами ХЦВБ, которые плохо диагностируются и требуют отдельного подхода к лечению.
Актуальной проблемой клинической фармакологии стал поиск препаратов с эндотелиопротективным действием. На сегодняшний день известно о положительном влиянии на функциональное состояние эндотелия препаратов различных фармакологических групп, среди которых L-аргинин, донаторы NO и др. Группы этих препаратов не нашли широкого клинического применения и не доказали своей эффективности в клинической практике. Для коррекции нарушенных функций эндотелия применяются кардиотропные препараты, у которых эндотелиопротективное действие является важным дополнительным, но не основным действием.
Ингибиторы ангиотензинпревращающего фермента (иАПФ). Обладают прямым влиянием на активность NOS, тем самым нивелируют Э.Д. Способствуют уменьшению уровня ангиотензина II (индуктор окcидантного стресса) и повышению активности кининов (брадикинина — стимулятора высвобождения NO, простациклина). Некоторые представители иАПФ (лизиноприл) имеют антиоксидантную, антитромботическую активности.
Блокаторы АТ1-рецепторов. При увеличенной продукции ангиотензина II в условиях блокады АТ1-рецепторов создаются условия для стимуляции рецепторов АТ2. Это может привести к вазодилатации и подавлению пролиферации через повышенный синтез NO и систему брадикинина. Блокаторы АТ1-рецепторов оказывают благоприятное воздействие на метаболический профиль, в том числе на процессы оксидативного стресса.
Антагонисты кальция. Обладают выраженными эндотелиопротективными, антиоксидантными свойствами. Положительно влияют на показатели различных звеньев гемостаза.
Тиазидные диуретики. Повышают активность nNOS и eNOS. Обладают антиоксидантными свойствами и прямым вазодилатирующим действием за счет повышения биодоступности NO и уменьшения его разрушения.
Фибраты. Снижают активность воспаления в сосудистой стенке, восстанавливают барьерную функцию эндотелия. Обладают антиоксидантным действием; благоприятно влияют на гемостаз.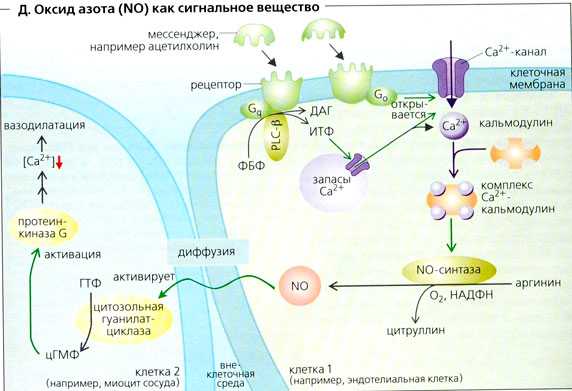
cтатины. Улучшают эндотелийзависимую вазодилатацию, уменьшают жесткость сосудистой стенки.
Антиагреганты (ацетилсалициловая кислота). В основе ее антиагрегантного действия лежит необратимое связывание фермента циклооксигеназы-1 тромбоцитов с последующим уменьшением синтеза индукторов агрегации тромбоцитов: простагландинов и тромбоксана А2, дополнительно являющегося мощным вазоконстриктором. Альтернативные механизмы действия ацетилсалициловой кислоты препятствуют окислению липопротеидов высокой плотности, уменьшают образование свободных радикалов. Доказано снижение частоты сердечно-сосудистых осложнений у пациентов с артериальной гипертензией и ишемической болезнью сердца за счет способности ацетилсалициловой кислоты восстанавливать эндотелийзависимую вазодилатацию.
Не считая сердечно-сосудистых средств с эндотелиопротективным действием, других эффективных препаратов для коррекции ЭД при цереброваскулярных заболеваниях с доказанной клинической эффективностью относительно немного. Исходя из важной роли эндотелиальной системы в развитии цереброваскулярных расстройств, с одной стороны, и отсутствия специфических средств профилактики и лечения ЭД — с другой, следует считать целесообразным и актуальным дальнейший поиск лекарственных средств с эндотелиопротективным действием [33].
Исходя из важной роли эндотелиальной системы в развитии цереброваскулярных расстройств, с одной стороны, и отсутствия специфических средств профилактики и лечения ЭД — с другой, следует считать целесообразным и актуальным дальнейший поиск лекарственных средств с эндотелиопротективным действием [33].
К препаратам с доказанной эндотелиопротективной активностью относится диваза, способная дополнительно решать проблему сосудистых когнитивных расстройств.
В состав дивазы входят релиз-активные формы антител к белку S100 (РА АТ S100) и еNOS (РА АТ еNOS). Получение Р.А. АТ осуществляется с применением принципиально новой технологии (US Patent 8,535,664 B2, 2013), обеспечивающей наличие у таких форм общего отличительного свойства — способности оказывать модифицирующее действие на исходное вещество (или структурно схожие биологические молекулы) посредством изменения его пространственной структуры, что влечет изменение физических, химических и биологических свойств [34].
Молекулярной мишенью РА АТ S100 является белок S100, участвующий в регуляции разнообразных внутриклеточных процессов: в передаче внутриклеточного сигнала, роста, дифференцировки, апоптоза нейронов и глии, поддержании энергетического метаболизма клеток [35, 36], а также осуществляющий в головном мозге сопряжение синаптических (информационных) и метаболических процессов. Влияние Р.А. АТ S100 способствует более стабильному связыванию белка S100 c Сa2+, что запускает ток Na+ внутрь клетки, а Cа2+ — вовне´ [37]. Изменение трансмембранного потенциала генерирует потенциал действия, в результате чего нервный импульс распространяется к соседним нейронам. Показано модулирующее влияние РА АТ S100 на синаптическую передачу различных рецепторов, в том числе ГАМК, серотониновых, σ1-, NMDA. РА АТ S100, оказывая ГАМК-миметическое и нейротрофическое действие, повышают активность стресс-лимитирующих систем, способствуют восстановлению процессов нейрональной пластичности. Широкий спектр фармакологической активности РА АТ S100, включающий ноотропную, нейропротективную, мембраностабилизирующую, подтвержден в экспериментальных исследованиях [37—41].
Влияние Р.А. АТ S100 способствует более стабильному связыванию белка S100 c Сa2+, что запускает ток Na+ внутрь клетки, а Cа2+ — вовне´ [37]. Изменение трансмембранного потенциала генерирует потенциал действия, в результате чего нервный импульс распространяется к соседним нейронам. Показано модулирующее влияние РА АТ S100 на синаптическую передачу различных рецепторов, в том числе ГАМК, серотониновых, σ1-, NMDA. РА АТ S100, оказывая ГАМК-миметическое и нейротрофическое действие, повышают активность стресс-лимитирующих систем, способствуют восстановлению процессов нейрональной пластичности. Широкий спектр фармакологической активности РА АТ S100, включающий ноотропную, нейропротективную, мембраностабилизирующую, подтвержден в экспериментальных исследованиях [37—41].
Механизм действия второго компонента препарата диваза — РА АТ eNOS направлен на восстановление функций эндотелия и заключается в регуляции работы каскада NO-синтаза → NO-гуанилатциклаза → цГМФ. В экспериментальных исследованиях при изучении механизмов действия РА АТ eNOS отмечено увеличение активности еNOS, продукции цГМФ, дериватов NO на фоне приема препарата [39]. Также выявлено снижение до уровня интактных животных коэффициента ЭД [42]. Полученные данные согласуются с данными клинических исследований, в которых наблюдалось увеличение продукции цГМФ и выработки NO [43] у пациентов с ЭД, принимавших РА АТ eNOS. Доклинические исследования комплексного препарата [44, 45] доказали, что диваза препятствует развитию патологических последствий гипоксии в ткани головного мозга, обладает выраженным антиоксидантным и эндотелиопротективным действием.
В экспериментальных исследованиях при изучении механизмов действия РА АТ eNOS отмечено увеличение активности еNOS, продукции цГМФ, дериватов NO на фоне приема препарата [39]. Также выявлено снижение до уровня интактных животных коэффициента ЭД [42]. Полученные данные согласуются с данными клинических исследований, в которых наблюдалось увеличение продукции цГМФ и выработки NO [43] у пациентов с ЭД, принимавших РА АТ eNOS. Доклинические исследования комплексного препарата [44, 45] доказали, что диваза препятствует развитию патологических последствий гипоксии в ткани головного мозга, обладает выраженным антиоксидантным и эндотелиопротективным действием.
В клинических исследованиях [45—48] после 12 нед приема дивазы у пациентов с ХЦВБ наблюдался значимый регресс основных симптомов заболевания (когнитивные расстройства, слабость, головная боль, тревога, нарушения сна) и нормализация повышенных уровней маркеров ЭД, таких как С-реактивный белок, хемоаттрактантный протеин-1, эндотелин-1, уровень циркулирующих десквамированных эндотелиоцитов и др. , что отражает патогенетические действие дивазы.
, что отражает патогенетические действие дивазы.
Необходимо отметить, что прием дивазы характеризовался отсутствием нежелательных лекарственных явлений; на фоне приема препарата не отмечено признаков седативного и миорелаксантного действия, так же как проявлений пристрастия или привыкания к препарату [46—48]. Имеются единичные сообщения об эффективности применения дивазы при преходящих нарушениях мозгового кровообращения. Прием препарата позволил эффективнее провести лечение и минимизировать риск развития сосудистой катастрофы. На фоне лечения дивазой отмечено улучшение кровоснабжения пораженной области головного мозга [49].
В клинической практике также отмечено улучшение когнитивных функций, эмоционального состояния и качества жизни у пациентов с цереброваскулярными заболеваниями на фоне артериальной гипертензии и/или церебрального атеросклероза, принимающих дивазу в составе комплексной терапии [50].
Имеется положительный опыт приема дивазы пациентами в раннем восстановительном периоде ишемического инсульта в качестве ноотропного, вазоактивного, антиоксидантного и эндотелийпротективного препарата. Наиболее значимые результаты проявлялись в коррекции когнитивных и эмоциональных расстройств. При этом достоверное улучшение познавательных функций, в том числе памяти, развивалось уже через месяц приема препарата. Выраженный ответ на терапию отмечался к 3-му месяцу лечения [51].
Наиболее значимые результаты проявлялись в коррекции когнитивных и эмоциональных расстройств. При этом достоверное улучшение познавательных функций, в том числе памяти, развивалось уже через месяц приема препарата. Выраженный ответ на терапию отмечался к 3-му месяцу лечения [51].
Полученный опыт клинического применения и результаты экспериментальных исследований дивазы позволяют рассматривать назначение препарата в качестве перспективной стратегии в терапии цереброваскулярных расстройств, который восстанавливает нарушенную функцию эндотелия, улучшает когнитивные функции у пациентов с легкими и умеренными сосудистыми когнитивными расстройствами. Необходимо отметить, что эффект препарата обусловлен влиянием на различные звенья патологического процесса, в том числе на про- и антиоксидантную систему, а также на дисфункцию эндотелия. Доказанная клиническая эффективность и отсутствие нежелательных явлений позволяют рекомендовать дивазу для широкого применения у больных с цереброваскулярной патологией, даже с хроническими формами.
Авторы заявляют об отсутствии конфликта интересов.
Передовые доноры оксида азота: химическая структура препаратов NO, наномедицины NO и биомедицинские применения
Усовершенствованные доноры оксида азота: химическая структура препаратов NO, нанопрепараты NO и биомедицинские применения
Юэци
Ян, аб
Чжанцзянь
Хуан* и
и
Ли-Ли
Ли
* б
Принадлежности автора
*
Соответствующие авторы
и
Государственная ключевая лаборатория натуральных лекарственных средств, Ключевая лаборатория Цзянсу по открытию лекарств от метаболических заболеваний, Китайский фармацевтический университет, Нанкин 210009, КНР
Электронная почта:
чжанцзяньхуан@cpu. edu.cn
edu.cn
б
Лаборатория биомедицинских эффектов наноматериалов и нанобезопасности, Центр передового опыта CAS в области нанонауки, Национальный центр нанонауки и технологий (NCNST), № 11 Бейитиао, Чжунгуаньцунь, Пекин, КНР
Электронная почта:
[email protected]
Аннотация
Оксид азота (NO) как эндогенная двухатомная молекула играет ключевую регулирующую роль во многих физиологических и патологических процессах. Было показано, что этот двухатомный свободный радикал влияет на различные физиологические и клеточные функции и участвует во многих регуляторных функциях, начиная от изменения сердечно-сосудистой системы и заканчивая регулированием функций нейронов. Таким образом, газовая терапия NO как новый и перспективный метод лечения привлекает все большее внимание при лечении различных патологических заболеваний. Как известно, физиологическая и патологическая регуляция NO зависит главным образом от его локализации, времени воздействия и высвобождаемой дозы. Тем не менее, газу NO не хватает эффективного накопления и контролируемой способности к долговременному выделению газа в определенных местах, что приводит к ограниченной терапевтической эффективности и потенциальным побочным эффектам. Таким образом, исследователи разработали различные доноры NO, но в итоге обнаружили, что по-прежнему трудно контролировать долговременное высвобождение NO. Вдохновленные свойствами самосборки наноматериалов, исследователи поняли, что наноматериалы можно использовать для поддержки доноров NO для формирования наномедицины для достижения пространственного и временного контролируемого высвобождения NO. В этом обзоре, в соответствии с историей разработки NO в медицинских целях, мы сначала суммируем химический дизайн доноров NO, пролекарств NO и NO-конъюгированных препаратов.
Таким образом, газовая терапия NO как новый и перспективный метод лечения привлекает все большее внимание при лечении различных патологических заболеваний. Как известно, физиологическая и патологическая регуляция NO зависит главным образом от его локализации, времени воздействия и высвобождаемой дозы. Тем не менее, газу NO не хватает эффективного накопления и контролируемой способности к долговременному выделению газа в определенных местах, что приводит к ограниченной терапевтической эффективности и потенциальным побочным эффектам. Таким образом, исследователи разработали различные доноры NO, но в итоге обнаружили, что по-прежнему трудно контролировать долговременное высвобождение NO. Вдохновленные свойствами самосборки наноматериалов, исследователи поняли, что наноматериалы можно использовать для поддержки доноров NO для формирования наномедицины для достижения пространственного и временного контролируемого высвобождения NO. В этом обзоре, в соответствии с историей разработки NO в медицинских целях, мы сначала суммируем химический дизайн доноров NO, пролекарств NO и NO-конъюгированных препаратов. Далее выделяются нанопрепараты NO, образованные различными наноматериалами и донорами NO в зависимости от нанотехнологии. Наконец, обобщены биомедицинские применения наномедицины NO с оптимизированными свойствами.
Далее выделяются нанопрепараты NO, образованные различными наноматериалами и донорами NO в зависимости от нанотехнологии. Наконец, обобщены биомедицинские применения наномедицины NO с оптимизированными свойствами.
- Эта статья входит в тематические подборки:
Последние обзорные статьи и начинающие исследователи Nanoscale 2021
Доноры оксида азота — 1-е издание
Выберите страну/регионСоединенные Штаты АмерикиВеликобританияАфганистанАландские островаАлбанияАлжирАмериканское СамоаАндорраАнголаАнгильяАнтигуа и БарбудаАргентинаАрменияАрубаАвстралияАвстрияАзербайджанБагамские островаБахрейнБангладешБарбадосБельгияБелизБенинБермуды и Южная АфрикаБутан ГерцеговинаБотсванаБразилияБританская территория в Индийском океанеБританские Виргинские островаБрунейБолгарияБуркина-ФасоБурундиКамерунКанадаКанарские островаКабо-ВердеКаймановы островаЦентральноафриканская РеспубликаЧадЧилиКитайОстров РождестваКокосовые острова (Килинг)КолумбияКоморские островаКонгоОстрова КукаКоста-РикаХорватияКубаКюрасаоКипрЧехияДемократическая Республика КонгоДанияДжибутиДоминикаДоминиканская РеспубликаЭквадорЕгипетЭль-СальвадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияФолклендские (Мальвинские) островаФарерские островаФедеративные Штаты МикронезииФиджиФинляндияФранцияФранцузская ГвианаФранцузская ПолинезияГабонГамбияГрузияГерманияГанаГибралтарГрецияГренадаГваделупаГуамаГуамалаГвинея-Гвинесса sГонконгВенгрияИсландияИндияИндонезияИранИракИрландияОстров МэнИзраильИталияЯмайкаЯпонияДжерсиИорданияКазахстанКенияКирибатиКувейтКыргызстанЛаоЛатвияЛесотоЛиберияЛивияЛихтенштейнЛюксембургМакаоМакедонияМадагаскарМалавиМалайзияМальдивские островаМалиМальтаМаршаллтМашалловаМартинуриМартинури МонголияЧерногорияМонтсерратМароккоМозамбикМьянмаНамибияНепалНидерландыНовая КаледонияНовая ЗеландияНикарагуаНигерНиуэ Остров НорфолкСеверная КореяСеверные Марианские островаНорвегияОманПакистанПалауПанамаПапуа-Новая ГвинеяПарагвайПеруФилиппиныПиткэрнПольшаПортугалияПуэрто-РикоКатарРеюньонСа-ЛюсияРумыния и РуандаМинтСент-Барте Сен-Мартен (французская часть)Сен-Пьер и МикелонСент-Винсент и ГренадиныСамоаСан-МариноСао Томе и ПринсипиСаудовская АравияСенегалСербияСейшельские островаСьерра-ЛеонеСингапурСент-Мартен (голландская часть)СловакияСловенияСоломоновы островаСомалиЮжная АфрикаЮжная Грузия и Южные Сандвичевы островаЮжная КореяЮжный СуданИспанияШри-ЛанкаСуданСуринамШпицберген и Ян-МайенСвазилендШвецияШвейцарияСирияТайванТаджикистанТанзанияТаиландТимор-ЛестеаТого ТурцияТуркменистанОстрова Теркс и КайкосТувалуУгандаУкраинаОбъединенные Арабские ЭмиратыУругвайВиргинские острова СШАУзбекистанВануатуВатиканВенесуэлаВьетнамУоллис и ФутунаЗападная СахараЙеменЗамбияЗимбабве
Варианты покупки
Комплект (мягкая обложка, электронная книга) Скидка 50% при оформлении заказа
Бесплатная доставка по всему миру
Нет минимального заказа
Описание
Доноры оксида азота: биомедицинские применения и перспективы представляет современное состояние дел, проблемы и инновации в разработке терапевтических доноров оксида азота, оказывающих большое влияние на некоторые аспекты физиологии и патофизиологии человека. Несмотря на то, что был достигнут значительный инновационный прогресс с использованием доноров оксида азота в биомедицинских приложениях, все еще необходимо преодолеть определенные недостатки, чтобы успешно перевести эти исследовательские инновации в клинические приложения. Эта книга охватывает несколько тем об оксиде азота, таких как его источники и биологические свойства; его действие на сердечно-сосудистую и неврологическую системы, на кожу человека и его применение в лечении запущенных заболеваний, нейродегенеративных заболеваний и рака. Кроме того, он охватывает его роль в воспалении и иммунитете, функции эрекции полового члена, фотодинамической терапии, антимикробной активности. В нем также обсуждается будущее доноров оксида азота в сочетании с другими терапевтическими препаратами, имплантируемыми датчиками, гидрогелями, высвобождающими оксид азота, и медицинскими устройствами для местного применения. Книга является ценным источником для исследователей в различных областях биомедицины, которые интересуются улучшениями, которые эти молекулы могут внести в лечение ряда заболеваний.
Несмотря на то, что был достигнут значительный инновационный прогресс с использованием доноров оксида азота в биомедицинских приложениях, все еще необходимо преодолеть определенные недостатки, чтобы успешно перевести эти исследовательские инновации в клинические приложения. Эта книга охватывает несколько тем об оксиде азота, таких как его источники и биологические свойства; его действие на сердечно-сосудистую и неврологическую системы, на кожу человека и его применение в лечении запущенных заболеваний, нейродегенеративных заболеваний и рака. Кроме того, он охватывает его роль в воспалении и иммунитете, функции эрекции полового члена, фотодинамической терапии, антимикробной активности. В нем также обсуждается будущее доноров оксида азота в сочетании с другими терапевтическими препаратами, имплантируемыми датчиками, гидрогелями, высвобождающими оксид азота, и медицинскими устройствами для местного применения. Книга является ценным источником для исследователей в различных областях биомедицины, которые интересуются улучшениями, которые эти молекулы могут внести в лечение ряда заболеваний.
Основные характеристики
- Предоставляет справочную информацию о биологии и химии оксида азота
- Обсуждает современное состояние в разработке наноматериалов, высвобождающих оксид азота, для биомедицинских применений
- Охватывает использование доноров оксида азота в лечение ряда состояний, таких как рак, кожа человека, сердечно-сосудистая система и иммунитет
- Обсуждается будущее доноров оксида азота и их одобрение FDA
Читательская аудитория
Аспиранты синтетические биологи, врачи, врачи, биохимики, фармацевты
Содержание
Информация о продукте
- Количество страниц: 364
- Язык: английский 2 0 Copyright : 1904 Press
- Опубликовано: 17 марта 2017 г.
- Выходные данные: Academic Press
- ISBN в мягкой обложке: 9780128092750
- ISBN электронной книги: 9780128134597
Об авторе
Amedea Seabra
Amedea B. Seabra имеет диплом по химии Университета Сан-Паулу (USP).
