Белки значение для организма: Белки, жиры, углеводы. Справка — РИА Новости, 23.08.2010
Рациональное питание
Рациональное питание — питание, сбалансированное в энергетическом отношении и по содержанию питательных веществ в зависимости от пола, возраста и рода деятельности.
В настоящее время у большей части нашего населения питание не соответствует этому понятию не только из-за недостаточной материальной обеспеченности, но еще из-за отсутствия или недостатка знаний по данному вопросу. Прежде чем перейти к рекомендациям по питанию в повседневной жизни, остановимся на роли пищевых веществ в организме.
Питание является неотъемлемой частью жизни, так как поддерживает обменные процессы на относительно постоянном уровне.
Значение основных питательных веществ, их энергетическая ценность
Белки — жизненно необходимые вещества в организме. Потребность организма в белках зависит от пола, возраста и энергозатрат, составляя в сутки 80-100 г, в том числе животных белков 50 г. Белки должны обеспечивать примерно 15 % калорийности суточного рациона.
Жиры являются основным источником энергии в организме. Суточная потребность организма в жирах составляет в среднем 80-100 г, в том числе растительных жиров 20-25 г. Жиры должны обеспечивать примерно 35 % калорийности суточного рациона
Углеводы являются одним из основных источников энергии. Суточная потребность организма в углеводах составляет от 400-500 г. Углеводы должны обеспечивать примерно 50 % калорийности суточного рациона. Если углеводов в организме избыток, то они переходят в жиры, т. е. избыточное количество углеводов способствует ожирению.
Кроме белков, жиров и углеводов важнейшей составляющей рационального питания являются витамины — биологически активные органические соединения, необходимые для нормальной жизнедеятельности. Недостаток витаминов приводит к гиповитаминозу (недостаток витаминов в организме) и авитаминозу (отсутствие витаминов в организме). Витамины в организме не образуются, а поступают в него с продуктами.
Кроме белков, жиров, углеводов и витаминов организму необходимы минеральные вещества, которые используются в качестве пластического материала и для синтеза ферментов.
Соотношение белков, жиров и углеводов для людей среднего возраста должно быть (по массе) 1: 1: 4.
Эти вещества организм получает только в том случае, если потребляется разнообразная пища, включающая шесть основных групп продуктов: молочные; мясо, птица, рыба; яйца; хлебобулочные, крупяные, макаронные и кондитерские изделия; жиры; овощи и фрукты.
Для здорового человека оптимально четырехразовое питание, так как более редкое питание приводит к накоплению жира в организме, уменьшению активности щитовидной железы и тканевых ферментов. Частая еда в одно и то же время способствует лучшему оттоку желчи. Нарушение режима питания является одной из основных причин возникновения хронических заболеваний желудка и кишечника. Кратность приемов пищи определяется возрастом, характером трудовой деятельности, распорядком дня, функциональным состоянием организма. Регулярность приема пищи способствует выработке условного рефлекса во время еды и ритмичной выработке пищеварительных соков.
Регулярность приема пищи способствует выработке условного рефлекса во время еды и ритмичной выработке пищеварительных соков.
При четырехразовом питании соотношение числа калорий пищи по отдельным приемам пиши должно быть 30, 15, 35, 20 %. Продукты, богатые животными белками (мясо, рыба), полезнее употреблять утром и днем, так как они повышают работоспособность. Второй завтрак может включать кисломолочные продукты, овощные блюда, бутерброды, фрукты. Обед должен быть самым значительным по объему пищи. Ужин должен быть небольшим по объему и состоять из легкоусвояемых блюд. Последний прием пиши должен быть за 2-3 ч до сна.
Снижение интенсивности обменных процессов в пожилом возрасте и уменьшение физической активности обусловливают уменьшение потребности в пищевых веществах и снижение калорийности пищи у этой группы населения. Рацион питания пожилого человека должен быть разнообразным и включать в себя достаточное количество овощей и фруктов. Пищу следует принимать часто, не менее 5-6 раз в день, небольшими порциями. В рацион следует вводить морскую рыбу, творог, молочнокислые продукты, нежирное мясо. Рыбу и мясо предпочтительно употреблять в отварном виде. Следует ограничить количество жиров животного происхождения, отдавая предпочтение растительным жирам, содержащим ненасыщенные жирные кислоты, что является профилактикой атеросклероза. Следует ограничить потребление соли, сахара (заменять медом или заменителем сахара), специй, копченостей, крепкого чая и кофе. Для регулярной работы кишечника пожилым людям следует включить в рацион хлеб из муки грубого помола.
В рацион следует вводить морскую рыбу, творог, молочнокислые продукты, нежирное мясо. Рыбу и мясо предпочтительно употреблять в отварном виде. Следует ограничить количество жиров животного происхождения, отдавая предпочтение растительным жирам, содержащим ненасыщенные жирные кислоты, что является профилактикой атеросклероза. Следует ограничить потребление соли, сахара (заменять медом или заменителем сахара), специй, копченостей, крепкого чая и кофе. Для регулярной работы кишечника пожилым людям следует включить в рацион хлеб из муки грубого помола.
Евченко Н.В.
врач-терапевт Кусинской ЦРБ
химический состав, свойства и значение для человеческого организма»
Доклад
по биологии
«Белки: химический состав, свойства
и значение для человеческого организма»
ученика 8 класса
ГБОУ ООШ пос. Аверьяновский
Аверьяновский
Григорьева Даниила
Руководитель: Величкина А.А.
Белки — основная структурная единица клеток. Это полимеры, мономерами которых являются аминокислоты. В состав белков входит 20 типов аминокислот. В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот. Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
Для каждого белка характерна своя форма.
Белки, состоящее из нескольких аминокислот, называют пептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура белка определяется последовательностью аминокислот в полипептидной цепи. Порядок чередования аминокислот в данной белковой молекуле определяет её особые физико-химические , биологические свойства.
Вторичная структура представляет собой белковую нить, закрученную в виде спирали. Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые при их большом числе обеспечивают образование прочной структуры.
Третичная структура — это клубок, или глобула, в который свертывается спираль. Он образуется в результате взаимодействия различных остатков аминокислот
Четвертичная структура характерна для сложных белков. Несколько глобул объединены вместе и удерживаются вместе благодаря ионным, водородным и другим связям. Белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Денатурация белков
Связи, поддерживающие пространственную структуру белка, довольно легко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яичный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за разрушения пространственной структуры белков альбумина в яичном белке и казеина. Такой процесс называется денатурацией. Денатурация белка — разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции. В нашем примере в первом случае денатурацию вызывает нагревание, а во втором — значительное увеличение кислотности (в результате жизнедеятельности обитающих в молоке бактерий). При денатурации белок теряет способность выполнять присущие ему в организме функции. Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков. Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию.
Такой процесс называется денатурацией. Денатурация белка — разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции. В нашем примере в первом случае денатурацию вызывает нагревание, а во втором — значительное увеличение кислотности (в результате жизнедеятельности обитающих в молоке бактерий). При денатурации белок теряет способность выполнять присущие ему в организме функции. Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков. Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию. Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура. В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели. Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура. В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели. Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
Функции белков в организме
Белки — это важные компоненты всех живых организмов, они участвуют в жизнедеятельности клетки.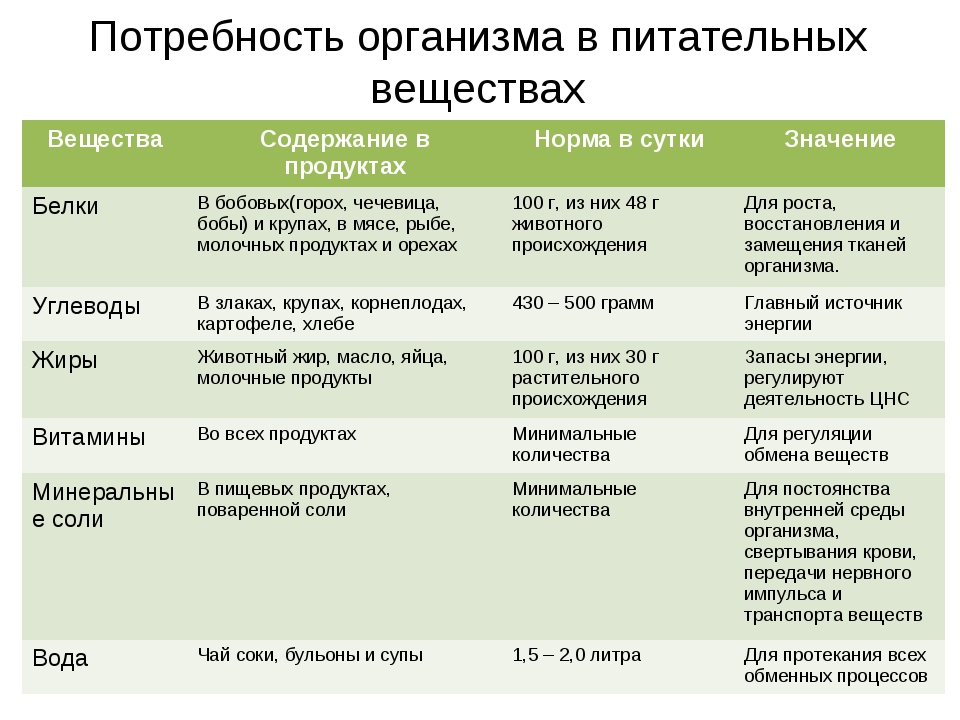
Каталитическая функция
Ферменты — это белки катализирующие разные реакции. Они способствуют расщеплению сложных молекул их образованию. Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Пластическая функция Белки — незаменимый строительный материал. Одной из важнейших функций белковых молекул является пластическая. Все клеточные мембраны содержат белок, роль которого здесь разнообразна. Количество белка в мембранах составляет более половины массы.Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов.
Энергетическая функция. Белки могут служить источ ником энергии для клетки. При недостатке в организме yглеводов или жиров окисляются молекулы аминокислот. При расщеплении 1 г белков высвобождается 17,6 кДж энергии.
Транспортная функция Имея различные функциональные группы и сложное строение макромолекулы, белки связывают и переносят с током крови многие соединения. Это гемоглобин, переносящий кислород из легких к клеткам. В мышцах эту функцию берет на себя еще один транспортный белок — миоглобин.
Запасающая функция
Эту функцию осуществляют так называемые резервные белки, являющиеся источниками питания для развития плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ. К запасным белкам относят ферритин — железо, овальбумин — белок яйца, казеин — белок молока, зеин — белок семян кукурузы. В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Регуляторная функция
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Двигательная функция
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных..
Энергетическая функция
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
Сигнальная функция
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку.
Защитная функция
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Значение белков в питании
Белок – необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание
Перечень продуктов, которые обеспечивают необходимое
количество белковых веществ.
Наименование продукта | Количество | Белковые вещества |
Ржаной хлеб | 250 | 12,8 |
Белый хлеб | 200 | 14,3 |
Крупа | 30 | 2,8 |
Макароны | 10 | 0,9 |
Мука пшеничная | 20 | 1,9 |
Мясо | 150 | 22,7 |
Рыба | 100 | 9,4 |
Молоко | 400 | 14,2 |
Творог, сыр | 70 | 11,2 |
Сметана | 30 | 0,6 |
Сливочное масло | 30 | 0,1 |
Яйца | 1/2шт. | 2,6 |
Картофель | 400 | 4,2 |
Овощи | 300 | 3,5 |
Фрукты, ягоды (свежие) | 200 | 0,8 |
Итого: | 102,0 |
В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые и всасываются в кровь. Пищевая ценность белка зависит от их аминокислотного состава, содержания в них так называемых незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин).
В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы – добавление в растительную пищу синтетических аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот.
Перспективно использование для этого методов генетической инженерии. Чрезвычайно важное значение имеет широкое внедрение промышленного микробиологического синтеза, например, выращивание дрожжей на гидролизном этиловом спирте, природном газе или нефти. Получаемые при этом белково-витаминные концентраты (БВК) используют в качестве добавок к корму сельскохозяйственных животных.
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определенных функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
На долю белка приходится не менее 50 % сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот.
Белки играют важнейшую роль в жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
Белки — важнейшие компоненты пищи человека и корма животных. Совокупность непрерывно протекающих химический превращений белков занимает ведущее место в обмене веществ организмов. Скорость обновления белков у живых организмов зависит от содержания белков в пище, а также его биологической ценности, которая определяется наличием и соотношением незаменимых аминокислот.
Белки растений беднее белков животного происхождения по содержанию незаменимых аминокислот, особенно лизина, метионина, триптофана. Белки сои и картофеля по аминокислотному составу наиболее близки белкам животных. Отсутствие в корме незаменимых аминокислот приходит к тяжёлым нарушениям азотистого обмена. Поэтому селекция зерновых культур направлена, в частности, и на повышение качества белкового состава зерна.
Белки значение для питания — Справочник химика 21
Изучение проблемы нормы белка в питании человека имеет, кроме академического интереса, большое социальное значение. Принятые в нашей стране нормы белка для взрослого человека и для детей разного возраста основаны на результатах многочисленных научных исследований отечественных ученых, учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы. Эти нормы выводятся из оптимального содержания белка в пищевом рационе. Так, взрослый человек, [c.412]
ЗНАЧЕНИЕ БЕЛКОВ В ПИТАНИИ И ЖИЗНЕДЕЯТЕЛЬНОСТИ [c.302]
Использование белков. Роль белков в процессах жизнедеятельности исключительно важна. Из этого вытекает огромное значение белков в питании животных и человека. Для нормального рациона взрослого человека нужно примерно 100—160 г белка в сутки. Отсутствие или недостаточное содержание белков в пище вызывает серьезные нарушения процессов жизнедеятельности и ряд тяжелых заболеваний. Это относится, в равной степени, и к сельскохозяйственным животным, рацион которых также должен содержать достаточное количество белковых компонентов. [c.442]
Важнейшее значение для питания растений имеют азот, фосфор и калий, от которых зависят обмен веществ в растении и его рост. Азот входит в состав белков и хлорофилла, принимает участие в фотосинтезе. Соединения фосфора играют важную роль в дыхании и размножении растений, участвуя в процессах превращения углеводов и азотсодержащих веществ. Калий регулирует жизненные процессы, происходящие в растении, улучшает водный режим, способствует обмену веществ и образованию углеводов в тканях растений. [c.240]
Оптимальные условия накопления биомассы ограничиваются прежде всего определенной температурой, значением pH среды, количеством и скоростью поступления питательных веществ, кислорода воздуха и др. Нормальные алканы используются микроорганизмами в качестве питания. Они вместе с аммиаком и минеральными солями превращаются в продукты обмена, представляющие биомассу, состоящую в основном из протеинов. В промышленном процессе производства белка важной ступенью является выделение продуктов ферментации и заключительная обработка полученных клеток микроорганизмов. Чистота углеводородного сырья оказывает существенное влияние на экономику процесса. [c.206]
Человек для поддержания здоровья должен получать с продуктами питания незаменимые аминокислоты. При этом пища не только должна содержать белки, обеспечивающие поступление в организм этих аминокислот, но и быть богатой углеводами и жирами, необходимыми для получения энергии. Существенное значение для сохранения здоровья имеют также и другие вещества, как неорганические, так и органические. [c.409]
В основе всех жизненных процессов, а также структур живых организмов, тканей и клеток лежат такие вещества, как белки, нуклеиновые кислоты, крахмал, гликоген, целлюлоза, построенные из гигантских цепных молекул. Продукты питания (хлеб, мясо, рыба, овощи), одежда и обувь (текстильные ткани, искусственное волокно, кожа, резина, пластмассы) образованы различного рода коллоидными системами. Изменение структуры и поглощающих свойств почв, выветривание горных пород, вынос частиц ила и глин реками, образование облаков и туманов — тесно связаны с коллоидными процессами. Производство строительных материалов (цемент, гипс), добыча и переработка нефти (бурение скважин, обезвоживание нефти), обогащение ценных руд методом флотации, производство лаков и красок, кинофотоматериалов, бумаги, сажи, удобрений в значительной степени основано на использовании свойств различных суспензий и эмульсий. В фармацевтической промышленности многие лекарственные вещества производятся в форме тонких суспензий или эмульсий, мазей, паст, кремов. Важное значение в промышленности, в сельском хозяйстве и в военном деле имеют различные дымы и туманы. Развитие авиационной и автомобильной промышленности, машиностроения и приборостроения было бы невозможно без резины и различных пластмасс. Изделия из целлюлозы, резины, пластмасс, искусственного волокна приобретают все большее значение в технике и в быту. Можно сказать, что материальная основа современной цивилизации и самого существования человека и всего биологического мира связана с коллоидными системами. [c.7]
В плане практического применения эти методы, совершенствуясь, приобретают все большее значение благодаря их избирательности, чувствительности, быстроте выполнения процедур в стандартизованных условиях, пригодности для обработки большого числа образцов. Эти методы постепенно заменяют некоторые традиционные биохимические способы количественного определения содержания веществ. В течение уже почти двух десятилетий при анализе белков для контроля качества пищевых продуктов очень серьезно рассматриваются возможности иммунохимических методов. Если значимость этих методов в данной области и не была так велика, как в клиническом анализе, то это объясняется трудностями анализа, изначально присущими исследуемому растительному материалу. В самом деле, клинический анализ чаще всего применяется к биологическим жидкостям или тканевым препаратам, которые минимально подвергаются денатурирующим воздействиям. В противоположность этой ситуации пищевые продукты, подвергаемые анализу, нередко имеют твердую форму, и из них надо извлекать белки. Кроме того, и в этом состоит принципиальная трудность, натуральные компоненты, используемые в этих продуктах питания, как твердых, так и жидких, могут испытывать резкие физико-химические [c.116]
Но наиболее значительные скопления белка, которые можно наблюдать у растений, встречаются в тканях некоторых семян. Именно там и располагаются запасные белки, которые являются темой данной книги. Эти белки, имеющие большое значение как для самого растения в период прорастания, так и для питания человека или животного, образуют в клетке многочисленные оформленные элементы, называемые белковыми тельцами, или алейроновыми зернами, форма и структура которых зачастую специфичны для определенного ботанического вида. [c.126]
Вкусовые и ароматические свойства имеют особое значение, когда белки предназначаются для питания человека, но они могут также влиять на аппетитность кормов, приготавливаемых для животных. [c.315]
Знание механических свойств имеет особое значение для оценки характеристик текстуры пищевых продуктов. Несмотря на то что филированные белки предназначены для выработки продуктов питания, первостепенным качественным показателем которых является текстура (аналогичная мясу и рыбе), исследований по оценке этих механических свойств проводилось мало. [c.538]
Свинец. В IV фуппе периодической системы особое значение имеет свинец вследствие высокой токсичности его соединений. Свинец ингибирует ферментативные реакции, вступая в химическое взаимодействие с белками и осаждая их. Присутствие повышенных концентраций свинца в воздухе и продуктах питания представляет угрозу для здоровья человека. [c.98]
Значение жиров как пищевого продукта весьма многообразно. Жиры в питании человека прежде всего имеют важное энергетическое значение. Энергетическая ценность жиров выше, чем белков и углеводов. Известно, что при окислении 1 г жиров организм получает 38,9 кДж (9,3 ккал), тогда как при окислении 1 г белков или углеводов—17,2 кДж (4,1 ккал). Кроме того, жиры являются растворителями витаминов А, О, Е и К, в связи с чем обеспеченность организма этими витаминами в значительной степени зависит от поступления жиров в составе пищи. С жирами в организм вводятся и некоторые полиненасыщенные жирные кислоты (линолевая, линоленовая, арахидоновая), которые относят к категории незаменимых (эссенциальных) жирных кислот, так как ткани человека и ряда животных потеряли способность синтезировать их. Эти кислоты условно объединены в группу под названием витамин Е . [c.363]
Все физические и химические процессы, связанные с построением содержащихся в организме веществ из продуктов питания (углеводов, жиров и белков), а также с превращением таких веществ и разрушением химических соединений в организме описывают общим термином обмен веществ (метаболизм). Для веществ, которые имеют значение при обмене веществ и в процессе роста организма, обычно используют термин метаболиты. [c.698]
Сера — элемент, значение которого в питании определяется в первую очередь тем, что он входит в состав белков в виде серосодержащих аминокислот (метионина и цистина), а также в состав некоторых гормонов и витаминов. Содержание серы обычно пропорционально содержанию белков в пищевых продуктах, поэтому ее больше в животных продуктах, чем в растительных. Потребность человека в сере (около 1 г в день) удовлетворяется обычным суточным рационом. [c.69]
I, тирозина) должны составлять примерно 40 % от суммы аминокислот в питании детей дошкольного возраста, 36 % — в питании взрослых, т. е. при суточной норме белка 80—90 г (для взрослого) должно потребляться около 30 г незаменимых аминокислот в оптимальном соотношении, приведенном на с. 8. Однако общее содержание незаменимых аминокислот не может считаться удовлетворительным, если хотя бы одной аминокислоты в белке будет меньше установленного оптимального количества. Соотношение заменимых аминокислот по некоторым данным тоже имеет значение, однако не такое серьезное. [c.201]
В сельском хозяйстве аминокислоты применяются преимущественно в качестве кормовых добавок. Многие растительные белки содержат лизин в очень малых количествах, поэтому добавление лизина в корма сельскохозяйственных животных с целью их сбалансирования по белковому питанию имеет первостепенное значение. Кроме того, в сельском хозяйстве аминокислоты применяются для защиты растений от различных болезней (метионин, глутаминовая кислота, валин). Производные таких аминокислот, как аланин и глицин, обладают гербицидным действием и используются для защиты растений от сорняков. [c.27]
Увеличение коэффициента сгущения имеет большое экономическое и гигиеническое значение. При сгущении молока в 5 раз вдвое сократятся расходы на тару и транспортировку и, кроме того, будет получен продукт питания с высоким содержанием легко усвояемых белков, жиров, сахаров при оптимальном их соотношении (1 1 4). [c.229]
В последние годы все большее значение приобретает качественно новое направление в производстве пищи. Оно заключается в переработке белков различного происхождения в искусственные продукты питания. Производство таких продуктов осуществляется практически индустриальными методами, что позволяет использовать для питания огромные ресурсы белка с минимальными его потерями, дает стандартную продукцию. При этом желательно, чтобы по составу они отвечали требованиям сбалансированного питания и превосходили в этом отношении большинство традиционных продуктов, особенно растительных. Если же говорить об искусственной пище неприродного происхождения, то ее синтез обязательно должен включать в себя синтез Ь-а-аминокислот. Физиологическими опытами по питанию высших животных искусственными смесями аминокислот было выяснено, что не все аминокислоты должны обязательно поступать с пищей. Некоторые ами- [c.513]
Значение витаминов было выяснено в результате опытов с животными, которых кормили искусственными пищевыми смесями. Эти смеси состояли из выделенных и очищенных белков, жиров, углеводов, минеральных веществ и воды, по своему количеству полностью соответствующих содержанию их в натуральных продуктах. Животные, находившиеся на искусственном питании, погибали. [c.123]
Для выяснения значения различных веществ в питании известный русский ученый Н. И. Лунин в 1880 г. провел ряд опытов на мышах, выращивая одну группу их на натуральном молоке, а другую — на искусственной питательной диете, которая по количеству белков, углеводов, жиров и минеральных солей отвечала по составу натуральному молоку и содержала, казалось бы, все необходимые для жизни мышей питательные вещества. Н. И. Лунин наблюдал, что мыши, получавшие искусственную диету, ве росли, теряли в весе и погибали, а мыши, получавшие натуральное молоко, развивались нормально. На основании таких опытов Лунин первый пришел к заключению, что, кроме белков, жиров, углеводов и минеральных солей, в пище [c.77]
Количество основных веществ в зерне злаков и особенно белков и крахмала может значительно изменяться в зависимости от условий выращивания. Особенно важное значение имеет изменчивость количества белка, поэтому повышению его содержания в сельскохозяйственных растениях уделяется очень большое внимание. Белок не может быть заменен в питании человека и животных другими веществами, и человек ежедневно должен получать с пищей от 70 до 120 г белка. Зерновые злаковые и зернобобовые культуры наиболее доступные, широко распространенные и дешевые источники белка, поэтому особое внимание уделяется повышению количества белка именно в этих культурах. В целом по СССР увеличение содержания белка в зерновых культурах только на 1 % дает возможность получить дополнительно 1 ООО ООО т чистого белка. [c.372]
Овощные культуры имеют большое значение в питании населения. Их ценность определяется содержанием углеводов или белков, витаминов, органических кислот, эфирных масел и ферментов. В некоторые овощи входят фитонциды — вещества, подавляющие рост микроорганизмов. [c.439]
Была показана особая роль белков в жизнедеятельности организма и значение их в питании. Изучая промежуточные превращения аминокислот — структурных элементов белковой молекулы, можно было отметить огромное количество разнообразных реакций, к которым они способны. Наряду с общим типом превращений, дезаминированием, переаминированием и декарбоксилированием, все аминокислоты подвергаются частным превращениям, свойственным только данной аминокислоте эти превращения приводят к образованию специфических веществ, включающихся в общую цепь реакций обмена. Установлено, что на завершающем этапе обмена простых белков в животном организме синтезируется мочевина — главный конечный продукт этого обмена. [c.356]
Как уже указывалось, ферментами называются специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов. Ферменты обусловливают способность живых организмов осуществлять необходимые для их жизнедеятельности превращения веществ. Значение ферментов в процессах обмена веществ между организмом и внешней средой огромно. В частности, питание организма, усвоение им веществ внешней среды происходят при участии ферментов, находящихся в соках пищеварительного канала. [c.111]
Значение белков в питании. Б.-необходимая составная часть продуктов питания. Проблема пищевого Б. стоит очень остро. По данным Международной организации по продовольствию и с. х-ву при ООН больше половины человечества не получает с пищей необходимого кол-ва Б. Недостаток Б. в пище вызывает тяжелое заболевание-к ва-шиоркор. [c.253]
Поскольку углеводы, липиды и белки продуктов питания включают моно- и полисахариды, жирные кислоты с короткой и длинной цепью, насыщенные и ненасыщенные жирные кислоты и т. д., калорийность каждого из индивидуальных компонентов различна. Так, глюкоза при окислении выделяет 3,75 ккал/г, в то время как гликоген 4,3 ккал/г. Животные белки более калорийны, чем растительные большинство животных липидов освобождает 9,5 ккал/г, а масло и свиное сало 9,2 ккал/г. Поэтому калорийность всех трех классов веществ, содержащихся в пище, указывается в виде средних значений 4,1, 9,3 и 4,1 ккал/г для углеводов, липидов i белков соответственно. Если допускать возможность неполного переваривания и/пли всасывания, эти значения можно округлить до целых тзгда каторийность глеводов, липидов и белков равна 4, 9 и 4 соответственно. [c.357]
Урок начинается с напоминания учащимся об огромном значении азота в жизни живой природы как составной части белка. Приводятся слова Ф. Энгельса Без белка нет жизни . Рассказывается, что в состав пищи человека и животных входит белок. Растения не могут использовать для своего питания свободный азот (хотя его много в воздухе), так как им необходим только связанный азот (входящий в состав каких-либо соединений). Лищь некоторые бактерии усваивают азот из воздуха, связывают его в соединения и создают белковые вещества. [c.126]
В основном в состав хлорофилла, каротиноидов, стеринов и хи-нонов. Среди глицеролипидов на линоленат приходится до 80 % всех остатков жирных кислот. С точки зрения питания они обладают активностью витаминов А, Е, Р и К- Более подробные сведения приводятся в публикации [20]. Чтобы наилучшим образом показать большое значение липидов, сопровождающих белки листьев, рассмотрим для примера (3-ситостерин, сапонины, каротиноиды и окисление остатков полиненасыщенных жирных кислот. [c.252]
При включении в небольших количествах с целью улучшения технологических и органолептических качеств пищи белки можно вводить в виде порошка. Функциональные свойства в таких случаях имеют первостепенное значение (см. главу 10). Наобо-1 рот, если включение белковых добавок предназначено для час-I тичной или полной замены традиционных белков, растительные белки не могут использоваться в порошковой форме, но должны быть соответствующим образом оструктурены перед включением в продукт питания, чтобы он имел привлекательную текстуру. [c.527]
С давних времен человек использовал ферменты для изменения свойств белков и приготовления различных пищевых продуктов. Сыроделие насчитывает уже около 10 тыс. лет, но лишь в недавние годы достаточно хорошо познана особая и первостепенная роль сычужного фермента при воздействии на белки молока. Протеолиз имеет также важное значение в производстве других традиционных продуктов питания, таких, как мизо. [c.596]
Развитие учения о витаминах, однако, справедливо связывают с именем отечественного врача Н.И. Лунина, открывшего новую главу в науке о питании. Он пришел к заключению, что, кроме белков (казеина), жиров, молочного сахара, солей и воды, животные нуждаются в каких-то еще неизвестных веществах, незаменимых для питания. В своей работе О значении минеральных солей для питания животных (1880) Н.И. Лунин писал Представляет большой интерес исследовать эти вещества и изучить их значение для питания . Это важное научное открытие позже (1912) было подтверждено работами Ф. Гопкинса. Поскольку первое вещество, выделенное К. Функом (1912) в кристаллическом виде из экстрактов оболочек [c.204]
Состояние белкового обмена целостного организма зависит не только от количества принимаемого с пищей белка, но и от качественного состава его. В опытах на животных было показано, что получение одинакового количества разных пищевьгх белков сопровождается в ряде случаев развитием отрицательного азотистого баланса. Так, скармливание равного количества казеина и желатина крысам приводило к положительному азотистому балансу в первом случае и к отрицательному—во втором . Имел значение различный аминокислотный состав белков, что послужило основанием для предположения о существовании в природе якобы неполноценных белков. Оказалось, что из 20 аминокислот в желатине почти отсутствуют (или содержатся в малых количествах) валин, тирозин, метионин и цистеин кроме того, желатин характеризуется другим, отличным от казеина процентным содержанием отдельных аминокислот. Этим можно объяснить тот факт, что замена в питании крыс казеина на желатин приводит к развитию отрицательного азотистого баланса. Приведенные данные свидетельствуют о том, что различные белки обладают неодинаковой пищевой ценностью. Поэтому для удовлетворения пластических потребностей организма требуются достаточные количества разных белков пищи. По-видимому, справедливо положение, что, чем ближе аминокислотный состав принимаемого пищевого белка к аминокислотному составу белков тела, тем выше его биологическая ценность. Следует, однако, отметить, что степень усвоения пищевого белка зависит также от эффективности его распада под влиянием ферментов желудочно-кишечного тракта. Ряд белковых веществ (например, белки шерсти, волос, перьев и др.), несмотря на их близкий аминокислотный состав к белкам тела человека, почти не используются в качестве пищевого белка, поскольку они не гидролизуются протеиназами кишечника человека и большинства животных. [c.413]
В основе процессов обмена веществ в большинстве случаев лежат простые обратимые реакции, которые многосторонне связаны друг с другом в цепочку последовательных конкурирующих реакций. Такие последовательности обратимых реакций часто называют подвиоюными равновесиями. Они тесно привязаны к узкой области температур, протекают в водных растворах и при строго определенных значениях pH. Эти реакции катализируются ферментами и регулируются гормонами. Высвобождающаяся при этом энергия проявляется в виде мускульной энергии или тепла или же накапливается за счет образования богатых энергией соединений (см. раздел 3.4). Энергия продуктов питания, используемая организмом, называется энергией физиологического сгорания. Для жиров она в среднем равна 9,4 ккал г ( 39,3 кДж-г ), для углеводов и белков — примерно равна 4,1 ккал-г (a 17,3 кДж г ). [c.698]
Триптофан является одной из десяти аминокислот, имеющих большое значение для роста и питания крыс [7], и входит в число восьми аминокислот, важных для поддержания азотного равновесия у человека [275]. В работах Гопкинса и Коле [276] описано получение триптофана гидролизом ряда белков. Этот препаративный метод получения триптофана ферментативным гидролизом с помощью панкреатина был повторен с хорошими результатами Абдергальденом и Кемпе [277], Дакином [278] и Онслоу [279] и улучшен Коксом и Кингом [280]. [c.42]
К тому же аминокислотный состав этих продуктов весьма благоприятный. Для таких важнейших овощей, как картофель, к, морковь, огурцы, капуста, свекла, и для основных фруктов ягод характерно низкое (50—70 % от нормы, даже еще мень—) содержание незаменимых серосодержащих аминокислот — тионина и цистина — и других незаменимых аминокислот. )этому значение овощей, фруктов и ягод как источника белка питании незначительно. Единственное исключение составляет ртофель. Хотя общее содержание азотистых веществ в нем гго 2 %, потребление картофеля в нашей стране довольно зна-тельно в среднем 330 г в день. Таким образом, с картофелем среднем удовлетворяется примерно 6—8 % общей потребности Ювека в белке, что, конечно, существенно. [c.127]
В настоящее время на земном шаре ощущается острый белковый дефииит, связанный с недостаточным производством и неравномерным распределением продуктов питания, а также быстрым ростом народонаселения. Эта проблема, особенно актуальная в развивающихся странах Азии и Африки, привлекает пристальное внимание многих государств и международных организаций. Лучшим и наиболее естественным путем увеличения производства пищевых продуктов является повышение продуктивности сельскохозяйственного производства во всех регионах нашей планеты на основе внедрения новейших достижений науки. Большое значение приобретает использование нетрадиционных источников белка — к ним можно отнести огромные биологические ресурсы Мирового океана, в частности криль, планктон и др. В этой связи несомненные перспективы открывает получение белка с помощью микробиологического синтеза исходным сырьем здесь могут служить углеводороды нефти, чистые парафины, природный газ, отходы деревообрабатывающей и целлюлозно бумажной промышленности, меласса, синтетические [c.23]
В отличие от шампуней, приготовленных на мыльной основе, шампуни на основе ПАВ имеют ряд преимуществ, которые способствуют их. быстрому распространению в мировой практике. Основными из них являются следующие в сочетании с полезными добавками не раздражают кожу значение pH их близко к реакции кожи головы (5-8,5) легко сочетаются с веществами лекарственного назначения, экстрактами лекарственных растений, лецитином, растительными маслами, продуктами переработки яичных белков и другими продуктами животного и рас—тительного происхождения, что обеспечивает эффективное питание корней волос легко растворяются в воде любой жесткости имеют высокую устойчивость к элементам жесткости воды обладают хорошей, пенообразующей способностью и цостаточным моющим действием стабильны в процессе хранения при температуре не ниже 5 °С хорошо смываются и не оставляют на волосах и коже налета, делают волосы мягкими и придают им блеск не обезжиривают волосы и кожу и не раз-цражают ее. [c.192]
Значение аминокислот как основного фактора во всех проблемах, связанных с белком, все более подчеркивается в исследованиях по химии питания… Очевидно, что неодинаковая питательная ценность различных белков связана с различным содержанием в них тех специальных аминокислот, которые необходимы для организма и не могут быть синтезированы животным… . Этн мысли, высказанные Т. Б. Осборном и Л. Б. Менделем еще в 1914 г., согласуются с общепринятыми взглядами на белковое питание и по настоящее время. Первоначальные опыты Унлькока и Гопкинса, Осборна и Менделя были доведены до успешного завершения работами ученика Менделя — проф. Роуза из Иллинойса . [c.7]
После того как Ц, Роуз, Г. Дж. Олмкуист, Р. Ц. Джексон, Г. Г. Митчель и др. доказали незаменимость для питания животного аминокислот — метионина, гистидина, лизина, триптофана, фенилаланина, треонина, лейцина, изолейцина и валина и особую важность цистина, аргинина, тирозина и гликоколя, стало возможно оценивать питательное значение белковых пищевых веществ на основании их аминокислотного состава. Сравнительно точное знание аминокислотного состава белков позволяет давать приблизительную оценку их питательности и, что важнее, дает возможность подбирать разные белки таким образом, чтобы они взаимно дополняли друг друга. Такой метод подбора пищевых рационов сокращает много времени и средств, которые тратились раньше при применявшемся до сих пор способе проб и ошибок в опытах на животных. [c.7]
Таким образом, для чисто химических или физико-химических исследований основным требованием является точность для широкого обзора в области пищевых белков самое первое, что нужно, это — получить возможно больше материала по присутствию и содержанию незаменимых аминокпслот. В нашей практике часто встречалось, что пищевой белок является хорошим источником больщинства незаменимых аминокислот, которые легко определить (именно цистин, метионин, аргинин, гистидин, лизин, тирозин и триптофан), и все же неполноценен в отношении других аминокислот, для выявления которых нет простых и точных способов определения. Если в таких случаях руководствоваться только анализами первой группы аЛтинокислот, то можно было бы впасть в серьезную ошибку при биологической оценке данного белка. Поэтому только полный анализ аминокислот, имеющих значение для питания, может дать правильную и полноценную картину исследуемых продуктов, даже если определение отдельных аминокислот будет произведено не абсолютными, а скорее сравнительными методами. [c.9]
Н. И. Луиип проводил свои опыты иа мышах, содержавшихся на искусственно приготовленной пище. Эта пища состояла из смеси очищенного казеина (белок молока), жира молока, молочного сахара, солей,входящих в состав молока, и воды. Казалось, налицо были все необходимые составные части молока мелоду тем мыши, находившиеся на такой диете, не росли, теряли в весе, переставали поедать даваемый им корм и, наконец, погибали. В то же время контрольная партия мышей, получавшая натуральное молоко, развивалась совершенно нормально. На основании этих работ Тунин в 1880 г. пришел к следующему заключению …если, как вышеупомянутые опыты учат, невозможно обеспечить жизнь белками, жирами, сахаром, солями и водой, то из этого следует, что в молоке, помимо казеина, жнра, молочного сахара и солей, содержатся еще другие вещества, незаменимые для питания. Представляет большой интерес исследовать эти вещества и изучить их значение для питания . [c.134]
Отсюда ясно, какое огромное значение в питании человека имеет подбор белков пищи таким образом, чтобы получился оптимальный состав аминокислот для удовлетворения всех потребностей человека. В Советском Союзе Б. И. Збарским и сотрудниками проделана большая работа по определению аминокислотного состава белков органов и тканей человека. Так как в белках одних пищевых продуктов некоторые аминокислоты встречаются в небольшом количестве, то, естественно, надо стремиться добавлять эти аминокислоты путем одновременного потребления таких пищевых продуктов, в белках которых эти аминокислоты находятся в большом количестве. А. Э. Шарпенак провел большую работу по определению аминокислотного состава белков различных пищевых продуктов и составлению на основании этого рационов для человека, в которых белки различных пищевых продуктов дополняют друг друга своими аминокислотами и дают, таким образом, биологически ценное пита[ше. [c.310]
Чем опасен избыток белка в рационе – блог justfood
По статистике половина всего населения Земли недовольна своей внешностью. В стремлении быть сильными, здоровыми и красивыми мы тщательно следим за питанием, посещаем тренажёрный зал и внимательно изучаем свое отражение в зеркале для оценки результатов своих стараний. Все, кто интересуется здоровым питанием и спортом, в курсе, что для наращивания мышечной массы и получения красивого мышечного рельефа необходимо потреблять много белка. Ведь именно он является основным строительным материалом для мышечной ткани.
Белок имеет огромное значение для человеческого организма. Это не только крепкие мышцы, но и упругая кожа, здоровые ногти и волосы. Белки участвуют в большинстве обменных процессов.
Однако иногда желание получить результат как можно скорее пересиливает здравый рассудок. Основываясь на поверхностных сведениях и не придавая должного значения дозировке, режиму приёма пищи, да и вообще не имея понимания необходимости соблюдения баланса КБЖУ, многие стараются просто максимально увеличить содержание белка в своём рационе. К сожалению, такие действия могут привести к нежелательным, а иногда и вовсе неожиданным последствиям.
Если у вас:
- ● Постоянная жажда
- ● Проблемы с пищеварением
- ● Неприятный запах изо рта
- ● Постоянно плохое настроение
то возможно ваш организм страдает от переизбытка белка. Это основные симптомы перенасыщения белковыми соединениями. Во-первых, богатое белками и бедное углеводами и жирами питание создаёт нагрузку на отдельные органы – почки и печень. Отсюда постоянная жажда и проблемы с пищеварением. Они в свою очередь провоцируют сбои в выработке гормонов, которые становятся причиной эмоциональных и в особо запущенных случаях – эндокринных сбоев.
Переизбыток белков провоцирует усиленную работу почек, необходимую для выведения продуктов их распада. Переизбыток белков и недостаток клетчатки – прямой путь к проблемам с желудком со всеми вытекающими: вздутие, тяжесть, диарея, изжога и иже с ними.
Если вышеперечисленные симптомы обошли вас стороной, или их проявления остались незамеченными, то в долгосрочной перспективе повышенное содержание белка и недостаток других питательных веществ в рационе способны провоцировать неблагоприятные изменения в эмоциональном состоянии, вплоть до депрессии и хронической усталости. Дело в том, что для выработки серотонина организму необходимы углеводы. При их недостатке выработка гормона радости существенно сокращается. Ситуацию усугубляют проблемы с пищеварением, дефицит кальция в костных тканях, снижение иммунитета, быстрая утомляемость и потеря мышечного тонуса. То есть результат мы получаем обратный желаемому.
Что же делать? Следовать простой истине «Всё хорошо в меру»! Все основные питательные компоненты организм должен получать с пищей в сбалансированной дозировке. Переизбыток любого способен привести к неблагоприятным последствиям, поэтому нужно следить за своим рационом с особой тщательностью, особенно если вы поставили себе цель добиться с помощью питания тех или иных результатов.
Помните, что норма белка составляет не более 3грамм на килограмм веса, а его общая доля не должна превышать 30% всего рациона. Употребляя максимально допустимую дозу белка, не забывайте дополнять свой рацион богатыми клетчаткой овощами, чтобы дать возможность своему организму правильно переварить довольно сложный в усвоении белок. При этом не забывайте, что на сам процесс расщепления белков потребуется немало энергии, так что вместе с белковой пищей организму необходимо получить и достаточное количество углеводов.
Если у вас нет возможности самостоятельно следить за количеством белка в своём рационе, то воспользуйтесь услугами сервиса доставки готового правильного питания justfood.pro. Кроме выверенного и сбалансированного по КБЖУ рациона в соответствии с вашими целями, так вы получите возможность освободить время, необходимое на подбор и приготовление продуктов. Всё что нужно сделать – это просто открыть нужный контейнер, разогреть своё правильное здоровое питание и съесть его.
Разнообразие программ позволяет получить подходящее питание для любой цели – от простого поддержания веса и состояния организма в норме до усиленного калориями питания для спортсменов, насыщенного белками – для бодибилдеров или со сниженной калорийностью для сушки или похудения. При этом все заботы по расчёту калорийности, содержания белков, жиров и углеводов, веса или размера порции мы берём на себя. Всё что нужно сделать вам – просто выбрать нужную программу.
Белки, связывающие тиреоидные гормоны и их физиологическая роль | Свиридов
Стероидные и тиреоидные гормоны окалывают регуляторное действие на целый комплекс физиологических процессов, составляющих основу нормального развития и функционирования организма. В русле крови человека от 96 до 99,9% общих масс кортизола, прогестерона, тироксина (Т- и трийодтиронина (Т3) циркулируют в виде комплексов с гормонсвязывающими транспортными белками (53]. Гипотеза «свободных гормонов» [68, 70] отводит этим транспортным белкам пассивную функцию поддержания стационарного пула биологически активных несвязанных гормонов за счет быстрой диссоциации комплексов в ответ на потребности тканей-мишеней. Исследования последних лет выявили активную роль транспортных белков и их рецепторов на поверхности клеточных мембран во взаимодействии стероидных и тиреоидных гормонов с компетентными тканями.
Структурные аспекты биологической активности комплексов кортикостероидсвязывающего и сексстероидсвязывающего глобулинов с природными лигандами подробно изложены в обзорной статье [76]. Настоящий обзор литературы посвящен описанию физико-химических свойств и биомедицинских характеристик многокомпонентной системы белков, связывающих тиреоидные гормоны в плазме крови человека. Особое внимание уделено рассмотрению физиологического значения этих белков в рамках гипотезы свободных гормонов и в свете их недавно обнаруженных специфических транспортных функций.
- Гипотеза: свободных горооиов о роли Т4—
связывающих Осикло оиааоы чсилвска
Содержание не связанных с белками тиреоидных гормонов в сыворотке человека не превышает 0,4% от их общей концентрации. Однако тиреоидный статус человека в норме и при заболеваниях, а также механизмы многих физиологических процессов с участием Т, и Т, можно объяснить биологической активностью свободных гормонов и количественно оценить путем определения их концентрации. Гипотеза о свободных гормонах, которая была выдвинута еще в 50-х годах [68], получила затем экспериментальное и теоретическое развитие, а недавно была представлена в виде физиологически обоснованной математической модели [53].
Рассмотрим, придерживаясь сложившейся в этой области терминологии, как гипотеза свободных гормонов в свете накопленных за длительный период экспериментальных данных определяет (физиологическое значение транспортных белков плазмы [53, 68, 70].
- Резервная функция. Тироксинсвязывающис белки обеспечивают накопление и хранение тиреоидных гормонов вне щитовидной железы.
- Буферная функция.Ткани защищены от неконтролируемого избыточного поступления гормона и захватывают его из постоянно возобновляемого свободного пула в соответствии с метаболической потребностью.
- Высвобождающая функция. Связана со второй функцией и основана на том, что кинетические характеристики обратимого гормон-белкового взаимодействия обеспечивают за счет быстрой диссоциации комплексов постоянное возобновление функции свободных гормонов.
1 Автор выражает благодарность д-ру Jacob Robbins (отдел генетики и биохимии, Национальный институт здоровья США) за методическую помощь в подготовке этого обзора.
Резервная функция вносит существенный вклад в тиреоидный гомеостаз, который заключается в поддержании постоянства поступления тиреоидного гормона в ткани и обеспечивает стационарный характер гормонального действия. Биохимическим индикатором резервной функции служит отношение средней концентрации общего Т, (100 нМ) к средней концентрации свободного Т- (30 пМ)в сыворотке. При отсутствии высокоаффинного Т—связывающего глобулина (ТСГ) в сыворотке это отношение уменьшается более чем в 3 раза, тогда как удаление среднеаффинного Т—связывающего преальбумина (ТСПА, транстиретин) или низкоаффинного альбумина дает лишь незначительный эффект. Значит, ТСГ сыворотки является главным периферическим запасающим белком для Т-, секретированного щитовидной железой. Соответствующий биохимический индекс для Т3 (2 нМ/8 пМ) мал и может обсуждаться в связи с механизмом доставки гормона тканям, а не с его резервированием в сыворотке. Существенный вклад в понимание важности резервной функции Т—Связз1вающих белков внесли данные о том, что транспортные белки обеспечивают равномерное распределение поступившего тиреоидного гормона по всем клеткам органа [51, 53]. Хотя альбумин в принципе сам способен выполнить эту роль, действие ТСГ может быть более эффективным из-за меньшей чувствительности к физиологическим вариациям содержания жирных кислот [53].
Эффективность выполнения транспортным белком буферной функции зависит от величины К4 его комплекса с тиреоидным гормоном, которая должна быть одного порядка с концентрацией свободного гормона в сыворотке. Сравнение значений концентрации свободного Т- (3,4 -10-11 М) и Ка ТСГ (10_10 М) показывает, что, хотя ТСГ и не самый оптимальный буфер, но все же более подходящий для этой роли, чем остальные гораздо менее аффинные Т—связывающие белки. Физиологическое значение буферной функции ТСГ выведено, в частности, из наблюдений за больными с наследственным отсутствием ТСГ. Эти больные имели повышенные концентрации тиреоглобулина в сыворотке вследствие ответной реакции щитовидной железы на увеличенную секрецию тиреотропина из-за больших флюктуаций содержания свободного Т- в сыворотке, лишенной ТСГ и обладающей пониженной буферной емкостью [70].
Физиологическая роль и механизм проявления гормонвысво- бождающей функции ТСГ явились предметом дискуссии, что нашло отражение в ряде противоречивых публикаций [32, 52, 55, 56]. W.Pardridge и соавт. [55, 56], основываясь на результатах экспериментов по перфузии органов in vivo, сделали вывод, что Т-, связанный с ТСГ, поступает только в некоторые органы, например печень, и недоступен для других, в частности для мозга, тогда как комплекс Т- с альбумином является главным источником гормона для всех тканей. Высвобождение тиреоидного гормона происходит внутри капилляров из-за резкого снижения гормон-белкового сродства под действием ингибирующих факторов [55]. Другие авторы [32, 52, 70], исходя из теоретических расчетов и собственных экспериментальных данных, показали, что скорость диссоциации комплекса и количество высвобождающегося гормона в равновесных условиях достаточны для удовлетворения потребностей любой ткани, т.е. избирательная доставка гормона в ткань за счет усиленной диссоциации в специфических условиях капиллярного транзита не может играть определяющую роль.
Трудно усомниться в фундаментальном положении гипотезы активных свободных гормонов о том, что связанные в системе транспортных белков Т- и Т3 могут переходить по законам термодинамики в свободный пул и следовать далее по пути метаболизма, включающему взаимодействие со своими мембранными рецепторами. Однако эта гипотеза оставляет открытым во-
Таблица i Многокомпонентная система белков, связывающих тиреоидные гормоны в плазме человека
Белок | Концентрация в плазме1, мг/л | Молекулярная масса, кД | К.-ит5, м-‘ | Ссылка | |
для Т4 | для Tj | ||||
ТСПА | 250 | 53 | 700“ | 100“ | 169.70] |
Альбумин | 42 000 | 66 | 5“ | 1“ | 158,70] |
ТСГ | 15 | 54 | 100 000 | 5 000 | 169.701 |
АпоА-1 | 1 500 | 28 | 750 | -7 | [17,71] |
АпоА-И | 350 | 17,5 | -10 | — | [22,71] |
AnoA-IV | 18 | 46 | -10 | — | [22,71| |
АлоВ-100 | 1 000 | 550 | 25 | — | [18,711 |
АпоС-1 | 50 | 6,6 | -10 | — | 117,711 |
АпоС-П | 40 | 8,8 | -10 | — | [17,7Ц |
АпоС-Ш | 130 | 8,8 | -10 | — | 117,71] |
АпоЕ | 45 | 34 | -10 | — | [22,711 |
IgA | 2 100 | 160 | 14 | — | 18.61] |
IgG | 12 500 | 150 | 20 | — | [8,611 |
IgM | 1 250 | 950 | 1 100 | 70 | 18.61] |
* Даны средние значения из диапазонов, приведенных в литературе |61, 70, 71|.
“ Равновесный параметр для первого высокоаффинного центра связывания.
прос о специфических функциях транспортных белков, присутствующих во внеклеточных жидкостях , в процессах взаимодействия тиреоидных гормонов с компетентными клетками. Дело в том, что данная гипотеза принимает во внимание главным образом кинетические и термодинамические аспекты гормон-бел- ковых взаимодействий, определяемые микроструктурой активных центров, оставляя на втором плане специфические физико-химические свойства макромолекулы в целом и ее характерные структурные элементы. Поэтому в следующем разделе нашей статьи перед тем, кай рассмотреть данные литературы об активной роли некоторых транспортных белков во взаимодействии тиреоидных гормонов с клеткой, мы остановимся на обсуждении макромолекулярных свойств отдельных компонентов системы Т4-связывающих белков плазмы.
- Свойства и специфические транспортные функции многокомпонентной системы бслкоо, тоязыонющех тетсоедныс оор- мосы о елнзмс еслооскн
Долгое время считали, что плазма крови человека содержит только три белка, взаимодействующих с тиреоидными гормонами: ТСГ, ТСПА и альбумин [68, 69]. В последнее время обнаружено новое свойство известных белков — аполипопротеинов и нормальных иммуноглобулинов плазмы — способность специфически связывать тиреоидные гормоны и регулировать их поступление в ткани-мишени [4, 6, 8, 19, 22]. Выявлена также активная роль “классических” Т4-связывающих белков во взаимодействии тиреоидных гормонов с клеткой [1, 30, 41, 51]. Таким образом, в настоящее время можно говорить о системе транспортных белков плазмы, компоненты которой связаны между собой и тиреоидными гормонами общим термодинамическим соотношением и в то же время выполняют индивидуальные функции по направленной доставке одного из двух гормонов в специфические ткани.
Подвижность компонентов системы Т4-связывающих белков сыворотки человека при электрофорезе в полиакриламидном геле уменьшается в следующем ряду: ТСПА, альбумин, ТСГ, липопротеины, иммуноглобулины. Применение элекрофоретической техники высокого разрешения позволяет провести анализ распределения связанных \ треоидных гормонов в этом ряду и сделать полезные для медицинской диагностики выводы о содержании и биологической активности как отдельных транспортных белков, так и системы в целом. Мы же используем указанный порядок при описании свойств компонентов системы Т — связывающих белков сыворотки человека, чтобы избежать произвольного разделения этих белков на важные и второстепенные поскольку их биологически обоснованная иерархия будет создана, судя по темпам исследований только в ближайшем будущем. В табл. 1 приведены основные характеристики системы транспорта тиреоидных гормонов в плазме человека.
II.1. ТСПА
ТСПА имеет мол. м—53 кД и является негликозилированным тетрамером четырех идентичных субъединиц, каждая из которых состоит из 127 аминокислотных остатков [46].
Высокоочищенный ТСПА доступен в больших количествах благодаря разработке эффективных способов его выделения традиционными методами белковой химии [14] и хроматографией по сродству к тиолсефарозе и иммобилизованному ретинолсвязывающему белку [34]. Однако из-за особенностей строения своего активного центра ТСПА практически не взаимодействует с биоспецифическими сорбентами, содержащими иммобилизованный тиреоидный гормон [6, 37].
Аминокислотная последовательность ТСПА, определенная прямым секвенированием белка [46], полностью соответствует последовательности нуклеотидов в клонированной кДНК для ТСПА [50]. Кристаллографические исследования белка при высоком разрешении (1, 8 А) дали исчерпывающую информацию о структурах высокого порядка, в частности о необычно большом вкладе Р-структуры, наличии короткого а-спирального участка и о пространственной организации Т4-связывающих центров [23, 24]. ТСПА — очень стабильный белок: по данным спектроскопии ‘Н-ЯМР [66] его вторичная и третичная структуры устойчивы даже при 80°С.
ТСПА имеет два одинаковых по строению [23], но различающихся по сродству и емкости центра связывания тиреоидных гормонов с К-7-10 7 и 710s M_1 (для Т4), 1 ТО7 и 6 -10s М_1 (для Т3) при pH 7,4 и 37°С [70]. Взаимодействие Т4или Т3 с одним из центров вызывает отрицательную кооперативность связывания по другому центру, и поэтому почти все молекулы ТСПА несут только по одной молекуле гормона [69]. Время полужизни комплекса ТСПА с Т4и Т3 составляет 7,4 и1,0 с соответственно [70]. Молекула ТСПА содержит на своей поверхности четыре идентичных, независимых от Т, центра взаимодействия с ретинолсвязывающим белком (Ke~106— 107 м_|), из которых in vivo занят только один [42].
Соединения, существенно отличающиеся по структуре от йод- тиронинов, также способны взаимодействовать с Т4-ввязьшаю- щим центром ТСПА. Среди них наиболее изучены барбитал, 8- анилин-1-нафталинсульфокислота, 2,4-динитрофенол, салицилаты и пенициллин [68, 70]. Недавно [54] было проведено системное исследование различных классов химических соединений, обладающих лекарственными свойствами, которые конкурируют со [1И1|-Т4 за связывание с ТСПА и другим высокоаффинным транспортным белком ТСГ. Показано, что эти два белка существенно различаются по сродству к изученным лекарствам. Так, с ТСПА особенно сильно взаимодействуют соединения ряда антраниловой кислоты (потенциал связывания 175—20% относительно Т4), причем флуфенамовая кислота связывается активнее самого Т4. В отличие от связывания с ТСГ комплексообразование ТСПА с Т4в существенной степени ингибируется салицилатом и ацетилсалициловой кислотой и не подвержено влиянию дифенилгидантоина [54].
Биосинтез ТСПА происходит главным образом в печени [25], центральной нервной системе [29] и в глазу [49] млекопитающих. Время полужизни этого белка в системе кровообращения человека составляет около 2 сут. Концентрация ТСПА в нормальной сыворотке варьирует от 100 до 400 мг/л. Регуляторное действие на биосинтез ТСПА оказывают половые и анаболические стероиды, половые стероидные гормоны и наркотические вещества [69]. Концентрации ТСПА и ТСГ в сыворотке изменяются под действием этих соединений в противоположных направлениях. Эстрогены, в частности, при беременности вызывают умеренное снижение уровня ТСПА, тогда как андрогены стимулируют увеличение содержания этого белка. Пониженные концентрации ТСПА были выявлены в сыворотке людей, принимающих героин и метадон [69]. Интересной с медицинской точки зрения характеристикой метаболизма ТСПА является снижение его концентрации при некоторых нетиреоидных заболеваниях, травмах, реакции острой фазы и недостатке питания [72]. Повышенное содержание ТСПА в сыворотке наблюдается при некоторых формах рака, в частности при карциноме поджелудочной железы [62].
Относительно небольшой по размерам ген ТСПА (7300 пар оснований) состоит из четырех эксонов и отличается высокой эволюционной стабильностью. Так, выявлено 90% гомологичных структур в ТСПА человека и крысы [36]. Некоторые авторы [45] на основании данных о структурной гомологии относят ТСПА к семейству гастроинтестинальных пептидов, к которому принадлежат глюкагон, секретин, вазоактивный пептид кишечника, ингибиторный пептид желудка и глицентин.
Неизвестны генетические нарушения, проявляющиеся при полном отсутствии ТСПА у человека. Вместе с тем обнаружены шесть генетических вариантов ТСПА с заменами одного аминокислотного остатка в полипептидной цепи. Один из вариантов имеет повышенное сродство к Т4, четыре других варианта у больных с наследственной амилоидотической полинейропатией и молекулярный вариант ТСПА при системном сенильном амилоидозе обладают более низким или нормальным сродством к Т4 [13, 64, 72].
Микрогетерогенность ТСПА, не связанная с генетическими факторами и посттрансляционной модификацией, обнаружена при изоэлектрическом фокусировании сыворотки [59]. Два химических агента, не относящихся к аминокислотам, и компоненты глутатиона способны ассоциировать с ТСПА, обусловливая микрогстерогенность белка и изменение сродства кТ4 [60]. Этим же методом в присутствии 8 М мочевины выявлены два компонента в пуле высокоочищенного ТСПА, введение которых в русло крови кролика существенно увеличивает обратный ток тиреоидных гормонов из внесосудистого пространства в кровоток. По мнению авторов [48], усиление обмена тиреоидных гормонов под действием экзогенно вводимых связывающих белков может иметь терапевтическое значение при плазмаферезе и гемофильтрации в случаях тяжелого тиреотоксикоза.
В литературе [13] обсуждалась особая функция ТСПА в центральной нервной системе. Предполагалось, что ТСПА переносит связанный тиреоидный гормон в спинномозговую жидкость. Однако позднее на биологической модели in vivo было показано, что ТСПА человека, химически конъюгированный с N-бро- мацетил-[1251 ]-Т4, не проникает из плазмы в спинномозговую жидкость крысы [28]. Тем не менее весьма вероятно, что Т4, поступающий из плазмы в эпителиальные клетки хориоидного сплетения, связывается с синтезированным in situ ТСПА, образовавшийся комплекс секретируется в спинномозговую жидкость и распределяется в мозге [29].
В цикле работ Ш.С.Азимовой и соавт. [1—3] с использованием биологической модели in vivo н очищенных гомологичных ТСПА человека и крысы изучена физиологическая роль комплексов тиреоидных гормонов с ТСПА. Комплекс ТСПА — тиреоидный гормон из сыворотки проникает через плазматическую мембрану в клетки-мишени [1]. В компетентных клетках комплекс локализуется на рибосомах, митохондриях, в липидных каплях и аппарате Гольджи. В клетках, не чувствительных к тиреоидным гормонам, небольшое количество поступившего ТСПА концентрируется- в лизосомах. Исследование транслокации ТСПА в различные субмптохондриальные фракции показало, что белок из цитоплазмы проникает через внешнюю мембрану и локализуется на внутренней мембране и матриксе митохондрий [2]. Найдено также, что ТСПА поступает в клетки печени, мозга и легких, транслоцируется из цитозоля в ядро и акцентируется хроматином, не подвергаясь при этом модификациям, затрагивающим его антигенные детерминанты [3]. На основании результатов сравнительного изучения структур ТСПА и клеточных рецепторов тиреоидных гормонов, а также данных о транслокации через плазматическую мембрану и внутриклеточном транспорте ТСПА сделан вывод о том, что ТСПА представляет собой базовую часть истинного рецептора тиреоидных гормонов.
По мнению авторов [55], механизм проникновения Т4 в орган может состоять либо в диссоциации комплекса под действием неконкурентного ингибитора в микроциркуляции печени, либо во взаимодействии ТСПА со специфическим рецептором на внешней поверхности клеточной мембраны.
С-Divino и G.Schussler [30] показали, что ТСПА, добавленный в разбавленную сыворотку или раствор альбумина человека, усиливает поглощение Т4 в культуре клеток гепатомы НЕр G2 человека. Это побудило авторов [30] изучить возможность прямого взаимодействия ТСПА со специфическими связывающими центрами на поверхности клеток НЕр G2. Найдено, что связывание ТСПА с клетками данной линии зависит от температуры и времени, причем термодинамическое равновесие наступает через 2 ч инкубации. Анализ взаимодействия по методу Скетчарда выявил один класс эквивалентных центров связывания с К„~5 нМ при 4°С и 14 нМ при 37°С. После протеолитического разрушения ТСПА, связанного на поверхности клеточной мембраны, определили, что 88% белка иитернализусгся клеткой. Насыщение связывающих центров ТСПА гормоном усиливало захват и интернализацию белка. Т4 и негормональные лиганды (салицилат и синтетический флавон EMD 21388) стимулировали поглощение нормального ТСПА и его молекулярного варианта с точечной заменой в положении 30 полипептидной цепи клетками астроцитомы и гепатомы [73]. Сделан вывод о том, что взаимодействие между ТСПА и его клеточным рецептором является частью механизма активного транспорта Т4 в клетку и может обусловливать дополнительные метаболические эффекты гормона.
II.2. Альбумин
Альбумин человека состоит из одной негликозилированной полипептидной цепи с мол. м. 66 кД. Известна последовательность 548 аминокислотных остатков этого белка. Из них 48% составляют (-структуру, а 15% образуют а-спиральные участки. Охарактеризованы три главных домена в полипептидной цепи с повторяющимися аминокислотными последовательностями. В русле крови альбумин транспортирует многие низкомолекулярные физиологически активные вещества, в том числе жирные кислоты, аминокислоты, билирубин, ионы металлов, стероиды и йодтиронины. Ген альбумина расположен на длинном плече хромосомы 4. Из 15 эксонов гена два кодируют сигнальный пептид из 18 аминокислотных остатков и пропептад из 6 остатков [58]. Альбумин продуцируется печенью в 25 и 1250 раз более интенсивно, чем соответственно ТСПА и ТСГ. Его концентрация в нормальной сыворотке составляет в среднем 4200 мг/мл, а время полужизни в кровообращении — 13 сут. Содержание альбумина в сыворотке умеренно снижается при циррозе печени, нефрозе, воспалительных реакциях, травмах [70]. В одном [58] из множества обзоров, посвященных альбумину, можно найти полные сведения о его структуре, физико-химических свойствах, молекулярной генетике и метаболизме. Мы же остановимся далее на описании свойств комплексов альбумина с тиреоидными гормонами.
Альбумин содержит один относительно высокоаффинный центр связывания йодтиронинов с Ка 5 46s М~’ (для Т4) и Г ■105 М“‘ (для Т,), а также от 2 до 6 центров низкого сродства с Ко 5 ТО4 М-1 (для Т4) и 5 ТО3 М—‘ (для Т3) [70]. Связывание тиреоидных гормонов с альбумином ингибируется жирными кислотами и другими органическими анионами [70], а также ЫаС1 в физиологических концентрациях [77].
В дополнение к “нормальным” центрам связывания Т4 при генетических повреждениях молекулы альбумина обнаружен центр с Ка 7 10е М_‘. Этот аналог в небольших количествах присутствует в нормальной сыворотке, и его концентрация резко повышается при дисальбуминемической гипертироксинемии [42]. При этом заболевании около 25% общего альбумина проявляет повышенное сродство к Т4, что приводит к существенному увеличению количества гормона, переносимого этим транспортным белком [42]. Важное для медицинской диагностики аномальное связывание Ри1]-Т4 с альбумином легко выявляется после ингибирования ТСПА барбиталом и инактивации ТСГ обработкой сыворотки при pH 3,0 [12].
О специфической роли альбумина в транспорте тиреоидных гормонов в ткани сообщалось лишь в нескольких публикациях [47,51, 81]. Было высказано предположение, что альбумин может опосредовать усиленное поглощение связанных с ним йод- тироиинов печенью за счет взаимодействия белка со своим рецептором на гепатоцитах [81]. В другой работе [47] отмечают факт интернализации комплекса Т3—альбумин периферическими лейкоцитами человека. С.Мепбс1 и соавт. [51] в экспериментах на крысах показали, что 4% раствор альбумина человека, не содержащий ТСПА и ТСГ, при введении вместе со [ |г55]-Т, через портальную вену в печень обеспечивает равномерное распределение меченого гормона по всем клеткам органа, тогда как при перфузии печени не связанным с альбумином [ч51]-Т4 весь гормон захватывается перипортальными клетками.
П.3. ТСГ
ТСГ имеет мол. м. 54 кД и в отличие от ТСПА и альбумина является гликопротеином, содержащим 23% сахаров по массе.
Современные эффективные методики выделения и очистки ТСГ основаны на лигацд-аффинной хроматографии [6, 37].-антихимотрипсином (58% гомологии),а,-антитрипсином (53%) и антитромбином III (27%) [35]. Интересно, что к тому же семейству относится и транскортин человека [40], хотя ни ТСГ, ни транскортин не обладают свойствами антипротеаз. Ген ТСГ расположен в средней части длинного плеча хромосомы X между полосами Xq 11 и Xq 23 [79]. Кодирующая область гена ТСГ состоит из 1245 пар оснований, организованных в 4 эксона [35]. Сведения о вторичной структуре ТСГ получены на основании характеристик кругового дихроизма и флюоресцентных свойств белка [38, 74]. ТСГ содержит примерно равные доли а-спирали и [3-структуры. Расчеты термодинамических параметров плавления третичной структуры ТСГ по данным микрокалориметрии показывают, что в ТСГ присутствуют два близких по пространственной организации домена.
Оба тиреоидных гормона и их структурные аналоги связывают по одному центру в молекуле ТСГ. При 37°С и pH 7,4 значения К составляют 1 1010 и 5 -10® М-1 для Т4 и Т3 соответственно [70]. Несмотря на очень высокую энергию связывания, прибл!гжающуюся по порядку к энергии химических реакций, взаимодействие является обратимым. Диссоциация комплексов ТСГ с тиреоидными гормонами протекает достаточно быстро: время полужизни равно 4 и 39 с соответственно для Т, и Т4 [70|. Т4 имеет структуру наиболее предпочтительного лиганда для ТСГ. Тем не менее этот белок способен связывать, хотя и с невысоким сродством, многие соединения, которые имеют лишь частичное структурное сходство с Т4. Так, сообщалось о взаимодействии с Т4-связывающим центром ТСГ лекарственных препаратов 5,5‘-дифенилгидантоина, фенклофенака, диазепама, салицилатов [69]. Кроме того, ТСГ связывает 8-анилин-1-нафталинсульфонат, что используется в исследованиях комплексообразования методами флюоресцентной спектроскопии и для вытеснения Т4 из комплекса с ТСГ при иммуноанализе [70].
ТСГ синтезируется в печени [13]. Его концентрация в нормальной сыворотке составляет 15—30 мг/л. Время полужизни ТСГ в кровообращении 5 дней [63]. Ряд природных и синтетических препаратов способны увеличивать (эстрогены, героин, метадон, 5-фторурацил, перфеназин, клофибрат) или уменьшать (андрогены, глюкокортикоиды, анаболические стероиды) содержание ТСГ в организме человека [69]. Высокие концентрации ТСГ в сыворотке обнаружены при остром вирусном гепатите, хроническом активном гепатите и первичном циррозе печени [72]. Поскольку повышенные концентрации ТСГ были выявлены у 92% больных с гепатоклеточной карциномой, то его можно считать надежным, хотя и неспецифическим, онкомаркером [78]. Скорость продуцирования этого белка снижается как при гипотиреозе, так и при тяжелом тиреотоксикозе. Клиренс замедляется при состояниях с аномально низкими концентрациями тиреоидных гормонов в плазме и усиливается при тиреотоксикозе. Этот сложный эффект тиреоидных гормонов обусловливает значительные колебания концентраций ТСГ в плазме людей с нарушениями функции щитовидной железы [70].
В последнее время интенсивно изучаются генетические варианты ТСГ. На молекулярном уровне установлены три типа альтераций гена ТСГ: делеция одного нуклеотида, замещение одного нуклеотида и замещение двух нуклеотидов [44]. Эти аномалии гена проявляются как наследственное полное отсутствие ТСГ в плазме человека или в виде генетических вариантов с заменами соответственно одного или двух аминокислотных остатков, пониженным сродством к тиреоидным гормонам, измененными зарядовыми свойствами и повышенной термолабильностью [65].
Из девяти описанных в литературе молекулярных вариантов ТСГ три имеют общую замену лейцина на фенилаланин в положении 283 наряду со специфичными для них мутациями. Такая же замена в положении 283 характерна и для ТСГ, обладающего всеми свойствами нативного белка [44]. Это позволяет говорить о полиморфизме ТСГ по кодону 283. Такой полиморфизм ТСГ характерен для всех этнических групп населения [44]. Вместе с тем можно сделать неблагоприятный прогноз о том, что замещение в положении 283 в принципе может быть важным для появления иных специфических мутаций гена ТСГ.
Олигосахаридные цени ответственны за микрогетерогенность ТСГ и в существенной степени определяют скорость выведения этого гликопротеина из кровообращения [13]. В процессе клиренса особенно важны концевые сиаловые кислоты. Десиали- рованный ТСГ с экспонированными остатками галактозы имеет очень высокую скорость клиренса за счет быстрого поглощения гепатоцитов поверхностными рецепторами, способными связывать многие асиалогликопротеины [63].
Особую роль углеводный компонент играет в функционировании ТСГ при беременности. Гиперэстрогенемия, характерная для этого физиологического состояния организма, влияет на углеводную структуру ТСГ, что в свою очередь приводит к уменьшению на 15% скорости клиренса ТСГ [9]. Этим, однако, нельзя объяснить двукратное повышение содержания ТСГ при беременности [69]. По-видимому, как усиленный синтез, так и замедленный клиренс определяют повышенные концентрации этого гликопротеина в сыворотке беременных женщин.
При хроматографии чистого ТСГ из сыворотки ретроплацен- тарной (послеродовой) крови на конканавалин А-сефарозе гликопротеин разделяется на две фракции, одна из которых (ТСГ- 1), составляющая около 10% от общей массы, не взаимодействует с иммобилизованным лектином и элюируется в свободном объеме, а другая адсорбируется на аффинной колонке [10, 75]. Установлено, что ТСГ-1 является характерным для беременности структурным вариантом ТСГ с особым строением углеводного компонента и специфической микрогетерогенной структурой. В то же время ТСГ-1 не отличается от ТСГ нормальной сыворотки по аминокислотному составу, вторичной и третичной структурам полипептидной цепи, а также по строению и свойствам гормонсвязывающего центра. Изучение в модельных системах in vivo клиренса вариантов ТСГ показало, что ТСГ-1 и характерная для беременности высокосиалированная фракция ТСГ [9] выводятся из кровообращения крысы в 1,5—2,5 раза медленнее, чем вариант, соответствующий ТСГ нормальной сыворотки.
Разработана радиоиммунологическая система для количественного определения ТСГ-1 в сыворотке крови человека. Найдено, что в сыворотке крови здоровых доноров доля ТСГ-1 составляет в среднем 1,2% от уровня общего ТСГ, к сроку разрешения от беременности эта величина повышается до 8 % в сыворотке и 9,5% в амниотической жидкости и медленно снижается после родов, достигая через 5 мес значения, характерного для нормы [5]. По данным двух групп авторов [9], при злокачественных новообразованиях различной локализации и нарушениях функции печени доля ТСГ-1 составляет 3—10%.
Таким образом, ТСГ-1 является минорным компонентом плазмы крови человека в норме. Повышение концентрации общего ТСГ, вызываемое различными ненаследственными причинами, сопровождается увеличением доли ТСГ-1. Высказано предположение, что биосинтез структурного варианта ТСГ, содержащего только трехантенные олигосахаридные цепи со специфической микрогетерогенной структурой, представляет собой один из способов физиологической адаптации к увеличению потребности организма в ТСГ. Если возникает необходимость в увеличении концентрации ТСГ в крови, то реакция синтезирующего органа может состоять в избирательном усилении биосинтеза долгоживущего структурного варианта за счет изменения механизмов посттрансляционного гликозилирования полипептидной цепи.
Биологический смысл обсуждавшейся выше структурной гомологии между ТСГ и серпинами рассматривается в работе [57]. Ингибиторы сериновых протеаз в активной форме имеют напряженную (S) конформацию. В этой конформации у а -антитрипсина действию протеазы доступна петля, в которой надлежащим образом сближены остатки активного центра Met-358 и Ser-359. Под действием фермента петля разрывается и молекула антипротеазы претерпевает необратимый переход в расслабленную (R) конформацию, в которой эти два аминокислотных остатка удалены друг от друга. Такой конформационный переход сопровождается существенным увеличением термостабильности макромолекулы. По данным авторов [57], ТСГ и транскортин, имея родственную а.-антитрипсину третичную структуру, расщепляются эластазой нейтрофилов и приобретают повышенную тепловую устойчивость. При этом у транскортина в отличие от ТСГ существенно снижается сродство к лиганду. Таким образом, в случае комплекса транскортина с кортизолом S — R-переход in vivo с участием компетентных лейкоцитов при воспалительной реакции может приводить к высвобождению гормона и обеспечению доставки повышенных количеств глюкокортикоида к месту воспаления. Хотя у ТСГ и не выявлено изменений сродства к лиганду в результате конформационного S— R-персхода, возможность сайтспецифичного ферментативного расщепления этого белка может реализовываться в ходе взаимодействий с клетками-мишенями направленного транспорта тиреоидного гормона.
К.Hashizume и соавт. [41]впервые высказали экспериментально обоснованное предположение о том, что ТСГ выполняет транспортную функцию не только в сыворотке крови, но и на уровне плазматической мембраны клетки. В их работе изучено взаимодействие in vitro между периферическими моноядерными клетками человека и комплексами [12‘1 |-Т4 с интактным и дсси- ащроввнным ТСГ. Найдено, что связанный с белком гормон способен проникать в клетку. Процесс поглощения комплекса клеткой зависит от температуры, времени инкубации и состояния углеводных цепей связывающего белка. Механизм трансмембранного переноса может включать интернализацию тройного комплекса Т, — ТСГ — рецептор ТСГ.
Важной функцией ТСГ при беременности может быть его участие в переносе тиреоидных гормонов из плазмы матери в кровообращение плода [31]. Т, играет ключевую роль в раннем нейрогенезе, и ТСГ может опосредовать гормональную связь между матерью и плодом путем регуляции трансплацентарного переноса Т, [31, 33]. В этой связи особую функцию в фетопла- центарной системе может выполнять характерный для беременности структурный вариант гликопротеина ТСГ-1, которым обогащен общий ТСГ, обнаруженный в амниотической жидкости [5].
- Аполипопротеины
Аполипопротеины составляют один из самых представительных классов белков плазмы крови человека. Благодаря своей амфифильной структуре эти белки обладают способностью связывать и тем самым обеспечивать солюбилизацию липидов в водном окружении плазмы. В известном обзоре [71] подробно описаны структурно-функциональные свойства и биомедицинское значение аполипопротеинов.
Ранние наблюдения показали, что Т, и Т3 способны ассоциировать с липопротеидными частицами плазмы человека [43]. Позже с помощью аффинной хроматографии плазмы на Т,-сефарозе [11,39] и фотоаффинного ковалентного мечения липопротеинов высокой, низкой и очень низкой плотности (соответственно ЛПВП, ЛПНП и ЛПОНП) [|251]-Т4 [17, 18, 22, 39] было найдено, что апоА-I, апоА-П, anoA-IV, апоВ-100, апоС-1, апоС-П, апоС-Ш и апоЕ являются Т,-связывающими компонентами липопротеидных частиц. На основании результатов кинетических и равновесных экспериментов [7, 17, 18, 39] сделан вывод о том, что связывание тиреоидных гормонов с аполипопротеинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом взаимодействия со структурно обособленным центром в белке, комплементарным лиганду. Число таких центров в макромолекуле варьирует от I в апоА-1 [21] до 3 в апоВ-100 [18, 20]. Из изученных аполипопротеинов только апоА-I и его липидный комплекс апоА-I—ЛПВП проявляют достаточно высокое сродство к гормону (Ка 107 — 108 М_|) [7, 17].
Известно, что многие типы клеток человека имеют поверхностные рецепторы апоВ-100 и апоЕ, участвующие в доставке холестерина в клетку путем связывания и последующей интернализации комплекса ЛПНП — рецептор [71]. Па основе этого механизма был создана гипотеза о физиологической роли комплекса тиреоидного гормона с ЛППП, которая недавно получила экспериментальную проверку [19]. Авторы изучили поглощение [|251]-Т3 и [ШТ, фибробластами кожи человека, выращенными в присутствии обедненной липопротеинами сыворотки. При добавлении в среду фракции ЛПНП, апоВ-100 или апоЕ в концентрациях, достаточных для связывания гормона, но не превышающих емкость клеточного рецептора, наблюдали увеличение на 27—63% начальной скорости поглощения и количества поглощенного Т, (но не Т3) в состоянии равновесия. Этот эффект отсутствовал у клеток с дефицитом рецепторов (наследственная гиперхолестеринемия, низкая экспрессия рецепторов при избытке холестерина в среде). Специфический характер действия ЛПНП и соответствующих аполипопротеинов подтверждался тем фактом, что другие Т,-связывающие белки, наоборот, пропорционально своим концентрациям в среде снижали количество Т,, проникающего в клетку. Авторы [19] предположили, что существуют два пути транспорта Т, в фибробласты. Первый — через центры связывания свободного гормона на клеточной поверхности, второй, дополнительный путь, недоступный для Т3, — через рецепцию комплекса Т, — ЛПНП и интернализацию последнего.
- Иммуноглобулины
Иммуноглобулины образуют обширное семейство структурно родственных белков, которые состоят из двух пар полипеп- тидных цепей, удерживаемых дисульфидными мостиками и нековалентными связями. Пять таких стандартных четырехцепочных фрагментов, соединенных J-цепыо, присутствуют в IgM. Тяжелые цепи, включающие около 450 аминокислотных остатков, по своему строению разделяются на пять классов, что лежит в основе классификации иммуноглобулинов: IgG, IgA, IgM, IgD и IgE; Кроме того, существуют 4 подкласса IgG и 2 подкласса IgA. Легкие цепи (около 214 остатков) являются общими для всех классов иммуноглобулинов, хотя и могут различаться соотношением типов К и X. В семейство иммуноглобулинов входят также белки, которые не обладают активностью антител. Это миеломные белки, свободные субъединицы иммуноглобулинов и белки Бенс-Джонса. Подробные сведения о структурных, функциональных и генетических характеристиках иммуноглобулинов можно почерпнуть из авторитетного источника [61] и соотнести с излагаемыми ниже гормонсвязывающими свойствами этих гликопротеинов.
Впервые уникальный клинический случай связывания Т, с фракцией иммуноглобулинов сыворотки больного карциномой щитовидной железы был описан J.Robbins и соавт. [67]. В последовавших затем многочисленных наблюдениях и системных исследованиях охарактеризованы приобретенные изменения в системе транспорта тиреоидных гормонов у человека, которые заключаются в появлении аномальных связывающих белков, аутоантител, относящихся к иммуноглобулинам различных классов [16]. Относительное число случаев (частотность) обнаружения аутоантител к тиреоидным гормонам при массовых обследованиях взрослого населения не превышает долей процента, но при тиреоидных заболеваниях такие аутоантитела присутствуют у 5% больных [16].
В ходе работ по изучению “патологического” связывания гормонов щитовидной железы с аномальными белками были полу- чены.отдельные сведения о взаимодействии Т, и Т3 с нормальными иммуноглобулинами человека. Так, при оценке методики детекции анти-Т, (Т3) аутоантител в очищенной фракции иммуноглобулинов нормальной сыворотки отмечалось “неспецифи- чсское” связывание Т, и Т3 с нормальными IgG [27]. При экспериментальной проверке предположения об “иммуноглобулиновой” природе ингибитора связывания тиреоидных гормонов в сыворотке были получены данные, косвенно свидетельствующие о Т,-связывающих свойствах нормального IgM человека [15].
В ходе системного исследования Т4-связывающих белков плазмы человека с помощью нового методического подхода, основанного на использовании лиганд-аффинной хроматографии, было показано, что постоянными компонентами белковой смеси, биоспецифически выделяемой из рстроплацентарной и нормальной сывороток человека с помощью Т,-сефарозы, являются IgG и IgM [6]. Оставалось неясным, являются ли Т-ссвязы- вающие иммуноглобулины аутоантителами, т.е. аномальными белками, которые появляются при достаточно редких патологических состояниях, или же они относятся к нормальным транспортным белкам плазмы.
С целью ответа на этот вопрос изучены кинетические и равновесные характеристики взаимодействия Т, с IgA, IgG, IgM и белками Бенс-Джонса, выделенными в чистом виде из сыворотки крови человека[8]. Найдено, что комплексообразование Т, с иммуноглобулинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом. Необходимым и достаточным для связывания Т, компонентом молекулярной структуры иммуноглобулина является, по-видимому, L-цепь типа К или X. Ковалентное присоединение Н-цепи может резко увеличивать сродство к тиреоидному гормону (ц-цепь в IgM) или изменять чувствительность участка связывания к химическим агентам и pH среды (ц-цепь в IgM, у- цепь в IgG). Экспериментальные данные показывают, что Т,- связывающий IgM не принадлежит к /‘патологическому” типу белков — анти-Т, аутоантителам: зависимость реакции связывания Т, от физико-химических условий среды является типичной для нормальных траспортных белков; частотность обнаружения Т,-связывающего IgM в случайно выбранных индивидуальных пробах сыворотки здоровых людей составляет 100%; комплекс IgM — Т, структурно отличается от комплекса антиген — антитело, так как не способен взаимодействовать с первым компонентом комплемента. Авторы [8] считают, что специфические Т,-связывающие свойства иммуноглобулинов нормальной сыворотки могли долгое время оставаться нераскрытыми из-за недостатков традиционного метода анализа, который не способен обнаружить слабые проявления Т,-связывающей активности этих белков в физиологических жидкостях, содержащих эндогенный ингибитор С1~ и (или) экзогенный ингибитор 8-анм- лин-1-нафталинсульфокислоту.
Особая биологическая роль IgM выявлена в ходе экспериментов in vitro с использованием модельной системы тиреоидный гормон — связывающий белок — плазматическая мембрана микроворсинок сннцитиотрофобласта человека [,]. Важно отметить, что выбранная в качестве объекта исследования ткань формирует поверхность контакта между материнской кровью и плодом, является компетентной в отношении тиреоидных гормонов [11] и содержит поверхностные рецепторы иммуноглобулинов [61). В этой модельной системе очищенные ТСПА, альбумин, апоА-I, ТСГ, IgG и IgM при концентрациях, близких к Kj их комплексов с тиреоидными гормонами, оказывали пропорциональное концентрациям ингибирующее действие на свя-
Таблица 2
Активная роль лиганд-бслковых комплексов в трпспорте тиреоидных гормонов в клетки некоторых тканей
Бел ox | Лиганд | Клстке | Механизм | Ссылка |
ТСПА | т„т4 | Гепатоциты in vivo НЕр G2 in vitro | Рецепция и интернализация комплекса | 11.301 |
Альбумин | т4 | Гепатоциты in vivo | Равномерное распределение лиганда по всем клеткам органа | 151,531 |
ТСГ | т4 | Лейкоциты in vitro | Рецепция и интернализация комплекса | 141) |
АпоВ-100 | Т4 | Фибробласты in vitro | То же | H9J |
IgM | Т, | Плазматические мембраны плациенты in vitro | Увеличение числа Т3-связывающих мест за счет рецепции IgM мембранами | 141 |
зывание [,И1]-ТЭ или [1И1]-Т4 с мембранным рецептором тиреоидных гормонов. Зависимость мембранного связывания 1,ИЦ- Т4 от концентрации IgM в системе носила типичный для всех изученных белков характер. В случае Т3 такая зависимость была уникальной для IgM и включала фазу стимулирующего действия IgM (10-11—10~’ М) и фазу ингибирования (10~*—10~’М). В присутствии 30 пМ IgM на 75% увеличивалась концентрация мембранных мест связывания Т3 при снижении Ка в 2,2 раза. В отдельном эксперименте показано [5] , что IgM специфически взаимодействует с двумя типами связывающих центров на плазматических мембранах плаценты с Ка<1)=5,0 -10’ М_|, В =34 фмоль/мг общего мембранного белка и Ка( =2,7 10′ М-1, Вгоах(2)=2,0 пмоль/мг мембранного белка. Авторы [4] считают, что стимулирующий эффект IgM обусловлен увеличением числа Т3— связывающих мест на мембранах микроворсинок за счет образования комплекса IgM с его мембранным рецептором, проявляющего повышенную Т3-связывающую активность.
В табл.2 обобщены специфические транспортные функции Т4-связывающих белков плазмы человека.
Система транспортных белков, обратимо связывающих более 99% общей массы Т4 и Т3 в плазме крови человека, включает ТСПА, альбумин, ТСГ, апоА-I, апоА-Н, anoA-IV, апоВ-100, апоС-I, апоС-П,апоС-Ш, апоЕ, IgM, IgYj и IgA. В этот широкий спектр белков входят и их структурные варианты, отличающиеся элементами химического состава, некоторыми физическими свойствами и особенностями взаимодействия с йодтирони- нами. По величине сродства к тиреоидным гормонам связывающие белки можно условно разделить на три группы: низкоаффинные (альбумин, большинство аполипопротеинов, IgG и IgA; К ~105 —106 М~‘), среднеаффинные (ТСПА и апоА-1; К -10’ — 10* М_|) и высокоаффинные (ТСГ и его варианты; Ка —10’ — 10’° М“’). Существуют эффективные методы выделения и очистки этих белков. Известны строение генов, параметры биосинтеза и клиренса, первичная, вторичная и третичная структуры полипептидных цепей, физические свойства молекул.
Т4-связывающие белки плазмы не обладают генетическим родством, различаются по химическому строению и физическим свойствам и выполняют различные основные или дополнительные биологические функции. Их объединяет участие в термодинамическом равновесии со свободными гормонами и наличие структурно обособленного активного центра, в большей или меньшей степени комплементарного структуре йодтирони- на.
Гипотеза о свободных гормонах объясняет и количественно описывает все клеточные эффекты Т4 и Т3 на основе концентрации несвязанных гормонов в плазме, а связывающим белкам отводит резервную, буферную и гормонвысвобождающую функции. Исследования последн!о< лет выявили активную роль транспортных белков и их клеточных рецепторов в механизмах взаимодействия тиреоидных гормонов с компетентными тканями: комплекс Т4 — ТСГ интернализуется периферическими моноя- дерными клетками, Т3 и Т4, связанные с ТСПА, траислоциру- ются через плазматическую мембрану и распределяются между субклеточными фракциями печени и других органов, апоА-I избирательно усиливает поглощение Т4 фибробластами, a IgM стимулирует связывание Т3 с плазматическими мембранами плаценты.
Понимание фундаментальных основ функционирования многокомпонентной системы Т4-связывающих белков плазмы важно для диагностики заболеваний человека и правильного применения фармакологических средств, которые могут влиять на комплексообразование тиреоидных гормонов с танспортны- ми белками.
Поскольку многие компоненты системы Т4-связывающих белков участвуют в целом ряде хорошо изученных физиологических процессов, казалось бы, не имеющих прямого отношения к метаболизму йодтиронинов, интересно выяснить влияние связанного тиреоидного гормона на эти процессы.
В целом создается впечатление, что каждый отдельный Т4— связывающий белок может выполнять специализированную функцию по доставке одного из двух тиреоидных гормонов в специфическую ткань. Разнообразие транспортных белков и компетентных тканей дает широкий простор исследованиям, результаты которых должны появиться уже в ближайшем будущем.
1. Азимова Ш.С., Умарова Г.Д., Петрова О.С. и др. // Биохимия. — 1984. — Т. 49, № 8. — С. 1350 — 1356.
2. Азимова Ш.С., Умарова Г.Д., Петрова О. С. и др. // Биохимия. — № 9. — С. 1478 — 1485.
3. Азимова Ш.С., Умарова Г.Д., Тухтаев К.Р., Абдукаримов А.Р. // Биохимия. — № 10. — С. 1640 — 1646.
4. Карпыза Е.И., Киклевич И.Е., Ермоленко М.Н., Свиридов О.В. // Биохимия. — 1993. — Т. 58, № 2. — С. 285 — 293.
5. Свиридов О.В., Ермоленко М.Н., Будникова Л.П., Карпыза И.Е. // Пробл. эндокринол. — 1989. — № 2. — С. 48 — 52.
6. Свиридов О.В., Ермоленко М.Н., Пышко Е.С. и др. // Биохимия. — 1990. — Т. 55, № 2. — С. 329 — 337.
7. Свиридов О.В., Пышко Е.С., Ермоленко М.Н., Стрельченок О.А. // Там же. — № 11. — С. 2002 — 2010.
8. Свиридов О.В., Ермоленко М.Н. // Там же. —1994. — Т. 59, № i. — С. 78-87.
9. Ain К.В., Morí Y., Refetoff S. // J. clin. Endocr. Metab. — 1987. — Vol. 65, N 4. — P. 689-696.
10. Ain K.B., Refetoff S. // Ibid. — 1988.- Vol. 66, N 5. — P. 1037-1043.
11. Alderson R., Pastan I., Cheng S.Y. // Endocrinology. — 1985. — Vol. 116, N 6. — P. 2621-2630.
12. Arevalo G. // Clin. Chem. — 1988. -Vol. 34, N 4. — P. 705- 708.
13. Bartalena L. // Endocr. Rev. — 1990. — Vol. 11, N 1. — P. 47-63.
14. Bashor M.M., Hewett J., Lackey A. et al. // Prep. Biochem. — 1987. — Vol. 17, N 3. — P. 209-227.
15. Benvenga S., Costante G., Melluso R. et.al. // Acta endocr. (Kbh.). — 1983. — Vol. 103, N 1. — P. 46-52.
16. Benvenga S., Trimarchi F., Robbins J. // J. Endocr. Invest. — 1987. — Vol. 10. — P. 605-619.
17. Benvenga S., Cahnmann H.J., Gregg R.E., Robbins J. // J. clin. Endocr. Metab. — 1989. — Vol. 68, N 6. — P. 1067— 1072.
18. Benvenga S., Cahnmann H.J., Gress R.E., Robbins J. // Biochimie. — 1989. — Vol. 71. — P. 263-268.
19. Benvenga S., Robbins J. // Endocrinology. — 1990. — Vol. 126, N 2. — P. 933-941.
20. Benvenga S., Cahnmann H.J., Robbins J. // Ibid. — Vol. 127, N5. — P. 2241-2246.
21. Benvenga S., Cahnmann H. J., Robbins J. Ц Ibid. — 1991. — Vol. 128, N 1. — P. 547-552.
22. Benvenga S., Cahnmann H.J., Rader D. et al. // Ibid. — 1992. — Vol. 131. N 6. — P. 2805-2811.
23. Blake C.C.F., Galley S.J. // Nature. — 1977. — Vol. 268. — P.115-120.
24. Blake C.C.F., Geisow M.J., Oalley S.J. et al. //J. molec. Biol.- 1978. — Vol. 121. — P. 339 356.
25. Bridges C.D.B., Peters T., Smith J.E. et al. // Fed. Proc. — 1986. — Vol. 45, N 9. — P. 2291-2303.
26. Bristow A.F., Gaines-Das R.E., Buttress N. et al. // Clin. Endocr. — 1993. — Vol. 38, N 4. — P. 361-366.
27. Calzi L.L., Benvenga S., Battiato S. et al. // Clin. Chem. — 1988. — Vol. 34, N 12. — P. 2561-2562.
28. Chanoine L.R., Alex S., Fang S.L. // Annual Meeting of the Endocrine Society, 73-rd: Abstracts. — Washington, 1991. — P. 132.
29. Dickson W.R., Aldred A.R., Menting J.G.T. et al. // J. biol. Chem. — 1987. — Vol. 262, N 29. — P. 13907- 13915.
30. Divino C.M., Schussler G.C. // Ibid. — 1990. — Vol. 265, N 3. — P. 1425-1429.
31. Ekins R. // Lancet. — 1985. — Vol. 1. — P. 1129-1132.
32. Ekins R., Edwards P.R. // Amer. J. Phisiol. — 1988. — Vol. 255. — P. E403-E409.
33. Ekins R. U Endocr. Rev. — 1990. — Vol. 11, N 1. — P. 5- 46.
34. Fex G., Laurell C.-B., Thulin E. // Europ. J. Biochem. — 1977. — Vol. 75, N 1. — P. 181-186.
35. Flink I.L., Bailey T.J., Gustafson T.A. et al. // Proc. nat. Akad. Sei. USA. — 1986. — Vol. 83. — P. 7708-7712.
36. Fung W.-P., Thomas T., Dickson P.W. et al. //J. biol. Chem. — 1988. — Vol. 263. — P. 480- 488.
37. Gershengom M. C., Cheng S.-Y., Lippoldt R.E. et al.// Ibid. — 1977,- Vol. 252, N 23. — P. 8713-8718.
38. Gershengom M.C., Lippoldt R.E., Edelhoch ff., Robbins J.U Biochemistry. — 1977.- Vol. 252, N 23. — P. 8719-8723.
39. Grimaldi S., Bartalena L., Carlini F., Robbins J. // Endocrinology. — 1986. — Vol. 118, N 6. — P. 2362—2369.
40. Hammond G.L. // Endocr. Rev. — 1990. — Vol. 11, N1.— P. 65-79.
41. Hashizume K., Sakurai A., Miyamoto T. et al. // Endocr. Jap. — 1986. — Vol. 33, N 5. — P. 665-674.
42. Hennemann G., Docter K. // The Thyroid Gland / Ed. M.A. Greer. — New York, 1990. — P. 221-231.
43. Hoch H., Lewallen C. G. // J. clin. Endocr. Metab. — 1974. — Vol. 38, N 4. — P. 663- 673.
44. Janssen O.E., Bertenshaw R., Takeda K. et al. //Trends Endocr. Metab. — 1991. — Vol. 2. — P. 104 -114.
45. Jornvall H., Carlstrom A., Petterson T. et al. // Nature. — 1981. — Vol. 291. — P. 261-263.
46. Kanda Y,Goodman D.S., Canfield R.E., Morgan F.J. // J. biol. Cem. — 1974. — Vol. 249. — P. 6796-6805.
47. Kostrouch Z., Raska I., Felt V. et al. // Experientia (Basel). — 1987,- Vol. 49, N 10. — P. 1119-1120.
48. Luckebach C., Wahl R., Kallee E. // Europ. J. clin. Chem. clin. Biochem. — 1992. — Vol. 30, N 7. — P. 387 -390.
49. Marione R.L., Herbert J., Dwork A., Shon E.A. // Biochem. biophys. Res. Commun. — 1988. — Vol. 151, N 2. — P. 905— 912.
50. Mita S., Maeda S., Shimada K., Araki S. // Ibid. — 1984. — Vol. 124. — P. 558-568.
51. Mendel C.M., Weisiger R.A., Jones A.L., Cavalieri R.R. // Endocrinology. — 1987. — Vol. 120, N 5. — P. 1742—1749.
52. Mendel C.M., Cavalieri R.R., Weisiger R.A. // Ibid. — 1988. — Vol. 123, N 4. — P. 1817-1824.
53. Mendel C.M. ¡/ Endocr. Rev. — 1989. — Vol. 10, N 3. — P. 232—274.
54. Munro S.L., Lim C.F., Hall J.G. et al. // J. clin. Endocr. Mctab. — 1989. — Vol. 68, N 6. — P. 1141 -1147.
55. Pardridge W.M., Premachandra B.M., Fierer G. // Amer. J. Phisiol. — 1985. — Vol. 248. — P. G545-G55O.
56. Pardridge W.M. // Ibid. — 1987. — Vol. 252. — P. E157 — EI64.
57. Pemberton P.A., Stein P.E., Pepys M.B. et al. // Nature. — 1988. — Vol. 336. — P. 257-258.
58. Peters T.Jr. // Advanc. Protein Chem. — 1985. — Vol. 37. — P. 161- 246.
59. Petterson T., Carlstrom A., Jornvall H. // Biochemistry. — 1987. — Vol. 26, N 14. — P. 4578-4583.
60. Petterson T.M., Carlstrom A., Ehrenberg A., Jornvall H. // Biochem. biophys. Res. Commun. — 1989. — Vol. 158, N 4. — P. 341-347.
61. Putnam F.W. // The Plasma Proteins / Ed. F. W. Putnam. — 2-nd Ed. — New York, 1987. — Vol. 5. — P. 50-140.
62. Rejatanavin R., Liberman C., Lawrence C.D. et al. //J. clin. Endocr. Metab. — 1985. — Vol. 61, N 1. — P. 17—21.
63. Refetojf S., Fang V.S., Marshall J.S. Ц Ibid. — 1975. — Vol. 56. — P. 177-182.
64. Refetojf S., Dwulet F.E., Benson M.D. // Ibid. — 1986. — Vol. 63, N 6. — P. 1432-1437.
65. Refetoff S. // Endocr. Rev. — 1989. — Vol. 10, N 3. — P. 275-293.
66. Reid D.G., Saunders M.R. // J. biol. Chem. — 1989. — Vol. 264, N 4. — P. 2003-2012.
67. Robbins J., Rail J.E., Rawson R.W. // J. clin. Endocr. Metab. — 1956. — Vol. 16, N 5. — P. 573- 579.
68. Robbins J., Rail J.E. // Physiol. Rev. — 1960. — Vol. 40. — P. 415-489.
69. Robbins J., Bartalena L. // Thyroid Hormone Metabolism / Ed. G. Hennemann. — New York, 1986. — P. 3—38.
70. Robbins J. Ц The Thyroid / Ed. R.D.Utiger. — Philadelphia, 1991. — P. 116-127.
71. Scanu A.M. // The Plasma Proteins. — New York,1987. — Vol. 5. — P. 142.
72. Schussler G.C. //Thyroid. — 1990. — Vol. 1, N 1. — P. 25— 34.
73. Schussler G., Divino C.M., Saraiva M.J. // Progress in Thyroid Research / Eds A.Gordon, /.Gross, G.Hennemann. — Rotterdam, 1991. — P. 725—728.
74. Siegel J.S., Villanueva G.B., Korcek L., Tabachnik M. // Int. J. Biochem. — 1984. — Vol. 16. N 5. — P. 575-577.
75. Strel’chyonok G.A., Avvakumov G.V., Akhrem A.A. Ц Carbo- hydr. Res.- 1984. — Vol.134. — P. 133- 140.
76. Strel’chyonok G.A., Avvakumov G.V. // J. Steroid Biochem. — 1990. — Vol.35,N 5. — P. 519-534.
77. Tabachnik M. //J. biol. Chem. — 1967. — Vol. 242, N 7. — P. 1646 -1650.
78. Teru S. I I Europ. J. nucl. Med. — 1984. — Vol. 9, N 3. — P. 121-124.
79. Trent J.M., Flink I.L., Morkin E. et al. // Amer. J. hum. Genet. — 1987. — Vol. 41, N 3. — P. 428-435.
80. Wahl R., Schmidberger H., Fessler E. et al. // Endocrynology. — 1989. — Vol. 124, N 3. — P. 1428-1437.
81. Weisiger R., Gollan J., Ockner R. // Science. — 1981. — Vol.211. — P. 1048-1051.
82. Zinn A.B., Marshall J.S., Carlson D.M. // J. biol. Chem. — 1978. — Vol. 253, N 19. — P. 6768-6773.
Свойства. Биологическое значение. — Белки — Азотосодержащие органические соединения — Органическая химия
11 января 2007
Физические свойства белков весьма разнообразны и определяются их строением. По физическим свойствам белки делят на два класса: глобулярные белки растворяются в воде или образуют коллоидные растворы, фибриллярные белки в воде нерастворимы.
Химические свойства. 1. Разрушение вторичной и третичной структуры белка с сохранением первичной структуры называется денатурацией. Она происходит при нагревании, изменении кислотности среды, действии излучения. Пример денатурации – свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
2. Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Анализируя продукты гидролиза, можно установить количественный состав белков.
3. Для белков известны несколько качественных реакций. Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе. Эта реакция называется биуретовой. Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина) дают желтое окрашивание при действии концентрированной азотной кислоты (ксантопротеиновая реакция).
Биологическое значение белков чрезвычайно велико. Упомянем только важнейшие функции белков в живых организмах.
1. Абсолютно все химические реакции в организме протекают в присутствии катализаторов — ферментов. Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой. Все известные ферменты представляют собой белковые молекулы. Белки — это очень мощные и, самое главное, селективные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой единственный фермент.
2. Некоторые белки выполняют транспортные функции и переносят молекулы или ионы в места синтеза или накопления. Например, содержащийся в крови белок гемоглобин переносит кислород к тканям, а белок миоглобин запасает кислород в мышцах.
3. Белки — это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
4. Белки играют важную роль в иммунной системе организма.
Существуют специфические белки (антитела), которые способны распознавать и связывать чужеродные объекты – вирусы, бактерии, чужие клетки.
5. Белки-рецепторы воспринимают и передают сигналы, поступающие от соседних клеток или из окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Из приведенного перечня функций белков ясно, что белки жизненно необходимы любому организму и являются, следовательно, важнейшей составной частью продуктов питания. В процессе пищеварения белки гидролизуются до аминокислот, которые служат исходным сырьем для синтеза белков, необходимых данному организму. Существуют аминокислоты, которые организм не в состоянии синтезировать сам и приобретает их только с пищей. Эти аминокислоты называются незаменимыми. Для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин.
Печень и ее функции в нашем организме — (клиники Di Центр)
Печень — самый большой внутренний орган человека. Она находится справа в полости живота под диафрагмой (в правом подреберье) и очень редко печень может находится слева. Печень — непарный орган, то есть второго такого органа в организме нет, и нарушение функции печени опасно для жизни. Поэтому при заболеваниях печени необходимо постоянное наблюдение специалиста, обследование для контроля за состоянием здоровья и лечением.
Печень выполняет важные функции в нашем организме. Компоненты пищи, поступившие в желудочно-кишечный тракт, всасываются в кровь и доставляются в первую очередь в печень. В ней происходят процессы их преобразования, образуются необходимые для жизнедеятельности вещества. Она принимает участие во всех видах обмена веществ — в обмене белков, жиров, углеводов. Только в печени образуется необходимый организму белок альбумин, многие факторы свертывания крови. В ней образуется и накапливается гликоген — источник энергии для организма. Печень участвует в обмене витаминов и микроэлементов. Ее важной функцией является дезинтоксикационная. В нее поступают образующиеся в организме в процессе пищеварения и в процессе жизнедеятельности вещества, лекарственные препараты. Некоторые из них могут быть токсичными для организма. В печени эти вещества преобразуются в малотоксичные продукты. В ней происходит дезактивация гормонов и других биологически активных веществ.
Так же печень обезвреживает всевозможные чужеродные для организма вещества, такие как аллергены, токсины и яды, превращает их в менее токсичные или проще выводимые соединения. Она участвует в обмене билирубина — пигмента, образующегося при естественном распаде красных кровяных клеток. Нарушение функции печени при различных заболеваниях приводит к нарушениям обмена и выведения билирубина с желчью и появлению желтушного окрашивания кожи и склер. Образующаяся в ней желчь имеет важное значение для процессов пищеварения. Таким образом, печень можно назвать большим химическим заводом, на котором синтезируется и преобразуется огромное количество веществ. Кроме того, печень естественное депо крови, предусмотренное самой природой. При нормальном функционировании в ней содержится более полулитра крови. Это позволяет поддерживать необходимый объем циркулирующей крови и работу органов кровообращения, что является особенно важным при кровопотерях.
Берегите свою печень, выполняйте периодическое обследование! Консультируйтесь с врачом и ваша печень ответит Вам взаимностью!
Печень — один из немногих органов, способных к регенерации, то есть восстановлению. За счет деления клеток (гепатоцитов) печень может восстанавливать свой первоначальный объем при сохранении лишь 25−30% нормальной ткани. Это очень важно для поддержания жизнедеятельности при различных заболеваниях.
*Способность печени к восстановлению отражена в мифе о Прометее. Прометей — один из титанов древнегреческой мифологии, защитник людей от произвола богов, царь скифов. Прометей тайно проник на священную гору Олимп и похитил огонь для людей. Он так же научил людей всему, что сам знал: счету, письму, ремеслам. Но действовал Прометей втайне от величайшего позволения Зевса, бога неба, грома и молний, ведающего всем миром. За это Прометей был обречен Зевсом на вечные муки — прикован к скале, куда каждый день прилетал орел, чтобы выклевать у него печень. На следующий день у Прометея отрастала новая печень. Так продолжалось долго, пока Геракл не сразил орла, разбил оковы и освободил Прометея.
Body Protein — обзор
6 Получение hGIB
Белок тела включения получали и сульфировали, как описано ранее, из вектора hGIB / pAB3. Сульфированный белок (80–100 мг) растворяли в 200–250 мл 6 M гуанидин-HCl, 50 мкл M Tris – HCl, pH 8,0 при комнатной температуре путем перемешивания. Любой оставшийся нерастворимый белок удаляли центрифугированием при 14000 × g в течение 15 минут при 4 ° C, и супернатант использовали для рефолдинга. Трубки для диализа (порог с молекулярной массой 6–8 кДа, SpectraPor) заполняли раствором белка и подвергали диализу против 7 л предварительно охлажденного раствора 0.9 M гуанидин-HCl, 50 м M Трис-HCl, pH 8,0, 5 м M свежий l-цистеин, 5 м M EDTA, 5 м M l-метионин (для предотвращения окисления sPLA 2 метионинов) и 5 m M SB12 детергента ( N -додецил- N , N -диметил-3-аммонио-1-пропансульфонат, Sigma 40232) при 4 ° C с магнитное перемешивание. На следующий день ферментативную активность небольшой аликвоты проверяли с помощью анализа пирен-PG, и ее снова проверяли днем.Если активность возрастала, диализ продолжали до тех пор, пока активность пирена-ПГ не переставала увеличиваться (~ 1-2 дня). Мешок для диализа переносили в 6,5 л трипсинового буфера (50 мл M Tris – HCl, pH 8,0, 100 мкм M NaCl, 1 мкм M CaCl 2 с 5 мл детергента M SB12). и диализ продолжали при 4 ° C в течение ночи. Содержимое мешка переносили в центрифужную бутыль, которую вращали при 15000 × g в течение 20 минут при 4 ° C для осаждения любого нерастворимого материала.
Супернатант проверяли на трипсинизацию, помещая 0,1–0,2 мл раствора в каждую из пяти пробирок. В каждую из пяти пробирок добавляли трипсин (Sigma Cat. T-1426 или T1005) в 1-2 мкл воды с получением 0,0, 0,25, 0,5, 1 и 1,5 мкг / мл. Пробирки инкубировали при комнатной температуре в течение 1,5 ч, и ферментативную активность проверяли каждые 20 мин с помощью анализа пирен-PG. Концентрация трипсина, которая давала самую высокую активность, была выбрана для крупномасштабной трипсинизации. Раствор трипсина (1–2 мкг / мкл в воде) по каплям добавляли к большому объему повторно свернутого раствора белка в течение 1–2 мин при перемешивании магнитной мешалкой.Образец инкубировали в течение 60–90 мин, и активность проверяли с помощью пирен-ПГ каждые 20–30 мин, пока она не переставала расти. PMSF (Sigma Cat. P7626) в этаноле добавляли с получением 0,5 мл M , и pH снижали до 2–3 разбавленной уксусной кислотой. Раствор хранили при 4 ° C перед ВЭЖХ. Раствор белка центрифугировали при 15000 × g в течение 20 минут при 4 ° C для осаждения любого нерастворимого материала. Супернатант фильтровали через фильтрующий элемент патронного шприца 0,45 мкм, и фильтрат, соответствующий 20-25 мг сульфированного белка, загружали (с помощью насоса напрямую) в колонку для ВЭЖХ (Vydac 218TP1010, C18, 1 × 25 см, 10 мкм. , 300 Å), предварительно уравновешенный растворителем A (вода, 0.08% трифторуксусной кислоты). Колонку промывали ~ 1 объемом колонки растворителя A перед началом линейного градиента от 0% до 25% растворителя B (ацетонитрил, 0,08% трифторуксусная кислота) в течение 40 минут и от 25% B до 60% B в течение следующих 110 минут. при скорости потока 1,5 мл / мин. SPLA 2 элюируется в виде острого пика примерно через 49 мин. Объединенные фракции ВЭЖХ разбавляли водой для уменьшения содержания ацетонитрила до 15–20%, и белок лиофилизировали с получением белого порошка. В более поздних анализах рефолдинга hGIB также продуцировали из вектора pET21a с аналогичным выходом и не нуждались в обработке трипсином.
Таблица данных о пищевых продуктах — белок
Белок
является неотъемлемой частью диеты. Он состоит из различных комбинаций
малых органических химикатов называется аминокислот . Когда мы едим пищу, содержащую
белок он расщепляется во время пищеварения на составляющие его аминокислоты
кислоты. Эти аминокислоты усваиваются нашим организмом и используются для
производить новые белки и другие необходимые вещества.Наши тела могут
производят одни аминокислоты, необходимые для производства белков, а другие
должны быть получены из рациона; это восемь так называемых «основных»
аминокислоты. Кроме того, младенцам нужна еще одна аминокислота.
в период раннего роста и развития.
Белковая форма
часть структуры тела, так что постоянное поступление амино
кислоты не нужны. Наш организм способен вырабатывать эти основные аминокислоты.
единиц вместе, используя различное расположение аминокислот, чтобы произвести
специфические белки, которые могут быть произведены только при наличии всех необходимых
аминокислоты доступны.
Питательный
о ценности белковой пищи можно судить по ее способности обеспечивать как
количество и количество незаменимых аминокислот, необходимых организму.
Различные источники пищи содержат разные группы белков, которые
состоят из различного расположения и количества аминокислот.
В целом, белки животного происхождения более питательны.
ценность, потому что они обычно содержат все незаменимые аминокислоты.Белки из растительных источников, таких как злаки и овощи, могут быть
дефицит одной из незаменимых аминокислот. Например,
белки, полученные из пшеницы, не имеют достаточного количества одного необходимого
аминокислота, а те, что из бобов, испытывают недостаток в другой.
Потому что дефицит
в каждой еде разные, когда их едят вместе, они дополняют
друг друга, и смесь имеет более высокую пищевую ценность, чем
раздельные продукты и не уступает животному белку.Это важно,
особенно для строгих вегетарианцев, которые не употребляют молочные продукты или яйца
продукты (см.
Рисунок 21), что различные типы белка
еда съедена.
Готовка может изменить
аминокислотный состав белка, что обычно приводит к
желаемый аромат и развитие потемнения. Очень мало питательных веществ
ценность потеряна.
РЕКОМЕНДУЕТСЯ
ЕЖЕДНЕВНОЕ ПОТРЕБЛЕНИЕ БЕЛКА В ДИЕТЕ В АВСТРАЛИИ
рекомендуемая диета (RDI) в Австралии — один грамм на килограмм.
массы тела в сутки.Потребление белка для 70-килограммового мужчины составляет
70 граммов, а для 58-килограммовой женщины — 58 граммов в день. Растущие дети
а беременным и кормящим женщинам требуется больше белка.
из-за дополнительных требований этих условий (см.
Рисунок 6). Люди, перенесшие тяжелые инфекции или перенесшие операцию, могут
требуется дополнительный белок. Из-за запаса прочности в
РСНП для протеина обычно не требуется увеличивать потребление протеина.
для дополнительной мышечной активности, например, при тяжелой работе или
обучение.
Дефицит
белок в рационе может привести к истощению мышц, отекам, анемии и,
у детей — замедление или остановка роста. Эти условия
обычно наблюдается в результате хронического белкового недоедания. Имея
адекватное потребление энергии (см. рисунок
11 и рисунок
12) почти всегда обеспечивает адекватное потребление белка.
Высшие уровни
потребления белка не приносит ни пользы, ни вреда.Однако возможно, что для
уравновесить чрезмерное потребление белка. Также есть высшее
нагрузка продуктов распада белка, которые должны выводиться
почки.
Белки: строительные блоки тела
Без воды и жира человеческое тело почти полностью состоит из белков. Белок является основным компонентом мышц, костей, органов, кожи и ногтей.Без воды мышцы состоят примерно на 80% из белка, что делает это питательное вещество особенно важным для спортсменов.
Как используется белок?
Организм расщепляет потребленный белок на аминокислоты и поглощает его. Он используется для наращивания мышц и органов, для выработки гормонов и антител, для хранения в виде жира и для сжигания в качестве энергии.
Виды протеиновых добавок
Существует много различных видов протеиновых добавок. Сывороточный протеин богат BCAA * , что делает его легко усваиваемым и высокоэффективным.
- BCAA (аминокислоты с разветвленной цепью) — это общее название незаменимых аминокислот валина, лейцина и изолейцина. BCAA — незаменимые аминокислоты, которые в мышцах превращаются в энергию.
Белок является неотъемлемой частью организма.
Сколько белка нужно организму?
Максимальное суточное количество, которое организм может использовать для синтеза белка, составляет около 2 граммов на 1 килограмм веса тела. Потребление большего количества белка не увеличит синтез, но увеличит количество потребляемой энергии и приведет к увеличению жировых отложений.Слишком много белка также может вызвать нагрузку на печень и почки.
Максимальное дневное количество, используемое для синтеза белка, составляет около 2 г на 1 кг массы тела
Поэтому важно регулировать количество потребляемого белка.
Если вы едите три хорошо сбалансированных приема пищи в день, вы легко сможете получить количество белка, необходимое вашему организму. Важно не только то, сколько вы едите, но и когда вы это едите.
Потребляйте белки и углеводы вместе
Когда белок потребляется вместе с углеводами (сахаром или глюкозой), повышается уровень сахара в крови и вырабатывается инсулин, способствуя синтезу аминокислот.
Углеводы также используются в качестве первого источника энергии, предотвращая использование аминокислот. После тренировки рекомендуется выпить что-нибудь вроде желеобразного напитка, который позволит вам одновременно потреблять углеводы и белок.
Когда употреблять белок
Важно употреблять белок в правильное время. Идеальное время для его употребления — сразу после тренировки.
Организм быстрее расщепляет белок сразу после тренировки, а также активнее синтезирует его, в результате чего в мышцы всасывается больше аминокислот.
Белок, потребленный сразу после тренировки, синтезируется лучше, чем белок, потребленный через 2 часа после тренировки.
Другие направления деятельности
Быстрая проверка питания на белок
Белок содержится во многих продуктах питания и необходим для поддержания здоровья. Ваше тело использует белок для:
- Обеспечивает строительные блоки для роста и восстановления клеток, таких как клетки ваших мышц, кожи и ногтей.
- Вырабатывает ферменты и гормоны, которые выполняют ключевые функции организма.
Белок содержится в горохе, бобах и чечевице, орехах, семенах и их масле, соевых продуктах, таких как тофу и соевый напиток, мясе, рыбе, птице, яйцах, молоке, сыре и йогурте. Зерновые, овощи и фрукты также добавляют небольшое количество белка в ваш рацион. Употребление протеина из самых разных источников пищи поможет вам удовлетворить ваши потребности в таких питательных веществах, как железо, цинк, витамин B12 и кальций.
Планируйте питание в соответствии с Руководством по питанию Канады https: // food-guide.canada.ca
Этот ресурс поможет вам проверить, достаточно ли в вашем рационе белка.
Шаги, которые вы можете предпринять
1. Узнайте, сколько белка вам нужно.
Большинству взрослых старше 19 лет требуется около 0,8 грамма (г) белка на килограмм (кг) веса тела. Вы можете использовать следующие уравнения для расчета потребности в белке.
Шаг 1: Вес в фунтах (фунтах) ÷ 2,2 = вес в кг
Шаг 2: Вес в кг × 0,8 = Среднесуточная потребность в белке (г)
Примечание: 1 кг = 2.2 фунта
Взрослому человеку с массой 80 кг (176 фунтов) необходимо около 64 г белка каждый день, а взрослому с массой тела 65 кг (143 фунта) требуется около 52 г белка каждый день.
Следующие группы имеют другие потребности в белке, чем рекомендовано выше:
- детей и юношества
- беременных и кормящих женщин
- спортсменов
- человек с определенными заболеваниями
Поговорите с дипломированным диетологом, чтобы он помог определить количество белка, которое вам подходит.
2. Узнайте, сколько белка вы едите.
Чтобы оценить количество белка в вашем рационе, ведите дневник питания в течение одного или двух дней. Записывайте, что и сколько вы едите и пьете. Затем добавьте белок в свой рацион, используя указанные ниже количества продуктов. Количество белка в продуктах питания также можно найти на этикетках продуктов.
| Продукты питания | Порция | Белок (г) (приблизительно) |
|---|---|---|
| Мясо, рыба или птица, приготовленные | 75 г (2 ½ унции) / 125 мл (½ стакана) | 21 |
| Тыквенные семечки | 60 мл (¼ чашки) | 17 |
| Йогурт по-гречески | 175 мл (¾ чашки) | 14 |
| творог | 125 мл (½ стакана) | 13 |
| семена конопли | 60 мл (¼ чашки) | 13 |
| Фирменный тофу | 150 г / 175 мл (стакана) | 12 |
| Бобы, горох или чечевица, приготовленные | 175 мл (чашки) | 12 |
| Яйцо, курица | 2 больших | 12 |
| Сыр | 50 г (1 ½ унции) | 12 |
| Коровье молоко | 250 мл (1 чашка) | 9 |
| Арахис | 60 мл (¼ чашки) | 9 |
| Арахисовое масло (натуральное) | 30 мл (2 столовые ложки) | 8 |
| Миндаль | 60 мл (¼ чашки) | 8 |
| Миндальное масло (обычное) | 30 мл (2 столовые ложки) | 7 |
| Йогурт | 175 мл (¾ чашки) | 7 |
| Обогащенный соевый напиток | 250 мл (1 чашка) | 7 |
| Семечки подсолнечника | 60 мл (¼ чашки) | 7 |
| Масло подсолнечное (обычное) | 30 мл (2 столовые ложки) | 6 |
| грецкие орехи | 60 мл (¼ чашки) | 5 |
| кешью | 60 мл (¼ чашки) | 5 |
| Масло кешью (обычное) | 30 мл (2 столовые ложки) | 4 |
| Хлеб | 1 ломтик (35 г) | 4 |
| Макаронные изделия, приготовленные | 125 мл (½ стакана) | 4 |
| Лебеда, приготовленная | 125 мл (½ стакана) | 4 |
| Крупы острые | 175 мл (¾ чашки) | от 2 до 4 |
| Злаки, холодные | 30 г | 3 |
| Рис, приготовленный | 125 мл (½ стакана) | 3 |
| Обогащенные напитки на растительной основе (миндаль, кешью, рис) | 250 мл (1 чашка) | 1 |
| Овощи | 125 мл (½ стакана) или 250 мл (1 стакан) салата | 1 |
| Фрукты | 1 фрукт или 125 мл (½ стакана) | 1 |
Источник: Canadian Nutrient File, 2015.
Особые соображения
Большинству людей протеиновый порошок не нужен. Если вам трудно получить достаточное количество белка из пищи, может оказаться полезным протеиновый порошок.
Протеиновые порошки часто имеют молочную (например, сыворотку или казеин) или растительную (например, сою или горох). Как правило, выбирайте простой протеиновый порошок без дополнительных ингредиентов, таких как подсластители, витамины, минералы или растительные продукты.
Протеиновые порошки часто содержат от 10 до 30 граммов белка на порцию.Размер совка может варьироваться в зависимости от продукта. Сверьтесь с таблицей пищевой ценности на этикетке, чтобы узнать, сколько белка содержит продукт.
Дополнительные ресурсы
Для получения информации и совета, основанных на ваших конкретных пищевых потребностях и предпочтениях в питании, позвоните по телефону 8-1-1 и попросите поговорить с диетологом HealthLink BC.
Для получения дополнительной информации см. Следующие ресурсы:
Белки составляют основу всех клеток, а белки — строительные блоки нашего тела
Белки, наряду с углеводами и жирами, представляют собой сложные молекулы, которые играют важную роль в организме.В то время как углеводы и жиры являются важными носителями энергии, белки выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела. Это настоящие питательные вещества для построения тела, состоящие из более мелких единиц, называемых аминокислотами. Все клетки нуждаются в аминокислотах, которые объединены в определенные белки, необходимые для структуры и восстановления мышц, костей, волос, ногтей и так далее.
Существует 20 различных типов аминокислот, которые необходимы нашему организму для производства белков.Двенадцать из этих аминокислот могут быть произведены в достаточном количестве в самом организме. Остальные восемь аминокислот, также называемые незаменимыми аминокислотами, должны поступать с пищей, которую мы потребляем. Незаменимыми аминокислотами являются лизин, фенилаланин, триптофан, метионин, треонин, лейцин, изолейцин и валин.
Азот — это естественный элемент, необходимый для роста и размножения. Он содержится в аминокислотах, из которых состоят белки. Количество азота в белке составляет примерно 16%.Некоторые аминокислоты также содержат серу (S), фосфор (P), железо (Fe) или йод (J).
Биологическая ценность
Когда белок содержит незаменимые аминокислоты в пропорции, подобной той, что требуется человеку, мы говорим, что он имеет высокую биологическую ценность. Биологическая ценность (БЦ) белка — это величина, которая измеряет, насколько хорошо организм может усваивать и использовать белок. Белки в одних продуктах дороже, чем в других. Чем больше белок похож на наш собственный белок (например, молочный белок), тем выше его ценность.Биологической ценности человеческого белка было присвоено значение 100.
Продукты, в которых отсутствует одна или несколько незаменимых аминокислот, получают более низкую ценность. Например: желатин животного происхождения с низким содержанием триптофана и метионина (незаменимые аминокислоты). Поэтому он считается неполным и имеет низкую биологическую ценность
Белки с высоким содержанием незаменимых аминокислот, которые помогают нашему организму вырабатывать собственные белки, называются полноценными белками. Источники животного белка, такие как яйца, молоко, мясо и рыба, обычно имеют высокую биологическую ценность.Считается, что белок яичного белка имеет один из лучших аминокислотных профилей для питания человека (но не белок коровьего молока, как часто говорят). Растительные белки, за исключением картофеля, риса и сои, обычно имеют более низкую биологическую ценность, поскольку в них отсутствует одна или несколько незаменимых кислот.
Белки и наша диета
Сбалансированная диета обеспечивает достаточное количество белка, так как некоторые белки содержат избыток незаменимых аминокислот для восполнения дефицита других белков.Когда мы едим хлеб с сыром или картофель с овощами, мы потребляем вместе белки всех этих продуктов. Горох в сочетании с пшеницей увеличивает белковую ценность пищи. Бобовые имеют высокий уровень лизина и очень низкий уровень метионина, тогда как для зерновых наблюдается обратное. Поэтому неудивительно, что гороховый суп часто подают с хлебом, поскольку белки в обоих продуктах дополняют друг друга. По той же причине рекомендуется запивать молоко хлебом или бутербродами, поскольку дефицит лизина в пшеничном хлебе восполняется за счет высокого уровня лизина в молоке.Чтобы повысить белковую ценность продуктов, которые вы едите, просто придерживайтесь сбалансированной диеты.
Выбор лучших источников белков для вашего тела
Не все белки одинаковы. Наш организм и пищеварительная система усваивают и используют одни белки лучше, чем другие, поэтому все сводится к выбору лучших белков для вашего тела.
Белки состоят из аминокислот. Существует девять незаменимых аминокислот, которые необходимы вашему организму для правильного функционирования, и когда пища содержит все девять, это называется полным белком .Источниками полноценного белка обычно являются продукты животного происхождения, такие как мясо, птица, рыба, яйца, молоко, сыр и йогурт. Некоторые полноценные белки растительного происхождения включают киноа, сою, семена чиа, коноплю и гречку.
Большинству растительных источников белка, как правило, не хватает одной или нескольких незаменимых аминокислот, но сочетание множества различных растительных белков может помочь веганам и вегетарианцам потреблять все девять аминокислот за один прием пищи. Также стоит отметить, что выбор овощей в качестве основного источника белка приведет к снижению потребления насыщенных жиров и холестерина, что хорошо! Это также хорошая причина не сосредотачиваться исключительно на продуктах животного происхождения как источниках белка. Разнообразие — ключ к успеху.
Понимание биологической ценности и потребления белка
Чтобы измерить, насколько эффективно организм использует потребленный белок, была введена биологическая ценность. Пища с высокой биологической ценностью коррелирует с большим количеством незаменимых аминокислот (то есть белков, необходимых вашему организму).
Ознакомьтесь с нашей инфографикой, чтобы узнать о распространенных здоровых источниках белка и их биологической ценности.
Употребление комбинации различных источников белка в течение дня увеличивает биологическую ценность и диапазон потребляемых аминокислот; поэтому лучше всего есть широкий выбор продуктов.Имейте в виду, что продукты растительного происхождения обычно содержат меньше белка, поэтому количество, которое вы потребляете, должно быть выше по сравнению с белками животного происхождения.
Помимо употребления большего количества этих растительных источников белка, мы также можем повысить биологическую ценность вегетарианской еды, сочетая бобовые с цельнозерновыми, орехами или семенами. См. Несколько примеров блюд ниже.
Полноценные белковые блюда из книги рецептов 8fit
Рис и бобы
Попробуйте блюдо 8fit’s Rice with Peas , чтобы удовлетворить свои потребности в белке.Это простое блюдо, в котором идеально сочетаются сладкие и соленые вкусы.
Тофу с кунжутом
Этот суп из цуккини содержит тофу, семена кунжута и другие вкусные ингредиенты. Когда вы съедите это на обед или ужин, вы получите весь необходимый белок в одной сытной миске. Найдите его в книге рецептов 8fit: Суп из цуккини и мяты с тофу .
Список продуктов с высоким содержанием белка
Все рецепты 8fit включают здоровый баланс белков, жиров и углеводов, поэтому, если размышления о биологической ценности вызывают у вас стресс, знайте, что вы на правильном пути, следуя плану питания 8fit .
Если вы соблюдаете стандартную диету, к источникам здоровой высокобелковой пищи относятся:
Птица
Постная говядина
Свинина
Яйца
Молочные продукты
Если вы вегетарианские продукты, молочные продукты и яйца по-прежнему на столе, но вы также можете включить в свой рацион некоторые растения с высоким содержанием белка. К высокобелковым продуктам на растительной основе относятся:
Соя
Квиноа
Фасоль
Бобовые
Орехи
Семена
Если вы пескатарианец , добавьте здоровые источники белка, например:
Тунец
Лосось
Сардины
Анчоусы
Креветки
Нужен ли нам протеиновый порошок?
Сбалансированная диета, состоящая из свежих цельных продуктов, должна обеспечить вас всем белком, необходимым вашему организму.Мы рекомендуем получать белок из таких продуктов, как нежирное мясо, рыба, яйца, греческий йогурт, тофу, цельнозерновые, чечевица и другие, а не из протеиновых порошков с высокой степенью переработки.
Однако в некоторых случаях протеиновый порошок можно использовать в качестве полезной добавки к вашему рациону. Например, если вы новичок в растительной диете и все еще работаете над своими навыками приготовления бобовых, добавление протеинового порошка может быть простым способом убедиться, что вы получаете достаточно белка.
Протеиновый порошок также может иметь смысл, если ваша еда или закуска не содержат достаточного количества белка (например,г., зеленый сок, смузи или салат). Добавление протеинового порошка может помочь предотвратить скачки или падение уровня сахара в крови, ведущие к тяге, голоду и усталости.
Вы можете купить протеиновый порошок в нескольких формах, включая сывороточный, коричневый рис, сою, коноплю и гороховый протеин. Ищите порошок с минимум 70% белка и без искусственных подсластителей — помните, чем короче список ингредиентов, тем лучше. Обратитесь к нашему полному руководству по протеиновым порошкам.
8fit recipes с высоким содержанием белка
Йогурт с инжиром и грецкими орехами
Это блюдо идеально подходит для завтрака, обеда, ужина или закуски.Когда вы добавляете наш йогурт с инжиром и грецким орехом в свой план питания, ингредиенты и количество калорий автоматически обновляются в соответствии с выбранным вами временем приема пищи.
Завтрак в дороге
У вас мало времени? Ешьте завтрак в дороге. Это блюдо состоит из вегетарианских продуктов с высоким содержанием белка (например, сыра и орехов) и представляет собой идеальный баланс макроэлементов, обеспечивающий сытость и удовлетворение все утро. (В книге рецептов 8fit он называется Breakfast On-The-Go .)
Шашлык из тофу и ананаса
Зайдите в свой план питания 8fit и замените одно из своих блюд на этот рецепт Шашлык из тофу и ананаса . Мы обещаем, что вы не пожалеете об этом.
Питательные вещества и здоровье — энергия и белок
Food Safety Focus (29-й выпуск, декабрь 2008 г.) — Платформа безопасности пищевых продуктов
Питательные вещества и здоровье — Энергия и белок
Об этом сообщила г-жа Жаклин ФУНГ, научный сотрудник,
Секция информирования о рисках,
Центр безопасности пищевых продуктов
Начиная с этого выпуска, серия статей о питании будет посвящена избранным питательным веществам.Для начала мы вводим силу, которая заставляет нас двигаться (то есть энергию), и вещество, которое помогает нам расти (то есть белок).
Энергия
Если тело — это машина, то пища — это топливо. Говоря более конкретно, углеводы, жиры и белки в пищевых продуктах обеспечивают энергию для функций организма и физической активности (см. Таблицу 1). Однако они не производят такое же количество энергии (см. Таблицу 2). Жир производит более чем в два раза больше энергии на грамм, чем углеводы или белок.Метаболизм в организме превращает углеводы, белки и жиры в энергию. Любой избыток этих питательных веществ будет откладываться в теле в виде жира. Другими словами, независимо от того, углеводы ли это, белок или жир, если он не используется, он будет превращаться в запасы жира в организме. По мере накопления жировых отложений наша масса тела увеличивается.
Таблица 1
Цели Всемирной организации здравоохранения по потреблению питательных веществ населением, производящими энергию для питательных веществ
- Углеводы = 55-75% вклада энергии
- Белок = 10-15% вклада энергии
- Жир = 15-30% вклада энергии
Таблица 2
Энергетическое содержание питательных веществ: —
- 1 грамм углеводов = 4 килокалории
- 1 грамм белка = 4 килокалории
- 1 грамм жира = 9 килокалорий
- Помимо углеводов, белков и жиров, алкоголь также может обеспечить энергию (1 грамм алкоголя = 7 килокалорий)
Примечание: —
- Килокалория (ккал) и килоджоуль (кДж) — единицы измерения энергии.
- 1 килокалория примерно равна 4,2 килоджоулей.
Энергетические потребности людей различаются в зависимости от нескольких факторов, включая термический эффект пищи (энергия, необходимая для обработки пищи), основной уровень метаболизма и уровень физической активности. Что касается рекомендованного китайцами потребления питательных веществ (RNI), потребности в энергии для взрослых мужчин и женщин с легкими физическими нагрузками составляют около 2400 ккал и 2100 ккал в день соответственно.Для поддержания веса важно сбалансировать потребление энергии и потребляемую энергию. Следовательно, чтобы контролировать массу тела, можно уменьшить потребление энергии и / или увеличить физическую активность.
Белок
Организм использует белок для создания и восстановления всех тканей тела. Аминокислоты — это строительные блоки белка. Существует девять незаменимых аминокислот (см. Таблицу 3), которые организм не может или не может производить в достаточном количестве для удовлетворения потребностей. Следовательно, они являются незаменимыми компонентами нашего рациона.Обычно белок животного происхождения считается полноценным белком, поскольку он содержит все незаменимые аминокислоты, тогда как белок из растительного источника, за исключением соевого белка, ограничен одной или несколькими незаменимыми аминокислотами. Например, зерно ограничено лизином, а бобовые — метионином, двумя из девяти незаменимых аминокислот. Строгим вегетарианцам рекомендуется, чтобы их диета включала смесь продуктов из различных растительных источников, чтобы разные продукты дополняли друг друга (т.е. Незаменимая аминокислота, отсутствующая в одном источнике, поступает из другого), что делает диету без мяса едой со всеми незаменимыми аминокислотами.
Таблица 3
| Девять незаменимых аминокислот | ||
|---|---|---|
| Гистидин | Лизин | Треонин |
| Изолейцин | метионин | Триптофан |
| лейцин | Фенилаланин | Валин |
Дефицит белка в Гонконге не является обычным явлением.Однако белково-энергетическая недостаточность (PEM) — одна из самых распространенных проблем недоедания в мире, которая широко распространена в Африке. С другой стороны, избыточное потребление белка не приносит дополнительных преимуществ для здоровья, поскольку дополнительный белок, который не используется организмом, будет преобразован в жир. Во время преобразования белок расщепляется и выводится избыток азота, тем самым создавая дополнительную нагрузку на печень и почки. Это особенно важно для людей с заболеваниями почек. Таким образом, пациентам с заболеванием почек часто советуют придерживаться диеты с высоким содержанием белка, но в ограниченном количестве.
Согласно Рекомендациям Китая по потреблению питательных веществ (RNI), взрослые мужчины и женщины с легкими уровнями физической активности должны потреблять 75 г и 65 г белка в день соответственно. Детям, подросткам, беременным и кормящим женщинам требуется больше белков для роста.
Мясо, птица, рыба, яйца и сушеные бобы — хорошие источники белка.

