Аминокислоты формулы и названия таблица: Аминокислоты, образующие белки — урок. Химия, 10 класс.
Аминокислоты – общая формула, таблица (химия, 10 класс)
4
Средняя оценка: 4
Всего получено оценок: 839.
4
Средняя оценка: 4
Всего получено оценок: 839.
Органические вещества, в молекуле которых содержатся карбоксильные и аминные группы, называются аминокислотами или аминокарбоновыми кислотами. Это жизненно важные соединения, являющиеся основой построения живых организмов.
Строение
Аминокислота – мономер, состоящий из азота, водорода, углерода и кислорода. Также к аминокислоте могут присоединяться не углеводородные радикалы, например, сера или фосфор.
Условная общая формула аминокислот – NH2-R-COOH, где R – двухвалентный радикал. При этом аминогрупп в одной молекуле может быть несколько.
Рис. 1. Структурное строение аминокислот.
С химической точки зрения аминокислоты – производные карбоновых кислот, в молекуле которых атомы водорода заменены аминогруппами.
Виды
Аминокислоты классифицируются по нескольким признакам. Классификация по трём признакам представлена в таблице.
Классификация по трём признакам представлена в таблице.
Признак | Вид | Описание | Пример |
По расположению аминных и карбоксильных групп относительно друг друга | α-аминокислоты | Содержат один атом углерода между функциональными группами | Аланин |
β-, γ-, δ-, ε- и другие аминокислоты | Содержат несколько атомов углерода между функциональными группами | β-аминопропионовая кислота (два атома между группами), ε-аминокапроновая кислота (пять атомов) | |
По изменяемой части (радикалу) | Алифатические (жирные) | Не содержат ароматических связей. Бывают линейными и циклическими | Лизин, серин, треонин, аргинин |
Ароматические | Содержат бензольное кольцо | Фенилаланин, триптофан, тирозин | |
Гетероциклические | Содержат гетероатом – радикал, не являющийся углеродом или водородом | Триптофан, гистидин, пролин | |
Иминокислоты | Содержат иминогруппу NH | Пролин, оксипролин | |
По физико-химическим свойствам | Неполярные (гидрофобные) | Не взаимодействуют с водой | Глицин, валин, лейцин, пролин |
Полярные (гидрофильные) | Взаимодействуют с водой. | Лизин, серин, аспартат, глутамат, глутамин |
Рис. 2. Схема классификации аминокислот.
Названия формируются из структурных или тривиальных наименований карбоновых кислот с приставкой «амино-». Цифры показывают, где располагается аминогруппа. Также используются тривиальные названия, заканчивающиеся на «-ин». Например, 2-аминобутановая или α-аминомасляная кислота.
Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
- горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2;
- гидролиз:
NH2CH2COOH + H2O ↔ NH3CH2COOH + OH;
- реакция с раствором щёлочи:
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O;
- реакция с раствором кислоты:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4;
- этерификация:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O.

Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
Рис. 3. Белки.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет.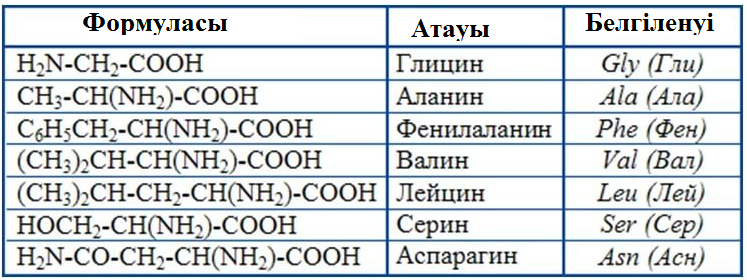 Будьте первым!
Будьте первым!
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 839.
А какая ваша оценка?
20 основных аминокислот с химическими формулами
Определение 1
Аминокислоты (АМК, аминокорбоновые кислоты, пептиды) — органические соединения на основе аминов, под которыми подразумеваются производные аммония 16%.
Из чего состоят заменимые и незаменимые аминокислоты
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека. Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма. Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Определение 2
Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.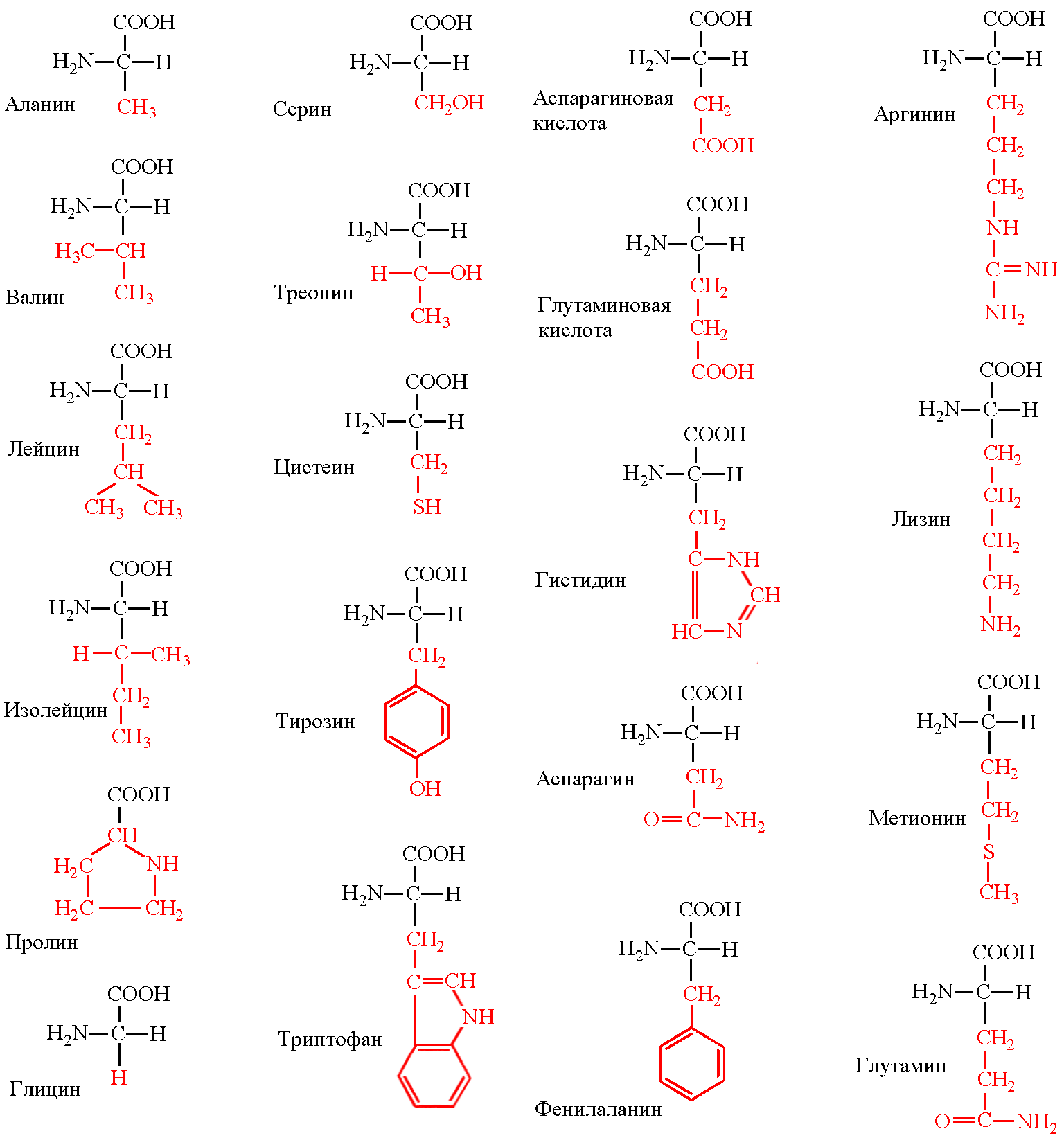
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа.
 Уменьшает негативное влияние на человеческий организм стрессовых факторов;
Уменьшает негативное влияние на человеческий организм стрессовых факторов; - глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Замечание 1
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Определение 3
Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.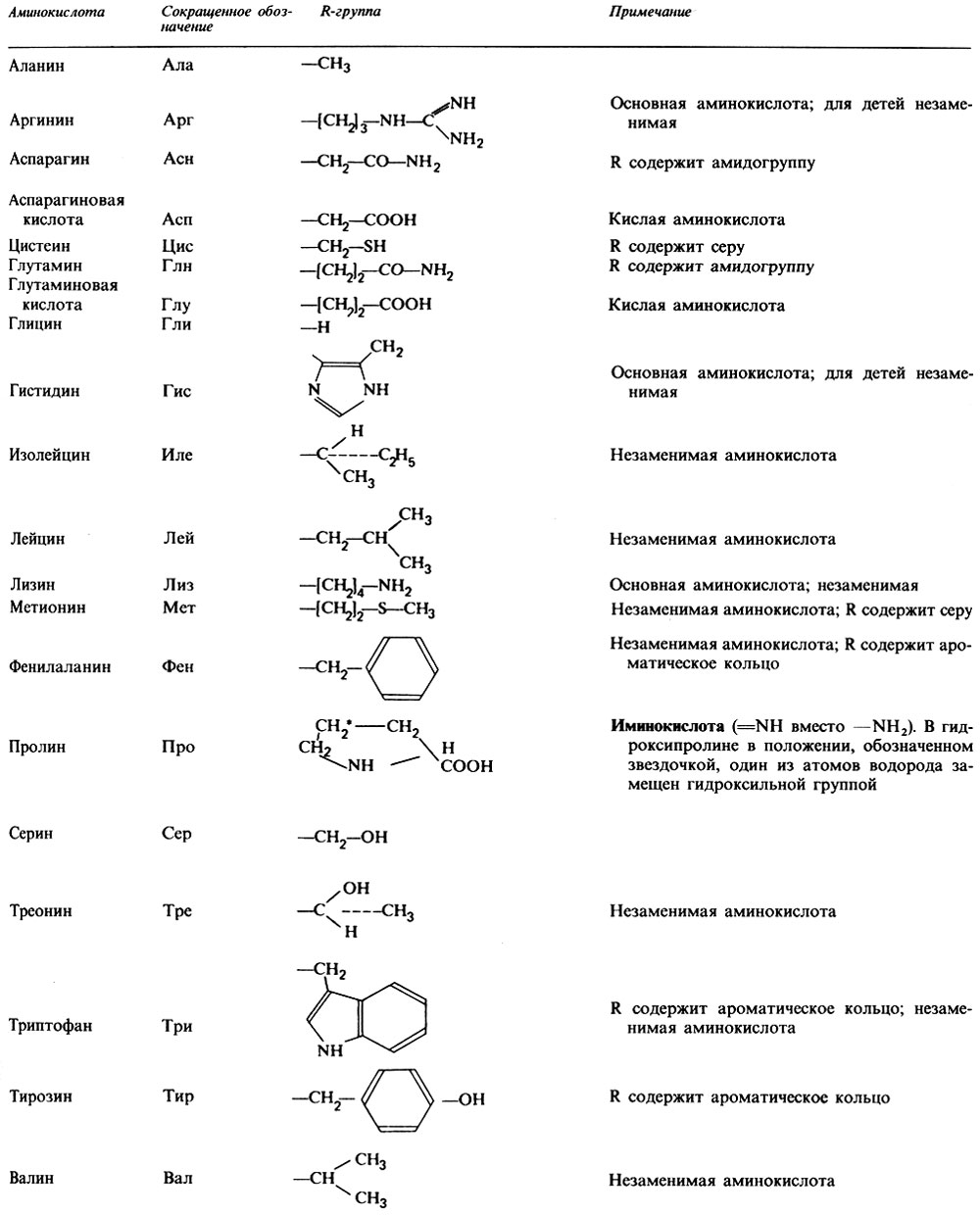
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов.
 Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена; - метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Химические формулы аминокислот
Условная формула аминокислоты в общем виде:
Вот как выглядит структурная формула аминокислот:
Ниже представлено фото с названиями аминокислот и структурными формулами:
Вот еще список аминокислот с молекулярными формулами в виде таблицы:
Чем грозит нехватка или избыток аминокислот в организме
Большинство аминокислот связано с регуляцией метаболизма. Практически любая аминокислота обеспечивает организм нужным количеством энергии для реализации химических реакций. Эти реакции отвечают за важные функции: дыхание, когнитивную деятельность, регуляцию психоэмоционального состояния и др.
Практически любая аминокислота обеспечивает организм нужным количеством энергии для реализации химических реакций. Эти реакции отвечают за важные функции: дыхание, когнитивную деятельность, регуляцию психоэмоционального состояния и др.
Согласно исследованиям ученых в области биохимии, аминокислот, которые содержались бы только в продуктах животного происхождения, не существует. К тому же, растительный белок усваивается организмом намного лучше животного. Однако стоит отметить, что веганы должны контролировать свой рацион тщательнее. И вот почему.
В 100 граммах мяса и 100 граммах бобов процентное соотношение АМК будет разным. По этой причине первое время количество аминокислот, потребляемых с пищей, нужно контролировать.
Примечание 2
Негативно на организме сказывается голодание и диеты, связанные с концентрацией на какой-либо одной группе продуктов: баланс полезных веществ будет нарушен.
Если аминокислот в организме не хватает, это выражается:
- Плохим самочувствием.

- Плохим аппетитом.
- Высокой утомляемостью.
- Нарушением гомеостаза.
При этом стоит отметить, что проблемы с самочувствием наблюдаются даже если в организме есть недостаток хотя бы одной аминокислоты.
Но и избыток аминокислот сказывается на организме не лучшим образом: появляются симптомы, напоминающие пищевые отравления.
Если человек ведет здоровый образ жизни, то ему нет необходимости задумываться о том, как выучить все аминокислоты и всех ли аминокислот хватает в его организме: все 20 основных аминокислот поступают вместе с пищей. Исключение — спортсмены, для которых важно высокое содержание белка, необходимого для строительства мышечной массы.
Своевременная корректировка пищевых привычек и соблюдение мер при разработке рациона питания — важная составляющая здоровья. И об этом стоит помнить.
Автор:
Станислав Янкевич
Преподаватель биологии и химии
Таблица аминокислот
| ChemTalk
Основные понятия
В этом учебном пособии вы узнаете о структуре 20 аминокислот, а также об их важных биохимических свойствах.
Темы, освещенные в других статьях
- Белки и аминокислоты
- Что такое АТФ?
- Функциональная группа аминокислот
Аминокислоты
Аминокислоты являются строительными блоками для полипептидов и белков. Они являются важными частями нашего тела и помогают во многих процессах, таких как синтез белка. В каждой аминокислоте к атому углерода присоединены аминогруппа и карбоксильная группа. Однако аминокислоты отличаются друг от друга составом их R-групп.
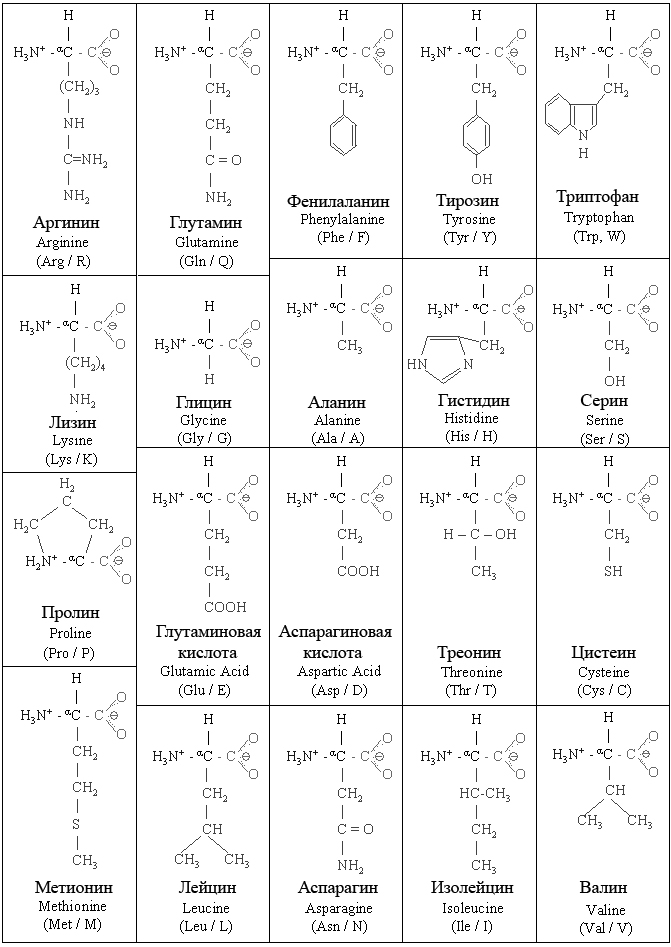
Структура аминокислот
20 аминокислот составляют все белки. Повторюсь, единственная разница в их структурах — это R-группы. Самая простая или самая маленькая аминокислота – глицин. В частности, глицин имеет водород в качестве группы R. Их разные боковые цепи классифицируются по заряду, гидрофобности (как они реагируют с водой), а также по полярности. В результате эти три свойства влияют на то, как они взаимодействуют с окружающей средой внутри полипептидов и белков. Это также влияет на трехмерную структуру и свойства белка.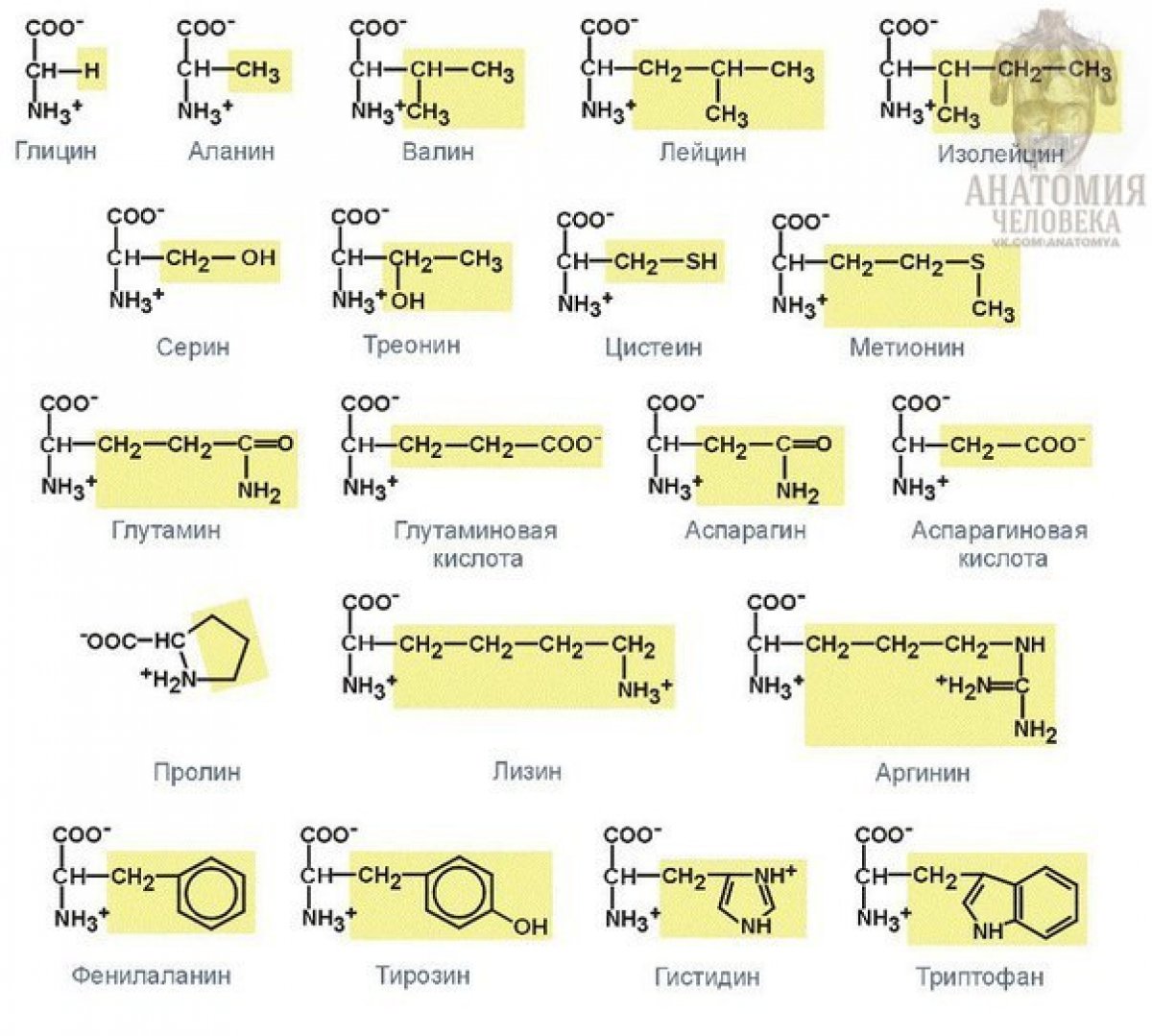
Таблица аминокислот
Таблица ниже содержит 21 аминокислоту. Однако селеноцистеин не входит в состав 20 незаменимых аминокислот, входящих в состав белков.
Боковые цепи аминокислот
Гидрофобные боковые цепи аминокислот
Аминокислоты ниже всех имеют боковую цепь, которая делает их гидрофобными. Это свойство делает их «водобоязненными» или неспособными растворяться в воде.
Аланин (Ala) является первой гидрофобной аминокислотой и имеет низкую реакционную способность. Это свойство позволяет аланину создавать удлиненную структуру, которая одинаково гибка и устойчива к растяжению.
Структура аланина
Валин (Val) способен распадаться на более простые соединения в нашем организме.
Структура валина
Изолейцин (Иле) важен при определении третичной структуры белка, в который он входит.
Структура изолейцина
Лейцин (Leu) подобен валину, поскольку в организме он расщепляется на более простые соединения. Однако он разлагается с помощью ферментов.
Однако он разлагается с помощью ферментов.
Структура лейцина
Метионин (Met) предотвращает накопление жира в печени и выводит шлаки и токсины.
Структура метионина
Фенилаланин (Phe) может распадаться в организме на тирозин.
Структура фенилаланина
Триптофан (Trp) может разрушаться в кишечнике человека. Кроме того, он может превращаться в витамин B3.
Структура триптофана
Тирозин (Tyr) также является важным предшественником жизненно важных гормонов в нашем организме. Он входит в состав гормонов надпочечников (эпинефрин и норадреналин), гормонов щитовидной железы (тироксин) и меланина (отвечает за пигмент волос и кожи). Фенилаланин производит тирозин.
Структура тирозина
Нейтральные боковые цепи аминокислот
Аминокислоты ниже всех имеют боковые цепи, которые являются полярно нейтральными. Это означает, что их боковые цепи не являются ни кислотными, ни основными.
Аспарагин (Asn) отвечает за удаление аммиака (токсичного химического вещества) из нашего организма.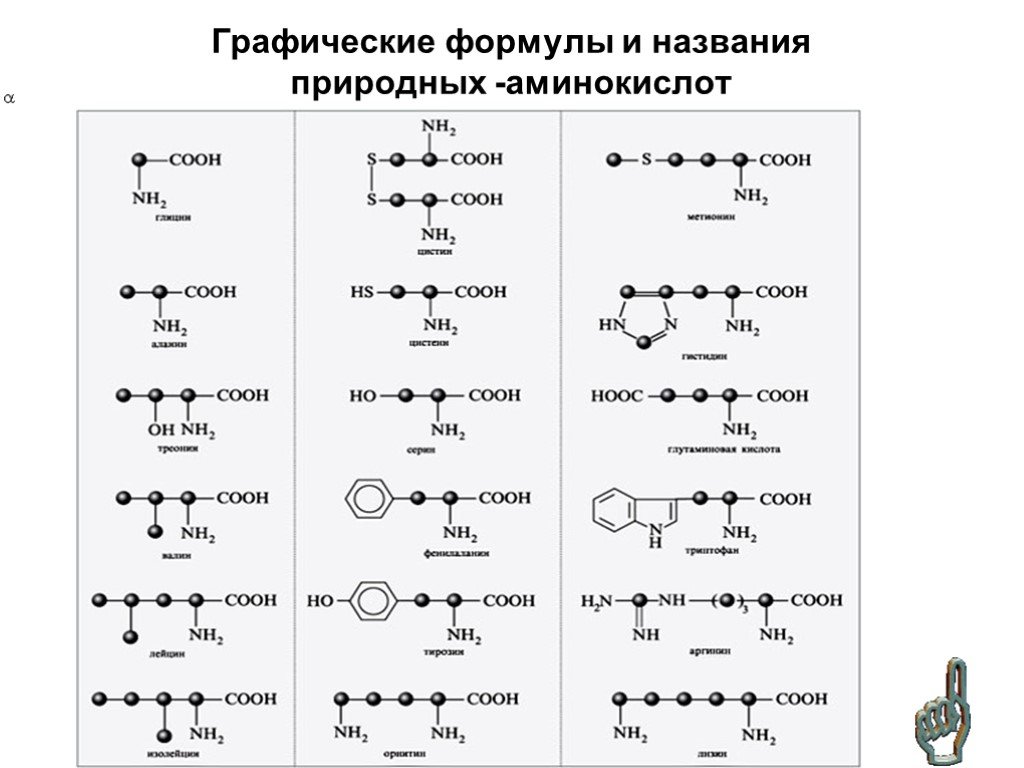
Структура аспарагина
Глутамин (Gln) является наиболее распространенной аминокислотой в нашем организме и выполняет несколько функций. Он отвечает за регулирование токсичных аммиака и мочевины в нашем организме. Причина, по которой глютамин может удалять токсичный аммиак, заключается в том, что его карбоксильная боковая цепь может выступать в качестве донора и акцептора аммиака (затем это обеспечивает безопасную транспортировку аммиака в нашем организме).
Структура глютамина
Серин (Ser) участвует в биосинтезе метаболитов и играет важную роль в каталитической функции ферментов.
Структура серина
Треонин (Thr) участвует в реакциях у бактерий и скорости метаболизма у животных. Однако точный эффект еще не определен.
Структура треонина
Аминокислота Кислотные боковые цепи
Аспарагиновая кислота (Asp) растворима в воде, что позволяет ей находиться рядом с активными центрами ферментов.
Структура аспарагиновой кислоты
Глутаминовая кислота (Glu) аналогична аспарагиновой кислоте и хорошо растворима в воде.
Структура глутаминовой кислоты.
Основные боковые цепи аминокислот.
Структура аргинина
Гистидин (His) в составе белков действует как акцептор и донор протонов. Благодаря этому свойству гистидин может объединяться в ферменты, участвующие в метаболизме белков, углеводов и нуклеиновых кислот.
Структура гистидина
Лизин (Lys) входит в состав ферментов, связывающих коферменты. Он играет важную роль в функционировании гистонов. В частности, он связывается с ацетилтрансферазами гистонов, которые изменяют транскрипцию определенных генов.
Структура лизина
Аминокислоты с особыми случаями
Цистеин (Cys) способен образовывать дисульфидные мостики между пептидными цепями, а также образовывать петли внутри одной цепи.
Цистеиновая структура
Глицин (Gly) не реагирует, когда находится в белках. Для биосинтеза серина (аминокислота), пуринов, гема (часть гемоглобина, содержащаяся в крови), а также глутатиона (коэнзим) требуется глицин.
Для биосинтеза серина (аминокислота), пуринов, гема (часть гемоглобина, содержащаяся в крови), а также глутатиона (коэнзим) требуется глицин.
Структура глицина
Пролин (Pro) изготовлен из глутаминовой кислоты. Когда он находится в белке, он вызывает резкие изгибы в пептидной цепи, изменяя окончательную структуру белка0009 Гликолиз: Давайте разберемся!
Номенклатура аминокислот. Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 490
Общие аминокислоты
Существует 20 распространенных аминокислот. Они состоят из атомов C, H, O, N и S. Они структурно и химически различны, а также отличаются размерами и объемом. Некоторые имеют разветвленную структуру, некоторые линейные, некоторые имеют кольцевую структуру. Одна из 20 распространенных аминокислот на самом деле является иминокислотой. Типичная группировка их химической природы выглядит следующим образом:
Некоторые имеют разветвленную структуру, некоторые линейные, некоторые имеют кольцевую структуру. Одна из 20 распространенных аминокислот на самом деле является иминокислотой. Типичная группировка их химической природы выглядит следующим образом:
- Неполярные (углеводороды и одна серосодержащая аминокислота). В их взаимодействии преобладают дисперсионные силы и гидрофобные эффекты. Они не могут образовывать водородные связи с водой, и эти боковые цепи обладают характерным гидрофобным эффектом в воде.
- Полар незаряженный. Содержат функциональные группы, способные связываться Н-связью с водой и другими аминокислотами. Включите атомы C, H, O, N и S.
- Кислотный. Содержат функциональную группу карбоновой кислоты с отрицательным зарядом при нейтральном pH. Могут образовывать водородные связи с водой, могут образовывать ионные взаимодействия, а также могут служить нуклеофилами или участвовать в кислотно-основной химии.
- Базовый. Азотсодержащие основания (например, гуанидино, имидазол или аминогруппы) с суммарным положительным зарядом при нейтральном pH.
 Могут служить донорами протонов в химических реакциях и образовывать ионные взаимодействия.
Могут служить донорами протонов в химических реакциях и образовывать ионные взаимодействия.
Аминокислоты имеют название, а также трехбуквенный или однобуквенный мнемонический код:
Тип | Имя | Структура группы R |
|---|---|---|
Неполярный | Лейцин Лей, Л | |
Изолейцин Иль, I | ||
Валин Вал, В | ||
Аланин Ала, А | ||
Метионин Мет, М | ||
Фенилаланин Фе, Ф | ||
Триптофан Трп, Вт | ||
Пролин Про, Р | ||
Глицин Гли, Г (примечание: иногда включается в полярную группу) | ||
Полярный, незаряженный | Серин Сер, С | |
Аспарагин Асн, N | ||
Глютамин Глн, Q | ||
Треонин Тр, Т | ||
Цистеин Цис, С | ||
Тирозин Тыр, Y | ||
Кислотный | Кислота аспарагиновая Асп, Д | |
Глутаминовая кислота клей, Е | ||
Базовый | Лизин Лис, К | |
Аргинин Арг, Р | ||
Гистидин Его, H |
Необычные аминокислоты
Помимо 20 распространенных аминокислот, обнаружено несколько необычных:
- Гидроксилизин и гидроксипролин.
 Они содержатся в белке коллагене. Коллаген представляет собой волокнистый белок, состоящий из трех полипептидов, образующих стабильную сборку, но только в том случае, если остатки пролина и лизина гидроксилированы. (требуется витамин С для восстановления этих аминокислот до гидроксильной формы)
Они содержатся в белке коллагене. Коллаген представляет собой волокнистый белок, состоящий из трех полипептидов, образующих стабильную сборку, но только в том случае, если остатки пролина и лизина гидроксилированы. (требуется витамин С для восстановления этих аминокислот до гидроксильной формы) - Тироксин, йодированное производное тирозина, входящее в состав тиреоглобулина (продуцируется щитовидной железой; требуется йод в рационе)
- г-карбоксиглутаминовая кислота (т. е. глутаминовая кислота с двумя карбоксильными группами), содержащаяся в некоторых ферментах свертывания крови (для производства требуется витамин К)
- N-метиларгинин и n-ацетиллизин. Обнаружен в некоторых ДНК-связывающих белках, известных как гистоны
.
Производные аминокислот, не встречающиеся в белках
Некоторые аминокислоты не предназначены для включения в белки, а сами по себе обладают важными функциями
- Серотонин (производное триптофана) и g-аминомасляная кислота (производное глутаминовой кислоты) являются нейротрансмиттерами
- Гистамин (производное гистидина), участвующий в аллергической реакции
- Адреналин (производное тирозина) гормон
- Различные антибиотики являются производными аминокислот (пенициллин)
Авторы и авторство
- Майк Блабер (Университет штата Флорида)
Миниатюра: 3D-модель L-триптофана.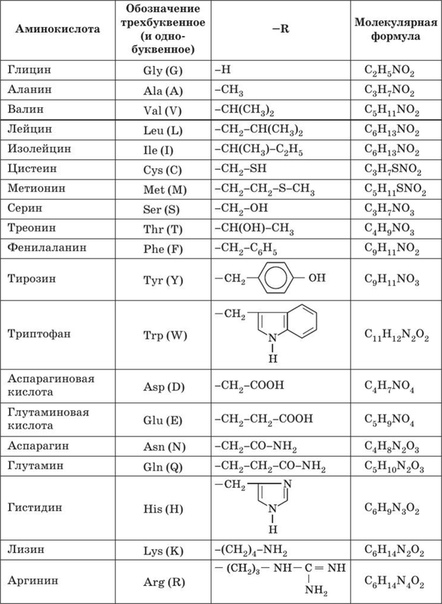

 Подразделяются на незаряженные, положительно и отрицательно заряженные
Подразделяются на незаряженные, положительно и отрицательно заряженные
 Уменьшает негативное влияние на человеческий организм стрессовых факторов;
Уменьшает негативное влияние на человеческий организм стрессовых факторов; Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
 Могут служить донорами протонов в химических реакциях и образовывать ионные взаимодействия.
Могут служить донорами протонов в химических реакциях и образовывать ионные взаимодействия. Они содержатся в белке коллагене. Коллаген представляет собой волокнистый белок, состоящий из трех полипептидов, образующих стабильную сборку, но только в том случае, если остатки пролина и лизина гидроксилированы. (требуется витамин С для восстановления этих аминокислот до гидроксильной формы)
Они содержатся в белке коллагене. Коллаген представляет собой волокнистый белок, состоящий из трех полипептидов, образующих стабильную сборку, но только в том случае, если остатки пролина и лизина гидроксилированы. (требуется витамин С для восстановления этих аминокислот до гидроксильной формы)