Пролин структурная формула: Пролин — описание вещества, фармакология, применение, противопоказания, формула
Пролин. Большая российская энциклопедия
Химические соединения
- Области знаний:
- Органическая химия, Органические соединения
- Другие наименования:
- пирролидин-α-карбоновая кислота, пирролидин-2-карбоновая кислота, Pro, P, Про
- Брутто-формула:
- C₅H₉NO₂
- Молярная масса:
- 115,13 г/моль
- Агрегатное состояние:
- Твёрдое
Проли́н (пирролидин-α-карбоновая кислота, пирролидин-2-карбоновая кислота, общепринятые сокращения: Pro, P, Про), (название от пирролидина, производным которого является пролин), неполярная алифатическая аминокислота; единственная из кодируемых аминокислот, α-аминогруппа которой является фрагментом гетероцикла (иминокислота). Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-пролин и D-пролин. В природе преобладает L-форма. Молярная масса 115,13 г/моль. Плотность 1,35–1,38 г/см³. Температура плавления 205 °C (DL-пролин), 215–220 °C (D-пролин), 220–222 °C (L-пролин), все с разложением. Пролин впервые был выделен из казеина (1901, Э. Фишер). В 1900 г. Р. Вильштеттер получил эту аминокислоту в реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном.
Пролин впервые был выделен из казеина (1901, Э. Фишер). В 1900 г. Р. Вильштеттер получил эту аминокислоту в реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном.
L-пролин – протеиногенная аминокислота, кодируется триплетами, начинающимися с CC (CCU, CCC, CCA, CCG). Входит в состав практически всех природных белков (частота встречаемости 5,24), биологически активных пептидов.
L-пролин является заменимой для человека аминокислотой (может синтезироваться в организме).
Физико-химические свойства
Пролин – бесцветное кристаллическое вещество, растворимое в воде [16,23 г/100 мл (25 °C)], этаноле [1,55 г/100 мл (19 °C)], нерастворимое в диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях пролин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 6,30. Константы диссоциации кислоты (рКа) составляют 1,99 для карбоксильной группы (α-COOH), 10,60 для аминогруппы (α-NH3+).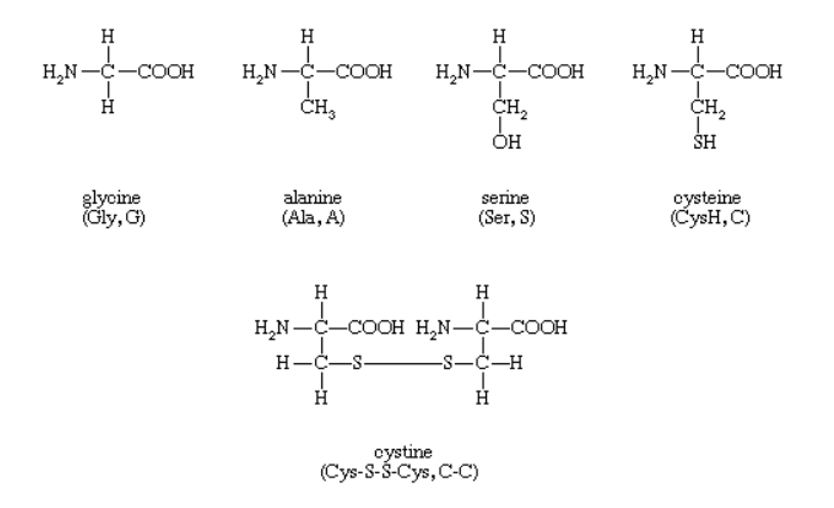
Пролин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное деаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. В отличие от других аминокислот пролин даёт жёлтую окраску при взаимодействии с нингидрином. В качественной реакции с изатином пролин даёт синее окрашивание.
Обладая жёсткой структурой, L-пролин способствует резким изгибам полипептидной цепи (β-поворот I типа), нарушая структуру α-спирали или β-листа. Белки с высоким содержанием L-пролина (например, коллаген) формируют левозакрученную полипропиленовую спираль II типа.
Способы получения
DL-пролин можно синтезировать из диэтилового эфира малоновой кислоты и акрилонитрила или аминированием α, δ-дихлорвалериановой кислоты. L-пролин получают микробной ферментацией.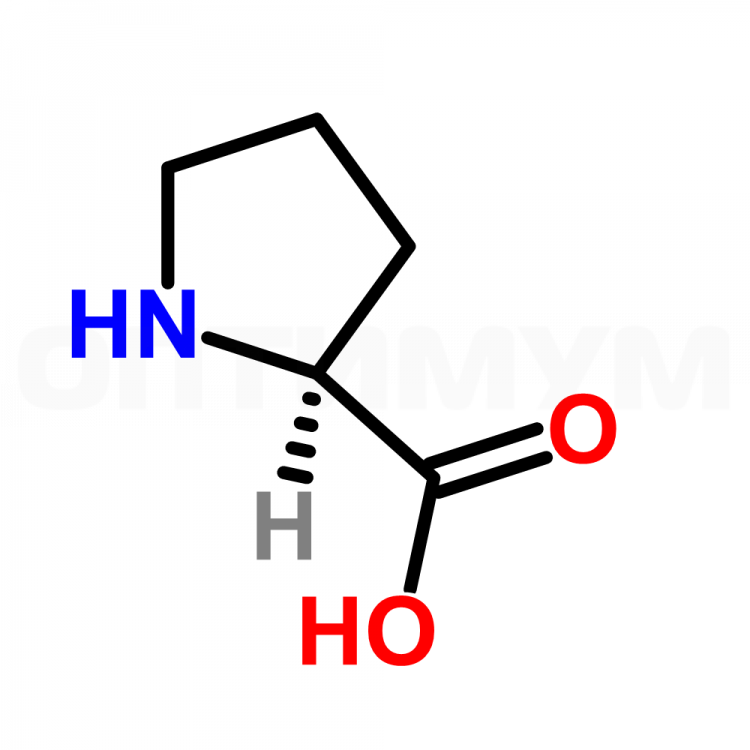
Участие в обмене веществ
Предшественником в биосинтезе L-пролина служит глутаминовая кислота.
Конечным продуктом катаболизма L-пролина является α-кетоглуторат.
В виде L-изомера входит в состав практически всех природных белков (6,9 % в сальмине, 10,6 % в казеине, 16,3 % в желатине), адренокортикотропного гормона, пептидного антибиотика грамицидина С и ряда других биологически активных пептидов. В некоторых белках L-пролин подвергается посттрансляционной модификации с образованием 3- и особенно 4-гидроксипролина. L-пролин, 3- и 4-гидроксипролин составляют почти треть всех аминокислотных остатков коллагена, фибриллярного белка, составляющего основу соединительной ткани организма. Другие производные L-пролина – 4-метилпролин и 4-гидроксиметилпролин встречаются в антибиотиках.
L-пролин защищает растения от абиотического стресса, выступая в качестве осмолитика, антиоксиданта, хелатирующего агента и регулятора специфических генов, ответственных за выход из стресса.
D-пролин – составная часть алкалоидов спорыньи.
Повышение уровня D-пролина в крови человека ассоциировано с заболеваниями почек, сахарным диабетом и старением.
Применение
L-пролин применяется в медицине в составе средств парентерального питания.
Выступает в роли органического катализатора. Добавление 3–30 % L-пролина в реакционную смесь позволяет преимущественный синтез определенного энантиомера или диастереомера (энантиоселективный синтез).
Редакция химических наук
Дата публикации: 31 мая 2022 г. в 13:46 (GMT+3)
Пролин | Химия онлайн
Пролин — гетероциклическая аминокислота, в которую атом азота входит в составе вторичного, а не первичного, амина (в связи с чем пролин правильнее называть иминокислотой).
Пролин заменимая аминокислота и содержится во всех природных белках. Особенно богаты им растительные белки – проламины (семенах злаков), белки соединительной ткани (10-15% в коллагене), β-казеин и эластин (до 13%).
Пролин — пирролидин-2-карбоновая или пирролидин-α-карбоновая кислота.
Пролин (Про, Pro, Р) – относится к аминокислотам пиррольного ряда, у которого аминогруппа является частью пирролидинового кольца, химическая формула C₅H₉NO₂.
Пролин впервые выделен из казеина в 1901 г. Э. Фишером.
Суточная потребность пролина 5 грамм.
Физические свойства
Пролин – бесцветные кристаллы с температурой плавления 220-222°С (с разл.). Хорошо растворим в воде, ограниченно – в этаноле, ацетоне, хлороформе, не растворим в диэтиловом эфире.
В составе коллагена пролин при участии аскорбиновой кислоты окисляется в гидроксипролин. Чередующиеся остатки молекулы пролина и гидроксипролина способствуют созданию стабильной трёхспиральной структуры коллагена, придающей молекуле прочность.
Химические свойства
Пролин в отличие от других аминокислот, дает желтую, а не фиолетовую нингидриновую реакцию.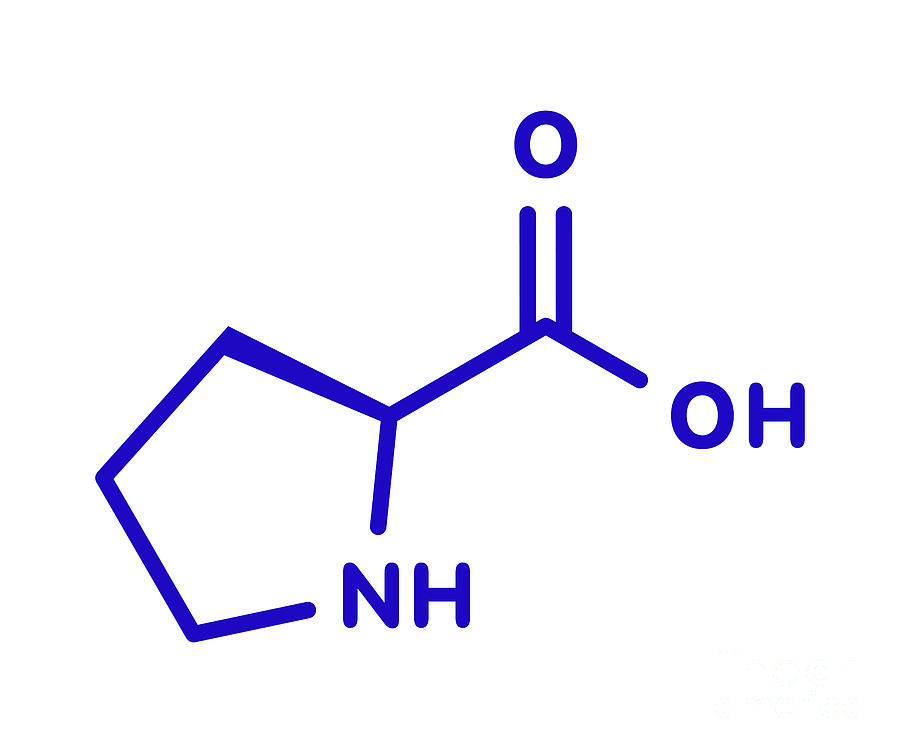 В реакции с азотистой кислотой пролин не дает азота.
В реакции с азотистой кислотой пролин не дает азота.
Биологическая роль
Пролин в организме человека синтезируется из глутаминовой кислоты.
Глутаминовая кислота занимает важное место в промежуточном обмене таких аминокислот, как глутамин, пролин, аргинин и гистидин.
Пролин входит в состав инсулина, адренокортикотропного гормона, грамицидина С и других биологически важных пептидов.
Участвует в образовании важных пептидов, в том числе и адреналина.
Важнейший белковый строительный материал человеческой клетки.
Пролин обладает антиоксидантными свойствами.
Пролин – это одна из главных аминокислот, которую организм использует для выработки коллагена. Из коллагена же производятся прочные, эластичные ткани на поверхности шрамов.
Он является главным строительным материалом организма – кости, сухожилия, связки и кожа содержат коллаген.
Пролин способствует хорошему формированию здоровых суставов, укрепляет сердечную мышцу, защищает стенки сосудов.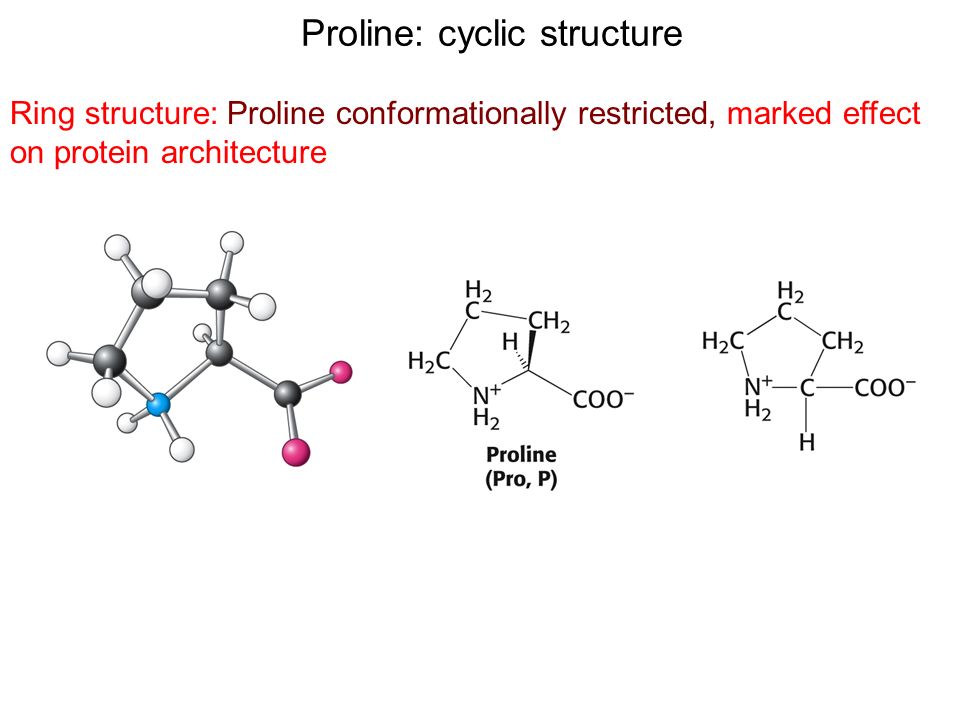
Фибриллярный белок коллаген – самый распространенный белок в мире животных. Его содержание в тканях животных превышает 60%. В организме человека массой 70 кг содержится 12-15 кг белков и половина этого количества приходится на коллаген.
Молекула коллагена построена из трех пептидных цепей, каждая из которых содержат около 1000 аминокислотных остатков.
Необычен аминокислотный состав коллагена: каждая третья аминокислота – это глицин, 20% составляют остатки пролина и гидроксипролина, 10% — аланина, остальные 40% представлены всеми другими аминокислотами.
Природные источники
Пролин содержится в твороге, в хрящах животных, в зернах злаков, яйцах, рыбе (тунец, сельдь), твердых сырах, рисе.
Наибольшее количество этой аминокислоты обнаруживается в мясных продуктах (говядина, баранина).
Области применения
Пролин применяется при инсультах, болезни Дауна, умственной отсталости и нарушении памяти.
Пролин применяется для восстановления тканей после повреждений, способствует заживлению ран, ожогов, язв и хирургических операций.
Может применяться при лечении травм.
Уменьшает воспаления кожи и слизистых оболочек, улучшает структуру кожи за счет увеличения выработки коллагена. Поддерживает в нормальном состоянии соединительные ткани (печень, почки, склера глаза, сосуды).
При помощи пролина, можно значительно повысить эффективность обучения.
Для заживления повреждений и укрепления сосудов и соединительной ткани пролин необходимо принимать вместе с витамином С, который необходим для выработки коллагена.
Пролин – одна из основных аминокислот сусла и вина.
В составе белков вина найдено до 5% пролина. Пролин дает желтую окраску винам.
Препараты, в состав которых входит пролин
L-пролин в капсулах № 90
Препарат применяется при механических повреждениях кожи и слизистых.
Воспалительных заболеваниях кожи и слизистых, труднозаживающих ранах, язвах, ожогах.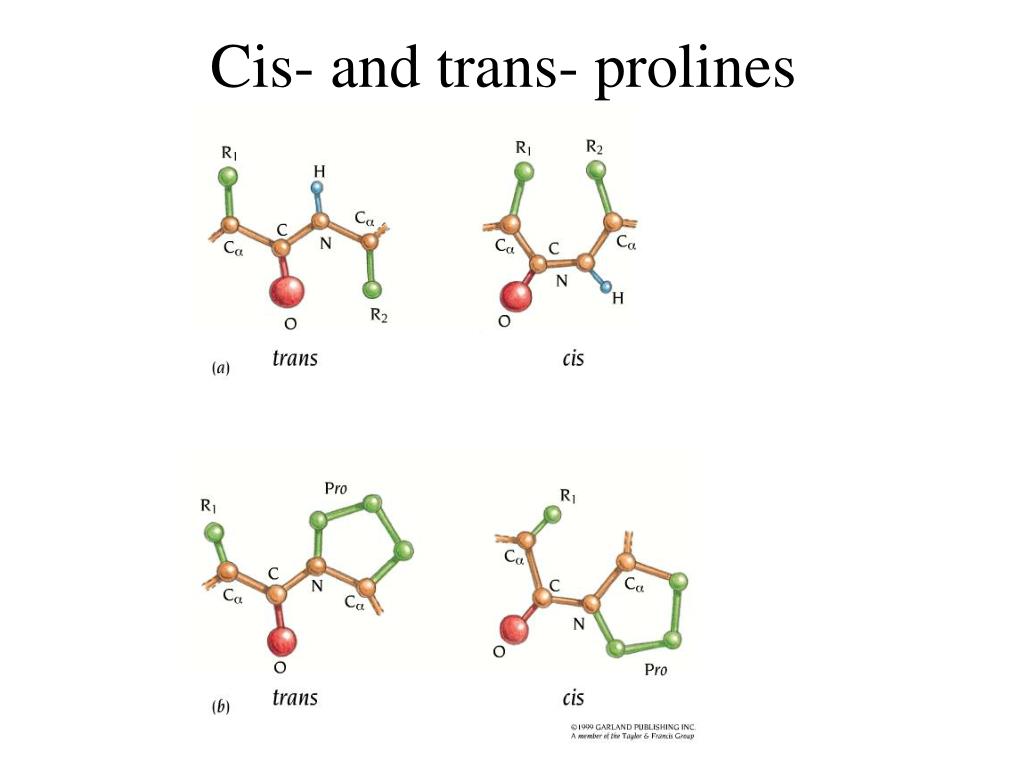
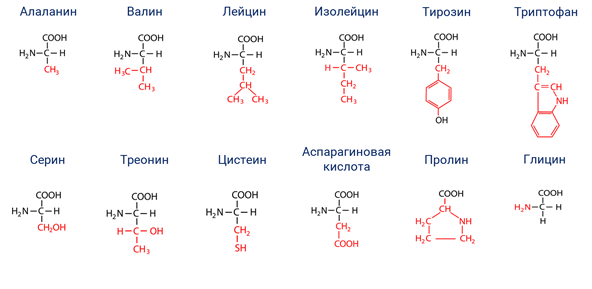
Препараты Аминосол (Аминосол, Аминосол Нео) содержат аминокислоты валин, изолейцин, лизин, фенилаланин, треонин, лейцин, триптофан, метионин, гистидин, аргинин, глицин, аланин, серин, пролин, тирозин, орнитин.
Препараты Аминосол применяются при остром панкреатите, синдроме кишечных свищах, тяжелых энтеритах, ожогах, тяжелых травмах, сепсисе, злокачественных новообразованиях, в послеоперационном периоде.
Аминокислоты
Классификация аминокислот
Структура, синтез, свойства и применение
Также известный как L-пролин, он представляет собой иминокислоту или молекулу, которая включает как карбоксильные, так и иминовые функциональные группы. Он также является частью двадцати наиболее важных аминокислот, так как люди и другие животные биосинтезируют его. Первичный амин, присутствующий на углероде полуальдегида глутамата, обычно образует основание Шиффа, из которого альдегид восстанавливается, образуя таким образом пролин.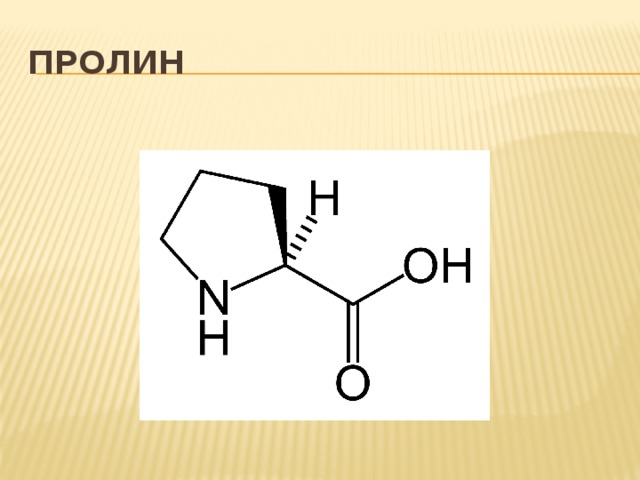 Пролин содержит вторичную аминогруппу (единственная природная аминокислота, имеющая вторичный амин), что дает его уникальные спиральные кольца в структуре. Белки, синтезированные из пролина, также имеют дискретную вторичную структуру и, следовательно, кажутся отличными от белков, синтезированных из белков с открытой цепью.
Пролин содержит вторичную аминогруппу (единственная природная аминокислота, имеющая вторичный амин), что дает его уникальные спиральные кольца в структуре. Белки, синтезированные из пролина, также имеют дискретную вторичную структуру и, следовательно, кажутся отличными от белков, синтезированных из белков с открытой цепью.
В 1900 году лауреат Нобелевской премии Ричард М. Вильштеттер изобрел D, L-рацемат, синтезированный из N-метилпролина. Обычно рассматриваемый как асимметричный катализатор в синтезе многочисленных белков, исследователи Гарвардского университета часто называли пролин «самым простым ферментом», который затем был разработан как пролин, являющийся одним из немногих катализаторов, обеспечивающих добиотическую эволюцию.
Структура пролина
Считается, что циклическая структура аминокислот крайне необычна (из-за вторичного амина), пролин образует пептидную связь, которая не содержит водорода в α-аминогруппе. Вот почему пролины не могут отдать свою водородную связь, чтобы сбалансировать α-спираль или β-лист.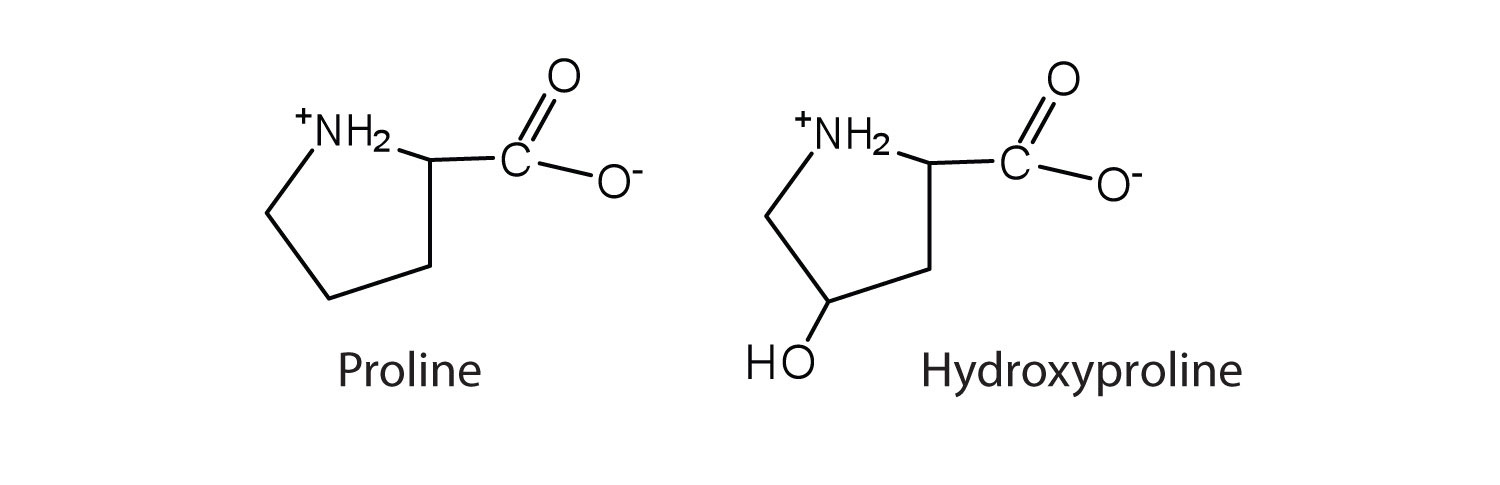 Для пролинов, находящихся на конце α-спирали, отсутствие атома водорода создает изгиб в структуре спирали и может существовать в изоэнергетических цис- и транс-вариациях.
Для пролинов, находящихся на конце α-спирали, отсутствие атома водорода создает изгиб в структуре спирали и может существовать в изоэнергетических цис- и транс-вариациях.
Для биологических систем животных и человека аминокислоты являются важнейшими компонентами из-за их жизненных свойств и свойств. Обнаруженные в различных клетках, мышцах, яйцах и других процессах животного происхождения, они могут помочь в регулировании выработки инсулина, заживлении мышечных тканей, а также способствовать метаболизму нашего тела. Часто представленные однобуквенным форматом P, эти аминокислоты состоят из аминогруппы и карбоксильной группы, а также R-группы, связанной с центральным атомом углерода, образуя спиральную структуру.
L-пролин происходит от пирролидина (циклического амина), в котором атом водорода pro-S заменен карбоксильной группой. Он имеет структуру, которая делает его энантиомером D-пролина и имеет конъюгированную кислоту с кислотой L-пролината.
Поскольку R-группа в пролине связана с атомом азота аминогруппы, именно это придает пролину его уникальную структуру, отличную от других аминокислот.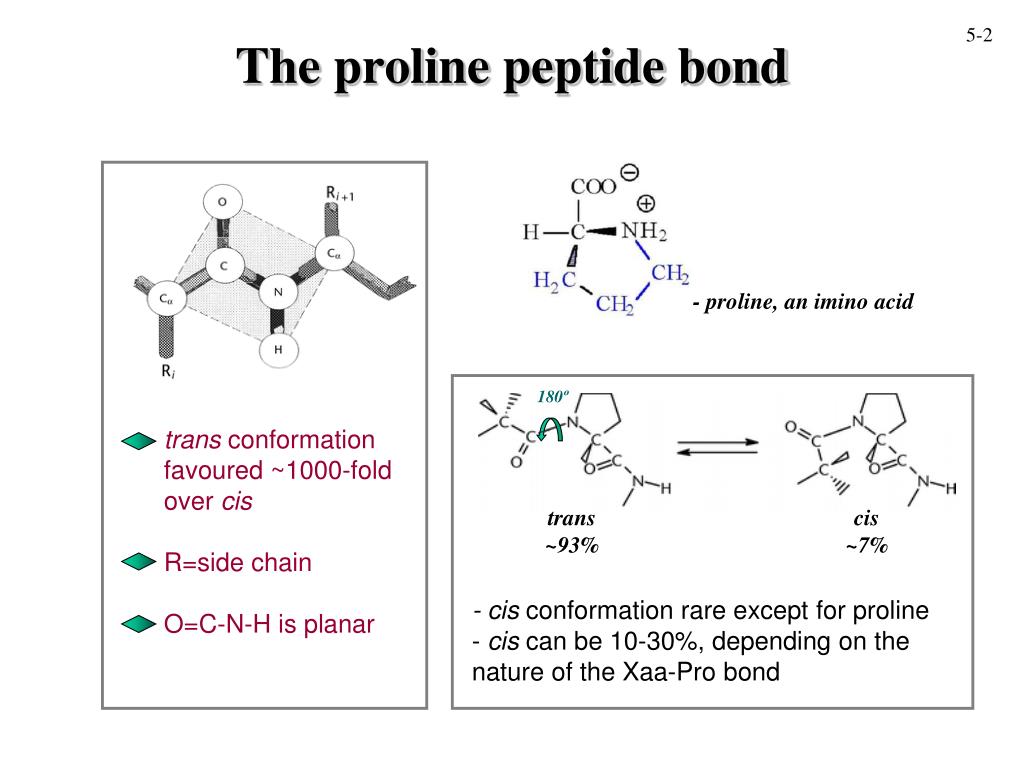 Вот как выглядит химическая структура пролина в форме:
Вот как выглядит химическая структура пролина в форме:
(Изображение будет добавлено в ближайшее время)
(Изображение будет добавлено в ближайшее время)
Синтез пролина
Для пролина требуется двойная связь углерод-азот (поскольку это иминокислота), и его можно легко синтезировать из глутаминовой кислоты. γ-карбоксильная группа восстанавливается до альдегида с образованием полуальдегида глутамата, который затем вступает в реакцию с α-аминогруппой с образованием воды и основания Шиффа (подкласс иминов). Это основание Шиффа также восстанавливается с образованием пролина.
Масса пролина (молярная) | 115,13 г/моль |
Химическая формула | C 8 0047 9 НЕТ 2 |
Температура плавления | 205–228 ºC |
Внешний вид в формах | Белые кристаллы |
900 Формула той же линии
900
(Изображение будет добавлено в ближайшее время)
Свойства пролина
Атом азота в пептидном пролине не остается присоединенным к водороду и поэтому оказывает значительное влияние на восприимчивость пептидных связей и стимулирует активность.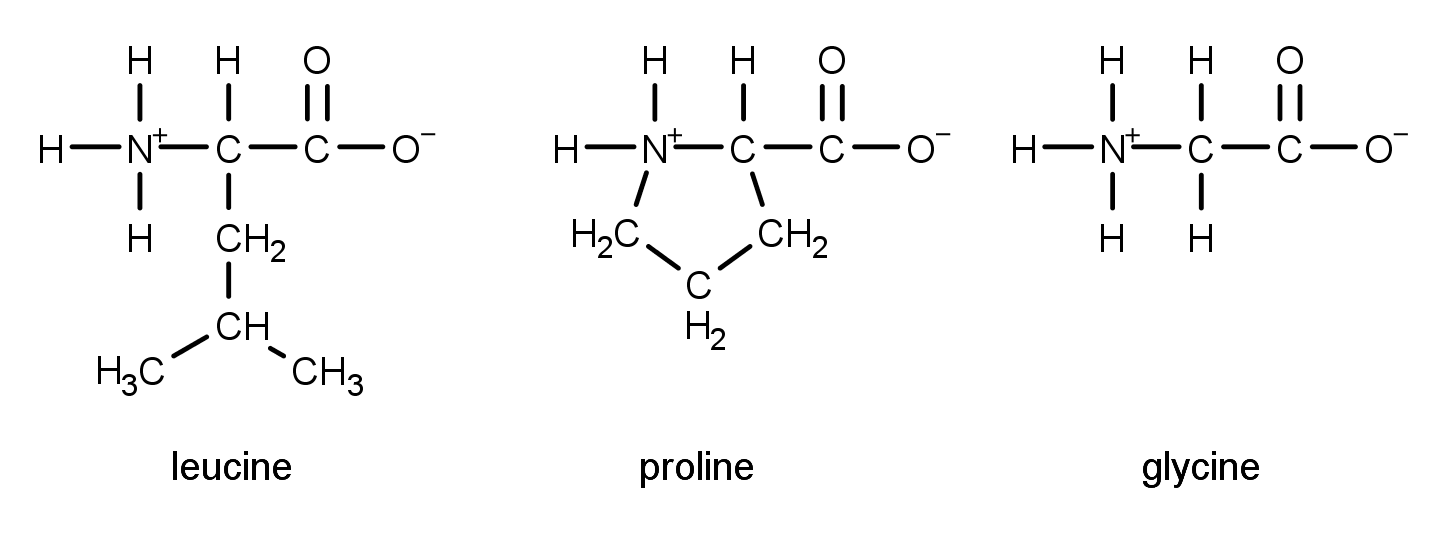 Пролин может образовывать агрегацию за счет гидрофобного взаимодействия пирролидинового кольца. Вот некоторые свойства пролина:
Пролин может образовывать агрегацию за счет гидрофобного взаимодействия пирролидинового кольца. Вот некоторые свойства пролина:
Пролины являются алифатическими и гидрофобными, что способствует внутриклеточной передаче сигналов в биосистемах.
Пептидазы, образующиеся в процессе биологических процессов с участием пролина, помогают регулировать выработку пролина на протяжении всей его жизни в форме аминопептидазы Р, пролидазы.
Фермент протеазы ВИЧ-I может приводить к образованию пептидной связи Xaa-Pro в процессе, который может быть критическим компонентом в некоторых иммунологических процессах.
Пролин может проявлять множество свойств, которые могут отличаться от других соединений с более легкой молекулярной массой в водной форме с точки зрения его растворимости, плотности и вязкости.
 В растворах пролина наблюдается сильная водородная связь с водой.
В растворах пролина наблюдается сильная водородная связь с водой.Растворы пролина могут повышать растворимость других белков, обеспечивая гидрофобное взаимодействие с поверхностью белка, что приводит к увеличению гидрофильной области.
Использование пролина
L-пролин используется в нескольких случаях. Вот некоторые из них:
L-пролин широко используется в качестве предшественника L-глутамата и поэтому известен своими способностями к энергетическому топливу.
Это одна из основных аминокислот, присутствующих в хрящах человека, которая помогает сохранить молодость кожи и способствует более быстрому восстановлению мышц, что имеет решающее значение для всесторонней работы суставов и сухожилий человека, включая укрепление сердечной мышцы и соединительной ткани. ткани.
Иногда L-пролин также может окисляться в почках из-за гликогена, который при дальнейшем окислении дает L-глутаминовую кислоту, играющую важную роль в борьбе с артрозом и хордами.

L-пролин также содержится в некоторых пищевых добавках в форме кристаллического пролина, который может способствовать метаболизму организма.
Молекула пролина
Молекула пролина
| | | |
| Сегодня |
|

 В растворах пролина наблюдается сильная водородная связь с водой.
В растворах пролина наблюдается сильная водородная связь с водой.