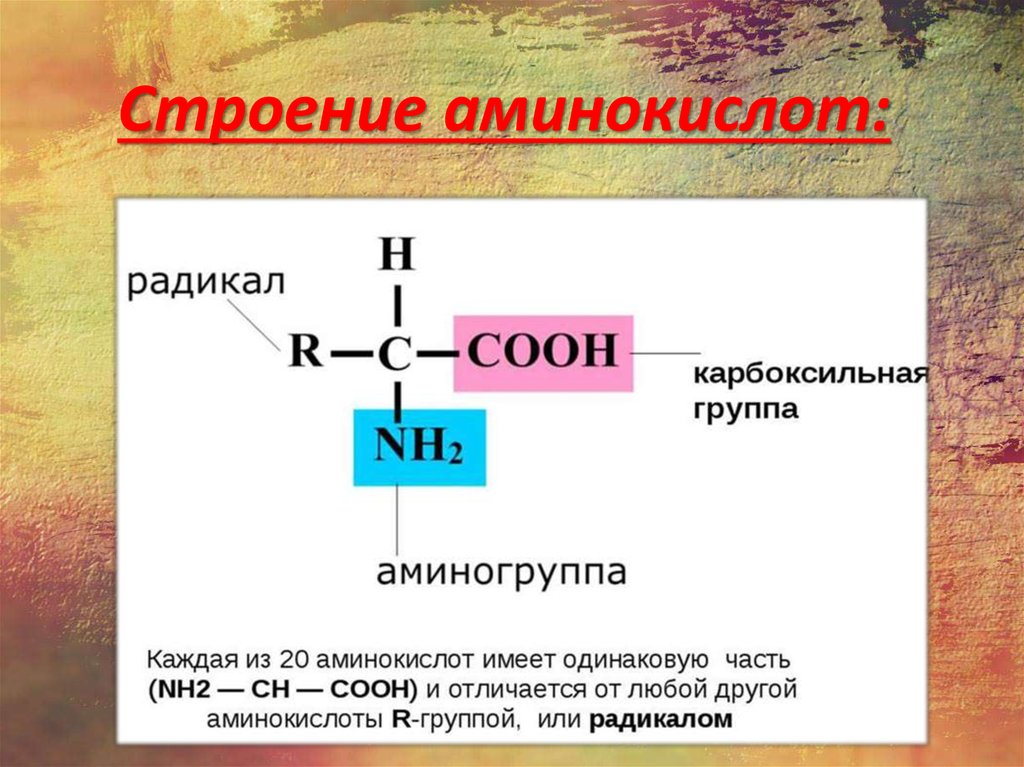
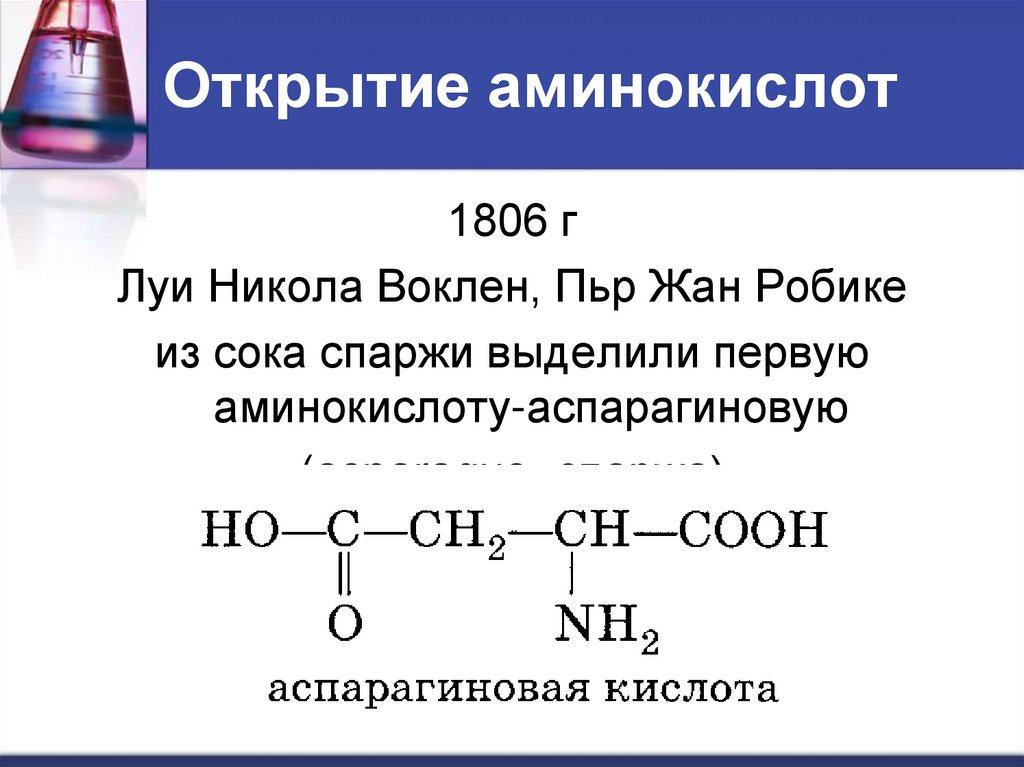
Изменяемыми частями аминокислоты является: Самостоятельная работа «Молекулярный уровень» 9 кл
» Химическая организация клетки. Белки»
Тест по теме:» Химическая организация клетки. Белки»
Тест с выбором одного правильного
ответа
1. Изменяемыми частями
аминокислоты являются:
а) аминогруппа и
карбоксильная группа;
б) радикал;
в) карбоксильная группа;
г) радикал и карбоксильная
группа.
2. Первичная структура белка
удерживается:
а) водородными связями;
б) пептидными связями;
в) гидрофобными связями;
г) дисульфидными связями.
3. Вторичную структуру
белковой молекулы поддерживают в основном … связи.
а) водородные;
б) ионные;
в) пептидные;
г) гликозидные.
4. Молекулы белков отличаются
друг от друга:
а) последовательностью
чередования аминокислот;
б) количеством аминокислот в
молекуле;
в) формой третичной
структуры;
г) всеми указанными
особенностями.
5. Какое из соединений не
построено из аминокислот?
а) гемоглобин;
б) гликоген;
в) инсулин;
г) альбумин.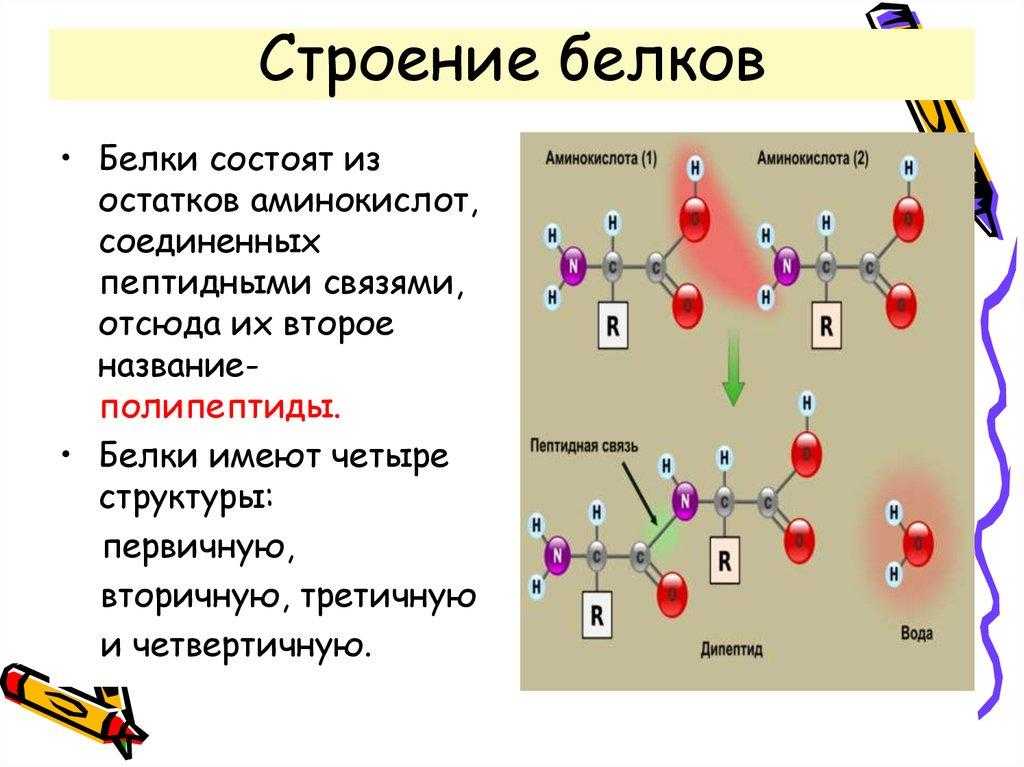
6. Как поступают в клетки
животных незаменимые аминокислоты?
а) синтезируются в самих
клетках;
б) поступают вместе с пищей;
в) поступают вместе с
витаминами;
г) поступают всеми указанными
путями.
7. Какие белки способствуют
отторжению органов и тканей при их пересадке от одного организма другому?
а) транспортные белки;
б) ферменты;
в) иммуноглобулины;
г) строительные белки.
8. В процессе биохимических
реакций ферменты:
а) ускоряют реакции и сами
при этом не изменяются;
б) ускоряют реакции и
изменяются в результате реакции;
в) замедляют химические
реакции, не изменяясь;
г) замедляют химические
реакции, изменяясь.
9. Для лечения тяжелых форм
сахарного диабета больным необходимо вводить:
а) гемоглобин;
б) инсулин;
в) антитела;
г) гликоген.
10. От каких условий зависит
действие ферментов в организме?
а) от температуры среды;
б) от рН среды;
в) от концентрации
реагирующих веществ и концентрации фермента;
г) от всех перечисленных
условий.
11. При обратимой денатурации
молекул белка происходит:
а) нарушение его первичной
структуры;
б) образование водородных
связей;
в) нарушение его третичной
структуры;
г) образование пептидных
связей.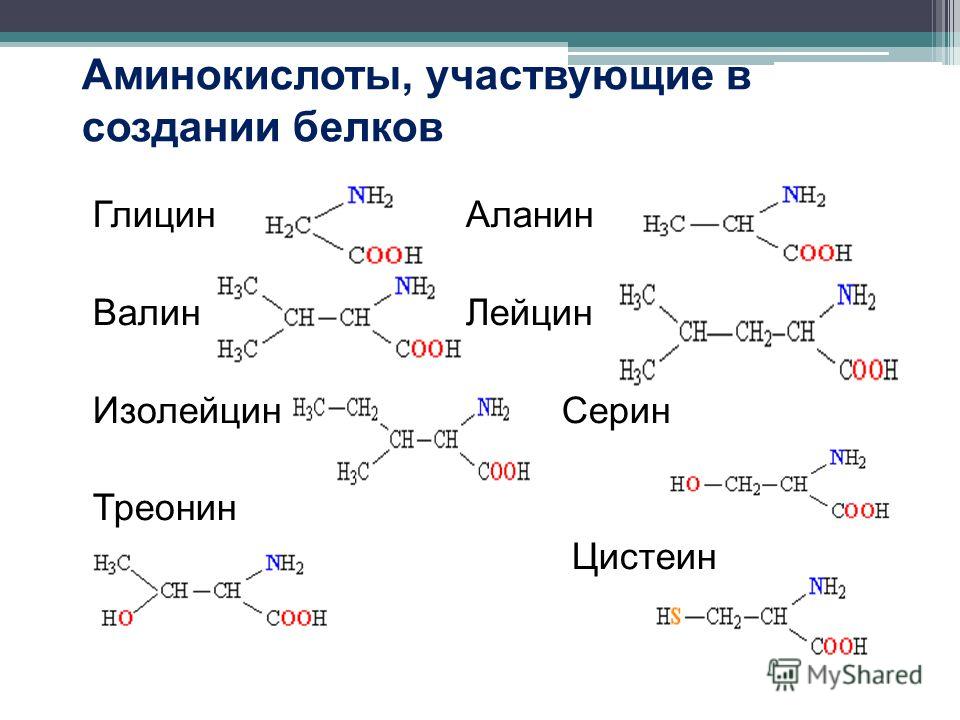
12. Полипептидная цепь,
свернутая в клубок, – это … структура белка.
а) первичная;
б) вторичная;
в) третичная;
г) четвертичная.
Тест с выбором нескольких правильных ответов
1.
Для третичной структуры белков характерно:
а)
в ее образовании принимают участие только водородные связи;
б)
образуется при укладке полипептидных цепей в глобулы;
в)
на ее уровне существуют белки, выполняющие защитную и механическую функции;
г)
образуется при упорядоченном свертывании полипептидной цепи в спираль;
д)
в ее образовании принимают участие водородные, ионные, дисульфидные связи;
е)
на ее уровне существуют ферменты, антитела, некоторые гормоны.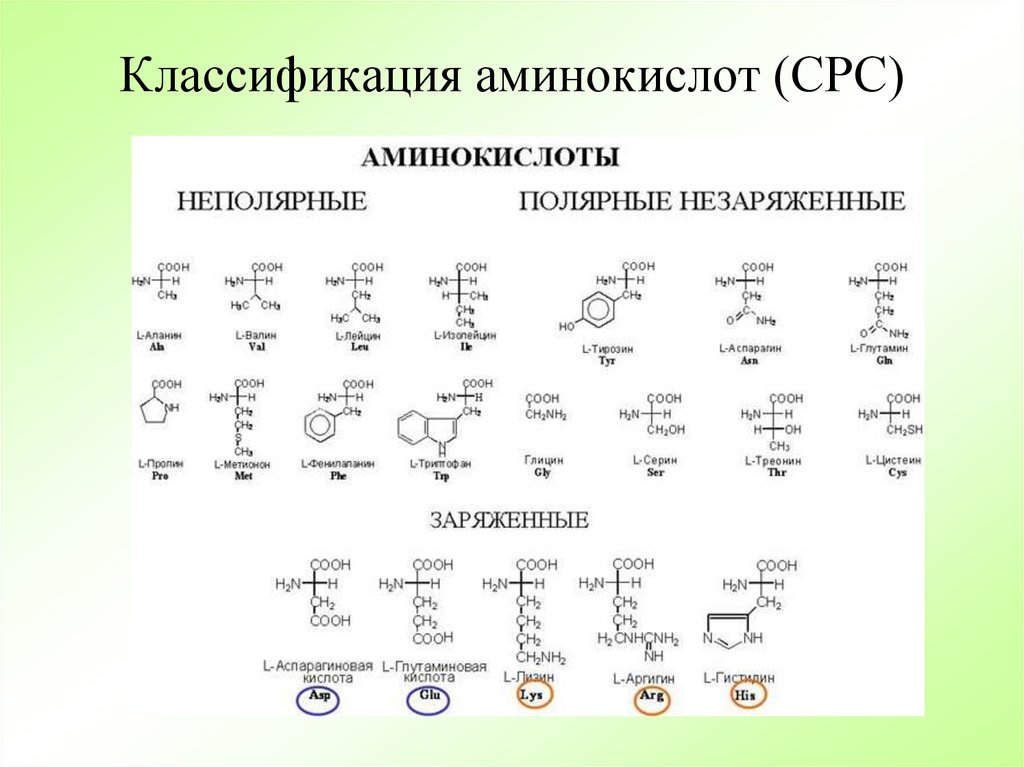
2. Выберите
верные утверждения:
1)
Мономером белка является
радикал.
2)
Аминокислота имеет радикал,
аминогруппу, карбоксильную группу.
3)
Вторичная структура белка
представлена спиралью или складчатым слоем.
4)
Все белки – ферменты.
5)
Дисульфидные связи – связи
между серосодержащими аминокислотами в молекуле белка.
6)
Активный центр фермента –
это липид.
7)
Гистоны входят в состав
хромосом.
8)
Денатурация – это
восстановление трехмерной структуры конформации белка.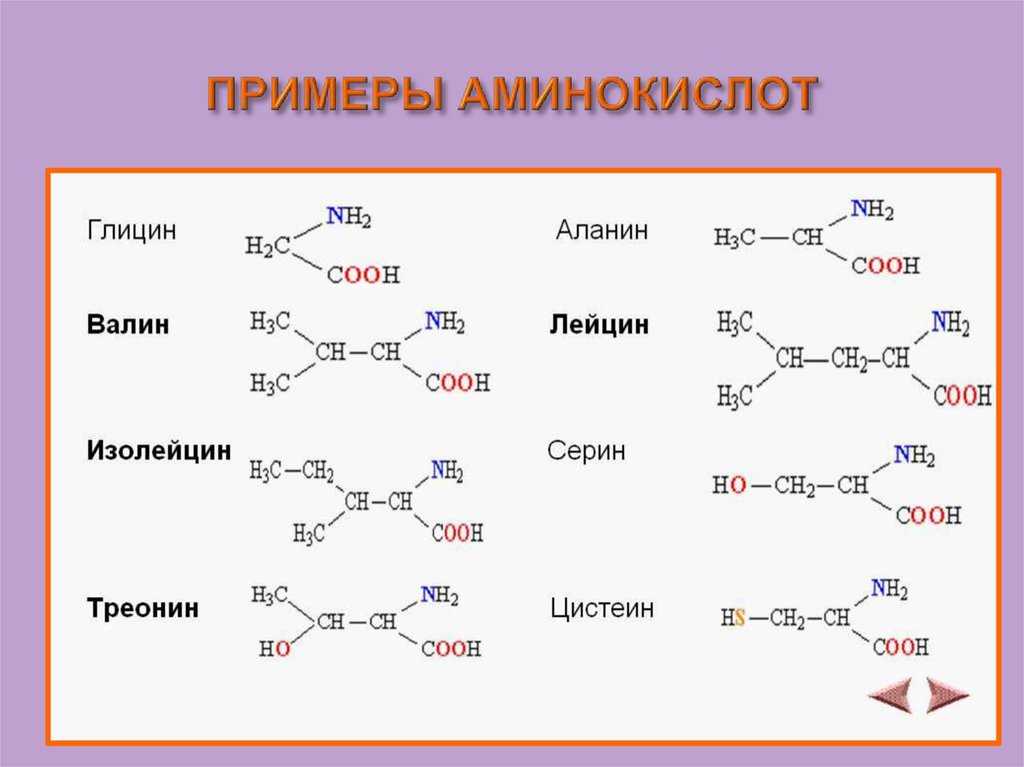
9)
Гемоглобин – белок
четвертичной структуры.
10)
Аминокислота – амфотерное соединение.
11)
Ферменты и антитела – глобулярные белки.
12)
Связь между Н и О называют пептидной.
13)
Реакция конденсации идет с выделением СО2.
14)
Первичную конформацию белка поддерживают водородные связи.
15)
Трипсин катализирует гидролиз белков.
16)
Ферменты – это биологические катализаторы.
17)
Ферменты обладают специфичностью.
18)
Активность фермента не зависит от рН.
19)
Анаболические реакции – реакции распада.
20)
Глюкагон инициирует распад гликогена в печени.
21)
Миоглобин переносит О2 в мышцах.
Следующее
Предыдущее
Главная страница
Подписаться на:
Комментарии к сообщению (Atom)
ТЕСТ ПО ТЕМЕ «МОЛЕКУЛЯРНЫЙ УРОВЕНЬ» | Тест по биологии (9 класс) на тему:
ТЕСТ ПО ТЕМЕ «МОЛЕКУЛЯРНЫЙ УРОВЕНЬ»
Вариант I
1. Какое из названных химических соединений не является биополимером?
а) Белок;
б) глюкоза;
в) дезоксирибонуклеиновая кислота;
г) целлюлоза.
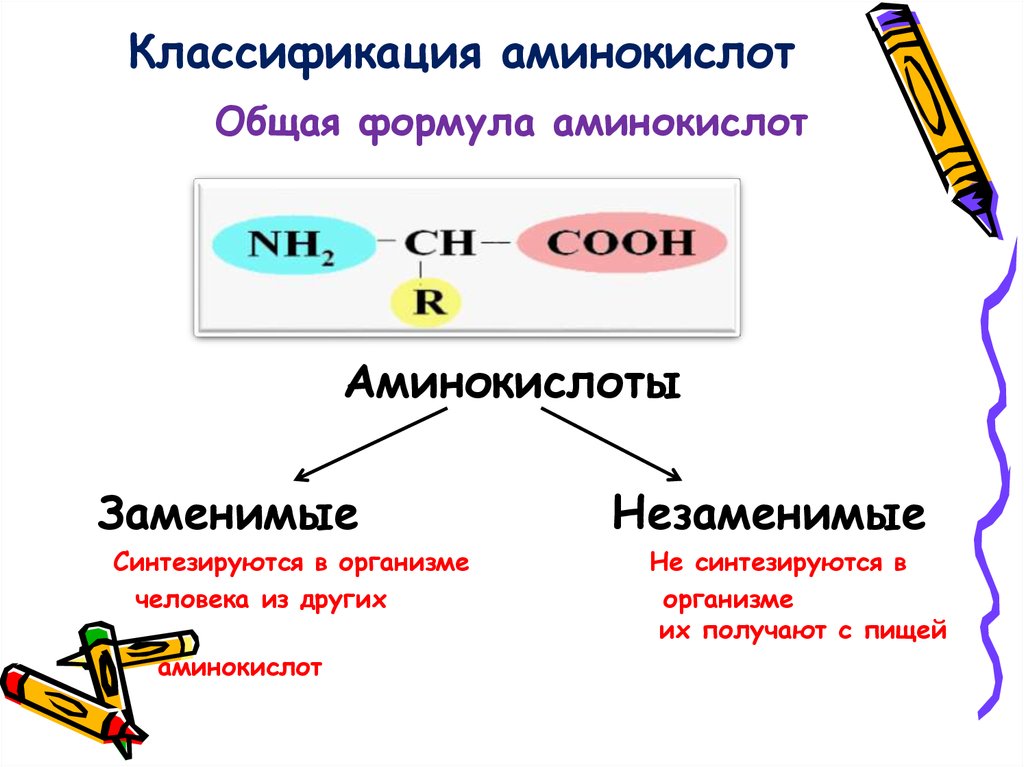
2. Изменяемыми частями аминокислоты являются:
а) аминогруппа и карбоксильная группа;
б) радикал;
в) карбоксильная группа;
г) радикал и карбоксильная группа.
3. В процессе биохимических реакций ферменты:
а) ускоряют реакции, а сами при этом не изменяются;
б) ускоряют реакции и изменяются в результате реакции;
в) замедляют реакции, не изменяясь;
г) замедляют реакции, изменяясь.
4. Мономерами ДНК и РНК являются:
а) азотистые основания;
б) дезоксирибоза и рибоза;
в) азотистые основания и фосфатные группы;
г) нуклеотиды.
5. Вторичная структура белка поддерживается:
а) пептидными связями;
б) водородными связями;
в) дисульфидными связями;
г) связями между радикалами кислот;
г) всеми перечисленными видами связи.
6. К полимерам относятся:
а) крахмал, белок, целлюлоза;
б) белок, гликоген, жир;
в) целлюлоза, сахароза, крахмал;
г) рибоза, белок, жир.
7. Из аминокислотных остатков построены молекулы:
а) углеводов;
б) белков;
в) липидов;
г) жиров.
8. К моносахаридам относятся:
а) лактоза, глюкоза;
б) дезоксирибоза, сахароза;
в) глюкоза, фруктоза;
г) гликоген, мальтоза.
9. Какую функцию выполняет рибосомальная РНК?
а) Формирует рибосомы;
б) снятие и перенос информации с ДНК;
в) перенос аминокислоты на рибосомы;
г) все перечисленные функции.
10. Соединение двух цепей ДНК в спираль осуществляют связи:
а) ионные;
б) водородные;
в) гидрофобные;
г) электростатические.
11. Белковая оболочка, в которую заключен геном вируса, называется
а) вирион
б) капсула
в) вироид
г) капсид
12. Вирусы размножаются
а) только в клетке хозяина
б) самостоятельно, вне клеток хозяина
в) оба варианта верные
Задача: фрагмент одной из цепей ДНК имеет следующее строение: ААГ-ГЦТ-АЦГ-ТТГ. Постройте на ней и-РНК.
Вариант II
1. Какое из веществ хорошо растворяется в воде?
а) Клетчатка;
б) белок;
в) глюкоза;
г) липиды.
2. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.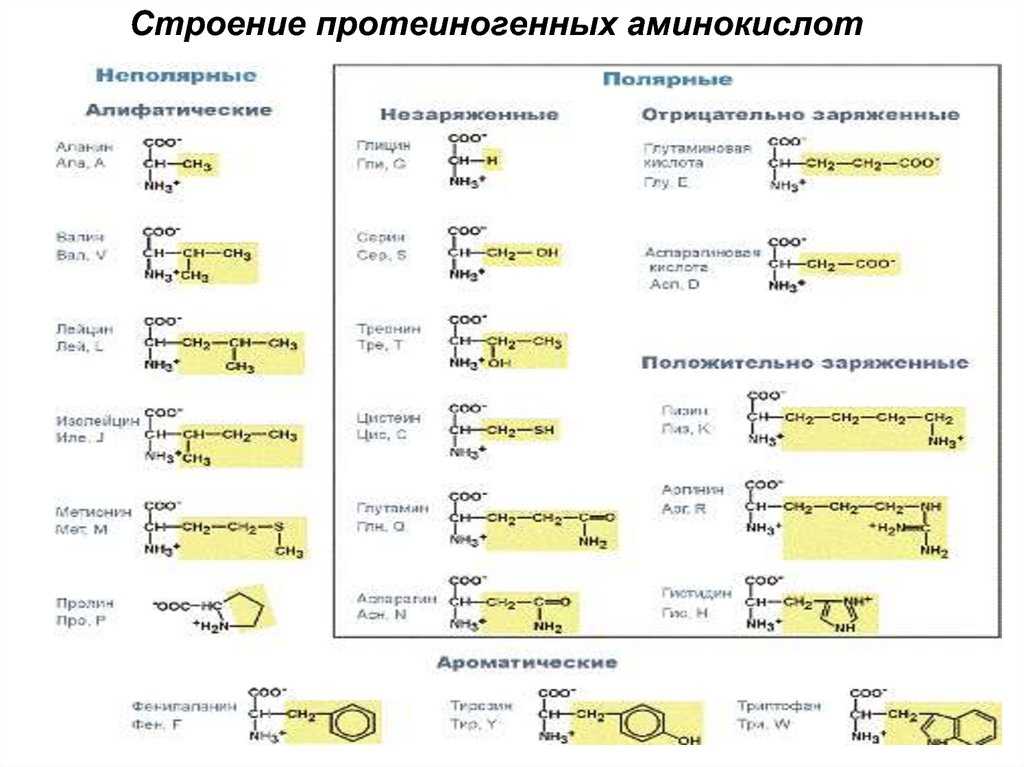
3. В каком случае правильно указан состав нуклеотида ДНК:
а) рибоза, остаток фосфорной кислоты, тимин;
б) фосфорная кислота, урацил, дезоксирибоза;
в) остаток фосфорной кислоты, дезоксирибоза, аденин;
г) фосфорная кислота, рибоза, гуанин.
4. Мономерами нуклеиновых кислот являются:
а) азотистые основания;
б) рибоза или дезоксирибоза;
в) дезоксирибоза и фосфатные группы;
г) нуклеотиды.
5. Аминокислоты в молекуле белка соединены посредством:
а) ионной связи;
б) пептидной связи;
в) водородной связи;
г) связи между радикалами кислот.
6. Какую функцию выполняет транспортная РНК?
а) Перенос аминокислоты на рибосомы;
б) снятие и перенос информации с ДНК;
в) формирует рибосомы;
г) все перечисленные функции.
7. Ферменты – это биокатализаторы, состоящие:
а) из белков;
б) липидов;
в) нуклеотидов;
г) жиров.
8. К полисахаридам относятся:
а) крахмал, рибоза;
б) гликоген, глюкоза;
в) целлюлоза, крахмал;
г) крахмал, сахароза.
9. Углерод как элемент входит в состав:
а) белков и углеводов;
б) углеводов и липидов;
в) углеводов и нуклеиновых кислот;
г) всех органических соединений клетки.
10. Клетка содержит ДНК:
а) в ядре и митохондриях:
б) ядре, цитоплазме и различных органоидах;
в) ядре, митохондриях и цитоплазме;
г) ядре, митохондриях и хлоропластах.
11.Вирусы — это …
а) неклеточная форма жизни
б) древнейшие эукариоты
в) примитивные бактерии
12. Вирусы состоят из
а) белков и нуклеиновой кислоты
б) целлюлозы и белков
в) ДНК и РНК
г) ядра и цитоплазмы
Задача: фрагмент и-РНК имеет следующее строение: ГАУ-ГАГ-УАЦ-УУЦ-ААА. Определите антикодоны т-РНК. Также напишите фрагмент молекулы ДНК, на котором была синтезирована эта и-РНК.
Ответы:
Вариант I: 1 – б, 2 – б, 3 – а, 4 – г, 5 – б, 6 – а, 7 – б, 8 – в, 9 – а, 10 – б, 11-г, 12-а.
Решение: по правилу комплементарности определяем фрагмент и-РНК и разбиваем его на триплеты: УУЦ-ЦГА-УГЦ-ААЦ.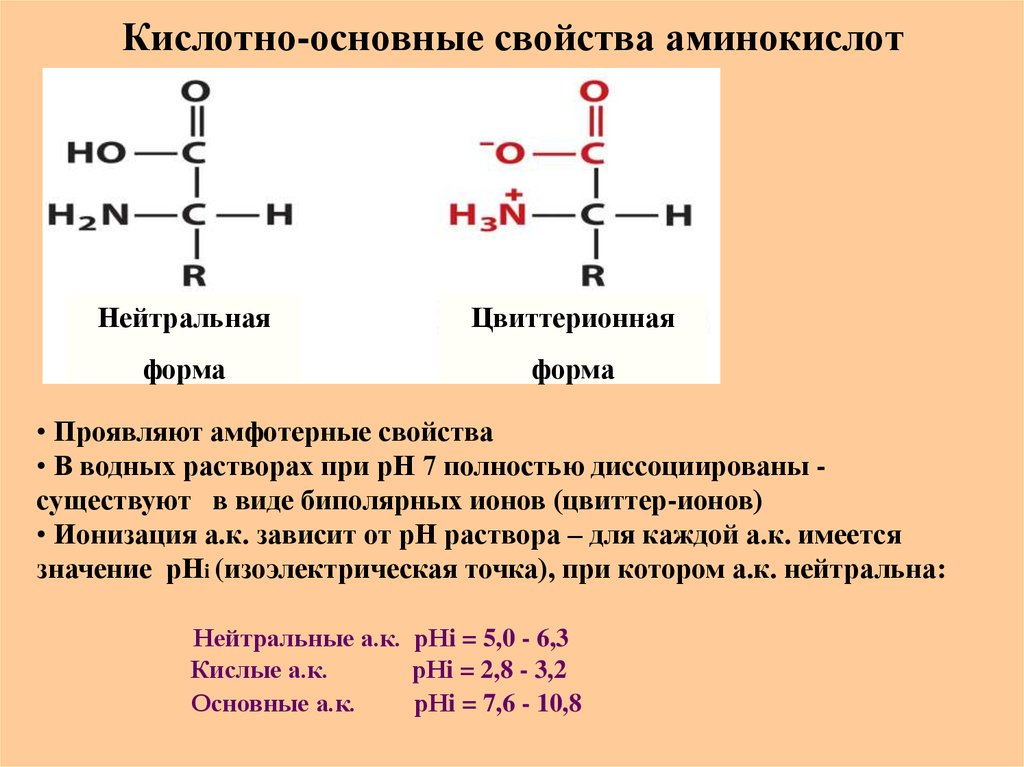
Вариант II: 1 – в, 2 – г, 3 – в, 4 – г, 5 – б, 6 – а, 7 – а, 8 – в, 9 – г, 10 – г, 11-а, 12-в.
Решение: разбиваем и-РНК на триплеты ГАУ-ГАГ-УАЦ-УУЦ-ААА. В данном фрагменте содержится 5 триплетов, поэтому в синтезе будет участвовать 5 т-РНК. Их антикодоны определяем по правилу комплементарности: ЦУА-ЦУЦ-АУГ-ААГ-УУУ. Также по правилу комплементарности определяем фрагмент ДНК (по и-РНК!!!): ЦТАЦТЦАТГААГТТТ.
4.3: Аминокислоты — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 8393
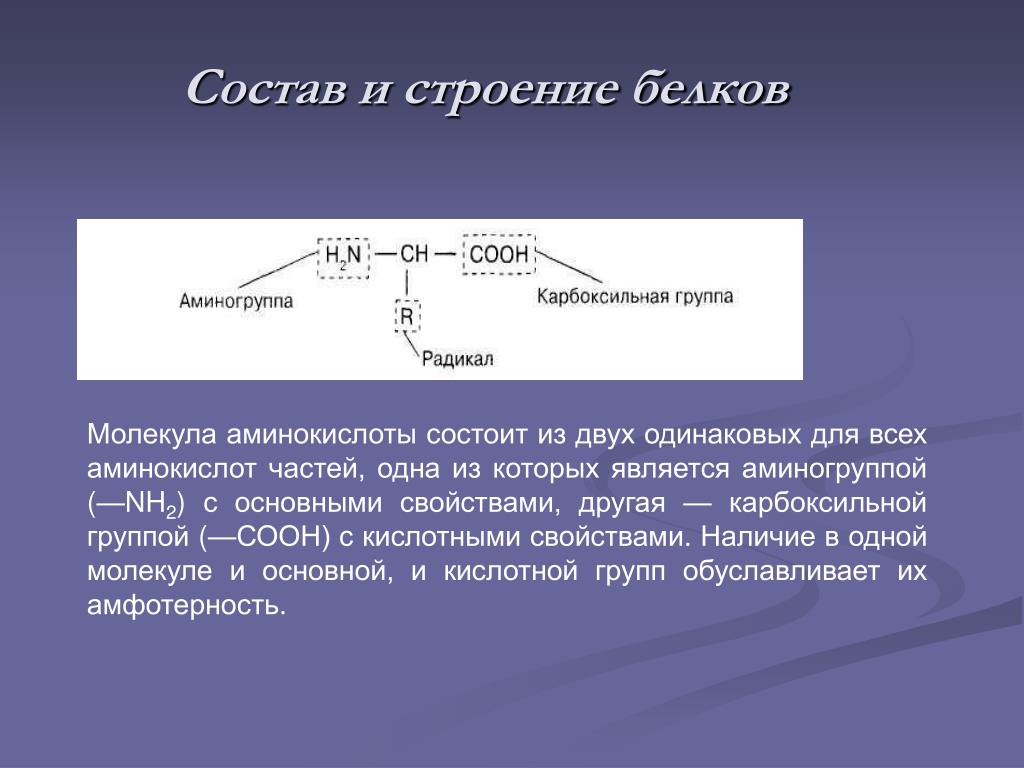
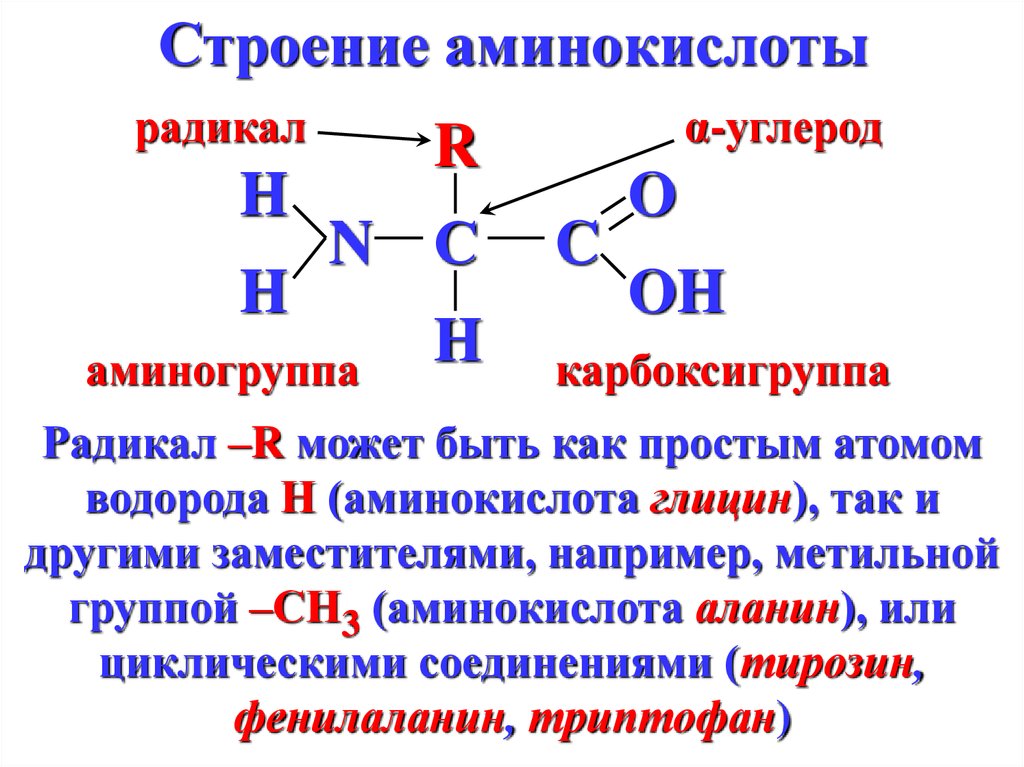
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую структуру ядра, которая состоит из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода.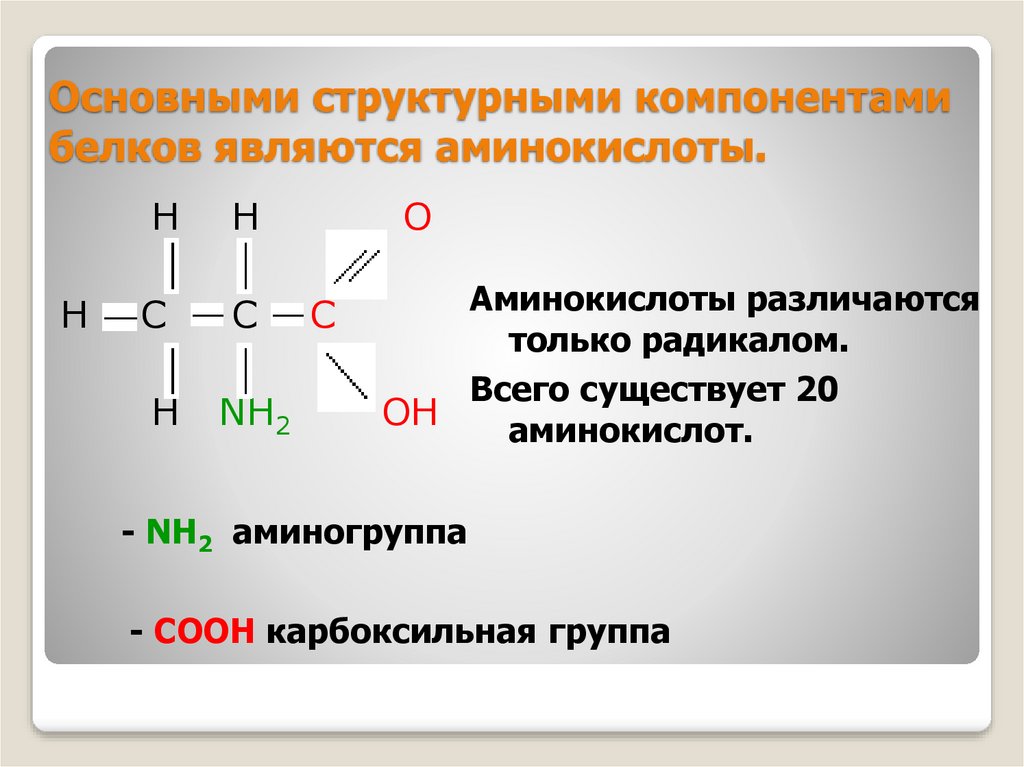 Каждая аминокислота также имеет другой атом или группу атомов, связанных с альфа-углеродом, которые также известны как группа R, вариабельная группа или боковая цепь.
Каждая аминокислота также имеет другой атом или группу атомов, связанных с альфа-углеродом, которые также известны как группа R, вариабельная группа или боковая цепь.
Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Атрибуция: Marc T. Facciotti (собственная работа)
Примечание: возможное обсуждение основу аминокислоты и ее боковую цепь (R-группу) и (b), чтобы можно было нарисовать общую аминокислоту. Убедитесь, что вы практикуете оба. Вы должны быть в состоянии воссоздать что-то вроде приведенного выше рисунка по памяти (хорошее использование вашего альбома для рисования — попрактиковаться в рисовании этой структуры, пока вы не научитесь делать это с помощью книги или Интернета).
Аминокислотная основа
Название «аминокислота» происходит от того факта, что все аминокислоты содержат как аминогруппу, так и карбоксильную группу в своей основе.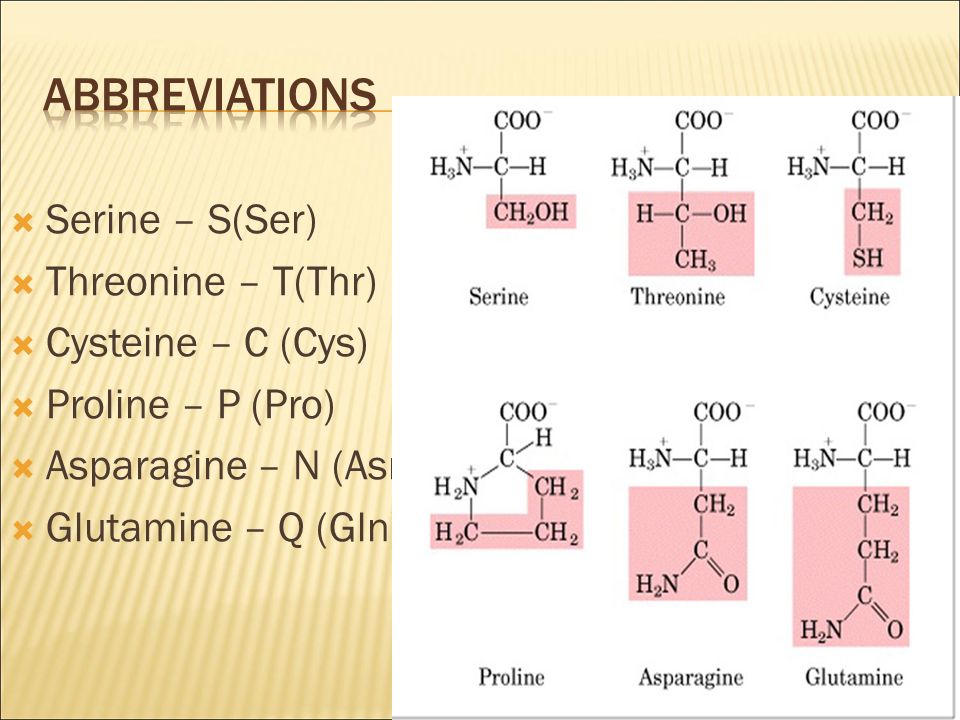 В природных белках присутствует 20 распространенных аминокислот, и каждая из них имеет одинаковую основу. Скелет, если не учитывать атомы водорода, состоит из паттерна:
В природных белках присутствует 20 распространенных аминокислот, и каждая из них имеет одинаковую основу. Скелет, если не учитывать атомы водорода, состоит из паттерна:
N-C-C
При взгляде на цепочку аминокислот всегда полезно сначала сориентироваться, найдя этот паттерн остова, начиная с N-конца (аминоконец аминокислоты). первая аминокислота) до С-конца (карбоксильный конец последней аминокислоты).
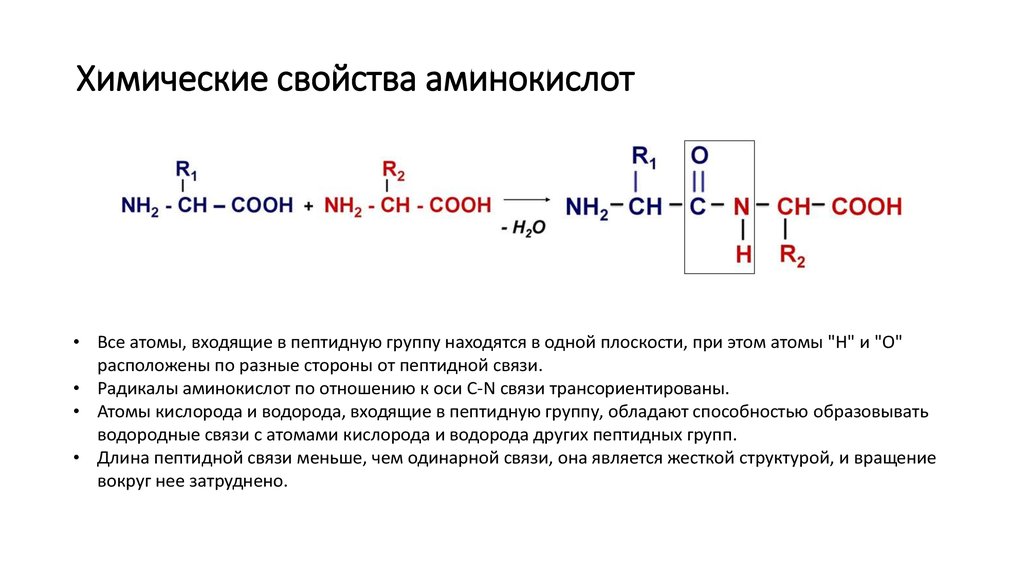
Образование пептидной связи является реакцией синтеза дегидратации. Карбоксильная группа первой аминокислоты связана с аминогруппой второй поступающей аминокислоты. При этом высвобождается молекула воды и образуется пептидная связь.
Попробуйте найти основу дипептида, образовавшегося в результате этой реакции. Искомый образец: N-C-C-N-C-C
Авторство: Marc T. Facciotti (собственная работа)
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь , которая образуется в результате реакции дегидратации-синтеза (конденсации). Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды и создавая пептидную связь.
Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды и создавая пептидную связь.
Аминокислота R-группа
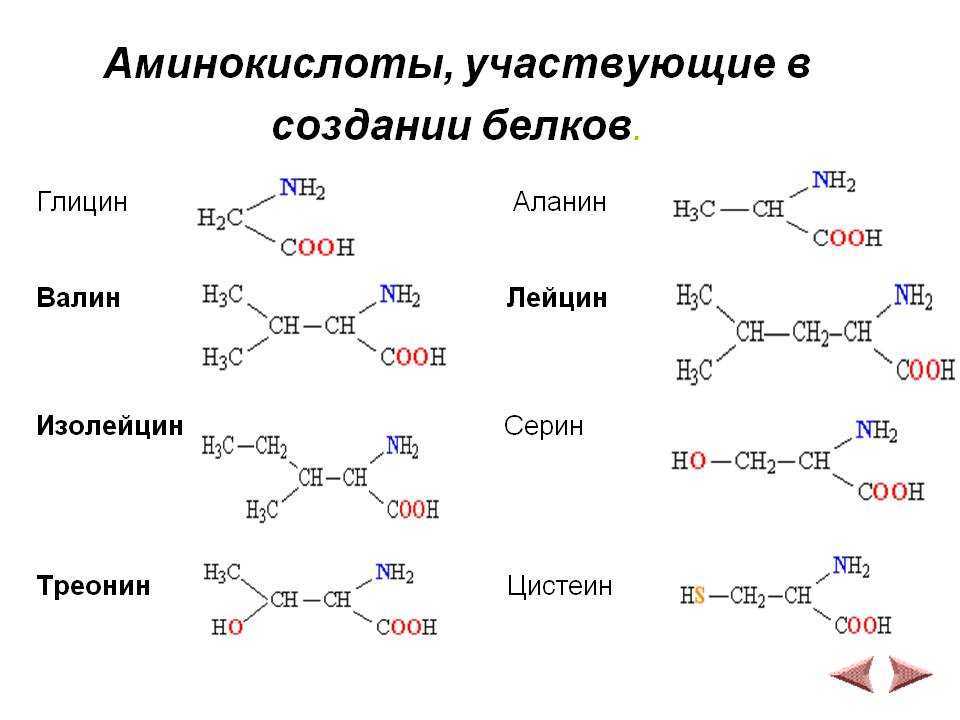
Аминокислота R-группа представляет собой термин, который относится к вариабельной группе каждой аминокислоты. Аминокислотный остов у всех аминокислот идентичен, R-группы у всех аминокислот разные. Структуру каждой аминокислоты см. на рисунке ниже.
В белках встречается 20 распространенных аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу. R-группы обведены бирюзовым цветом. Заряды назначены при рН ~ 6,0. Отображается полное название, трехбуквенная аббревиатура и однобуквенная аббревиатура.
Атрибуция: Marc T. Facciotti (собственная работа)
Примечание: возможное обсуждение
Давайте подумаем о важности наличия 20 различных аминокислот. Если бы вы использовали биологию для создания белков с нуля, что было бы полезно, если бы в вашем распоряжении было еще 10 различных аминокислот? Кстати, это на самом деле происходит в различных исследовательских лабораториях — почему это может быть потенциально полезно?
Каждая вариабельная группа аминокислоты придает этой аминокислоте определенные химические свойства (кислотные, основные, полярные или неполярные). Вы уже должны быть знакомы с большинством функциональных групп R-групп. Химические свойства, связанные со всем набором отдельных функциональных групп, придают каждой R-группе аминокислот уникальный химический потенциал.
Вы уже должны быть знакомы с большинством функциональных групп R-групп. Химические свойства, связанные со всем набором отдельных функциональных групп, придают каждой R-группе аминокислот уникальный химический потенциал.
Например, аминокислоты, такие как валин, метионин и аланин, обычно неполярны или гидрофобны по своей природе, в то время как аминокислоты, такие как серин и треонин, считаются полярными и имеют гидрофильные боковые цепи.
Примечание: Практика
Используя свои знания о функциональных группах, попробуйте классифицировать каждую аминокислоту на рисунке выше как имеющую тенденцию быть полярной или неполярной. Попробуйте найти другие схемы классификации и подумайте, составьте для себя список аминокислот, которые вы бы отнесли к каждой группе. Вы также можете поискать в Интернете схемы классификации аминокислот — вы заметите, что существуют разные способы группировки этих химических веществ на основе химических свойств. Вы даже можете обнаружить, что существуют противоречивые схемы.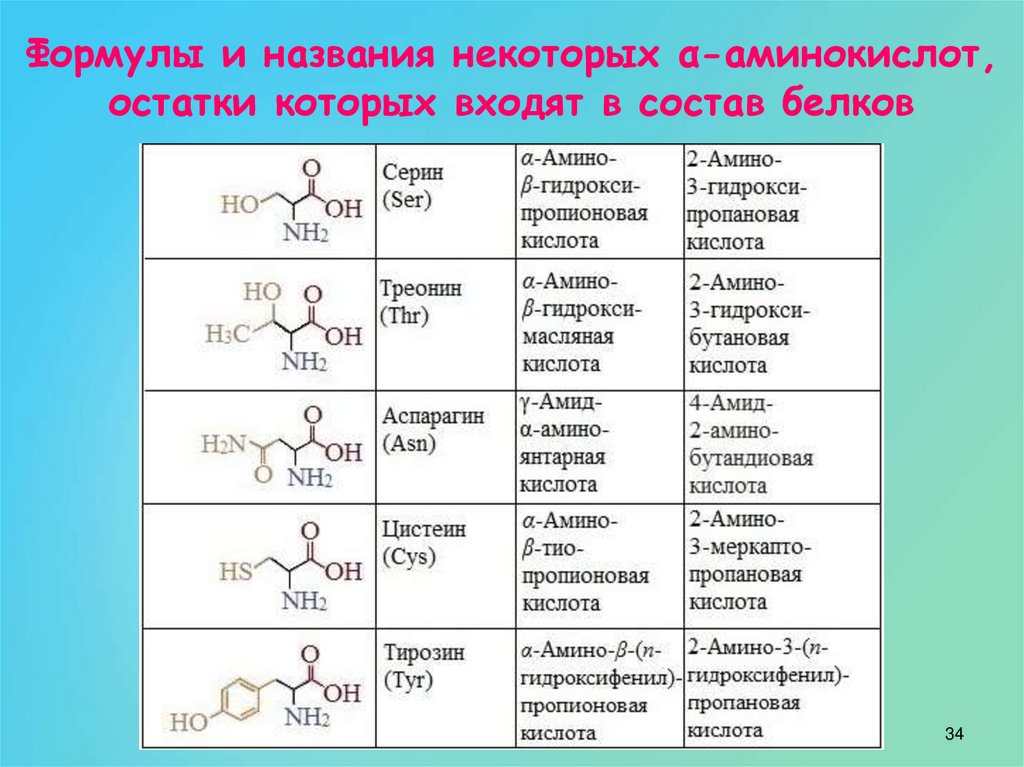 Попробуйте подумать, почему это может быть, и примените свою химическую логику, чтобы выяснить, почему были приняты определенные схемы классификации и почему определенные аминокислоты были помещены в определенные группы.
Попробуйте подумать, почему это может быть, и примените свою химическую логику, чтобы выяснить, почему были приняты определенные схемы классификации и почему определенные аминокислоты были помещены в определенные группы.
Теги рекомендованные шаблоном: статья:тема
4.3: Аминокислоты распространяются по незаявленной лицензии и были созданы, изменены и/или курированы LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать оглавление
- нет
- Теги

Понимание характеристик боковой цепи аминокислот для MCAT
Аминокислоты являются строительными блоками живых существ. Длинные цепочки аминокислот составляют белки, которые, в свою очередь, составляют многие структурные и функциональные компоненты клетки.
Мне нравится думать о клетке как об автономном городе, где ядро — это столица, митохондрии — электростанция и так далее. Но затем у вас есть рабочие, транспортная система и сама структура клеточного города, которые состоят из белков, которые, в свою очередь, состоят из аминокислот.
Сложность структуры белка определяется его последовательностью аминокислот и химической природой их вариабельных групп боковых цепей. MCAT требует понимания природы полярных и неполярных боковых цепей, а также скручивания и конформаций, вызванных гидрофобными и гидрофильными взаимодействиями
И да, вы должны запомнить каждую аминокислоту для MCAT. Включает боковую цепь, полное имя, трехбуквенное имя и однобуквенную аббревиатуру. Но не просто наклеивайте слова и конструкции на карточки, надеясь заставить их запомниться. Вам нужно активно заниматься каждой аминокислотой в отдельности.
Но не просто наклеивайте слова и конструкции на карточки, надеясь заставить их запомниться. Вам нужно активно заниматься каждой аминокислотой в отдельности.
Чтобы получить краткий справочный список, загрузите мою бесплатную памятку по аминокислотам. Учебное пособие
- Напишите полное название
- Нарисуйте структуру аминокислот и группу переменных
- Запишите трехбуквенные и однобуквенные сокращения
- Расскажите что-нибудь уникальное об этой конкретной боковой цепи — вслух! Чем смешнее и безумнее будет связь, тем легче вы ее запомните.
- Повторяйте название/рисунок один раз СРАЗУ
- Повторяйте еженедельно, пока не почувствуете себя ТВЕРДЫМ с этой информацией. Аминокислота имеет центральный хиральный углерод, называемый альфа-углеродом (черный). К центральному углероду присоединены атом водорода (серый), аминогруппа или группа Nh3 (зеленый) и группа COOH карбоновой кислоты (фиолетовый). Наконец, у нас есть группа R (красная), которая представляет собой вариабельную боковую цепь.

Существует 20 различных аминокислот, отличающихся своими уникальными боковыми цепями. Они варьируются от простого атома водорода (глицин) до сложной резонирующей ароматической системы с двумя кольцами (триптофан).
Хотя приведенная выше полностью нейтральная версия — это то, как большинство студентов изучают аминокислоты, и форма, которую мы будем использовать в этой статье, имейте в виду, что это технически неверно.
Аминокислота в форме цвиттер-иона
Поскольку карбоксильная группа является кислотной, а аминогруппа основной, они будут существовать в виде цвиттер-иона в сопряженных заряженных формах при физиологических значениях рН. Подробнее о зарядах цвиттерионов и аминокислот в моей следующей статье (ссылка ниже).
Еще одна концепция, прежде чем мы разберем отдельные аминокислоты, и это трехмерная структура белка. В биологической системе структура определяет функцию , поэтому понимание характеристик аминокислот является ключом к пониманию структуры и, в конечном счете, функции белка.

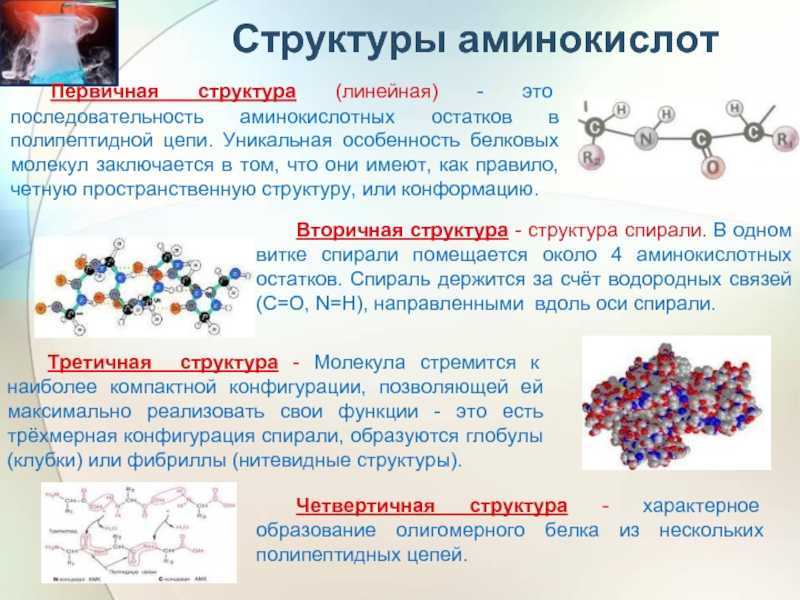
Первичная структура трехмерного белка
Первым и наиболее важным фактором, определяющим структуру белка, является последовательность аминокислот. Если полипептидная цепь присоединена в другом порядке, вы получите совершенно другую общую структуру.Вторичная структура трехмерного белка
Вторичная структура возникает в результате взаимодействия водородных связей в основной цепи. Пептидная связь превращает каждую бывшую карбоксильную и аминогруппу в амидную функциональную группу. Вторичная структура альфа-спирали и бета-складчатых листов возникает из-за водородных связей между частично отрицательным кислородом на карбониле и частично положительным водородом на азоте.Третичная структура трехмерного белка
Третичная структура — это место, где представлена настоящая трехмерная складка, и вы впервые заметите взаимодействие боковых цепей. Именно здесь знание и понимание боковых цепей аминокислот имеют решающее значение.
Позвольте мне повторить: третичная структура — это первый случай, когда вы увидите вариабельные взаимодействия боковых цепей R-группы в полипептидной цепи. Многие студенты путают это со вторичной структурой, которая представляет собой только магистральные взаимодействия.
Четвертичная структура трехмерного мультиполипептидного белка
Четвертичная структура относится к взаимодействию вариабельных групп между различными полипептидами с образованием одного более крупного белка.Четвертичные структуры встречаются не во всех белках. Если белок содержит только одну аминокислотную цепь, то высший уровень сворачивания — это его третичная структура. Однако если белок состоит из нескольких полипептидных субъединиц, то четвертичная структура удерживает вместе разные полипептиды.
Теперь, когда вы понимаете значение характеристик боковой цепи, давайте углубимся в аминокислоты. Имейте в виду, что, поскольку исходные амино- и карбоксильные группы «заняты» первичной/вторичной структурой, они НЕ анализируются при изучении свойств и характеристик боковой цепи.

Это означает, что вы игнорируете любую потенциальную полярность как карбоксильной, так и аминогруппы и смотрите ТОЛЬКО на боковые цепи.Неполярные гидрофобные аминокислоты
Гидрофобные, как следует из названия, гидро – вода , фобия – боязнь . Гидрофобные аминокислоты имеют небольшую полярность или вообще не имеют полярности в своих боковых цепях. Отсутствие полярности означает, что у них нет возможности взаимодействовать с сильно полярными молекулами воды, что заставляет их бояться воды.
В ваших переменных аминокислотных группах будет только пять атомов: H, C, N, O и S.
Учитывайте полярность только тогда, когда у вас есть N, O, S в качестве фактора «большинства». Я буду указывать на них по мере их возникновения. Однако, если все, что вы видите, это Cs и Hs, вы должны автоматически распознать аминокислоту, боящуюся воды.Глицин
Gly
GГлицин — уникальная аминокислота, поскольку она не имеет R-группы.
 Когда вы думаете о «переменной группе R», вы должны думать об углероде, присоединенном к другим атомам. Но глицин имеет водород только в положении боковой цепи. Поскольку глицин имеет 2 атома водорода, по одному в родительской и боковой цепи, это единственная симметричная и, следовательно, ахиральная аминокислота. Поскольку водород неполярен, глицин является гидрофобной аминокислотой. Боковая цепь водорода делает глицин самой маленькой аминокислотой.
Когда вы думаете о «переменной группе R», вы должны думать об углероде, присоединенном к другим атомам. Но глицин имеет водород только в положении боковой цепи. Поскольку глицин имеет 2 атома водорода, по одному в родительской и боковой цепи, это единственная симметричная и, следовательно, ахиральная аминокислота. Поскольку водород неполярен, глицин является гидрофобной аминокислотой. Боковая цепь водорода делает глицин самой маленькой аминокислотой.Аланин
Ala
AАланин представляет собой простую аминокислоту, которая имеет только метильную группу или группу Ch4 в качестве боковой цепи. Поскольку вы не видите ничего, кроме углерода и водорода, аланин является неполярной гидрофобной аминокислотой. Важно понимать, что это очень маленькая аминокислота, способная «вклиниваться» в плотные петли или цепочки.
Валин
Вал
VВалин – еще одна простая аминокислота, содержащая только изопропильную вариабельную группу.
 Как и в случае с аланином, мы не видим ничего, кроме углерода и водорода, что делает валин неполярной гидрофобной аминокислотой.
Как и в случае с аланином, мы не видим ничего, кроме углерода и водорода, что делает валин неполярной гидрофобной аминокислотой.Лейцин
Leu
LВы можете распознать лейцин как имеющий ту же вариабельную группу, что и валин, но с дополнительной группой Ch3. Или вы можете просто распознать его изобутильную боковую цепь.
Посмотрите это видео, если вы не знакомы с разветвленными боковыми цепями, такими как изопропил или втор-бутил. Поскольку в лейцине есть только Cs и Hs, это неполярная аминокислота, боящаяся воды.Изолейцин
Ile
IИзолейцин, как следует из названия, является изомером лейцина. Разница заключается в расположении Ch4 для втор-бутиловой, а не изобутильной боковой цепи. Как и его изомер, изолейцин неполярен и гидрофобен.
Метионин
Метионин
MМетионин – первая потенциально сложная аминокислота. Его боковая цепь содержит в основном Cs и Hs, но со встроенным атомом серы.
 Хотя вы можете подумать, что он гидрофильный, обратите особое внимание на расположение атома серы. Встроенная в цепочку и прикрепленная только к атомам углерода, сера частично «спрятана» от внешней среды.
Хотя вы можете подумать, что он гидрофильный, обратите особое внимание на расположение атома серы. Встроенная в цепочку и прикрепленная только к атомам углерода, сера частично «спрятана» от внешней среды.Хотя вам не нужно знать значения электроотрицательности для MCAT, полезно понять, что S = 2,58 и C = 2,55. Поскольку разница в электроотрицательности меньше 0,5, на этой боковой цепи НЕТ полярности.
Вы также должны распознать метионин как стартовый кодон AUG в трансляции РНК в белки.Фенилаланин
Phe
FЧтобы помочь вам запомнить, что фенилаланин — это F, помните, что «ph» произносится как «F». Не путайте это с P для пролина.
Обратите внимание на структуру фенилаланина. Он имеет одну углеродную группу с присоединенным бензольным кольцом. Фенил — это название бензольного заместителя, и эта молекула имеет бензол (фенил), присоединенный к структуре аланина. Поскольку в ароматической боковой цепи фенилаланина нет ничего, кроме Cs и Hs, он неполярен и гидрофобен.
Триптофан
Trp
WЭто хитрый вопрос. Обратите внимание на NH в этой боковой цепи. NH должен быть полярным и способным образовывать водородные связи. Однако есть две причины, по которым эта аминокислота все еще неполярна и гидрофобна.
- Группа NH представляет собой крошечную часть очень большой боковой цепи.
- Внимательно посмотрите на азот и, что более важно, на его неподеленные пары. Электроны азота являются неотъемлемой частью сопряженной ароматичности боковой цепи триптофана. Другими словами, считайте его электроны «слишком отвлеченными» резонансом, чтобы уделять много внимания внешней водной среде.
MCAT требует, чтобы вы признали, что это большая и громоздкая аминокислота. Но поскольку это экзамен с несколькими вариантами ответов, вы можете просто запомнить, что триптофан — это ЕДИНСТВЕННАЯ аминокислота с ДВУМЯ слитыми кольцами.
На самом деле, оно такое большое, что может СОПРОТИВАТЬСЯ (трп) о себя и кричать Ваааааа (W)
(Примечание по мнемотехнике: чем смешнее, страннее или грязнее мнемоника, тем больше вероятность, что вы ее запомните. Имейте это в виду. для медицинских школ.)
Имейте это в виду. для медицинских школ.)Пролин
Pro
PПролин — уникальная аминокислота, поскольку она ЕДИНСТВЕННАЯ, которая включает основную цепь в боковую цепь. Боковая цепь пролина представляет собой цепь из 3 атомов углерода, которая образует петлю и присоединяется к исходной аминогруппе. Это означает, что, в отличие от других аминокислот, пролин НЕ имеет атома водорода на атоме азота, когда он является частью полипептидной цепи.
Однако нельзя забывать, что азот НА САМОМ ДЕЛЕ НЕ является частью переменной группы, а это значит, что он не может вносить никакой полярности. Поскольку у нас есть только 3 группы Ch3 для анализа, мы получаем неполярную гидрофобную боковую цепь. Эта родительская петля создает выпуклость и не позволяет цепи, содержащей пролин, быть линейной, что означает, что вы часто найдете ее в петлях и в конце альфа-спирали.
Полярные гидрофобные аминокислоты
*Это липкий раздел, и , в зависимости от того, где вы исследуете, вы можете найти следующие категории, классифицированные как полярные или неполярные, гидрофильные или гидрофобные.
 Обратите внимание на наличие полярных групп, которые малы по сравнению с общей боковой цепью или очень слабо полярны и, следовательно, гидрофобны.
Обратите внимание на наличие полярных групп, которые малы по сравнению с общей боковой цепью или очень слабо полярны и, следовательно, гидрофобны.Цистеин
Цис
CЦистеин имеет слегка полярный S-H, но его полярность настолько слабая, что цистеин не может должным образом взаимодействовать с водой, что делает его гидрофобным.
Цистеин является очень важной аминокислотой, когда речь идет о третичной и четвертичной структуре. Большинство взаимодействий боковых цепей включают полярные/заряженные взаимодействия или неполярную Ван-дер-Ваальсову и лондонскую дисперсию. Однако боковая цепь цистеина способна образовывать дисульфидный мостик, который представляет собой ковалентную связь между 2 атомами серы посредством окисления боковой цепи и удаления 2 атомов водорода. Эта ковалентная связь намного прочнее и постояннее по сравнению со стандартными третичными и четвертичными взаимодействиями.
Это также является причиной экспериментальной ошибки при определении размера/длины белка для белков с несколькими субъединицами.
Тирозин
Tyr
YНекоторые учащиеся видят в этом утечку OH из шины (tyr).
Присмотритесь к тирозину. Что ты видишь? Похоже на ароматический фенилаланин с группой ОН в пара-положении (орто/мета/пара 2-е видео).
С одной стороны, у нас есть очень полярная и способная образовывать водородную связь ОН-группа, но, с другой стороны, ОН крошечная по сравнению с размером бензильной группы (Ch3-фенил). Эта головоломка является распространенным источником путаницы, но если вы поймете это, вы поймете, что тирозин, хотя и полярный, все же является гидрофобной аминокислотой.
Полярные гидрофильные аминокислоты
Гидрофильные, как следует из названия, происходят от гидро-вода и фильно-любящий .
Полярность обусловлена разницей в 0,5-1,9 электроотрицательности между связанными атомами. Хотя вам не нужно знать эти значения для MCAT, вы должны понимать, что полярные связи будут существовать, когда N и O связаны с неуглеродными атомами.
Разницы в электроотрицательности достаточно, чтобы создать небольшое разделение заряда или полярности. А поскольку подобное притягивает подобное, эти частично заряженные группы будут притягиваться к противоположно заряженным или частично заряженным группам, таким как вода. Эти группы будут скручивать полипептидную цепь, чтобы взаимодействовать друг с другом и с водой.
Гидрофобные группы будут откручиваться от этих боковых цепей.Серин
Серин
SДумайте о серине как об аланине с присоединенной группой ОН. В отличие от тирозина, ОН составляет большинство в этой молекуле, и его полярности достаточно, чтобы влиять на всю группу. Это делает серию полярной и очень гидрофильной.
Треонин
Thr
TЕсть несколько способов взглянуть на эту группу. Вы можете думать о нем как о серине с дополнительной метильной группой или как о валине, но с ОН, заменяющим одну из метильных групп. Я помню, что THREEonine имеет 3 разные группы: CH, Ch4 и OH.

Подобно серину, эта вариабельная группа является полярной и гидрофильной.Аспарагин
Asn
NПопробуйте это: произносите фразу «аспарагин» очень быстро. Звучит так, как будто вы говорите AS…N, как я помню трехбуквенное сокращение для этой аминокислоты. Кh3 на конце этой молекулы заставляет вас думать о «базе», но посмотрите на его соседа. Nh3 рядом с карбонилом образует амид, который не любит действовать как кислота или основание в стандартных физиологических условиях. Однако с частичными зарядами и способностью связывания Н-связей как у карбонильного кислорода, так и у групп Nh3 мы получаем полярную гидрофильную аминокислоту.
Глютамин
Gln
QЯ думаю, что обе «перенасыщенные» аминокислоты являются обжорами, «потребившими» дополнительную группу Ch3. Глютамин имеет ту же структуру, что и аспарагин, но с дополнительным прожорливым Ch3 в его цепи. Как и аспарагин, он полярен и гидрофильен.
Кислотные и основные боковые цепи аминокислот
Кислотность и основность аминокислот — еще один источник путаницы среди учащихся.
 Если он начинается как кислота, становится ли он основанием? Как найти заряд? И так далее.
Если он начинается как кислота, становится ли он основанием? Как найти заряд? И так далее.Вот в чем хитрость: карбоновая КИСЛОТА в боковой цепи дает кислую аминокислоту. Когда карбоксильная группа депротонирована, вы получаете сопряженное основание СОЛЬ. Поэтому, если вы видите солевой вариант боковой цепи карбоновой кислоты, хотя ТЕХНИЧЕСКИ он является «конъюгированным основанием», мы будем просто называть его солевым вариантом кислой аминокислоты. То же самое для базы. Обратите внимание на «неотвлеченные» атомы азота в боковой цепи.
Кислые аминокислоты
Кислые аминокислоты должны выглядеть очень знакомо по сравнению с аспарагином и глютамином. И это потому, что все в них одинаково, за исключением терминальной функциональной группы. Амиды (обсуждаемые выше) полярны, но если Nh3 заменить на ОН-группу, вы получите кислую карбоксильную группу.
Аспарагиновая кислота/аспартат
Asp
DАспарагиновая кислота относится к протонированной кислой форме аминокислоты.
 При депротонировании вы часто увидите конъюгированную основную соль, называемую аспартатом. Это стандартная номенклатура карбоновых кислот.
При депротонировании вы часто увидите конъюгированную основную соль, называемую аспартатом. Это стандартная номенклатура карбоновых кислот.Вспомните этановую кислоту. Его общее название – уксусная кислота. При депротонировании получается ацетат. Кислоты очень стабильны в воде, так как они частично заряжены в протонированной форме и полностью заряжены в депротонированной форме. Это делает их очень гидрофильными.
Глутаминовая кислота/глутамат
Glu
EИ снова у нас есть «обжорская» аминокислота с дополнительной группой Ch3. Глутаминовая кислота относится к протонированной кислой форме, а глутамат относится к депротонированной конъюгированной форме основания/соли.
Подобно аспарагиновой кислоте, глутаминовая кислота очень стабильна в воде и поэтому гидрофильна.Основные аминокислоты
Основные аминокислоты содержат атом азота с неподеленной электронной парой, способной атаковать атом водорода. Когда основная аминокислота подвергается воздействию низкого (кислого) pH, она захватывает один из свободных протонов в растворе с образованием сопряженной кислой соли.
 Их легко распознать по положительному азоту в боковой цепи. В отличие от кислых аминокислот, для этих сопряженных солей нет «обычно используемых названий», которые нужно запоминать.
Их легко распознать по положительному азоту в боковой цепи. В отличие от кислых аминокислот, для этих сопряженных солей нет «обычно используемых названий», которые нужно запоминать.Лизин
Лиз
KЛизин — простая основная аминокислота. Несмотря на длинную и потенциально гидрофобную цепь, она имеет на конце основной Nh3. В своей основной депротонированной форме лизин нейтрален и гидрофильен; однако, если он обнаружен при физиологическом pH, лизин будет поглощать H+ из раствора с образованием соли Nh4+. Соли заряжены и, следовательно, определенно гидрофильны. Почему? Основная часть этой переменной группы состоит из NH, C=NH и Nh3.
2 атома азота с одинарной связью могут использовать свои неподеленные пары для резонирования с атомом углерода и атомом азота с двойной связью. Это делает их электроны НЕДОСТУПНЫМИ для работы в качестве основания. Однако азот с двойной связью использует свою пи-связь для резонирования, в результате чего его свободная неподеленная пара (показана черным цветом) действует как основной азот в этой группе.
Арх!Гистидин
His
HГистидин — еще одно сложное основание по той же причине, что и аргинин. КАКОЙ азот является основным? Посмотрите на рисунок здесь, особенно на неподеленные пары двух атомов азота. Гистидиновое кольцо представляет собой гетероциклическое ароматическое соединение. Верхний атом азота не имеет пи-связи. Это означает, что он должен использовать свои неподеленные пары для участия в резонансе.
Нижний атом азота уже имеет резонирующую пи-связь. Это оставляет его одинокие электроны (показаны черным) свободными для захвата протона, что делает его основным атомом.В заключение
Аминокислоты являются важным компонентом биологических структур и вашего понимания биологии и биохимии на MCAT. Итак, когда вы пытаетесь запомнить все об этих 20 аминокислотах, важно, чтобы вы также понимали, почему у вас есть полярные и неполярные аминокислоты, что делает вариабельную группу гидрофобной или гидрофильной, и, конечно же, логику протонированных/депротонированных кислых и основные аминокислоты.


 Когда вы думаете о «переменной группе R», вы должны думать об углероде, присоединенном к другим атомам. Но глицин имеет водород только в положении боковой цепи. Поскольку глицин имеет 2 атома водорода, по одному в родительской и боковой цепи, это единственная симметричная и, следовательно, ахиральная аминокислота. Поскольку водород неполярен, глицин является гидрофобной аминокислотой. Боковая цепь водорода делает глицин самой маленькой аминокислотой.
Когда вы думаете о «переменной группе R», вы должны думать об углероде, присоединенном к другим атомам. Но глицин имеет водород только в положении боковой цепи. Поскольку глицин имеет 2 атома водорода, по одному в родительской и боковой цепи, это единственная симметричная и, следовательно, ахиральная аминокислота. Поскольку водород неполярен, глицин является гидрофобной аминокислотой. Боковая цепь водорода делает глицин самой маленькой аминокислотой. Как и в случае с аланином, мы не видим ничего, кроме углерода и водорода, что делает валин неполярной гидрофобной аминокислотой.
Как и в случае с аланином, мы не видим ничего, кроме углерода и водорода, что делает валин неполярной гидрофобной аминокислотой. Хотя вы можете подумать, что он гидрофильный, обратите особое внимание на расположение атома серы. Встроенная в цепочку и прикрепленная только к атомам углерода, сера частично «спрятана» от внешней среды.
Хотя вы можете подумать, что он гидрофильный, обратите особое внимание на расположение атома серы. Встроенная в цепочку и прикрепленная только к атомам углерода, сера частично «спрятана» от внешней среды.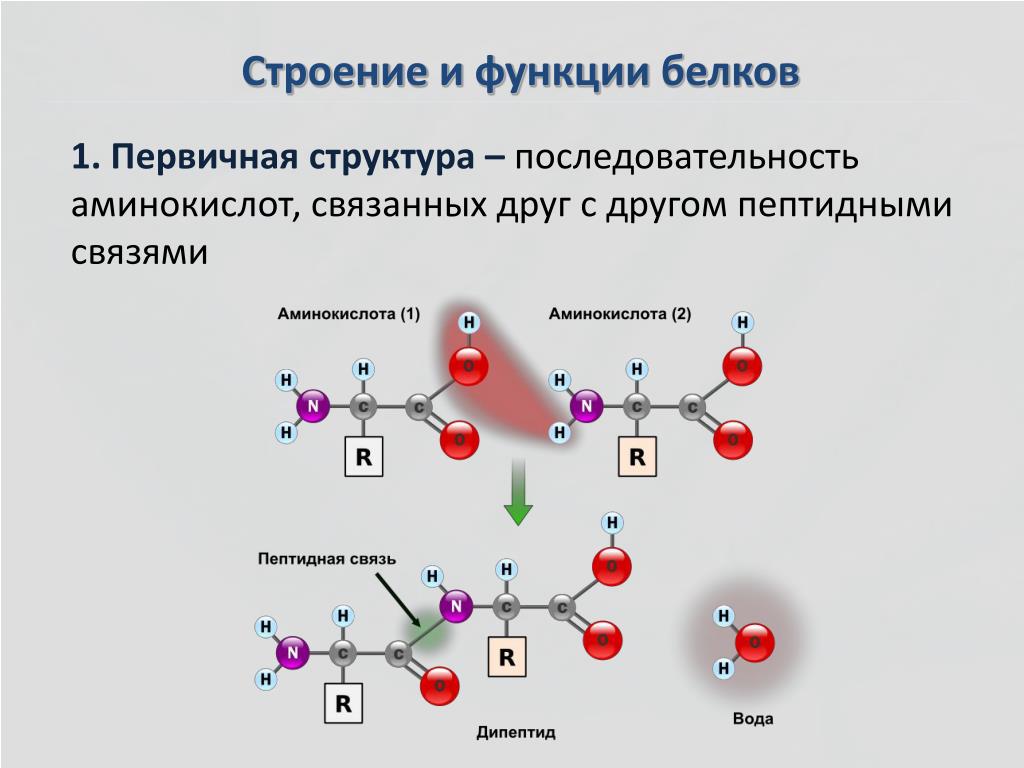
 Имейте это в виду. для медицинских школ.)
Имейте это в виду. для медицинских школ.) Обратите внимание на наличие полярных групп, которые малы по сравнению с общей боковой цепью или очень слабо полярны и, следовательно, гидрофобны.
Обратите внимание на наличие полярных групп, которые малы по сравнению с общей боковой цепью или очень слабо полярны и, следовательно, гидрофобны.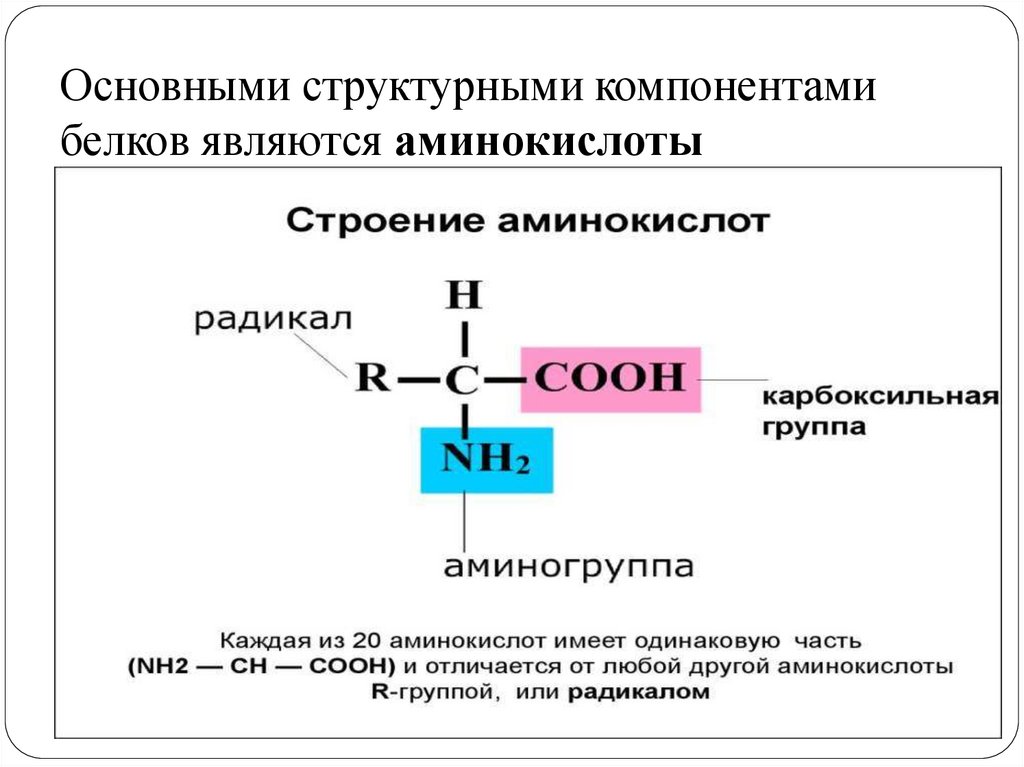

 Если он начинается как кислота, становится ли он основанием? Как найти заряд? И так далее.
Если он начинается как кислота, становится ли он основанием? Как найти заряд? И так далее.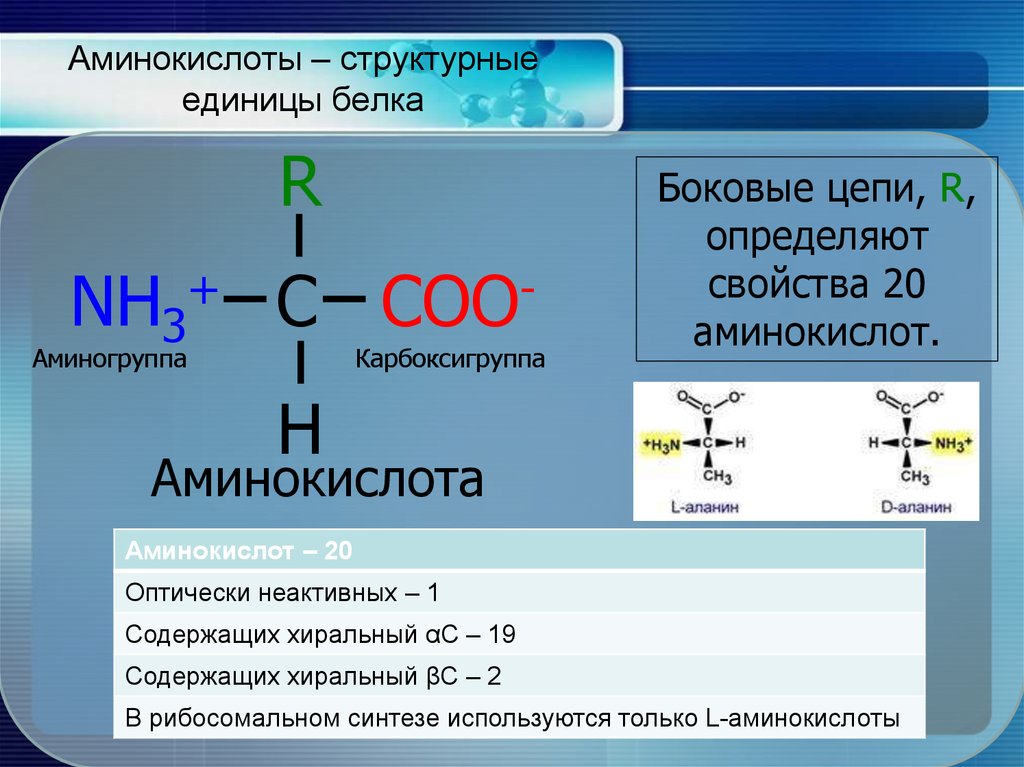 При депротонировании вы часто увидите конъюгированную основную соль, называемую аспартатом. Это стандартная номенклатура карбоновых кислот.
При депротонировании вы часто увидите конъюгированную основную соль, называемую аспартатом. Это стандартная номенклатура карбоновых кислот.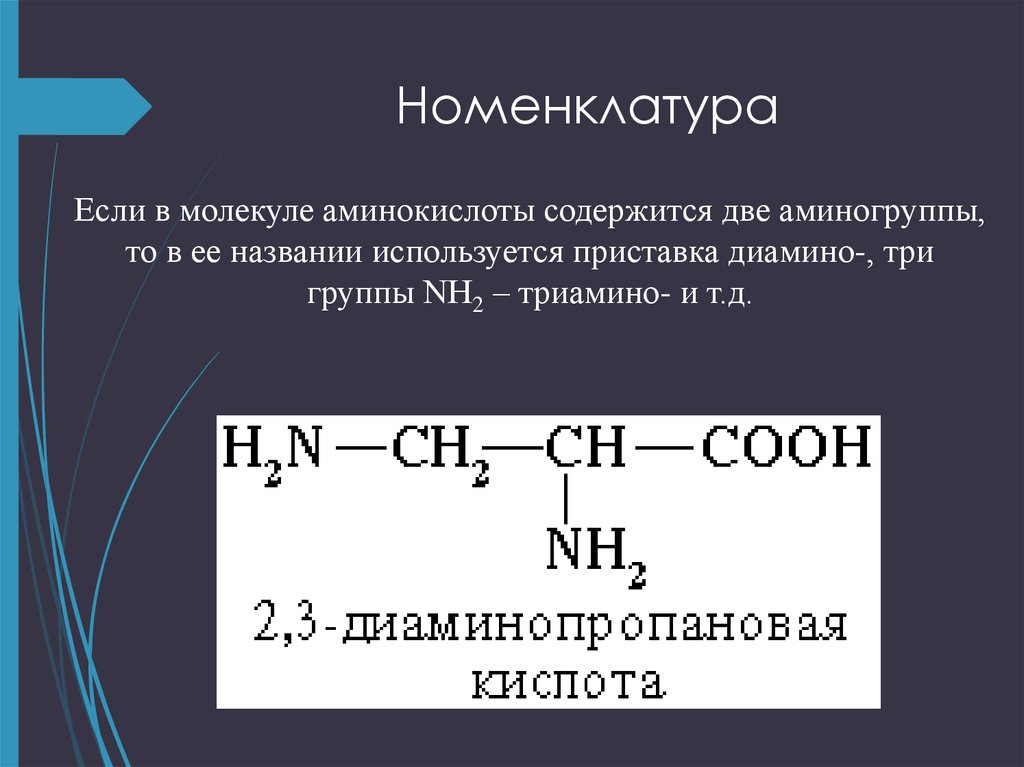 Их легко распознать по положительному азоту в боковой цепи. В отличие от кислых аминокислот, для этих сопряженных солей нет «обычно используемых названий», которые нужно запоминать.
Их легко распознать по положительному азоту в боковой цепи. В отличие от кислых аминокислот, для этих сопряженных солей нет «обычно используемых названий», которые нужно запоминать.