Где осуществляется транспортная функция белков: Основные функции белков в клетке / Блог / Справочник :: Бингоскул
Транспортная функция белков — это… Что такое Транспортная функция белков?
Транспортная функция белков — участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
Перенос веществ через клеточную мембрану
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но липидный бислой для них практически непроницаем. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос полярных или заряженных соединений. Транспорт этих соединений в клетку делится на активный и пассивный. Пассивный транспорт — транспорт веществ из области с высокой концентрацией в область низкой без затрат энергии, то есть диффузия. Она делится на 2 варианта: простая и облегчённая.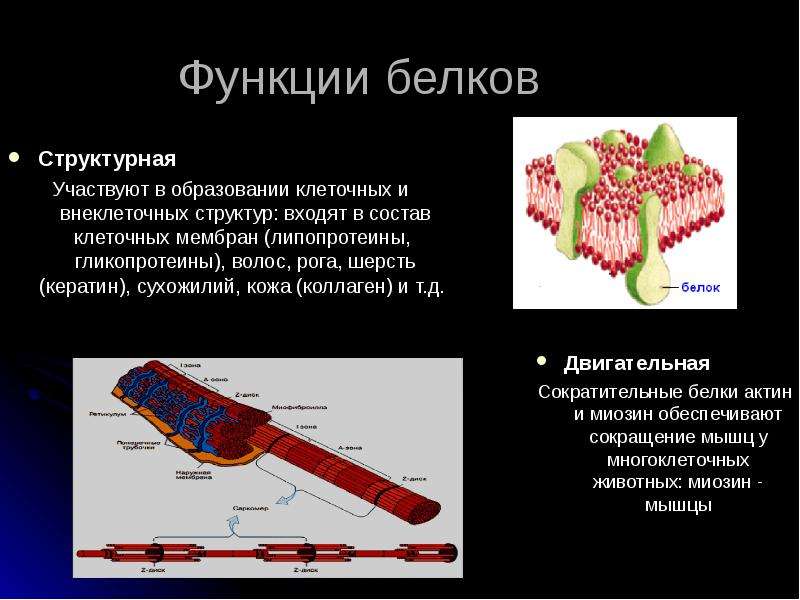
В облегчённой диффузии участвуют белки-переносчики. Этот вариант может сопровождаться конформационными изменениями белка. Есть несколько путей переноса веществ в этом случае: когда участвует один белок и когда участвуют несколько. Если участвует один белок(транслоказа), то он связывает вещество, потом сближается с другой стороной мембраны, отдаёт связанное вещество и возвращается в исходное состояние. Если участвуют несколько белков, то один связывается с веществом, потом передаёт его другому и так далее, пока вещество не дойдёт по цепи до противоположной стороны мембраны.
Пассивный транспорт обеспечивают также белки-каналы. Каналообразующие белки образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества. особые семейства каналообразующих белков (коннексины и паннексины) формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины и в клетки из внешней среды).
Активный транспорт происходит против градиента концентрации и протекает с затратой энергии. В активном транспорте участвуют белки-переносчики. Энергия, которая требуется для осуществления активного транспорта, обычно получается транспортными белками при расщеплении АТФ. Один из наиболее изученных белков, осуществляющих активный транспорт — Na+/K+-аденозинтрифосфатаза. За полный цикл работы этого насоса в клетку попадают из внешней среды 3 иона Na+ и выбрасывается наружу 2 иона K+.
В активном транспорте участвуют белки-переносчики. Энергия, которая требуется для осуществления активного транспорта, обычно получается транспортными белками при расщеплении АТФ. Один из наиболее изученных белков, осуществляющих активный транспорт — Na+/K+-аденозинтрифосфатаза. За полный цикл работы этого насоса в клетку попадают из внешней среды 3 иона Na+ и выбрасывается наружу 2 иона K+.
Ещё один путь попадания веществ внутрь клетки — их поглощение путем эндоцитоза. В этом процессе также могут участвовать специальные транспортные белки. Например, гастромукопротеид (внутренний фактор Касла), который синтезируется в клетках слизистой оболочки желудка, обеспечивает поглощение путем эндоцитоза клетками подвздошной кишки витамина B12.
Перенос веществ внутри клетки
Этот перенос осуществляется между ядром и другими органоидами и цитоплазмой клетки. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт) происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с белками — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Они состоят примерно из тридцати белков — нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с белками — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Перенос белков из цитоплазмы к другим органоидам клетки происходит с помощью белков-переносчиков. В этом процессе участвуют также шапероны.
Также для транспортировки веществ внутри клеток используются микротрубочки — структуры, состоящие из белков тубулинов. По их поверхности могут передвигаться митохондрии и мембранные пузырьки с грузом (везикулы). Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + -конца к — -концу, а кинезины в обратном направлении.
Перенос веществ по организму
Транспорт веществ по организму в основном осуществляется кровью. Кровь переносит гормоны, пептиды, ионы от эндокринных желез к другим органам, переносит конечные продукты метаболизма к органам выделения, переносит питательные вещества и ферменты, кислород и углекислый газ.
Наиболее известный транспортный белок, осуществляющий транспорт веществ по организму — это гемоглобин. Он переносит кислород и диоксид углерода по кровеносной системе от лёгких к органам и тканям. У человека около 15 % углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком, который называется миоглобин.
В плазме крови всегда находятся транспортные белки — сывороточные альбумины. Жирные кислоты, например, транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств (аспирин, пенициллины) и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин — церулоплазмин, транспорт ионов железа — белок трансферрин, транспорт витамина B12 — транскобаламин.
См. также
Белки, выполняющие транспортную функцию
Определение 1
Транспортные белки – это группа белков, которые выполняют функцию переноса различных лигандов через клеточную мембрану и внутрь клетки (в одноклеточных организмах) и между различными клетками многоклеточного организма.
Транспортные белки
Белки выполняют в клетках весьма разнообразные функции: каталитическую, строительную, ферментативную, энергетическую.
Любая белковая молекула по сути является гетерополимером и имеет различную длину. Мономерами белков являются аминокислоты. В состав белков входят такие вещества, как водород, углерод, азот и кислород. Почти все белки также содержат серу, поскольку она является основной составляющей таких аминокислот как цистеин и метионин.
Транспортыне белки внедряются в мембрану или секретируются из клетки в виде растворов из ядра и органелл эукариотического организма.
К основным группам транспортных белков относят:
- хелатирующие белки;
- ионные каналы;
- транспортирующие белки.
Каждая группа представленных белков выполняет транспортную функцию по-особенному, а именно это зависит от направления и скорости транспорта. Считается, что белковая молекула может укладываться различными способами и принимать множество различных форм и конформаций. Все это зависит от условий рН, уровня температуры, и наличия конкретных ионов. Также эта структура определяется тем, как сворачивается полипептидная цепь внутри раствора, что зависит от последовательности аминокислот.
Определение 2
Транспортная функция белков – это участие белков в переносе веществ в клетки и за их пределы, а также внутри клеточного пространства. В рамках человеческого организма функция белков реализуется в транспорте крови и других жидкостей организма, которые имеют в своем составе белковые молекулы.
При помощи белков могут осуществляться совершенно различные виды транспорта. Перенос веществ через клеточную мембрану проходит в несколько этапов и зависит от степени прохождения веществ через билипидный мембранный слой. Для полноценной жизнедеятельности в клетку должны поступать:
- углеводы;
- аминокислоты;
- ионы щелочных металлов.
Так как слои липидов практически не проницаемы для различных веществ, внутри мембраны находятся специализированные транспортные белки, которые осуществляют перенос полярных заряженных соединений. Такой транспорт веществ может быть активным и пассивным.
Активный транспорт реализуется за счет специализированных каналов внутри мембраны против градиента концентрации и протекает с затратой энергии. В активном транспорте участвуют белки – переносчики. Для такого переноса необходима энергия, которая получается транспортными белками при расщеплении АТФ.
Пассивный транспорт веществ реализуется из области высокой концентрации в область низкой, но без затрат энергии. Другими словами, этот путь имеет вид диффузии. Диффузия может быть облегченной и простой.
Другими словами, этот путь имеет вид диффузии. Диффузия может быть облегченной и простой.
Облегченная диффузия обеспечивается белками – переносчиками. Такой вариант транспорта осуществляется различными конформациями белка. В данном процессе может участвовать один белок или несколько белков. Если участвует только транслоказа, то этот белок связывает вещество и сближается с другой стороной мембраны и отдает связанное вещество, постепенно возвращаясь в исходное состояние. При участии нескольких белков один из них связывается с исходным веществом, потом передает его другому белку до тех пор, пока вещество по цепи не доходит до другой стороны мембраны.
Также пассивный транспорт осуществляется по белкам – каналам. Они образуют водные поры, которые открыты в какой – либо период времени. По этим каналам белки могут транспортироваться из одной клетки в другую.
Еще один путь попадания веществ клетку называется эндоцитозом. В этом процессе могут участвовать только специализированные транспортные белки.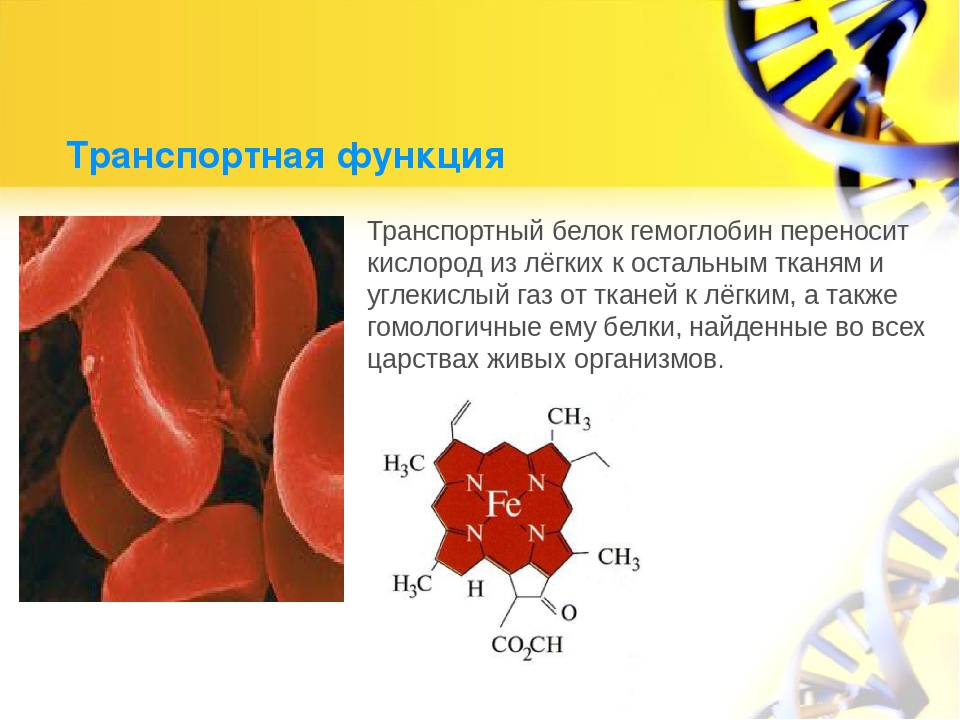
Путем простой диффузии в клетку проникают различные гидрофобные вещества (кислород, азот, бензол), а также различные полярные молекулы (углекислый газ, вода). Путем простой диффузии в клетку не могут проникнуть такие вещества, как аминокислоты и моносахариды.
Вода диффундирует в клетку путем осмоса. Осмос представляет собой одностороннюю диффузию воды сквозь полупроницаемую мембрану в раствор с более высокой концентрации. При этом раствор с высокой концентрацией содержит минимальную концентрацию молекул растворителя. В него путем диффузии просачивается растворитель из области вещества с меньшей концентрацией.
Функции транспортных белков
Внутри клетки происходит перенос веществ между ядром и другими органоидами через клеточную цитоплазму. Это происходит благодаря ядерным порам, пронизывающих два слоя белковой оболочки. Эти оболочки также состоят из белков. Вещества переносятся из цитоплазмы в ядро клетки вместе с белками — транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Впоследствии этот белок соединяется с белками ядерной поры и распадается, а транспортные белки возвращаются обратно в цитоплазму.
Впоследствии этот белок соединяется с белками ядерной поры и распадается, а транспортные белки возвращаются обратно в цитоплазму.
Перенос белков из цитоплазмы к другим органоидам проходит при участии белков переносчиков. Что касается переноса веществ внутри организма, то он также осуществляет при участии белков.
Например, гемоглобин переносит кислород. Также в плазме крови всегда находятся транспортные белки.
Определение 3
Транспортные белки плазмы крови – это сывороточные альбумины.
Жирные кислоты транспортируются с помощью альбуминов сывороток крови. Гормоны щитовидной железы переносятся транстиретином. Кроме того, альбумины могут переносить билирубин, многочисленные лекарства, ионы и многие другие вещества.
Также существуют другие примеры транспортных белков. Например, альбумин является белком плазмы крови, переносящим лекарства и неорганические ионы. Миоглобин является белком скелетных мышц и способствует переносу кислорода. Глобулин переносит различные гормоны и витамины.
Транспортная функция белков — Вики
Транспортная функция белков – участие белков в переносе веществ в клетки и из клеток, в их перемещениях внутри клеток, а также в их транспорте кровью и другими жидкостями по организму.
Есть разные виды транспорта, которые осуществляются при помощи белков.
Перенос веществ через клеточную мембрану
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества (сахара, аминокислоты, ионы щелочных металлов), но мембрана для них непроницаема. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос всех необходимых соединений.
Транспорт этих соединений осуществляется двумя способами:
1) белками-переносчиками, которые взаимодействуют с молекулой переносимого вещества и каким-либо способом доставляют её внутрь клетки.
2) каналообразующими белками, которые образуют в мембране водные поры, через которые (когда они открыты) могут проходить вещества.
Каналообразующие белки (коннексины и паннексины) формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую (через паннексины и в клетки из внешней среды).
Перенос веществ внутри клетки
Этот перенос осуществляется между ядром и другими органоидами и цитоплазмой клетки. Например, перенос белков между ядром и цитоплазмой (ядерно-цитоплазматический транспорт)происходит благодаря ядерным порам, которые пронизывают двухслойную оболочку ядра. Они состоят примерно из тридцати белков – нуклеопоринов. Вещества переносятся из цитоплазмы в ядро клетки вместе с беклами – транспортинами. Эти белки узнают вещества, предназначенные для транспорта в ядро, и связываются с ними. Затем этот комплекс белков заякоривается на белках ядерной поры и попадает в её канал, а затем в ядро. Там она связывается ещё с одним белком и распадается, а транспортины направляются обратно в цитоплазму.
Также для транспортировки веществ внутри клеток используются микротрубочки. По их поверхности могут передвигаться митохондрии и мембранные пузырьки. Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + конца к – концу, а кинезины наоборот.
По их поверхности могут передвигаться митохондрии и мембранные пузырьки. Этот транспорт осуществляют моторные белки. Они делятся на два типа: цитоплазматические динеины и кинезины. Эти две группы белков различаются тем, от какого конца микротрубочки они перемещают груз: динеины от + конца к – концу, а кинезины наоборот.
Перенос веществ по организму
Наиболее известный транспортный белок, осуществляющий транспорт веществ по организму – это гемоглобин. Он переносит кислород по кровеносной системе от лёгких к органам и тканям. 15% углекислого газа транспортируется к лёгким с помощью гемоглобина. В скелетных и сердечной мышцах перенос кислорода выполняется белком, который называется миоглобин.
Жирные кислоты транспортируются альбуминами сыворотки крови. Кроме того, белки группы альбуминов, например, транстиретин, транспортируют гормоны щитовидной железы. Также важнейшей транспортной функцией альбуминов является перенос билирубина, желчных кислот, стероидных гормонов, лекарств и неорганических ионов.
Другие белки крови — глобулины переносят различные гормоны, липиды и витамины. Транспорт ионов меди в организме осуществляет глобулин – церулоплазмин, а транспорт ионов железа – белок трансферрин.
См. также
Транспортные белки — Справочник химика 21
Транспортные белки Переносчики кислорода Гемоглобин (переносит [c.259]
Глобулярные белки включают гормоны, ферменты и транспортные белки. Все они двигаются внутри клетки нли переносятся кровью. Такой тип передвижения предполагает растворимость в воде. Поэтому в глобулярных структурах гидрофобные неполярные группы находятся внутри, а ионные полярные — снаружи. [c.453]
Транспортные белки Эти белки осуществляют транспорт кислорода в крови. К ним относятся, например, гемоглобин крови, миоглобин мышц. [c.26]
В глобулярных белках одно или большее число полипептидных цепей свернуты в плотную компактную структуру сферической или глобулярной формы. К белкам данного типа относятся почти все ферменты, транспортные белки крови, антитела, а также пищевые белки. [c.425]
К белкам данного типа относятся почти все ферменты, транспортные белки крови, антитела, а также пищевые белки. [c.425]
Белки могут выполнять множество функций. Некоторые из них — ферменты — катализируют реакции, как уже было описано. Другие служат гормонами — специальными веществами, выделяемыми некоторыми органами и разносимыми кровью к другим органам, где они вызывают биохимическую активность (например, ряд гормонов переключает деятельность женского организма на подготовку к беременности). Третьи — транспортные белки — служат переносчиками жизненно важных веществ в организме из одного места в другое. Гемоглобин — одна из таких молекул он разносит кислород от легких к тканям. Белки также служат структурным материалом тела. Волосы, мышцы, кожа, хрящи и ногти построены из белков (см. также табл. ГУ.б в главе о пище). [c.452]
Периплазматическое пространство, куда погружен пептидогликановый слой, заполнено раствором, в состав которого входят специфические белки, олигосахариды и неорганические молекулы. Периплазматические белки представлены двумя типами транспортными белками и гидролитическими ферментами. Транспортные белки — это переносчики, связывающиеся с соответствующими субстратами внешней среды и транспортирующие их от наружной мембраны к цитоплазматической. [c.37]
Периплазматические белки представлены двумя типами транспортными белками и гидролитическими ферментами. Транспортные белки — это переносчики, связывающиеся с соответствующими субстратами внешней среды и транспортирующие их от наружной мембраны к цитоплазматической. [c.37]
По функциям ферменты, структурные белки, транспортные белки, защитные белки, сократительные белки мышц, гормоны (гормон роста, пролактин, паратгормон), токсины (ботулиновый, столбнячный, холерный), рецепторы (зрительный, ацетилхолиновый), запасные белки в семенах растений и др. [c.23]
Помимо ферментов, методом А, х. можно выделять также токсины, рецепторы, ингибиторы, транспортные белки и др. биологически активные в-ва. Высокой избирательностью отличается т.наз. иммуносорбция, при к-рой в кач-ве лиганда используют антитела, обладающие специфичностью к выделяемым белкам особенно эффективны моноклональные антитела. [c.221]
Втор 1Я важная функция белков — транспорт веществ. У одноклеточных это в основном транспорт через мембрану. Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время фосфолипидная мембрана непроницаема для таки.х важнейших компонентов, как аминокислоты, сахара, ионы щелочных металлов. Их проникновение внутрь клетки из окружающей среды происходит при участии специальных транспортных белков, вмонтированных в мембрану. Наприме 5, у многих бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара — лактозы (6). Последняя представляет собой дисахарид, образованный молекулами глюкозы и ее изомера галактозы [c.35]
У одноклеточных это в основном транспорт через мембрану. Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время фосфолипидная мембрана непроницаема для таки.х важнейших компонентов, как аминокислоты, сахара, ионы щелочных металлов. Их проникновение внутрь клетки из окружающей среды происходит при участии специальных транспортных белков, вмонтированных в мембрану. Наприме 5, у многих бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара — лактозы (6). Последняя представляет собой дисахарид, образованный молекулами глюкозы и ее изомера галактозы [c.35]
Структурную основу мембран составляют липиды, а функциональную роль выполняют белки, которые являются ферментами, транспортными белками, рецепторами, переносчиками, образующими поры, каналы и насосы. Существуют две основные теории строения мембран. [c.107]
Однако по мере изучения природы белков и биологической роли каждого из них классификация сильно изменялась и стала основываться на свойствах, которые связаны с их большим функциональным разнообразием и распространенностью. Белки организма в целом представлены широким спектром веществ на долю белков, входящих в состав клеток, обычно приходится более половины сухой массы. Можно выделить некоторые отдельные группы ферменты, которые обеспечивают катализ биохимических реакций в клетке резервные белки структурные белки транспортные белки мышечные белки антитела токсины гормоны и регуляторные белки. Возможно также несколько более широкое понимание биологических функций белков для того, чтобы их классифицировать на три основные категории (табл. 23.1.2)—резервные белки, структурные, или механические белки и белки, проявляющие свои различные биологические свойства при комбинации или связывании с ионами или другими молекулами. [c.221]
Белки организма в целом представлены широким спектром веществ на долю белков, входящих в состав клеток, обычно приходится более половины сухой массы. Можно выделить некоторые отдельные группы ферменты, которые обеспечивают катализ биохимических реакций в клетке резервные белки структурные белки транспортные белки мышечные белки антитела токсины гормоны и регуляторные белки. Возможно также несколько более широкое понимание биологических функций белков для того, чтобы их классифицировать на три основные категории (табл. 23.1.2)—резервные белки, структурные, или механические белки и белки, проявляющие свои различные биологические свойства при комбинации или связывании с ионами или другими молекулами. [c.221]
Известно, что связывание стероидов с транспортными белками крови играет важную роль в механизме их специфической активности. [c.114]
До настоящего времени структура и механизм функционирования транспортных белков изучены недостаточно, что в значительной степени связано с трудностью их выделения в солюбилизированной форме. По-видимому, наиболее распространенным путем трансмембранного переноса веществ по механизму облегченной диффузии является транспорт с помощью каналообразующих веществ. [c.310]
По-видимому, наиболее распространенным путем трансмембранного переноса веществ по механизму облегченной диффузии является транспорт с помощью каналообразующих веществ. [c.310]
Перечисленными функциями роль белков в живой природе не исчерпывается. Некоторые из них будут изложены ниже в этом параграфе, другие будут рассмотрены в различных разделах курса. Однако уже из приведенных примеров видно, что функциональные белки обладают уникальной способностью с высокой степенью избирательности взаимодействовать с вполне определенными партнерами или, как принято говорить в биохимии, узнавать этих партнеров. Так, ферменты узнают совершенно определенные вещества — субстраты, превращение которых они катализируют рецепторы узнают определенный гормон или нейромедиатор, транспортные белки — те компоненты, перенос которых через клеточную мембрану они должны обеспечить, и т.п. [c.38]
Клеточная мембрана — неотъемлемый элемент любой клетки. Ее роль в первую очередь состоит в том, чтобы отгородить содержимое клетки от окружающей среды, сосредоточить в небольшом объеме простран,ства все необходимые информационные и функциональные структуры, а у клеток эукариот, кроме того, разделить внутреннюю часть клетки на различные функционально автономные отсеки-ядро, митохондрии и ряд других. Во внешней плазматической мембране клетки функционируют транспортные белки, рецепторы и связанные с ними белковые системы преобразования полученных сигналов. Но структурную основу мембран составляют липиды. [c.55]
Во внешней плазматической мембране клетки функционируют транспортные белки, рецепторы и связанные с ними белковые системы преобразования полученных сигналов. Но структурную основу мембран составляют липиды. [c.55]
Белки — переносчики всех типов, напоминают связанные с мембранами ферменты, а процесс облегченной диффузии — ферментативную реакцию по ряду свойств 1) транспортные белки обладают высокой специфичностью и имеют участки (сайты) связывания для транспортируемой молекулы (по аналогии — субстрата) 2) когда все участки связывания заняты (т. е. белок насыщен), скорость транспорта достигает максимального значения, обозначаемого (рис. 22.7) 3) белок-переносчик имеет характерную для него константу связывания Ky , равную концентрации транспортируемого вещества, при которой скорость транспорта составляет половину ее максимальной величины (аналогично для системы фермент—субстрат), транспортные белки чувствительны к изменению значения pH среды 4) они ингибируются конкурентными или неконкурентными ингибиторами. Однако в отличие от ферментной реакции молекула транспортируемого вещества не претерпевает ковалентного превращения при взаимодействии с транспортным белком (рис. 22.7), [c.310]
Однако в отличие от ферментной реакции молекула транспортируемого вещества не претерпевает ковалентного превращения при взаимодействии с транспортным белком (рис. 22.7), [c.310]
Большую группу составляют так называемые транспортные белки, т. е. белки, участвующие в переносе различных вешеств, ионов и т. п. К ним обычно относят цитохром с, участвующий в транспорте электронов, гемоглобин, гемоцианин и миоглобин, переносящие кислород, а также сывороточный альбумин (транспорт жирных кислот в крови), -липопрокин (транспорт липидов), церулоплаз-мин (транспорт меди в крови), липид-обменивающие белки мембран. В последнее время эта группа пополнилась мембранными белками, выполняющими функции нонных каналов,— здесь необходимо упомянуть белковые компоненты полосы В-3, ответственные за транспорт анионов через эритроцитарную мембрану, белки Na -, Са — и К -каналов возбудимых мембран. К транспортным пептидам резонно отнести канал-образующие соединения типа аламетицина и грамицидинов А, В и С, а также пептидные антибиотики — ионофоры ряда валиномицина, энниатина и др.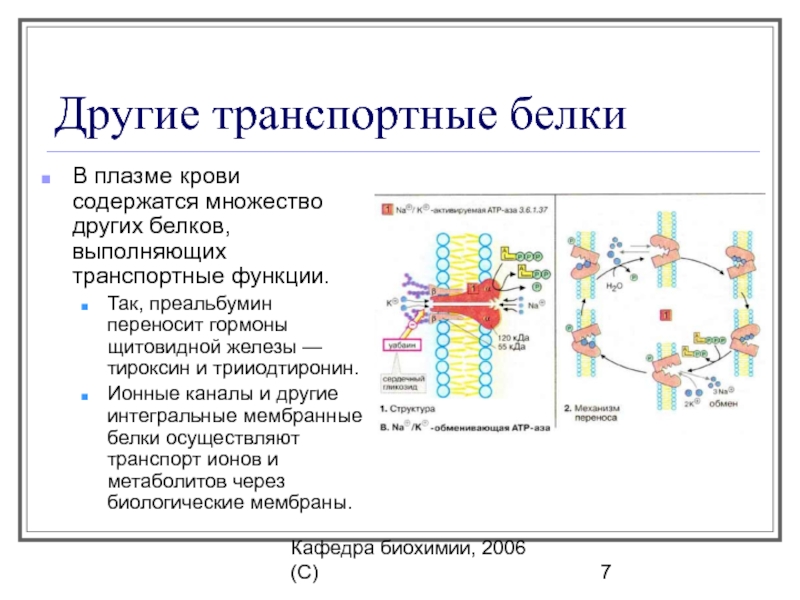 [c.22]
[c.22]
Для активного транспорта, как и для облегченной диффузии, характерны высокая специфичность, эффект насыщения транспортных белков транспортируемыми молекулами, когда кинетическая кривая выходит на плато, а также действие ингибиторов.. [c.311]
Критериями различия транспорта без участия и с участием транспортных белков являются [c.48]
Для транспорта аминокислот существует множество транспортных белков (пермеаз). В упрощенном виде можно говорить о том, что имеется четыре системы транспорта [c.64]
По своему существу аффинная хроматография — это особый тип адсорбционной хроматографии. В отличие от того, что было описано в гл. 6, адсорбция здесь осуществляется за счет биоспецифп-ческого взаимодействия между молекулами, закрепленными на матрице, т. е. связанными в неподвижной фазе, и комплементарными к ним молекулами, подлежащими очистке или фракционированию, поступающими, а затем элюируемыми с подвижной фазой. Биоспеци-фическое взаимодействие отличается исключительной избирательностью, а зачастую и очень высокой степенью сродства между партнерами. Оно лежит в основе множества строго детерминированных процессов, протекающих в организме. В качестве примеров можно назвать взаимодействия между ферментами и их субстратами, кофакторами или ингибиторами, между гормонами и их рецепторами, между антигенами и специфическими для них антителами, между нуклеиновыми кислотами и специфическими белками, связывающимися с ними в процессе осуществления своих функций (полимераза.мп, нуклеазами, гистонами, регуляторными белками), а также между самими нуклеиновыми кислотами-матрицами и продуктами их транскрипции. Наконец, многие малые молекулы (витамины, жирные кнслоты и др.) специфически связываются со специальными транспортными белками. [c.339]
Биоспеци-фическое взаимодействие отличается исключительной избирательностью, а зачастую и очень высокой степенью сродства между партнерами. Оно лежит в основе множества строго детерминированных процессов, протекающих в организме. В качестве примеров можно назвать взаимодействия между ферментами и их субстратами, кофакторами или ингибиторами, между гормонами и их рецепторами, между антигенами и специфическими для них антителами, между нуклеиновыми кислотами и специфическими белками, связывающимися с ними в процессе осуществления своих функций (полимераза.мп, нуклеазами, гистонами, регуляторными белками), а также между самими нуклеиновыми кислотами-матрицами и продуктами их транскрипции. Наконец, многие малые молекулы (витамины, жирные кнслоты и др.) специфически связываются со специальными транспортными белками. [c.339]
Допольно пгмрокпмп (10 —10 М). СпязЬ гормонов с рецепторами заметно прочнее (10″ —10 М). 11аконец, для белков, ведущих в крови и через мсыбрань( перенос витаминов, гормонов и других низ-комолекулярных соединений (транспортных белков), сродство может быть очень сильным и К], снижается иной раз до 10″ —Ю» М. [c.401]
[c.401]
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться вьщелить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т.д. Это взаимодействие основано на принципе биоспе-цифического узнавания, завершающегося связыванием фермента с соответствующей молекулой субстрата, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность. [c.22]
[c.22]
Известны два типа мембранных транспортных белков белки-переносчики, называемые транслоказами или пермеазами, и белки каналообразующие. Транспортные белки связывают специфические вещества и переносят их через бислой по градиенту их концентрации или электрохимическому потенциалу, и, следовательно, для осуществления этого процесса, как и при простой диффузии, не требуется затраты энергии АТФ. [c.309]
Биологические мембраны представляют собой динамическую структуру, компоненты которой подвержены быстрому метаболизму. Благодаря этому липвдное окружение мембранных белков обладает способностью в соответствии с изменением условий функционирования изменять свои физикохимические свойства упаковку, микровязкость, латеральную подвижность компонентов в бислое и т.д. Подавляющее больщинство мембранных белков функционирует в составе олигомерных ансамблей, например в дыхательной цепи митохондрий. Транспортные белки также организуют ассоциаты в бислое димеры (Са -АТФаза), тетрамеры (Ка /К -АТФаза) или даже более высокоорганизованные надмолекулярные комплексы. [c.316]
[c.316]
Примерами сложных белков могут служить транспортные белки миоглобин и гемоглобин, в которых белковая часть — глобин — соединена с простетической группой — г е м о м. По типу простетической группы их относят к гемопротеинам. Фосфопротеины содержат остаток фосфорной кислоты, металлопротеины — ионы металла. [c.376]
Аналогичное рассуждение можно провести для транспорта веществ через клеточную мембрану с помощью специальных транспортных белков. Если, например, белок осуществляет транспорт лактозы, то он должен обладать способностью образовывать специфический комплекс с находящимися вне клетки молекулами лактозы. Но для этого фрагмент белковой молекулы, узнающий лактозу, должен находиться на наружной по отношению к мембране поверхности транспортного белка, в данном случае Д-галактозидпермеазы. Поэтому само по себе узнавание не может привести к попаданию лактозы внутрь клетки. Необходимо, чтобы образование комплекса вызвало такое изменение пространственной структуры, при котором область узнавания вместе со связанным сахаром переместилась внутрь клетки. Диссоциация комплекса в этом случае привела бы к попаданию лактозы внутрь клетки, а лишенная лактозы /З-галактозидпермёаза должна была бы вернуться в исходное конформационное состояние с центром узнавания, экспонированным наружу. [c.117]
Диссоциация комплекса в этом случае привела бы к попаданию лактозы внутрь клетки, а лишенная лактозы /З-галактозидпермёаза должна была бы вернуться в исходное конформационное состояние с центром узнавания, экспонированным наружу. [c.117]
Ряд белков выполняет функции переноса веществ из одного компартмен-та клетки в другой или между органами целого организма. Например, гемоглобин переносит кислород от легких к тканям и углекислый газ из тканей в легкие. В крови локализованы специальные транспортные белки — альбумины, переносящие различные эндогенные и экзогенные вещества. Имеются также специальные белки — пермеазы, переносящие различные вещества через биологические мембраны. [c.45]
Каналообразующие белки (или белки-каналы) формируют трансмембранные гидрофильные каналы, через которые молекулы растворенных веществ соответствующих размеров и заряда могут проходить путем облегченной диффузии. В отличие от транспорта, осуществляемого транслоказами, перенос с помощью каналов не обладает высокой специфичностью, но может осуществляться с гораздо большей скоростью, не достигающей насыщения в широком диапазоне концентрации транспортируемого вещества (рис. 22.6). Некоторые каналы постоянно открыты, тогда как другие ожрьшаются лишь в ответ на связывание транспортируемого вещества. Это приводит к изменению конформации транспортного белка, в результате чего в мембране открывается гидрофильный канал и вещество освобождается с другой стороны мембраны (см. рис. 22.6). [c.309]
22.6). Некоторые каналы постоянно открыты, тогда как другие ожрьшаются лишь в ответ на связывание транспортируемого вещества. Это приводит к изменению конформации транспортного белка, в результате чего в мембране открывается гидрофильный канал и вещество освобождается с другой стороны мембраны (см. рис. 22.6). [c.309]
Котранспортные системы — это транспортные белки, переносящие совместно два различных вещества по типу симпорта или антипорта, т. е. переносчик имеет центры связывания для обоих веществ. [c.313]
Например, для того чтобы снять авидин с биоцитин — сефарозы, использовали 6 М гуанидинхлорид в солянокислом растворе (pH 1,5) [10]. В табл. 11.1 приведены и другие примеры выделения связывающих и транспортных белков с использованием аффинных лигандов. [c.124]
Додециламип является полезным аффинным лигандом для выделения липидов [12]. При выделении гормонов соответствующие антитела, транспортные белки или лектины служат аффинными сорбентами (см. табл. 11.1). Примером является аффинная хроматография лютеинизирующего гормона овцы на сефарозе с ковалентно связанной иммуноглобулиновой фракцией антител к лютеинизирующему гормону [23]. [c.133]
табл. 11.1). Примером является аффинная хроматография лютеинизирующего гормона овцы на сефарозе с ковалентно связанной иммуноглобулиновой фракцией антител к лютеинизирующему гормону [23]. [c.133]
Аминокислоты Пептиды Белки (1985) — [
c.344
,
c.412
]
Общая органическая химия Т.10 (1986) — [
c.221
]
Молекулярная биология клетки Том5 (1987) — [
c.82
,
c.84
,
c.86
]
Основы биохимии Т 1,2,3 (1985) — [
c.139
]
Биология Том3 Изд3 (2004) — [
c.0
]
Биоэнергетика Введение в хемиосмотическую теорию (1985) — [
c.27
,
c. 28
28
,
c.40
]
Молекулярная биология клетки Сборник задач (1994) — [
c.59
,
c.60
,
c.63
]
Биологическая химия (2004) — [
c.49
,
c.180
,
c.389
,
c.429
]
Транспортные белки
2. Перенос веществ через клеточную мембрану
У всех клеток есть мембрана, состоящая из двойного слоя липидов. В клетку должны поступать многие необходимые для жизни вещества, но липидный бислой для них практически непроницаем. Поэтому в состав мембраны входят транспортные белки, которые и осуществляют перенос полярных или заряженных соединений. Транспорт этих соединений в клетку делится на активный и пассивный. Пассивный транспорт — транспорт веществ из области с высокой концентрацией в область низкой без затрат энергии, то есть диффузия. Она делится на 2 варианта: простая и облегчённая.
Транспорт этих соединений в клетку делится на активный и пассивный. Пассивный транспорт — транспорт веществ из области с высокой концентрацией в область низкой без затрат энергии, то есть диффузия. Она делится на 2 варианта: простая и облегчённая.
В облегчённой диффузии участвуют белки-переносчики. Этот вариант может сопровождаться конформационными изменениями белка. Есть несколько путей переноса веществ в этом случае: когда участвует один белок и когда участвуют несколько. Если участвует один белоктранслоказа, то он связывает вещество, потом сближается с другой стороной мембраны, отдаёт связанное вещество и возвращается в исходное состояние. Если участвуют несколько белков, то один связывается с веществом, потом передаёт его другому и так далее, пока вещество не дойдёт по цепи до противоположной стороны мембраны.
Пассивный транспорт обеспечивают также белки-каналы. Каналообразующие белки образуют в мембране водные поры, через которые когда они открыты могут проходить вещества.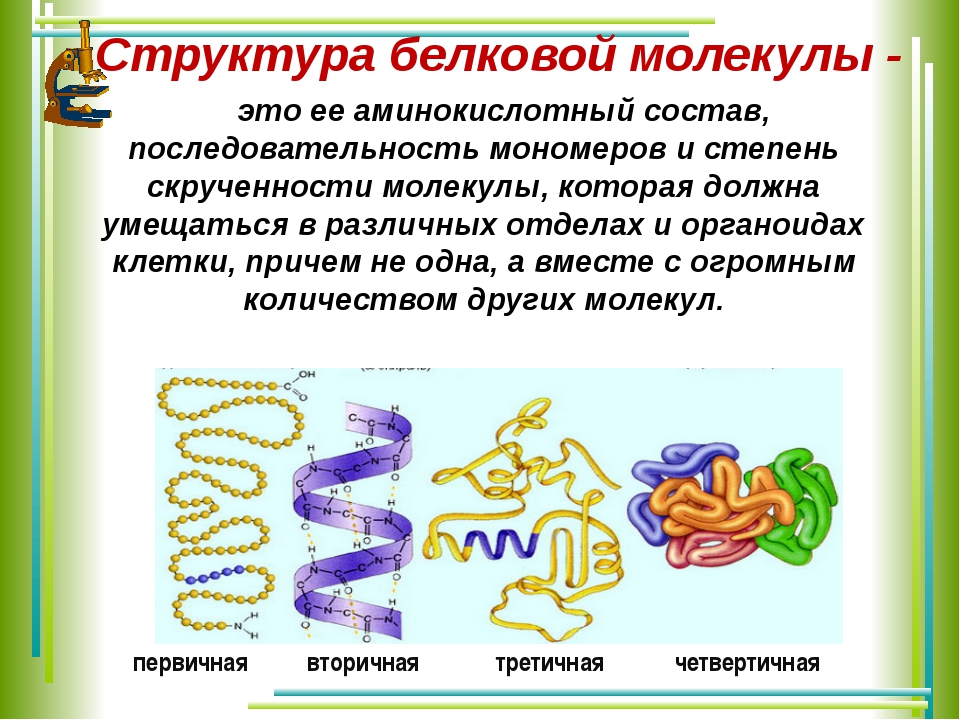 особые семейства каналообразующих белков коннексины и паннексины формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую через паннексины и в клетки из внешней среды.
особые семейства каналообразующих белков коннексины и паннексины формируют щелевые контакты, через которые низкомолекулярные вещества могут транспортироваться из одной клетки в другую через паннексины и в клетки из внешней среды.
Активный транспорт происходит против градиента концентрации и протекает с затратой энергии. В активном транспорте участвуют белки-переносчики. Энергия, которая требуется для осуществления активного транспорта, обычно получается транспортными белками при расщеплении АТФ. Один из наиболее изученных белков, осуществляющих активный транспорт — Na + /K + -аденозинтрифосфатаза. За полный цикл работы этого насоса в клетку попадают из внешней среды 2 иона K + и выбрасывается наружу 3 иона Na +.
Ещё один путь попадания веществ внутрь клетки — их поглощение путём эндоцитоза. В этом процессе также могут участвовать специальные транспортные белки. Например, гастромукопротеид внутренний фактор Касла, который синтезируется в клетках слизистой оболочки желудка, обеспечивает поглощение путём эндоцитоза клетками подвздошной кишки витамина B12.
Функции белков | Кинезиолог
Лекция 4. Функции белков
Определение:
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипетид — понятие химическое. Белок — понятие биологическое.
Например, иммуноглобулин состоит из четырех полипептидных цепей, которые по отдельности не являются белками, белок — только их функциональный агрегат.
Функции белков
1. Структурная функция.
Белки входят в состав всех клеточных органелл: мембранных — плазмалемма, ядерная оболочка, эндоплазматическая или ретику-лярная сеть (ЭР), комплекс Гольджи, лизосомы, пероксисомы, вакуоль, митохондрии, пластиды — и немембранных — хромосомы, рибосомы, клеточный центр (центриоли), реснички и жгутики, микрофиламенты.
2. Каталитическая функция.
Все ферменты — белки. Эта функция в 1982 году перестала считаться уникальной. Выяснилось, что некоторые РНК тоже обладают каталитической активностью. Их называют РНКзимами.
Выяснилось, что некоторые РНК тоже обладают каталитической активностью. Их называют РНКзимами.
3. Защитная функция (пока уникальна).
Антитела — это белки особого класса (иммуноглобулины).
Иммуноглобулины «склеивают» антигены и образуется преципитат
4. Регуляторная функция.
На клеточном уровне: белки — репрессоры и белки – активаторы транскрипции.
На организменном уровне: некоторые гормоны — белки.
Например, инсулин — гормон поджелудочной железы. Регулирует переход глюкозы через плазмалемму. При недостаточной секреции инсулина развивается тяжелое заболевание — сахарный диабет.
Соматотропин — гормон роста. Образуется в передней доле гипофиза.
Там же образуется и адренокортикотропный гормон (АКТГ). Он действует на кору надпочечников, регулируя синтез стероидных гормонов.
5. Трансформация энергии.
Белки сетчатки глаза родопсин и ретинен трансформируют световую энергию в электрическую. Актино-миозиновые комплексы в мышцах преобразуют энергию химических связей в механическую.
6. Транспортная функция.
Гемоглобин осуществляет транспорт О2, СО2.
Трансферрин — транспорт железа.
Системы пермеаз — это мембранные белки, которые переносят полярные соединения через мембрану как по, так и против градиента концентрации.
7. Энергетическая функция.
11 из 20 аминокислот, входящих в состав белков, в организме человека «сгорают» с выделением энергии. Это — заменимые аминокислоты. Они могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов.
8. Питательная функция.
а) Поставка незаменимых аминокислот. У человека 9 из 20 аминокислот не
могут быть синтезированы в организме. Они должны поступать извне.
Понятие «заменимые и незаменимые аминокислоты» видоспецифическое и касается только животных и грибов.
б) Запасные белки для развития зародыша и вскармливания младенца.
Например, казеин — белок молока, овальбумин — яичный белок, глиадин —
белок зерен пшеницы.
9. Буферная функция.
Любой белок — амфотерный полиэлектролит. Белки способствуют поддержанию определенных значений рН в разных отсеках клетки, обеспечивая этим компартментализацию.
Источники: Дымшиц Г.М. Молекулярная биология: http://www.medliter.ru/?page=get&id=012131
Видеолекция: Общие свойства прионов. Лектор: Виталий Кушниров, д.б.н., ведущий научный сотрудник лаборатории молекулярной генетики, Институт биохимии имени А.Н. Баха РАН, Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН, 27.08.2015
Транспортная функция
Растворимые белки, участвующие в
транспорте малых молекул, должны иметь
высокое сродство (афинность)
к субстрату, когда он присутствует в
высокой концентрации, и легко его
высвобождать в местах низкой концентрации
субстрата. Примером транспортных белков
Примером транспортных белков
можно назватьгемоглобин,
который переноситкислородиз лёгких к остальным тканям иуглекислый
газот тканей к лёгким, а
такжегомологичныеему белки, найденные во всех царствах
живых организмов.
Некоторые мембранные
белкиучаствуют в транспорте
малых молекул через мембрану клетки,
изменяя её проницаемость.Липидныйкомпонент мембраны водонепроницаем
(гидрофобен), что предотвращаетдиффузиюполярных или заряженных (ионы) молекул.
Мембранные транспортные белки принято
подразделять на белки-каналы и
белки-переносчики. Белки-каналы содержат
внутренние заполненные водой поры,
которые позволяют ионам (через ионные
каналы) или молекулам воды (через
белки-аквапорины) перемещаться внутрь
или наружу. Многиеионные
каналыспециализируются
на транспорте только одного иона; так,калиевыеинатриевыеканалы часто различают эти сходные ионы
и пропускают только один из них[38].
Белки-переносчики связывают, подобно
ферментам, каждую переносимую молекулу
или ион и, в отличие от каналов, могут
осуществлять активный транспорт с
использованием энергии АТФ. «Электростанция
«Электростанция
клетки» —АТФ-синтаза,
которая осуществляет синтез АТФ за счётпротонного
градиента, также может
быть отнесена к мембранным транспортным
белкам.
Запасная (резервная) функция белков
К таким белкам относятся так называемые
резервные белки, которые запасаются в
качестве источника энергии и вещества
в семенах растений и яйцеклетках
животных; белки третичных оболочек яйца(овальбумины)
и основной белокмолока(казеин)
также выполняют, главным образом,
питательную функцию. Ряд других белков
используется в организме в качестве
источника аминокислот, которые в свою
очередь являются предшественниками
биологически активных веществ,
регулирующих процессыметаболизма.
Рецепторная функция
Белковые рецепторы могут как находиться
в цитоплазме, так и встраиваться в
клеточную мембрану.
Одна часть молекулы рецептора воспринимаетсигнал,
которым чаще всего служит химическое
вещество, а в некоторых случаях — свет,
механическое воздействие (например,
растяжение) и другие стимулы. При
При
воздействии сигнала на определенный
участок молекулы белок-рецептор
происходят еёконформационные
изменения. В результате
меняется конформация другой части
молекулы, осуществляющей передачу
сигнала на другие клеточные компоненты.
Существует несколько механизмов передачи
сигнала. Некоторые рецепторыкатализируютопределенную химическую реакцию; другие
служат ионными каналами, которые при
действии сигнала открываются или
закрываются; третьи специфически
связывают внутриклеточные
молекулы-посредники. У мембранных
рецепторов часть молекулы, связывающаяся
с сигнальной молекулой, находится на
поверхности клетки, а домен, передающий
сигнал, внутри.
Моторная (двигательная) функция
Целый класс моторных
белковобеспечивает
движения организма (например, сокращение
мышц, в том числе локомоцию (миозин),
перемещение клеток внутри организма
(например, амебоидное движениелейкоцитов),
движениересничекижгутиков,
а также активный и направленный
внутриклеточный транспорт (кинезин,динеин).
Динеины и кинезины проводят транспортировку
молекул (так называемогокарго)
вдольмикротрубочекс использованиемгидролизаАТФв качестве источника энергии. Динеины
переносят карго из периферических
частей клетки по направлению кцентросоме,
кинезины в противоположном направлении.
Динеины также отвечают за движение
ресничек ижгутиковэукариот. Цитоплазматические варианты
миозина могут перемещать карго вдоль
микрофиламентов.
Список использованной
литературы:
Альбертс
Б., Брей Д., Льюис Дж. и др.Молекулярная
биология клетки. В 3 томах. — М.: Мир,
1994. —ISBN
5-03-001986-3Ленинджер
А.Основы биохимии. В 3 томах. — М.:
Мир, 1985.Страйер
Л.Биохимия. В 3 томах. — М.: Мир, 1984.http://www.molbiol.ru/appendix/02_01.html
Транспортный белок — определение, функция, типы и примеры
Определение транспортного белка
Транспортные белки — это белки, которые переносят вещества через биологические мембраны. Транспортные белки находятся внутри самой мембраны, где они образуют канал или механизм переноса, позволяющий их субстрату переходить с одной стороны на другую.
Транспортные белки находятся внутри самой мембраны, где они образуют канал или механизм переноса, позволяющий их субстрату переходить с одной стороны на другую.
Вещества, переносимые этими белками, могут включать ионы, такие как натрий и калий; сахара, такие как глюкоза; белки и молекулы-мессенджеры; и многое другое.
Транспортные белки обычно выполняют два типа транспорта: «облегченная диффузия», когда транспортный белок просто создает отверстие для диффузии вещества вниз по градиенту его концентрации; и «активный транспорт», когда клетка расходует энергию, чтобы переместить вещество против градиента его концентрации.
Функция транспортного белка
Жизнь, как мы знаем, зависит от способности клеток выборочно перемещать вещества, когда они в этом нуждаются. Некоторые важные молекулы, такие как ДНК, должны постоянно находиться внутри клетки; но другие молекулы, такие как ионы, сахара и белки, могут нуждаться в прохождении внутрь и наружу, чтобы клетка функционировала должным образом.
Каждый транспортный белок предназначен для транспортировки определенного вещества по мере необходимости. Например, некоторые белки каналов открываются только тогда, когда они получают правильный сигнал, позволяя транспортируемым веществам течь по мере необходимости. Аналогичным образом, активные переносчики часто могут «включаться и выключаться» молекулами-посредниками.
Перемещая вещества через мембраны, транспортные белки делают возможным все, от нервных импульсов до клеточного метаболизма.
Без транспортных белков, например, градиент натрий-калий, который позволяет нашим нервам срабатывать, не существовал бы.
Типы транспортных белков
Каналы / поры
Судя по их названию, «канальные» или «поровые» белки открывают отверстия в мембране клетки.
Эти белки характеризуются тем, что они открыты как во внутриклеточное, так и во внеклеточное пространство одновременно. Напротив, белки-носители открыты только внутри или снаружи клетки в любой момент времени.
Каналы или поры обычно устроены так, что сквозь них может проходить только одно конкретное вещество.
Например, потенциалзависимые ионные каналы часто используют заряженные аминокислоты, расположенные на точных расстояниях, чтобы привлечь желаемый ион и оттолкнуть все остальные. Затем нужный ион может протекать через канал, в то время как другие вещества — нет.
Управляемые напряжением ионные каналы являются хорошими примерами транспортных белков, которые действуют по мере необходимости. Часто обнаруживаемые в нейронах, потенциалзависимые ионные каналы открываются в ответ на изменения электрохимического потенциала мембраны.
В закрытом состоянии управляемый по напряжению канал не позволяет ионам проходить через клеточную мембрану.Но когда он открыт, он позволяет огромным количествам ионов проходить очень быстро, позволяя клетке быстро изменять свой мембранный потенциал и запускать нервный импульс.
Белки-носители
Белки-носители — это транспортные белки, которые одновременно открыты только с одной стороны мембраны.
Их часто проектируют таким образом, потому что они транспортируют вещества против градиента их концентрации. Одновременное открытие обеих сторон мембраны может позволить этим веществам просто течь обратно по градиенту их концентрации, сводя на нет работу белка-носителя.
Для выполнения своей работы белки-носители обычно используют энергию для изменения формы.
Натрий-калиевый насос, например, использует энергию АТФ для изменения своей формы, открывающейся для внутриклеточного раствора, на открытую для внеклеточного раствора. Это позволяет ему собирать ионы внутри клетки и выпускать их за пределы клетки, а затем наоборот.
Другие белки-носители могут использовать другие источники энергии, такие как существующие градиенты концентрации, для выполнения «вторичного активного транспорта».Это означает, что их транспорт возможен благодаря расходу энергии клеткой, но сам белок не использует АТФ напрямую.
Как это возможно? Эти белки-носители часто используют энергию одного вещества, которое «хочет» двигаться вниз по градиенту концентрации, чтобы изменить свою форму. Такое же изменение формы позволяет ему транспортировать вещество, которое «не хочет» одновременно двигаться.
Хорошим примером является транспортный белок натрий-глюкоза, который использует градиент концентрации натрия, первоначально созданный натрий-калиевым насосом, для перемещения глюкозы против градиента ее концентрации.
Мы подробно обсуждаем натрий-калиевый насос и транспортный белок натрий-глюкозу ниже.
Примеры транспортных белков
Натрий-калиевый насос
Самым известным примером первичного активного транспортного белка является натриево-калиевый насос. Именно этот насос создает ионный градиент, который позволяет нейронам срабатывать.
Натрий-калиевый насос начинается с участков связывания натрия, обращенных внутрь клетки. Эти участки притягивают ионы натрия и удерживают их.
Когда каждый из трех сайтов связывания натрия связывает ион натрия, белок затем связывается с молекулой АТФ и расщепляет ее на АДФ + фосфатную группу. Белок использует энергию, выделяемую в этом процессе, для изменения формы.
Теперь сайты связывания натрия обращены к внеклеточному раствору. Они высвобождают три иона натрия за пределы клетки, в то время как сайты связывания калия белка связываются с двумя ионами калия.
Когда оба сайта связывания калия заполнены, белок возвращается к своей исходной форме.Теперь ионы калия высвобождаются внутри клетки, а пустые участки связывания натрия могут связывать больше ионов натрия.
Схема натрий-калиевый насос
Для каждого АТФ, используемого этим насосом, он транспортирует три положительно заряженных иона за пределы клетки, а обратно в нее — только два. Это создает электрохимический градиент, при котором внутренняя часть ячейки заряжается отрицательно по сравнению с внешним раствором. Он также создает сильный градиент концентрации с гораздо большим количеством калия внутри клетки и гораздо большим количеством натрия вне клетки.
Когда приходит время нервной клетке сработать, сильные электрические и химические градиенты позволяют клетке производить огромные, мгновенные изменения, открывая свои потенциалзависимые ионные каналы.
Транспортные белки натрий-глюкоза
Транспортный белок натрий-глюкоза использует вторичный активный транспорт для перемещения глюкозы в клетки. Они активны в клетках кишечника и почек, которые должны перемещать глюкозу в системы организма против градиента ее концентрации.
Эта операция требует энергии, потому что рассматриваемые клетки имеют более высокую концентрацию глюкозы, чем внеклеточная жидкость. Следовательно, глюкоза не сможет диффундировать в клетки сама по себе; необходимо приложить энергию.
В этом случае энергия исходит от градиента концентрации натрия. Благодаря действию натрий-калиевого насоса вне клетки натрия намного больше, чем внутри нее. Таким образом, существует сильный градиент концентрации, способствующий перемещению натрия в клетку.
Этот градиент концентрации можно рассматривать как тип «накопленной энергии». Натрий-калиевый насос получает энергию от АТФ и преобразует ее в этот градиент концентрации, который затем можно использовать для других целей, например, для транспортного белка натрия и глюкозы.
Управляемые ионные каналы в улитке
Управляемые ионные каналы — это пассивные транспортные белки, которые открываются в ответ на определенные стимулы. Возможно, вы знакомы с ионными каналами, управляемыми напряжением, такими как те, которые заставляют наши нейроны срабатывать в ответ на входные данные от других нейронов.
Менее известны закрытые ионные каналы улитки, которые открываются механическим давлением вместо изменения напряжения. Эти замечательные ионные каналы позволяют нервам нашего внутреннего уха срабатывать в ответ на колебания звука. Вот как мы слышим.
В улитке за наш слух отвечают особые клетки, называемые «волосковыми клетками». «Внешние волосковые клетки» колеблются в ответ на звуковые волны, усиливая их колебания.
С другой стороны, внутренние волосковые клетки выполняют особую работу.В ответ на эти колебания они открывают ионные каналы в своих клеточных мембранах и высвобождают нейротрансмиттеры — точно так же, как это сделал бы нейрон.
Эти нейротрансмиттеры вызывают возбуждение прилегающих нервов. Вот так звук превращается в нервные импульсы!
- Активный транспорт — Транспорт веществ через биологические мембраны, требующий от клетки расхода энергии.
- Стробируемый ионный канал — Белок, который позволяет ионам проходить, когда открыт, который открывается в ответ на определенный стимул.
- Пассивный транспорт — Транспорт веществ через биологические мембраны, который происходит естественным путем, без затрат энергии.
Тест
1. Почему это называется «облегченная диффузия»?
A. Потому что вещество диффундирует естественным образом вниз по градиенту концентрации, без помощи транспортного белка.
B. Потому что веществу требуется транспортный белок, чтобы расходовать энергию, чтобы облегчить его движение.
C. Потому что вещество естественно диффундирует вниз по градиенту концентрации, но ему помогает белок, который открывает канал или поры в клеточной мембране, через которые оно может проходить.
D. Потому что вещество пытается диффундировать, но его останавливает клеточная мембрана.
Ответ на вопрос № 1
C правильный. При облегченной диффузии транспортные белки «облегчают», открывая каналы или поры в непроницаемой в противном случае клеточной мембране.
2. В чем разница между первичным и вторичным активным транспортом?
A. Первичный активный транспорт использует белки-носители, а вторичный активный транспорт использует белки каналов.
B. Первичный активный транспорт может транспортировать только одно вещество за раз, в то время как вторичный активный транспорт может транспортировать два.
C. Первичный активный транспорт требует энергии; вторичный активный транспорт — нет.
D. Первичные активные транспортные белки напрямую используют АТФ.Вторичные активные транспортные белки используют энергию, полученную в результате других АТФ-зависимых процессов.
Ответ на вопрос № 2
D правильный. Все виды активного транспорта требуют от клетки затрат энергии. Первичные активные транспортные белки получают энергию непосредственно от АТФ; вторичные активные транспортные белки используют энергию процессов, производных от АТФ.
3. Что из следующего НЕ является примером активного транспорта?
A. Натрий-калиевый насос перемещает натрий и калий против градиента их концентрации.
B. Ионные каналы волосковых клеток открываются в ответ на давление, позволяя ионам проходить через них.
C. Транспортер натрия-глюкозы использует градиент концентрации натрия для перемещения глюкозы в клетку.
D. Ничего из вышеперечисленного.
Ответ на вопрос № 3
B правильный. Ионные каналы — это форма пассивного транспорта; они позволяют ионам двигаться вниз по градиенту их концентрации, что не требует затрат энергии.
Ссылки
- Холл, Джон Э .; Гайтон, Артур С. (2006). Учебник медицинской физиологии . Сент-Луис, Миссури: Elsevier Saunders. ISBN 0-7216-0240-1
- Рычаг, Дж. Э. (1992). Клеточная и молекулярная биология Na / Gluosis Symport. Мембранный транспорт в биологии , 56-72. doi: 10.1007 / 978-3-642-76983-2_2
Транспортные белки: определение, типы, функции и примеры — видео и стенограмма урока
Пассивный и активный сотовый транспорт
Существует два основных вида клеточного транспорта: пассивный транспорт и активный транспорт.
Когда происходит пассивный перенос , молекулы перемещаются из концентрированной области в менее концентрированную область. Это не требует энергии; давление в концентрированной области естественным образом выталкивает молекулы в область с более низким давлением. Противоположный этому процессу процесс , активный транспорт , перемещает молекулы из менее концентрированной области в более концентрированную область. Это требует ввода энергии в виде АТФ, аденозинтрифосфата.
Вернемся на почту.Представьте, что в почтовом отделении 100 почтовых работников, а снаружи — 20. Это будет 100 молекул внутри клетки и 20 снаружи. Когда рабочие изнутри уходят и выходят за пределы почтового отделения, они перемещаются из области с большим количеством рабочих (более высокая концентрация) в область с меньшим количеством рабочих (более низкая концентрация). Снаружи места намного больше, поэтому выход из переполненного почтового отделения требует очень мало энергии. Именно так работает пассивный транспорт.
С другой стороны, если некоторые из внешних рабочих решат пойти в почтовое отделение, они перейдут из области с меньшим количеством рабочих (более низкая концентрация) в область с большим количеством рабочих (более высокая концентрация).Им потребуется приложить энергию, чтобы снова втиснуться в переполненное здание. Вот почему активный транспорт требует энергии от клетки.
Функции транспортных белков
Транспортные белки действуют как в активном, так и в пассивном транспорте, перемещая молекулы через плазматическую мембрану. Внутри плазматической мембраны можно найти две основные группы транспортных белков, каждая из которых помогает водолюбивым молекулам проходить через плазматическую мембрану.
Канальный белок служит туннелем через мембрану в клетку.В частности, канальные белки помогают молекулам через мембрану посредством пассивного транспорта, процесса, называемого облегченной диффузией. Эти белки каналов несут ответственность за доставку ионов и других небольших молекул в клетку. Важно помнить, что каждый белок канала может вводить только определенную молекулу. Например, кальциевый канал может использоваться только для транспортировки кальция в клетку и из клетки. Существуют разные типы канальных белков для разных молекул, в том числе для натрия, калия и хлорида.Фактически, есть даже канал, специально предназначенный для транспортировки воды через плазматическую мембрану.
Другой тип транспортного белка называется белком-носителем . Белки-носители должны изменить форму, чтобы пройти молекулу через плазматическую мембрану. Думайте об этом как о вращающейся двери в почтовое отделение. Когда вы входите в вращающуюся дверь, она должна сдвинуться с места, чтобы попасть внутрь почтового отделения. Белок-носитель действует аналогичным образом.
Подобно канальным белкам, белки-носители специфичны для молекул, которые они пытаются перемещать через мембрану.Некоторые носители могут перемещать только одно вещество за раз, в то время как другие могут перемещать два вещества одновременно. Подобно канальным белкам, белки-носители могут использоваться для облегчения диффузии. Например, несколько молекул-носителей глюкозы способствуют облегченной диффузии глюкозы через мембрану. Однако их также можно использовать во время активного транспорта. Например, натриево-калиевый насос транспортирует три иона натрия в ячейку, а два иона калия выкачивает из ячейки.
Резюме урока
Транспортные белки действуют как двери в клетку, помогая определенным молекулам проходить вперед и назад через плазматическую мембрану, которая окружает каждую живую клетку.В пассивном транспорте молекул перемещаются из области высокой концентрации в область низкой концентрации. Активный транспорт , с другой стороны, перемещает молекулы от низкой концентрации к более высокой.
Есть два основных класса транспортных белков, которые находятся в плазматической мембране. Канальные белки помогают в пассивном транспорте, процессе, называемом облегченной диффузией. Во время этого процесса они служат туннелем для определенных ионов и небольших молекул.Примеры канальных белков включают ионные каналы хлорида, натрия, кальция и калия. Белки-носители используются как в пассивном, так и в активном транспорте и изменяют форму, перемещая свою конкретную молекулу через мембрану. Примеры белков-носителей в наших клетках включают натрий-калиевый насос и переносчики глюкозы.
Известные словарные термины и определения
| Словарь | Определения |
|---|---|
| Транспортные белки | Двери в камеру; они помогают молекулам двигаться вперед и назад через плазматическую мембрану |
| Пассивный транспорт | Молекулы переходят от высокой к низкой концентрации |
| Активный транспорт | Перемещает молекулы с низкой концентрации на более высокую |
| Белки каналов | (т.е. хлорид, кальций) Действует как туннель, по которому проходят ионы и небольшие молекулы во время облегченной диффузии |
| Белки-носители | (т.е. транспортеры глюкозы) Работает как в активном, так и в пассивном транспорте; они меняют форму при перемещении молекул через мембраны |
Результаты обучения
Используйте этот урок, чтобы расширить свои знания о транспортных белках в процессе подготовки до следующих:
- Интерпретация действий транспортных белков
- Контрастность активного и пассивного клеточного транспорта
- Обратите внимание на функции каналов и белков-носителей
4.3: Мембранные транспортные белки — Biology LibreTexts
Мембранные белки бывают двух основных типов: интегральные мембранные белки (иногда называемые внутренними), которые вставляются непосредственно в фосфолипидный бислой, и периферические мембранные белки (иногда называемые внешними), которые расположены очень близко друг к другу. близко или даже в контакте с одной стороной мембраны, но не проникают в гидрофобное ядро бислоя. Интегральные мембранные белки могут полностью проходить через мембрану, контактируя как с внеклеточной средой, так и с цитоплазмой, или они могут только частично вставляться в мембрану (с обеих сторон) и контактировать только с цитоплазмой или внеклеточной средой.Нет никаких известных белков, которые полностью похоронены в ядре мембраны.
Интегральные мембранные белки (рисунок \ (\ PageIndex {9} \)) плотно удерживаются на месте гидрофобными силами, и для их очистки от липидов требуются агенты, разрушающие мембраны, такие как органические растворители (например, метанол) или детергенты (например, SDS , Тритон Х-100). Из-за природы бислоя часть интегральных мембранных белков, которые лежат внутри гидрофобного ядра мембраны, обычно очень гидрофобные по характеру или имеют обращенные наружу гидрофобные остатки для взаимодействия с ядром мембраны.Эти трансмембранные домены обычно принимают одну из двух форм, изображенных на рисунках 8 и 14: альфа-спирали — либо по отдельности, либо в комплекте с другими альфа-спиралями, или бочкообразные вставки, в которых стенки цилиндра построены из бета-складчатых листов. Гидрофобные вставки ограничены короткой серией полярных или заряженных остатков, которые взаимодействуют с водной средой и полярными головными группами, чтобы предотвратить скольжение гидрофобной части белка с места. Более того, белки могут иметь несколько доменов, перекрывающих мембрану.
Рисунок \ (\ PageIndex {9} \). Интегральный (оранжевый) и периферический (синий) мембранные белки, встроенные в фосфолипидный бислой.
Периферические мембранные белки (также показанные на рисунке \ (\ PageIndex {9} \)) менее предсказуемы по своей структуре, но могут быть прикреплены к мембране либо посредством взаимодействия с интегральными мембранными белками, либо ковалентно присоединенными липидами. Наиболее распространенными такими модификациями белков периферических мембран являются ацилирование жирных кислот, пренилирование и связывание с якорями гликозилфосфатидилинозитола (GPI).Жирное ацилирование чаще всего представляет собой миристоилирование (ацильная цепь 14: 0) и пальмитоилирование (цепь 16: 0) белка. Белок может быть ацилирован более чем одной цепью, хотя чаще всего встречается одна или две ацильные группы. Эти жирные ацильные цепи стабильно вставляются в сердцевину фосфолипидного бислоя. Хотя миристоилированные белки находятся во множестве компартментов, почти все пальмитоилированные белки расположены на цитоплазматической стороне плазматической мембраны. С другой стороны, пренилированные белки в основном прикреплены к внутриклеточным мембранам.Пренилирование — это ковалентное присоединение изопреноидов к белку — чаще всего изопреновой (углеводород C5), фарнезильной (C15) или геранилгеранильной (C20) групп (рисунок \ (\ PageIndex {10} \)). Якоря GPI (рис. \ (\ PageIndex {11} \)) находятся исключительно на белках на внешней поверхности клетки, но, похоже, нет никакой другой общности в их структурах или функциях.
Рисунок \ (\ PageIndex {10} \). PrenylationFigure \ (\ PageIndex {11} \). GPI-связанные белки соединены С-концевой карбоксильной группой с фосфоэтаноламином, который связан с центральным тетрасахаридом из трех остатков маннозы и одного N-ацетилглюкоазмина, последний из которых связан гликозидной связью с фосфатидилинозитолом.
Конечно, не все мембранные белки или даже все трансмембранные белки являются переносчиками, и многие другие функции мембранных белков — в качестве рецепторов, молекул адгезии, сигнальных молекул и структурных молекул — будут обсуждаться в последующих главах. Основное внимание здесь уделяется роли мембранных белков в облегчении транспорта молекул через клеточную мембрану.
Транспорт через мембрану может быть либо пассивным, не требующим внешнего источника энергии при перемещении растворенного вещества от высокой до низкой концентрации, либо активным, требующим затрат энергии при перемещении растворенного вещества от низкой до высокой концентрации (Рисунок \ (\ PageIndex {12} \) ).
Рисунок \ (\ PageIndex {12} \). Для ионов Na и клеток животных пассивный транспорт осуществляется внутрь, отправляя Na + из высокой концентрации вне клетки в низкую внутри клетки. Активный транспорт требует энергии, такой как гидролиз АТФ, чтобы подтолкнуть ион Na + от низкой концентрации внутри клетки к более высокой концентрации снаружи.
Пассивный транспорт также можно разделить на неопосредованный транспорт, при котором движение растворенных веществ определяется исключительно диффузией, и растворенное вещество не требует транспортного белка, и опосредованный пассивный транспорт (также известный как облегченная диффузия), при котором транспортный белок необходим для помочь растворенному веществу перейти от высокой к низкой концентрации.Несмотря на то, что иногда это может включать изменение экстерьера, для этого процесса не требуется никакой внешней энергии. Неопосредованный пассивный перенос применяется только к небольшим неполярным молекулам, растворимым в мембране, а кинетика движения определяется диффузией, толщиной мембраны и электрохимическим мембранным потенциалом. Активный транспорт — всегда опосредованный транспортный процесс.
Рисунок \ (\ PageIndex {13} \). Неопосредованный и опосредованный транспорт: поток по сравнению с концентрацией.
Сравнивая поток растворенного вещества с исходной концентрацией на рисунке \ (\ PageIndex {13} \), мы видим, что существует линейная зависимость для немодированного транспорта, в то время как опосредованный пассивный транспорт (и в этом отношении активный транспорт) показывает эффект насыщения из-за ограничивающему фактору количества доступных белков, которые пропускают растворенное вещество.Когда растворенного вещества будет достаточно, чтобы постоянно занимать все транспортеры или каналы, будет достигнут максимальный поток, и увеличение концентрации не сможет преодолеть этот предел. Это справедливо независимо от типа белка-переносчика, хотя некоторые из них более тесно вовлечены в транспорт, чем другие.
Помимо переносчиков белков, существуют и другие способы облегчить перемещение ионов через мембраны. Ионофоры — это небольшие органические молекулы, часто (но не исключительно) созданные бактериями, которые помогают ионам перемещаться через мембраны.Многие ионофоры являются антибиотиками, которые действуют, заставляя мембраны становиться проницаемыми для определенных ионов, изменяя электрохимический потенциал мембраны и химический состав внутри клетки. Ионофоры являются исключительно пассивно-транспортным механизмом и делятся на два типа.
Ионофор первого типа — это небольшой, в основном гидрофобный носитель, почти полностью встроенный в мембрану, который связывается с конкретным ионом и окружает его, защищая его от липидов, а затем перемещает его через клеточную мембрану.Наиболее изученным ионофором носителя является валиномицин, который связывается с K +. Валиномицин представляет собой циклический депсипептид с 12 остатками (содержит амидные и сложноэфирные связи) с чередующимися d- и l-аминокислотами. Все карбонильные группы обращены внутрь для взаимодействия с ионом, в то время как гидрофобные боковые цепи обращены наружу к липиду мембраны. Ионофоры-носители не обязательно являются пептидами: промышленный химикат 2,4-динитрофенол является носителем H + и представляет собой серьезную проблему для отходов окружающей среды, а нистатин, противогрибковое средство, используемое для лечения инфекций человека Candida albicans , представляет собой K + . перевозчик.
Второй тип носителя формирует каналы в мембране-мишени, но, опять же, не является белком. Грамицидин является типичным примером антиграмположительного антибактериального средства (за исключением источника грамицидинов, грамположительного Bacillus brevis ) и ионофорного канала для одновалентных катионов, таких как Na + , K + и H + . Он непроницаем для анионов и может блокироваться двухвалентным катионом Ca 2+ . Как и валиномицин, грамицидин A также состоит из чередующихся d- и l-аминокислот, каждая из которых является гидрофобной (l-Val / Ile-Gly-l-Ala-d-Leu-l-Ala-d-Val-l -Val-d-Val-l-Trp-d-Leu-l-Trp-d-Leu-l-Trp-d-Leu-l-Trp).Грамицидин А димеризуется в мембране с образованием сжатой структуры b-листа, известной как b-спираль. Димеризация образует N-конец к N-концу, размещая остатки Trp по направлению к внешним краям мембраны, с полярными группами NH по направлению к внеклеточным и цитоплазматическим поверхностям, закрепляя поры на месте.
Каналы — это, по сути, автономные транспортные системы, которые, как следует из названия, обеспечивают переход от одной стороны ячейки к другой. Хотя каналы могут быть закрытыми — например, открываться и закрываться в ответ на изменения мембранного потенциала или связывания лиганда — они пропускают растворенные вещества с высокой скоростью без их прочного связывания и без изменения конформации.Растворенное вещество может перемещаться только по каналам от высокой до низкой концентрации. Калиевый канал, изображенный ниже (рис. \ (\ PageIndex {14} \) A), является примером: есть фильтр селективности (14B) выровненных карбонильных атомов кислорода, который временно позиционирует ионы K + для быстрого прохождения через канал, но это действительно так. не связывает K + в течение какого-либо значительного периода времени, и канал не претерпевает никаких конформационных изменений в результате взаимодействия. Более мелкие ионы Na + могут (и в редких случаях это удается) пройти через канал K +, но поскольку они слишком малы, чтобы их правильно позиционировал фильтр K + , они обычно выскакивают обратно.Следует отметить, что этот канал представляет собой тетрамер (14C), и на диаграмме в разрезе (14A) для ясности показана только половина канала.
Рисунок \ (\ PageIndex {14} \). (A) Половина тетрамерного канала K + , показывающая две субъединицы. (B) Деталь фильтра селективности, заключенная в рамку A. (C) Изображение сверху вниз, созданное на основе данных из банка данных белка RCSB.
В то время как большинство белков, называемых «каналами», образованы множеством альфа-спиралей, порины образованы цилиндрическим бета-листом. В обоих случаях растворенные вещества могут двигаться только вниз по градиенту концентрации от высокого к низкому, и в обоих случаях растворенные вещества не имеют значительного контакта с порой или каналом.Внутренняя часть поры обычно гидрофильна из-за чередования гидрофильных / гидрофобных остатков вдоль бета-ленты, которая размещает гидрофобные боковые цепи снаружи, взаимодействуя с ядром мембраны.
Рисунок \ (\ PageIndex {15} \).
Порины в основном обнаруживаются в грамотрицательных бактериях, некоторых грамположительных бактериях, а также в митохондриях и хлоропластах эукариот. Обычно они не обнаруживаются в плазматической мембране эукариот. Кроме того, несмотря на сходство в названии, они структурно не связаны с аквапоринами, которые представляют собой каналы, которые способствуют диффузии воды в клетки и из них.
Транспортные белки работают иначе, чем каналы или поры. Вместо того, чтобы обеспечивать относительно быстрый поток растворенных веществ через мембрану, транспортные белки перемещают растворенные вещества через мембрану дискретными квантами, связываясь с растворенным веществом на одной стороне мембраны, изменяя конформацию таким образом, чтобы переносить растворенное вещество на другую сторону мембраны. , а затем выпустить растворенное вещество. Эти транспортные белки могут работать с отдельными молекулами растворенных веществ, такими как переносчики глюкозы, или они могут перемещать несколько растворенных веществ.Транспортеры глюкозы — это , пассивные транспортные белки , поэтому они перемещают глюкозу только от более высоких концентраций к более низким и не требуют внешнего источника энергии. Эти четыре изоформы очень похожи по структуре, но различаются по своему распределению в тканях внутри животного: например, GLUT2 обнаруживается в основном в b-клетках поджелудочной железы, а GLUT4 — в основном в мышечных и жировых клетках.
С другой стороны, классический пример активного транспортного белка , АТФаза Na + / K + , также известная как антипорт Na + / K + , использует энергию гидролиза АТФ. для обеспечения конформационных изменений, необходимых для перемещения ионов Na + и K + против градиента.Ссылаясь на рисунок \ (\ PageIndex {16} \), в состоянии покоя Na + / K + АТФаза открыта для цитоплазмы и может связывать три иона Na + (1). После связывания трех Na + переносчик может катализировать гидролиз молекулы АТФ, удаляя фосфатную группу и перенося ее на саму АТФазу (2). Это запускает конформационное изменение, которое открывает белок во внеклеточное пространство, а также изменяет сайт связывания иона, так что Na + больше не связывается с высоким сродством и исчезает (3).Однако при этом конформационном изменении также изменяется специфичность сайта связывания иона, и эти новые сайты обладают высоким сродством к ионам K + (4). Как только два K + связываются, присоединенная фосфатная группа высвобождается (5), и другой конформационный сдвиг возвращает белок-переносчик обратно в его исходную конформацию, изменяя сайты связывания K + , чтобы позволить высвобождение K + в цитоплазма (6) и снова обнаруживает сродство к Na + .
Рисунок \ (\ PageIndex {16} \). Активный транспорт с помощью Na + / K + АТФазы. Этот фермент выталкивает три иона Na + из клетки и два иона K + в клетку, двигаясь против градиента в обоих направлениях и используя энергию гидролиза АТФ. [Примечание: в некоторых текстах показана эта ферментативная активность с отдельными сайтами связывания для Na + и K + , но недавние кристаллографические данные показывают, что существует только один сайт связывания иона, который изменяет конформацию и специфичность.]
АТФаза Na + / K + является членом семейства АТФаз P-типа. Они названы из-за аутофосфорилирования, которое происходит, когда АТФ гидролизуется для управления транспортом. Другими выдающимися членами этого семейства АТФаз являются Са 2+ -АТФаза, которая перекачивает Са 2+ из цитоплазмы в органеллы или из клетки, и АТФаза H + / K + , хотя Насосы P-типа H + также присутствуют в плазматических мембранах грибов и растений, а также в бактериях.
Сердечные гликозиды (также сердечные стероиды) ингибируют Na + / K + АТФазу, связываясь с внеклеточной стороной фермента. Эти препараты, в том числе наперстянка (извлекается из пурпурной наперстянки) и уабаин (извлекается из дерева уабио), обычно назначаются для лечения сердечных заболеваний, которые увеличивают интенсивность сердечных сокращений. Ингибирование Na + / K + АТФазы вызывает повышение [Na + ] в , что затем активирует сердечные антипорты Na + / Ca 2+ , выкачивая избыток натрия и Ca 2 + в.Увеличенная [Ca 2+ ] цитоплазма захватывается саркоплазматической сетью, что приводит к дополнительному Ca 2+ , когда он высвобождается, чтобы вызвать сокращение мышц, вызывая более сильные сокращения.
В отличие от Na + или K + , градиент Ca 2+ не очень важен с точки зрения электрохимического потенциала мембраны или использования ее энергии. Однако жесткая регуляция Ca 2+ важна другим образом: он используется в качестве внутриклеточного сигнала.Чтобы оптимизировать эффективность Ca 2+ в качестве сигнала, его цитоплазматические уровни поддерживаются чрезвычайно низкими, с помощью насосов Ca 2+ , выталкивающих ион в ER (SR в мышцах), Гольджи и из клетки. Эти насосы сами регулируются уровнями Ca 2+ через белок кальмодулин. При низких уровнях Ca 2+ помпа неактивна, и ингибирующий домен самой помпы предотвращает ее активность. Однако, когда уровни Ca 2+ повышаются, ионы связываются с кальмодулином, и комплекс Ca 2+ -кальмодулин может связываться с ингибирующей областью насоса Ca 2+ , снимая ингибирование и позволяя избытку Ca 2+ для откачки из цитоплазмы.
Есть три других семейства АТФаз: АТФазы F-типа представляют собой протонные насосы в бактериях, митохондриях и хлоропластах, которые также могут образовывать АТФ, бегая «назад» с протонами, протекающими через них, вниз по градиенту концентрации. Они будут обсуждены в следующей главе (Метаболизм). Кроме того, существуют АТФазы V-типа, которые регулируют pH в кислых пузырьках и вакуолях растений, и, наконец, есть АТФазы, транспортирующие анионы.
Рисунок \ (\ PageIndex {17} \). Симпорт и Антипорт.Эти термины относятся только к направлению растворенных веществ внутрь или из клетки, но не к энергетике. В этом симпорте энергия, выделяемая в результате пассивного транспорта Na + в клетку, также используется для активного транспорта глюкозы внутрь. В примере с антипортом снова используется транспорт Na + , на этот раз для обеспечения энергией активного транспорта H + из клетки.
Гидролиз АТФ, являясь обычным источником энергии для многих биологических процессов, не является единственным источником энергии для транспорта.Активный перенос одного растворенного вещества против его градиента может быть связан с энергией от пассивного переноса другого растворенного вещества вниз по его градиенту. На рисунке \ (\ PageIndex {17} \) показаны два примера: хотя один — это симпорт (оба растворенных вещества пересекают мембрану в одном физическом направлении), а другой — антипорт (два растворенных вещества пересекают мембрану в противоположных физических направлениях), у них обоих одно растворенное вещество движется вниз по своему градиенту, а одно растворенное вещество движется вверх против градиента его концентрации.Так получилось, что мы использовали движение Na + как движущую силу в обоих этих примерах. Фактически, градиент Na + через мембрану является чрезвычайно важным источником энергии для большинства клеток животных. Однако это не универсально для всех клеток или даже для всех эукариотических клеток. В большинстве растительных клеток и одноклеточных организмов градиент H + (протон) играет ту же роль, что и Na + у животных.
Ацетилхолиновые рецепторы (AchR), которые обнаруживаются в некоторых нейронах и мышечных клетках в нервно-мышечных соединениях, представляют собой ионные каналы, управляемые лигандами.Когда нейротрансмиттер (ацетилхолин) или агонист, такой как никотин (для рецепторов никотинового типа) или мускарин (для рецепторов мускаринового типа), связывается с рецептором, он открывает канал, который позволяет потоку небольших катионов, в первую очередь Na + и K + , разумеется, в противоположных направлениях. Прилив Na + намного сильнее и приводит к начальной деполяризации мембраны, которая либо инициирует потенциал действия в нейроне, либо в мышцах, инициирует сокращение.
Транспорт через клеточную мембрану
Облегченный транспорт
Облегченная диффузия — это процесс, при котором молекулы транспортируются через плазматическую мембрану с помощью мембранных белков.
Цели обучения
Объясните, почему и как происходит пассивный перенос
Основные выводы
Ключевые моменты
- Существует градиент концентрации, который позволяет ионам и полярным молекулам диффундировать в клетку, но эти материалы отталкиваются гидрофобными частями клеточной мембраны.
- Облегченная диффузия использует интегральные мембранные белки для перемещения полярных или заряженных веществ через гидрофобные области мембраны.
- Канальные белки могут способствовать облегченной диффузии веществ за счет образования гидрофильного прохода через плазматическую мембрану, через который могут проходить полярные и заряженные вещества.
- Канальные белки могут быть открыты в любое время, постоянно позволяя определенному веществу проникать в клетку или выходить из нее, в зависимости от градиента концентрации; или они могут быть закрыты и могут быть открыты только определенным биологическим сигналом.
- Белки-носители способствуют облегчению диффузии, связывая определенное вещество, а затем изменяя свою форму, чтобы доставить это вещество в клетку или из нее.
Ключевые термины
- облегчает диффузию : спонтанный проход молекул или ионов через биологическую мембрану, проходящих через определенные трансмембранные интегральные белки.
- мембранный белок : белки, которые прикреплены или связаны с мембраной клетки или органеллы.
Облегченный транспорт
Облегченный транспорт — это вид пассивного транспорта. В отличие от простой диффузии, когда материалы проходят через мембрану без помощи белков, при облегченном транспорте, также называемом облегченной диффузией, материалы диффундируют через плазматическую мембрану с помощью мембранных белков. Существует градиент концентрации, который позволяет этим материалам диффундировать в клетку без затрат клеточной энергии. Однако эти материалы представляют собой ионы или полярные молекулы, которые отталкиваются гидрофобными частями клеточной мембраны.Облегченные транспортные белки защищают эти материалы от силы отталкивания мембраны, позволяя им диффундировать в клетку.
Транспортируемый материал сначала прикрепляется к рецепторам белка или гликопротеина на внешней поверхности плазматической мембраны. Это позволяет удалить материал, необходимый клетке, из внеклеточной жидкости. Затем вещества передаются определенным интегральным белкам, которые облегчают их прохождение. Некоторые из этих интегральных белков представляют собой совокупность бета-складчатых листов, которые образуют канал через фосфолипидный бислой.Другие являются белками-переносчиками, которые связываются с веществом и способствуют его диффузии через мембрану.
Каналы
Интегральные белки, участвующие в облегченном транспорте, вместе называются транспортными белками; они функционируют либо как каналы для материала, либо как носители. В обоих случаях это трансмембранные белки. Каналы специфичны для транспортируемого вещества. Белки каналов имеют гидрофильные домены, открытые для внутриклеточной и внеклеточной жидкости; они дополнительно имеют гидрофильный канал через их ядро, который обеспечивает гидратированное отверстие через слои мембраны.Прохождение через канал позволяет полярным соединениям избегать неполярного центрального слоя плазматической мембраны, который в противном случае замедлит или предотвратит их проникновение в клетку. Аквапорины — это канальные белки, которые позволяют воде проходить через мембрану с очень высокой скоростью.
Канальные белки в облегченной транспортировке : Упрощенная транспортировка перемещает вещества вниз по градиенту их концентрации. Они могут пересекать плазматическую мембрану с помощью канальных белков.
Белки канала либо открыты все время, либо они «закрыты», что контролирует открытие канала.Присоединение определенного иона к белку канала может контролировать открытие, или могут быть задействованы другие механизмы или вещества. В некоторых тканях ионы натрия и хлора свободно проходят через открытые каналы, тогда как в других тканях необходимо открыть ворота для прохождения. Пример этого происходит в почках, где обе формы каналов находятся в разных частях почечных канальцев. Клетки, участвующие в передаче электрических импульсов, такие как нервные и мышечные клетки, имеют закрытые каналы для натрия, калия и кальция в своих мембранах.Открытие и закрытие этих каналов изменяет относительную концентрацию этих ионов на противоположных сторонах мембраны, что приводит к облегчению электрической передачи по мембранам (в случае нервных клеток) или к сокращению мышц (в случае мышечных клеток).
Белки-носители
Другой тип белка, встроенного в плазматическую мембрану, — это белок-носитель. Этот белок связывает вещество и при этом вызывает изменение его собственной формы, перемещая связанную молекулу из внешней части клетки в ее внутреннюю часть; в зависимости от градиента материал может двигаться в противоположном направлении.Белки-носители обычно специфичны для одного вещества. Это увеличивает общую селективность плазматической мембраны. Точный механизм изменения формы плохо изучен. Белки могут изменять форму, когда затрагиваются их водородные связи, но это не может полностью объяснить этот механизм. Каждый белок-носитель специфичен для одного вещества, и в любой мембране имеется конечное число этих белков. Это может вызвать проблемы с транспортировкой достаточного количества материала для правильного функционирования ячейки.
Белки-носители : Некоторые вещества способны перемещаться вниз по градиенту концентрации через плазматическую мембрану с помощью белков-носителей. Белки-носители изменяют форму, перемещая молекулы через мембрану.
Пример этого процесса происходит в почках. Глюкоза, вода, соли, ионы и аминокислоты, необходимые организму, фильтруются в одной части почек. Этот фильтрат, который включает глюкозу, затем реабсорбируется в другой части почек.Поскольку существует только конечное число белков-носителей для глюкозы, если глюкозы присутствует больше, чем белки могут обработать, избыток не переносится; выводится из организма с мочой. У диабетиков это описывается как «проливание глюкозы с мочой». Другая группа белков-носителей, называемых белками транспорта глюкозы, или GLUT, участвует в транспортировке глюкозы и других гексозных сахаров через плазматические мембраны внутри организма.
Канал и белки-носители транспортируют материал с разной скоростью.Белки каналов транспортируются намного быстрее, чем белки-носители. Белки каналов способствуют диффузии со скоростью десятков миллионов молекул в секунду, тогда как белки-носители работают со скоростью от тысячи до миллиона молекул в секунду.
Основной активный транспорт
Натрий-калиевый насос поддерживает электрохимический градиент живых клеток, перемещая натрий внутрь и калий из клетки.
Цели обучения
Опишите, как клетка перемещает натрий и калий из клетки и внутрь клетки против своего электрохимического градиента.
Основные выводы
Ключевые моменты
- Натрий-калиевый насос перемещает K + в ячейку, перемещая Na + в соотношении три Na + на каждые два иона K +.
- Когда фермент натрий-калий-АТФаза направляется внутрь клетки, он имеет высокое сродство к ионам натрия и связывает три из них, гидролизуя АТФ и меняя форму.
- По мере того как фермент меняет форму, он переориентируется по направлению к внешней стороне клетки, и высвобождаются три иона натрия.
- Новая форма фермента позволяет двум калиям связываться и фосфатной группе отделяться, а белок-носитель перемещается внутрь клетки.
- Фермент снова меняет форму, высвобождая ионы калия в клетку.
- После того, как калий попадает в клетку, фермент связывает три иона натрия, что снова запускает процесс.
Ключевые термины
- электрогенный насос : ионный насос, который генерирует чистый поток заряда в результате своей работы.
- Na + -K + АТФаза : фермент, расположенный в плазматической мембране всех клеток животных, который выкачивает натрий из клеток, перекачивая калий в клетки.
Основной активный транспорт
Первичный активный транспорт, который функционирует с активным транспортом натрия и калия, позволяет осуществлять вторичный активный транспорт.Вторичный транспортный метод по-прежнему считается активным, поскольку он зависит от использования энергии, как и первичный транспорт.
Активный транспорт натрия и калия : Первичный активный транспорт перемещает ионы через мембрану, создавая электрохимический градиент (электрогенный транспорт).
Одним из наиболее важных насосов в клетках животных является натриево-калиевый насос (Na + -K + АТФаза), который поддерживает электрохимический градиент (и правильные концентрации Na + и K + ). в живых клетках.Натрий-калиевый насос перемещает два K + в ячейку, одновременно перемещая три Na + из ячейки. Na + -K + АТФаза существует в двух формах, в зависимости от ее ориентации внутри или снаружи клетки и ее сродства к ионам натрия или калия. Процесс состоит из следующих шести шагов:
- Поскольку фермент ориентирован внутрь клетки, носитель имеет высокое сродство к ионам натрия. С белком связываются три иона натрия.
- АТФ гидролизуется белком-носителем, и к нему присоединяется низкоэнергетическая фосфатная группа.
- В результате носитель изменяет форму и переориентируется по направлению к внешней стороне мембраны. Сродство белка к натрию снижается, и три иона натрия покидают носитель.
- Изменение формы увеличивает сродство носителя к ионам калия, и два таких иона присоединяются к белку. Впоследствии низкоэнергетическая фосфатная группа отделяется от носителя.
- После удаления фосфатной группы и присоединения ионов калия белок-носитель перемещается внутрь клетки.
- Белок-носитель в своей новой конфигурации имеет пониженное сродство к калию, и два иона высвобождаются в цитоплазму. Теперь белок имеет более высокое сродство к ионам натрия, и процесс начинается снова.
В результате этого процесса произошло несколько событий. В этот момент снаружи клетки больше ионов натрия, чем внутри, и больше ионов калия внутри, чем снаружи. На каждые три выходящих иона натрия входят два иона калия.Это приводит к тому, что интерьер становится немного более негативным по сравнению с экстерьером. Эта разница в загрузке важна для создания условий, необходимых для вторичного процесса. Таким образом, натрий-калиевый насос является электрогенным насосом (насос, который создает дисбаланс заряда), создающий электрический дисбаланс на мембране и способствующий мембранному потенциалу.
АВС Транспортеры
Транспортеры
ABC представляют собой суперсемейство белков, которые все имеют АТФ-связывающую кассету и транспортируют вещества через мембраны.
Цели обучения
Обобщите функции трех основных категорий переносчиков ABC: у прокариот, у грамотрицательных бактерий и подгруппы белков ABC
Основные выводы
Ключевые моменты
- ABC-транспортеры используют энергию гидролиза АТФ для транспортировки субстратов через клеточные мембраны.
- Бактериальные переносчики ABC важны для жизнеспособности, вирулентности и патогенности клеток.
- Субстраты, которые можно транспортировать, включают ионы, аминокислоты, пептиды, сахара и другие молекулы, которые в основном являются гидрофильными.
Ключевые термины
- мембрана : гибкая, охватывающая или разделяющая ткань, образующая плоскость или пленку и разделяющая две среды (обычно в растении или животном).
- гидролиз : химический процесс разложения, включающий расщепление связи и добавление катиона водорода и аниона гидроксида воды.
- Домен АТФ-связывающей кассеты (ABC) : Семейство АТФ-связывающих кассет (ABC) представляет собой группу белков, которые связывают и гидролизуют АТФ, чтобы транспортировать вещества через клеточные мембраны.
АТФ-связывающих кассетных транспортеров (ABC-транспортеров) являются членами суперсемейства белков, которое является одним из самых крупных и древних семейств с представителями всех существующих типов от прокариот до человека.
Переносчики
ABC представляют собой трансмембранные белки, которые используют энергию гидролиза аденозинтрифосфата (АТФ) для выполнения определенных биологических процессов, включая перемещение различных субстратов через мембраны и процессы, не связанные с транспортом, такие как трансляция РНК и репарация ДНК.Они транспортируют широкий спектр субстратов через внеклеточные и внутриклеточные мембраны, включая продукты метаболизма, липиды и стерины, а также лекарства. Белки классифицируются как переносчики ABC на основании последовательности и организации их домена (ов) АТФ-связывающей кассеты (ABC).
транспортеров ABC участвуют в развитии устойчивости к опухолям, муковисцидозе и ряде других наследственных заболеваний человека, а также в развитии устойчивости к нескольким лекарственным средствам как у бактерий (прокариот), так и у эукариот (включая человека).Бактериальные переносчики ABC важны для жизнеспособности, вирулентности и патогенности клеток.
Транспортеры
ABC делятся на три основные функциональные категории. У прокариот импортеры опосредуют поглощение питательных веществ клеткой. Субстраты, которые можно транспортировать, включают ионы, аминокислоты, пептиды, сахара и другие молекулы, которые в основном являются гидрофильными. Перекрывающая мембрану область переносчика ABC защищает гидрофильные субстраты от липидов двухслойной мембраны, обеспечивая, таким образом, путь через клеточную мембрану.У грамотрицательных бактерий экспортеры транспортируют липиды и некоторые полисахариды из цитоплазмы в периплазму. У эукариот нет импортеров. Экспортеры или эффлюксеры, которые присутствуют как у прокариот, так и у эукариот, действуют как насосы, выталкивающие токсины и лекарства из клетки. Третья подгруппа белков ABC не функционирует как транспортеры, а скорее участвует в процессах трансляции и репарации ДНК.
Механизм транспортировки ABC : Предлагаемый механизм транспортировки для импортеров ABC.Эта модель с переменным доступом была основана на кристаллических структурах ModBC-A
.
В системах бактериального оттока определенные вещества, которые необходимо экструдировать из клетки, включают поверхностные компоненты бактериальной клетки (например, капсульные полисахариды, липополисахариды и тейхоевую кислоту), белки, участвующие в патогенезе бактерий (например, гемолиз, гем-связывающий белок и щелочная протеаза), гем, гидролитические ферменты, белки S-слоя, факторы компетентности, токсины, антибиотики, бактериоцины, пептидные антибиотики, лекарства и сидерофоры.Они также играют важную роль в биосинтетических путях, включая биосинтез внеклеточных полисахаридов и биогенез цитохрома.
Сидерофоры
Сидерофоры классифицируются по лигандам, которые они используют для хелатирования трехвалентного железа, включая катехолаты, гидроксаматы и карбоксилаты.
Цели обучения
Опишите функции и разновидности сидерофоров
Основные выводы
Ключевые моменты
- Сидерофоры важны для некоторых патогенных бактерий для приобретения ими железа.Многие сидерофоры представляют собой нерибосомные пептиды, хотя некоторые из них биосинтезируются независимо.
- Большое разнообразие сидерофоров может быть связано с эволюционным давлением, оказываемым на микробы, с образованием структурно различных сидерофоров, которые не могут переноситься специфическими активными транспортными системами других микробов, или в случае дезактивации патогенов организмом-хозяином.
- Микробы выделяют сидерофоры для удаления железа из этих минеральных фаз путем образования растворимых комплексов Fe3 +, которые могут быть поглощены активными транспортными механизмами.
Ключевые термины
- сидерофоры : Сидереофоры представляют собой небольшие хелатирующие соединения железа с высоким сродством, секретируемые микроорганизмами, такими как бактерии и грибы, а также травами. Сидерофоры являются одними из самых сильных известных растворимых связывающих Fe3 + агентов.
Железо необходимо почти для всех живых организмов, поскольку оно участвует в большом количестве важных метаболических процессов. Однако железо не всегда доступно; поэтому микроорганизмы используют различные системы поглощения железа, чтобы обеспечить достаточные запасы железа из своего окружения.Существуют значительные различия в диапазоне переносчиков железа и источников железа, используемых различными видами микробов. Патогенам, в частности, требуются эффективные механизмы усвоения железа, чтобы они могли успешно конкурировать за железо в среде тканей и жидкостей организма хозяина, в которых железо сильно ограничено.
Сидерофоры представляют собой небольшие хелатирующие соединения железа с высоким сродством, секретируемые такими микроорганизмами, как бактерии, грибы и травы. Сидерофоры являются одними из самых сильных известных растворимых связывающих агентов Fe 3+ .Железо необходимо почти для всей жизни из-за его жизненно важной роли в таких процессах, как дыхание и синтез ДНК. Однако, несмотря на то, что это один из самых распространенных элементов в земной коре, биодоступность железа во многих средах, таких как почва или море, ограничена очень низкой растворимостью иона Fe 3+ . Это ионное состояние является преобладающим для железа в водной, некислой, насыщенной кислородом среде и накапливается в обычных минеральных фазах, таких как оксиды и гидроксиды железа (минералы, которые отвечают за красный и желтый цвета почвы).Следовательно, он не может быть легко использован организмами. Микробы выделяют сидерофоры для поглощения железа из этих минеральных фаз за счет образования растворимых комплексов Fe 3+ , которые могут захватываться активными транспортными механизмами. Многие сидерофоры представляют собой нерибосомные пептиды, хотя некоторые из них биосинтезируются независимо.
Сидерофоры являются одними из самых сильных из известных связующих с Fe 3+ , причем энтеробактин является одним из самых сильных из них. Благодаря этому свойству они привлекли интерес медицинской науки к металлохелатной терапии, при этом сидерофор десфериоксамин B получил широкое распространение при лечении отравлений железом и талассемии.
Синтез энтеробактина : Энтеробактин (также известный как энтерохелин) является сидерофором с высоким сродством, который приобретает железо для микробных систем. В первую очередь он содержится в грамотрицательных бактериях, таких как кишечная палочка и сальмонелла тифимуриум.
Железо прочно связано с белками, такими как гемоглобин, трансферрин, лактоферрин и ферритин. Чтобы получить этот металл, патогенные бактерии подвергаются огромному эволюционному давлению. Например, возбудитель сибирской язвы Bacillus anthracis выделяет два сидерофоров, бациллибактин и петробактин, для удаления трехвалентного железа из белков железа.Хотя было показано, что бациллибактин связывается с белком иммунной системы сидерокалином, предполагается, что петробактин ускользает от иммунной системы и, как было показано, важен для вирулентности у мышей.
Помимо сидерофоров, некоторые патогенные бактерии продуцируют гемофоров (связывающие гем белки, поглощающие белок) или имеют рецепторы, которые связываются непосредственно с железом / гемовыми белками. У эукариот другими стратегиями повышения растворимости и поглощения железа являются подкисление окружающей среды (например, используется корнями растений) или внеклеточное восстановление Fe 3+ до более растворимых ионов Fe 2+ .
Сидерофоры обычно образуют стабильный гексадентатный октаэдрический комплекс с Fe 3+ , предпочтительно по сравнению с другими встречающимися в природе многочисленными ионами металлов, хотя, если имеется менее шести донорных атомов, вода также может координироваться. Наиболее эффективными сидерофорами являются те, которые имеют три бидентатных лиганда на молекулу, образующие гексадентатный комплекс и вызывающие меньшее изменение энтропии, чем вызванное хелатированием одного иона трехвалентного железа с отдельными лигандами.
Сидерофоры обычно классифицируются по лигандам, используемым для хелатирования трехвалентного железа.Основные группы сидерофоров включают катехолаты (феноляты), гидроксаматы и карбоксилаты (например, производные лимонной кислоты). Лимонная кислота также может действовать как сидерофор. Большое разнообразие сидерофоров может быть связано с эволюционным давлением, оказываемым на микробы, с образованием структурно различных сидерофоров, которые не могут переноситься специфическими активными транспортными системами других микробов, или в случае дезактивации патогенов организмом-хозяином.
Групповое перемещение
Групповая транслокация — это путь экспорта или секреции белка, обнаруживаемый у растений, бактерий и архей.
Цели обучения
Вспомните следующие типы транспортных систем: групповая транслокация PEP и путь TAT
Основные выводы
Ключевые моменты
- PEP известен как многокомпонентная система, которая всегда включает ферменты плазматической мембраны и ферменты цитоплазмы. Пример этого транспорта обнаружен в клетках E. coli.
- Путь Tat представляет собой путь экспорта белка или путь секреции, который служит для активного перемещения свернутых белков через бислой липидной мембраны.
- Системы секретирования белков через внешнюю бактериальную мембрану могут быть довольно сложными и играть ключевую роль в патогенезе.
Ключевые термины
- фосфотрансферазная система : отдельный метод, используемый бактериями для поглощения сахара, где источником энергии является фосфоенолпируват (PEP).
- Путь Tat : Путь экспорта или секреции белка, обнаруженный у растений, бактерий и архей.
За некоторыми исключениями, у бактерий отсутствуют мембраносвязанные органеллы, как у эукариот, но они могут собирать белки на различных типах включений, таких как газовые везикулы и накопительные гранулы.Бактерии могут иметь единственную плазматическую мембрану (грамположительные бактерии) или внутреннюю мембрану плюс внешнюю мембрану, разделенную периплазмой (грамотрицательные бактерии). Белки могут быть включены в плазматическую мембрану. Они также могут быть захвачены либо в периплазме, либо секретироваться в окружающую среду, в зависимости от наличия внешней мембраны. Основной механизм на плазматической мембране аналогичен эукариотическому. Кроме того, бактерии могут нацеливать белки внутрь или через внешнюю мембрану.Системы секретирования белков через внешнюю бактериальную мембрану могут быть довольно сложными. Системы играют ключевую роль в патогенезе. Эти системы могут быть описаны как секреция типа I, секреция типа II и т. Д. У большинства грамположительных бактерий определенные белки нацелены на экспорт через плазматическую мембрану и последующее ковалентное прикрепление к стенке бактериальной клетки.
Специализированный фермент, сортаза, расщепляет целевой белок в характерном сайте узнавания рядом с С-концом белка, таком как мотив LPXTG (где X может быть любой аминокислотой), а затем переносит белок на клеточную стенку.Обнаружено несколько аналогичных систем, которые также имеют сигнатурный мотив на внецитоплазматической поверхности, С-концевой трансмембранный домен и кластер основных остатков на цитозольной поверхности на крайнем С-конце белка. Система PEP-CTERM / экзосортаза, обнаруженная у многих грамотрицательных бактерий, по-видимому, связана с производством внеклеточного полимерного вещества. Система PGF-CTERM / archaeosortase A у архей связана с продукцией S-слоя. Система GlyGly-CTERM / ромбосортаза, обнаруженная у Shewanella, Vibrio и некоторых других родов, по-видимому, участвует в высвобождении протеаз, нуклеаз и других ферментов.
Транслокация группы
PEP, также известная как система фосфотрансфераз или PTS, представляет собой отдельный метод, используемый бактериями для поглощения сахара, где источником энергии является фосфоенолпируват (PEP). Он известен как многокомпонентная система, в которой всегда задействованы ферменты плазматической мембраны и ферменты цитоплазмы. Пример этого транспорта обнаружен в клетках E. coli. Система была открыта Солом Роземаном в 1964 году.
Путь транслокации двойного аргинина (путь Tat) — это путь экспорта или секреции белка, обнаруженный у растений, бактерий и архей.В отличие от пути Sec, который транспортирует белки в развернутом виде, путь Tat служит для активного перемещения свернутых белков через бислой липидной мембраны. У бактерий транслоказа Tat находится в цитоплазматической мембране и служит для экспорта белков в клеточную оболочку или во внеклеточное пространство. У грамотрицательных бактерий транслоказа Tat состоит из трех основных мембранных белков: TatA, TatB и TatC. В наиболее широко изученном пути Tat, связанном с грамотрицательной бактерией Escherichia coli, эти три белка экспрессируются из оперона с четвертым белком Tat, TatD, который не требуется для функции Tat.Пятый белок Tat TatE, который гомологичен белку TatA, присутствует в клетке на гораздо более низком уровне, чем TatA. Считается, что он не играет какой-либо существенной роли в функции Tat.
Пути Tat у грамположительных бактерий отличаются тем, что они не содержат компонента TatB. У этих бактерий система Tat состоит из одного компонента TatA и TatC, при этом белок TatA является бифункциональным и выполняет роли как TatA, так и TatB E. coli. Не все бактерии несут в своем геноме гены tatABC.Однако среди тех, кто это делает, похоже, нет различия между патогенами и непатогенами. Несмотря на этот факт, некоторые патогенные бактерии, такие как Pseudomonas aeruginosa, Legionella pneumophila, Yersinia pseudotuberculosis и E. coli O157: H7, полагаются на функционирующий путь Tat для полной вирулентности в моделях инфекции. Кроме того, было показано, что ряд экспортируемых факторов вирулентности зависит от пути Tat. Одной из таких категорий факторов вирулентности являются ферменты фосфолипазы C, которые, как было показано, экспортируются Tat у Pseudomonas aeruginosa и считаются экспортируемыми Tat в Mycobacterium tuberculosis.
Pseudomonas aeruginosa : P. aeruginosa может расти в дизельном топливе и реактивном топливе, где он известен как микроорганизм, использующий углеводороды (или «жук HUM»), вызывая микробную коррозию. Он создает темные желтоватые маты, которые иногда неправильно называют «водорослями» из-за их внешнего вида.
Транспортные белки — обзор
2.3 Мембранные белки
Транспортные белки перемещают ионы и небольшие молекулы через мембрану, и существует большое количество подкатегорий для этого класса мембранных белков.Транспорт протонов играет важную роль в разнообразных биологических процессах, включая фотосинтез, ферментный катализ и кислотно-щелочную нейтрализацию. Протонная проводимость может происходить за счет образования ионов гидроксония. Это позволяет «избыточному» протону использовать сеть водородных связей молекул воды внутри канала для прохождения через клеточную мембрану. Перенос протона посредством образования иона гидроксония возможен из-за ограниченных условий внутри гидрофильной полости белка, которая преобразует сеть водородных связей воды в проволочную структуру, в отличие от структуры, наблюдаемой в объемной воде.Основное предположение при изучении транспорта протонов с помощью 2DIR заключается в том, что динамика белкового канала приводит к колебаниям частоты колебаний амида I, а также зависит от переноса протона (Ghosh, Qiu, DeGrado, & Hochstrasser, 2011 ; Лян, Янсен и Кнестер, 2011).
Янсен и его коллеги исследовали, что определяет форму линии полосы амида I, каналы транспорта протонов и степень, в которой сам транспорт протонов может быть исследован с помощью 2DIR (Liang, Knoester, & Jansen, 2012).Они изучили пептид грамицидин А, хорошо охарактеризованный прототип протонного канала. Грамицидин А обладает антибиотической активностью, которая возникает из-за повышенной проницаемости неорганических моновалентных катионов через мембраны бактериальных клеток. Это разрушает протонно-ионные градиенты между внутриклеточной и внеклеточной средами. Транспорт протонов в канале может происходить посредством одного из двух механизмов: прыжков протонов или переориентации воды. МД-моделирование и 2DIR-расчеты использовались для изучения транспорта протонов через канал.Силовое поле OLPS-AA использовалось вместе с методом эффекта Штарка для расчета частот сайтов амида I. Спектры 2DIR были рассчитаны из гамильтониана с использованием схемы NISE (Jansen & Knoester, 2006). Ставки в центре канала были примерно в пять раз выше, чем у входа в канал. Работа показала, что перенос протонов действительно изменяет динамику системы, за чем можно следить, отслеживая изменение во времени ширины антидиагональной линии и наклона спектра.В измеренном изотопе, помеченном 2DIR-спектром, зависящие от положения скорости переноса протонов размыты из-за действующих механизмов, включая вращение воды в канале и прыжки протонов.
Частоты локальных сайтов амида I чувствительны к прыжкам протонов в пределах примерно 10 Å. Моделирование показало, что ступень ограничения скорости, по-видимому, представляет собой протон, входящий в канал. Протон легко уходит из канала обратно в объем, но имеет низкую вероятность попадания в канал из объемной области.Таким образом, только при низком pH протон будет оставаться внутри канала в течение значительного количества времени, и при исследовании транспорта протонов в мембранных белках 2DIR будет чувствительным только при низком pH. Поступление протонов в канал, по-видимому, является значительным узким местом в транспорте протонов и представляет собой интересную область для будущих исследований. Другие системы, включающие перенос протонов, такие как семейства ферментов, кристаллы конденсированной фазы, углеродные нанотрубки и электролитные мембраны топливных элементов, также изучаются. Комбинация моделирования МД и моделирования спектра 2DIR представляет собой многообещающий инструмент для изучения транспорта протонов в этих системах.
Работа Knoester и его коллег показала, что измерение ширины линии спектра как функции времени ожидания может быть использовано в качестве экспериментального инструмента для определения скорости межмолекулярного транспорта протонов в биологических каналах (Liang et al., 2011). Они обнаружили, что скорость изменения ширины антидиагональной линии во времени не равна скорости прыжков протона. Напротив, это определяется сложным взаимодействием между скоростью прыжков протонов, скоростью переориентации воды и скоростью диффузии воды.Следовательно, для определения локальной скорости перескока протонов необходимо сравнение с теорией. Их модель показала взаимосвязь между спектральным поведением и фактической скоростью переноса протонов, которая должна быть проверена более совершенными методами, основанными на модели переноса протонов. Их метод строго применим только к четвертому остатку грамицидина А, для которого он был параметризован, хотя ожидается, что основной вклад в частотные колебания возникает из-за электрических полей, генерируемых протоном и водой, а вклад конкретного участка должен быть незначительным.Метод должен быть применим к другим белкам, участвующим в транспорте протонов.
Токмаков и его коллеги изучили мембранные белки, которые участвуют в переносе ионов вместо протонов (Ganim, Tokmakoff, & Vaziri, 2011). Недавние эксперименты с фотосинтетическими центрами (Engel et al., 2007) показывают, что неклассические явления, такие как когерентная передача возбуждения, могут происходить в белковых комплексах в определенных временных, пространственных и энергетических масштабах. Хотя было проведено большое количество теоретических и экспериментальных работ, особенно в отношении фотосинтетической системы, остаются вопросы относительно того, происходят ли наблюдаемые явления в других системах.В частности, ограничивается ли квантовая когерентность или туннелирование процессами с участием электронов или они также участвуют в гораздо более крупных частицах, таких как ионы? Наблюдение квантовых эффектов могло бы пролить новый свет на фундаментальные принципы функционирования этих систем.
Ионный канал калия — один из наиболее изученных классов ионных каналов. Кристаллография и молекулярное моделирование предложили несколько моделей селективности и высокой скорости переноса. В настоящее время предпочтительной моделью ионной селективности является модель «плотного прилегания» (Noskov & Roux, 2006).МД-моделирование проводилось на канальном белке, и полученные траектории использовались для расчета 2DIR-спектров (Ghosh et al., 2011). В то время это был самый крупный белок, для которого были рассчитаны моделируемые 2DIR-спектры. Предварительная работа с нонактином и валиномицином в сочетании с калием показала сужение спектральной линии из-за повышенной жесткости из-за координации ионов. Такое же сужение линии наблюдается для самого ионного канала, когда канал содержит калий. Изменения интенсивности может быть достаточно, чтобы дифференцировать связывание калия.Наряду с жесткостью, вызванной связыванием калия, произошел сдвиг частот осцилляторов, координирующих калий. В белке нативного канала этот сдвиг трудно обнаружить. Маркировка изотопов может выделить эти изменения и дать разностные сигналы для идентификации переключения. В этой работе сделан вывод, что электростатические изменения являются основной причиной наблюдаемых флуктуаций колебательного спектра. Локальные изменения, такие как вращение карбонильных групп, вносят меньший вклад в наблюдаемые различия в спектре, чем электростатические изменения, вызванные движением иона калия.
TooT-T: отличия транспортных белков от нетранспортных белков | BMC Bioinformatics
Обзор
Мы предлагаем классификатор ансамбля, который объединяет результаты, полученные с помощью двух различных методов, а именно передачи аннотаций гомологии и машинного обучения, для обнаружения белков-переносчиков. Во-первых, с учетом запрашиваемого белка Q выполняется традиционный поиск гомологии в базе данных классификации транспортеров (TCDB) с использованием BLAST. Запрос прогнозируется как переносчик, если попадание обнаружено с использованием трех заранее определенных наборов пороговых значений.Все три прогноза передаются в ансамбль. Затем вычисляются три варианта характеристик пси-состава — psiAAC, psiPAAC и psiPseAAC, которые вводятся в соответствующие обученные модели SVM, последующие прогнозы передаются ансамблю. Наконец, обученная метамодель ансамбля предсказывает конечный класс как транспортер T или нетранспортер NT . На рисунке 1 представлен обзор этапов прогнозирования. Подробное описание каждого шага представлено в следующих разделах.
Рис. 1
Набор данных
Тот же набор данных эталонного тестирования, который используется большинством предикторов транспортеров, таких как TrSSP [6], SCMMTP [7], Li et al. [8] и Ou et al. [9], был использован для построения этой системы.
Этот набор данных сравнительного анализа предоставлен Mishra et al. (доступно по адресу http://bioinfo.noble.org/TrSSP/?dowhat=Datasets) взят из базы данных Swiss-Prot. Набор данных первоначально содержал 10780 белков-транспортеров, носителей и каналов, которые были хорошо охарактеризованы на уровне белка и имели четкие аннотации к субстрату.Затем Mishra et al. удалил переносчики с более чем двумя субстратными специфичностями, последовательности с аннотациями биологических функций, основанными исключительно на схожести последовательностей, и последовательности с более чем 70% сходством. Окончательный набор данных Mishra et al. содержал в общей сложности 1560 последовательностей, разделенных на обучающие и тестовые наборы, как показано в таблице 1.
Композиции повторного выравнивания, зависящие от позиции
PSI-BLAST [11] (3 итерации, пороговое значение e-value 0.001) для поиска гомологичных последовательностей был проведен поиск по образцу последовательности белка с использованием модифицированной версии базы данных Swiss-Prot (выпуск 2018_6). В модифицированной базе данных Swiss-Prot нет точных совпадений тестовых последовательностей. Области в последовательностях совпадений базы данных, которые не были выровнены с белком запроса, отбрасывались. Белок запроса (Q) и выровненные области его совпадений ( h 1 , h 2 , …, h n ) затем использовались для вычисления повторяющихся с учетом позиции аминокислотный состав (psiAAC), парный аминокислотный состав (psiPAAC) и псевдо-аминокислотный состав (psiPseAAC) следующим образом:
Итерированный аминокислотный состав, специфичный для позиции (psiAAC)
AAC запрашиваемого белка (Q) и каждого его отфильтрованных совпадений ( h 1 , h 2 ,…, h n ) были рассчитаны отдельно как доли всех 20 природных аминокислот и как:
$$ c_ {i} = \ frac {F_ {i}} {L} \ qquad i = (1,2,3 ,…20) $$
(1)
, где F i — частота аминокислоты i t h , а L — длина последовательности. AAC представлен как вектор размером 20:
$$ AAC (P_ {x}) \, = \, \ left [c_ {1}, c_ {2}, c_ {3}, …, c_ {20} \ right] \ qquad x \ in (Q, h_ {1}, h_ {2} \ dots, h_ {n}) $$
(2)
, где c i — состав i t h аминокислоты.Среднее значение индивидуальных композиций AAC представляет собой psiAAC для Q и рассчитывается как:
$$ {\ begin {align} {AAC} _ {psi} (Q) & = \ frac {1} {n + 1} \ sum {AAC (P_ {x})} \\ & \ qquad x \ in (Q, h_ {1}, h_ {2} \ dots, h_ {n}) \ end {align}} $$
(3)
Позиционно-зависимая итерированная аминокислотная композиция (psiPAAC)
Аналогичным образом индивидуальные дескрипторы PAAC для запрашиваемого белка (Q) и каждого из его отфильтрованных совпадений ( h 1 , h 2 ,…, h n ) рассчитывались как
$$ d_ {i, j} = \ frac {F_ {i, j}} {L-1} \ qquad i, j = (1,2,3 ,…20) $$
(4)
, где F i , j — частота i t h и j t h пара аминокислот (ди-аминокислота ) и L — длина последовательности. Как и AAC, PAAC представлен в виде вектора размером 400 следующим образом:
$$ {\ begin {align} PAAC (P_ {x}) & = \ left [d_ {1,1}, d_ {1,2}, d_ {1,3} ,…, d_ {20,20} \ right] \ qquad \\ & x \ in (Q, h_ {1}, h_ {2} \ dots, h_ {n}) \ end {align}} $$
(5)
, где d i , j — дипептидный состав аминокислоты i t h и j t h . Среднее значение индивидуальных композиций PAAC представляет собой psiPAAC для Q и рассчитывается как:
$$ {\ begin {align} {PAAC} _ {psi} (Q) & = \ frac {1} {n + 1} \ sum {PAAC (P_ {x})} \\ & \ qquad x \ in (Q, h_ {1}, h_ {2} \ dots, h_ {n}) \ end {align}} $$
(6)
Позиционно-зависимая итерированная псевдоаминокислотная композиция (psiPseAAC)
PseAAC представляет собой комбинацию 20 компонентов стандартной аминокислотной композиции и набора факторов корреляции порядка последовательностей, которые включают определенные биохимические свойства, первоначально предложенные Чоу [12] . {2} } {20}}} $$
(10)
, где H 1∘ ( R i ) — исходное значение гидрофобности для аминокислоты R i , взятой из Танфорда [13]; H 2∘ ( R i ) и M ∘ ( R i ) преобразованы в H 2 ( R
) ) и M ( R i ) таким же образом.Исходное значение гидрофильности H 2∘ ( R i ) для аминокислоты R i было взято из Hopp and Woods [14]. Массу M ( R i ) боковой цепи аминокислоты R i можно получить из любого учебника биохимии. PseAAC представлен в виде вектора размером (20+ λ ) следующим образом:
$$ {\ begin {align} PseAAC (P_ {x}) & = \ left [s_ {1} ,.{\ lambda} \ theta_ {j}} & 20
(12)
, где f i — нормализованная частота встречаемости i-й аминокислоты в последовательности белка, θ j — j t h Коэффициент корреляции порядка последовательности , вычисленный из уравнения 8, и ω является весовым коэффициентом для эффекта порядка последовательности.Весовой коэффициент ω увеличивает вес дополнительных компонентов PseAAC по сравнению с традиционными компонентами AAC. Пользователь может выбрать любое значение от 0,05 до 0,7 весового коэффициента. Значение по умолчанию, данное Чжоу [12] — 05.
Среднее значение отдельных композиций PseAAC представляет psiPseAAC для Q и рассчитывается следующим образом:
$$ {\ begin {align} {PseAAC} _ {psi} (Q) & = \ frac {1} {n + 1} \ sum {PseAAC (P_ {x})} \\ & \ qquad x \ in (Q, h_ {1}, h_ {2} \ dots, h_ {n}) \ end {align}} $$
(13)
Машина опорных векторов
SVM — это мощный инструмент машинного обучения, который используется во многих инструментах биологического прогнозирования, таких как [6] и [9].Мы использовали SVM с ядром RBF, как это реализовано библиотекой R e1071 версии 1.6-8. Наилучшая комбинация параметров C и γ была определена с использованием метода поиска по сетке.
Перенос аннотации по гомологии
В отличие от дискретного представления образца белка в пси-композициях, здесь образец белка был представлен его аминокислотной последовательностью и использовался в инструменте поиска на основе сходства (BLAST) для поиска похожих совпадений в TCDB [15]. TCDB использует систему классификации, одобренную Международным союзом биохимии и молекулярной биологии (IUBMB) для белков мембранного транспорта, известную как система классификации транспортеров (TC).TCDB — это тщательно подобранная база данных точных и экспериментально охарактеризованных транспортеров из более чем 10 000 опубликованных ссылок. Если поиск BLAST произвел попадание, предполагается, что запрос является транспортером. Поскольку применяемые пороги играют важную роль в качестве прогноза, использовались разные пороги, как показано в таблице 2.
Таблица 2 Различные пороги взрыва в TCDB
Классификатор ансамбля
Мы применили ансамблевую технику, известную как суммированное обобщение или суммирование [16], для разработки TooT-T.Вместо того, чтобы комбинировать прогнозы от нескольких предикторов с помощью простой функции (например, голосования), стекирование обучает новую модель выполнять агрегирование.
Структура стекирования включает два уровня обучения. Первый уровень содержит базовых классификаторов , которые обучаются непосредственно на основе данных обучения. Второй уровень содержит мета-классификатор , который обучается с использованием прогнозов из базовых классификаторов. Обучающие экземпляры мета-классификатора были созданы при выполнении перекрестной проверки.Алгоритм 1 иллюстрирует, как генерируется обучающий набор данных метаклассификатора [17].
Когда новый белок запроса вводится в TooT-T, класс запроса прогнозируется шестью базовыми классификаторами: три из моделей SVM, которые используют функции psiAAC, psiPAAC и psiPseAAC соответственно, и три с использованием передачи аннотаций по гомологии с использованием различных пороги: TCDB_exact, TCDB_high и TCDB_med. Затем шесть прогнозов вводятся в мета-классификатор, который выводит окончательный прогноз.Машина повышения градиента (GBM), реализованная в пакете caret в R, использовалась для разработки мета-классификатора.
Оценка производительности
Производительность различных моделей оценивалась на обучающем наборе данных с использованием 10-кратной перекрестной проверки (10-CV), при которой обучающий набор данных был случайным образом разделен на десять наборов одинакового размера. Один набор был сохранен в качестве данных проверки, а оставшиеся девять наборов использовались для обучения соответствующей модели. Затем обученная модель была протестирована с использованием набора для проверки.Процесс перекрестной проверки повторялся десять раз, и каждый из наборов использовался один раз в качестве данных проверки. Производительность каждой модели была усреднена для получения единственной оценки. Поскольку 10-кратная производительность меняется в зависимости от различных случайных разбиений, и чтобы сделать оценку ошибки более стабильной, мы повторили 10-CV десять раз с разными случайными разбиениями, и различия производительности между запусками были зафиксированы путем вычисления стандартного отклонения. Сообщалось [18], что повторная версия стабилизирует оценку ошибки и, следовательно, уменьшает дисперсию оценки k-cv.В остальной части документа производительность перекрестной проверки представлена как m e a n ± s d из десяти различных прогонов 10-CV.
Кроме того, независимый набор данных также использовался для проведения тщательного оценочного эксперимента. Данные в независимом наборе данных не использовались в процессе обучения и полностью неизвестны нашим моделям. Для оценки эффективности использовались четыре основных показателя оценки: чувствительность, специфичность, точность и MCC.Чувствительность, которая вычисляет долю правильно идентифицированных позитивов (переносчиков).
$$ Чувствительность = \ frac {TP} {TP + FN} $$
(14)
Специфичность, измеряющая долю правильно идентифицированных нетранспортеров.
$$ Специфичность = \ frac {TN} {TN + FP} $$
(15)
Точность, которая относится к пропорции сделанных правильных прогнозов, деленной на общее количество прогнозов.
$$ Точность = \ frac {TP + TN} {TP + FN + TN + FP} $$
(16)
На MCC меньше влияют несбалансированные тесты, поскольку он учитывает истинные и ложные положительные и отрицательные результаты. Значения MCC находятся в диапазоне от 1 до -1, где 1 указывает на идеальное предсказание, 0 представляет не лучше, чем случайное, а -1 означает полное несоответствие между предсказанием и наблюдением. Более высокие значения MCC означают, что предиктор имеет высокую точность с положительными и отрицательными классами, а также меньшую степень ошибочной классификации с двумя классами.MCC считается лучшим единичным показателем оценки, когда данные несбалансированы [19–21].
$$ {{} \ begin {align} MCC = \ frac {(TP \ times TN — FP \ times FN)} {\ sqrt {(TP + FP) \ times (TP + FN) \ times (TN + FP) \ times (TN + FN)}} \ end {align}} $$
(17)
Мембранные белки | BioNinja
Понимание:
• Мембранные белки разнообразны по структуре, положению в мембране и функции
Фосфолипидные бислои залиты белками, которые могут быть постоянно или временно прикреплены к мембране
- Интегральные белки постоянно прикреплены к мембране и обычно являются трансмембранными (они охватывают бислой)
- Периферические белки временно присоединяются посредством нековалентных взаимодействий и связываются с одной поверхностью мембраны
Структура мембранных белков
Аминокислоты мембранного белка локализованы в соответствии с полярностью:
- Неполярные (гидрофобные ) аминокислоты непосредственно связаны с липидным бислоем
- Полярные (гидрофильные) аминокислоты расположены внутри и обращены к водным растворам
Трансмембранные белки обычно имеют одну из двух третичных структур:
- Одинарные спирали / спиральные пучки
- Бета-баррели ( общее в канале про teins)
Мембранные белковые структуры
Функции мембранных белков
Мембранные белки могут выполнять множество ключевых функций:
- J единиц — Служат для соединения и соединения двух клеток вместе
- E nzymes — Фиксация мембраны локализуют метаболические пути
- T ransport — отвечает за облегчение диффузии и активного транспорта
- R ecognition — Может функционировать как маркеры для клеточной идентификации
- A nchorage — точки прикрепления цитоскелета и внеклеточный матрикс
- T трансдукция — Функция как рецепторы для пептидных гормонов
Мнемоника: Jet Rat
Функции мембранного белка
.
