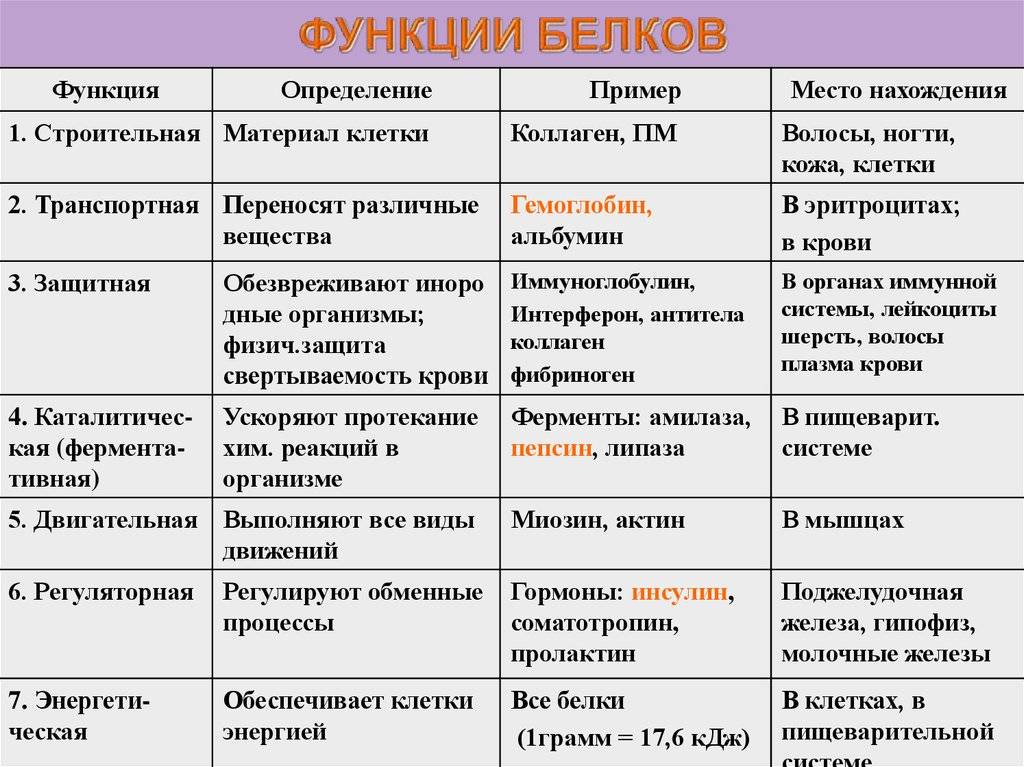
Где осуществляется двигательная функция белка: Таблица “Функции белков” (биология, 10 класс)
Где осуществляется строительная функция белков?
помогите написать доклат на тему теплокровные животные только небольшой)))
Чи можна отримати результати, корисні для боротьби з вірусом грипу, аналізуючи його філогенетичне дерево?
Помогите пожалуйста с биологией
Задача 1
Які з вказаних організмів екосистеми лісу відносять до продуцентів, первинних консументів, вторинних консумен
…
тів, редуцентів: 1.Бактерії гниття, 2. Лось, 3.Ялина, 4.Заєць, 5.Вовк, 6.Модрина, 7.Рись, 8.Береза, 9.Аскарида, 10.Білий гриб, 11. Щука, 12.Пеніцил
Продуценти:________________________________________________________
Первинні консументи:________________________________________________
Вторинні консументи: :_______________________________________________
Третинні консументи : ________________________________________________
Редуценти:__________________________________________________________
2. Біомаса сухого сіна з 1м2 поля становить 300г. На підставі правила екологічної піраміди визначте скільки гектарів поля необхідно, щоб прогодувати школяра масою 50кг (70% маси становить вода), згідно до харчового ланцюга: трава – корова – людина
Найдите признаки, характерные только для покрытосеменных растений.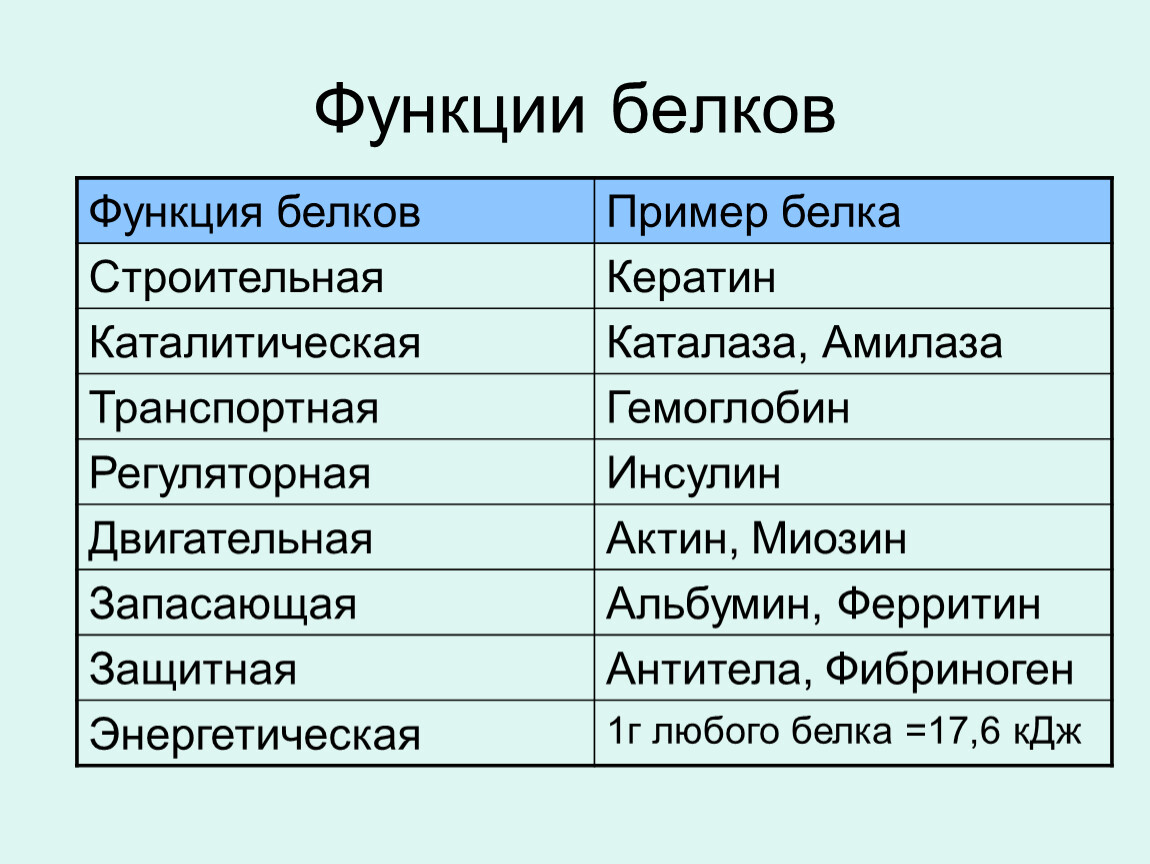
опыляются ветром, водой, животными (например, насекомыми)
опыляются только ветром
е
…
сть семя
двойное оплодотворение
есть корневая система
есть плод
есть цветок
Какие способы размножения растений относятся к вегетативному размножению покрытосеменных растений?
прививка
конъюгация
черенкование
споровое размножен
…
ие
жилкование
фотосинтез
Выберите организмы, которые могут размножаться спорами.
трутовик сосновый
папоротник кочедыжник
плаун булавовидный
василёк синий
лиственница обыкновен
…
ная
улотрикс
козья ива
мох сфагнум
К классу Однодольные относятся семейства:
Злаки
Розоцветные
Бобовые
Лилейные
Паслёновые
Крестоцветные
Сложноцветные
Неподвижные мужские гаметы (спермии) имеет:
Страусник
Тюльпан
Кукушкин лён
Сфагнум
памагите зделать до завтра
помогите пожалуйста
Выберите организмы, которые могут размножаться спорами.
трутовик сосновый
папоротник кочедыжник
плаун булавовидный
василёк синий
л
…
иственница обыкновенная
улотрикс
козья ива
мох сфагнум
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
Возможно, карта сайта Вам поможет.
-
Главная -
Университет-
Об университете -
Структура -
Нормативные документы и процедуры -
Лечебная деятельность -
Международное сотрудничество -
Пресс-центр-
Новости -
Анонсы -
События -
Объявления и поздравления -
Online конференции -
Фотоальбом-
Диалоговая площадка с председателем Гродненского областного Совета депутатов -
Праздничные городские мероприятия к Дню Победы -
Областной этап конкурса «Королева студенчества-2021″ -
Праздничный концерт к 9 мая 2021 -
IV Республиканский гражданско-патриотический марафон «Вместе – за сильную и процветающую Беларусь!» -
Университетский кубок КВН-2021 -
Музыкальная планета студенчества (завершение Дней ФИУ-2021) -
Молодёжный круглый стол «Мы разные, но мы вместе» -
Дни ФИУ-2021. Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
-
Неделя донорства в ГрГМУ -
Творческая гостиная. Дни ФИУ-2021 -
Открытие XVIII студенческого фестиваля национальных культур -
Передвижная мультимедийная выставка «Партизаны Беларуси» -
Республиканский субботник-2021 -
Семинар «Человек внутри себя» -
Международный конкурс «Здоровый образ жизни глазами разных поколений» -
Вручение нагрудного знака «Жена пограничника» -
Встреча с представителями медуниверситета г. Люблина -
Королева Студенчества ГрГМУ — 2021 -
День открытых дверей-2021 -
Управление личными финансами (встреча с представителями «БПС-Сбербанк») -
Весенний «Мелотрек» -
Праздничный концерт к 8 Марта -
Диалоговая площадка с председателем Гродненского облисполкома -
Расширенное заседание совета университета -
Гродно — Молодежная столица Республики Беларусь-2021 -
Торжественное собрание, приуроченное к Дню защитника Отечества -
Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты -
Новогодний ScienceQuiz -
Финал IV Турнира трех вузов ScienseQuiz -
Областной этап конкурса «Студент года-2020″ -
Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения» -
Студент года — 2020 -
День Знаний — 2020 -
Церемония награждения лауреатов Премии Правительства в области качества -
Военная присяга -
Выпускной лечебного факультета-2020 -
Выпускной медико-психологического факультета-2020 -
Выпускной педиатрического факультета-2020 -
Выпускной факультета иностранных учащихся-2020 -
Распределение — 2020 -
Стоп коронавирус! -
Навстречу весне — 2020 -
Профориентация — 18-я Международная специализированная выставка «Образование и карьера» -
Спартакиада среди сотрудников «Здоровье-2020″ -
Конференция «Актуальные проблемы медицины» -
Открытие общежития №4 -
Встреча Президента Беларуси со студентами и преподавателями медвузов -
Новогодний утренник в ГрГМУ -
XIX Республиканская студенческая конференция «Язык. Общество. Медицина»
Общество. Медицина»
-
Alma mater – любовь с первого курса -
Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике -
Областной этап «Студент года-2019″ -
Финал Science Qiuz -
Конференция «Актуальные проблемы психологии личности и социального взаимодействия» -
Посвящение в студенты ФИУ -
День Матери -
День открытых дверей — 2019 -
Визит в Азербайджанский медицинский университет -
Семинар-тренинг с международным участием «Современные аспекты сестринского образования» -
Осенний легкоатлетический кросс — 2019 -
40 лет педиатрическому факультету -
День Знаний — 2019 -
Посвящение в первокурсники -
Акция к Всемирному дню предотвращения суицида -
Турслет-2019 -
Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы -
День Независимости -
Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии» -
Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019 -
Выпускной медико-психологического факультета — 2019 -
Выпускной лечебного факультета — 2019 -
В добрый путь, выпускники! -
Распределение по профилям субординатуры -
Государственные экзамены -
Интеллектуальная игра «Что? Где? Когда?» -
Мистер и Мисс факультета иностранных учащихся-2019 -
День Победы -
IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава» -
Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!» -
Литературно-художественный марафон «На хвалях спадчыны маёй» -
День открытых дверей-2019 -
Их имена останутся в наших сердцах -
Областной этап конкурса «Королева Весна — 2019″ -
Королева Весна ГрГМУ — 2019 -
Профориентация «Абитуриент – 2019» (г. Барановичи)
Барановичи)
-
Мероприятие «Карьера начинается с образования!» (г. Лида) -
Итоговое распределение выпускников — 2019 -
«Навстречу весне — 2019″ -
Торжественная церемония, посвященная Дню защитника Отечества -
Торжественное собрание к Дню защитника Отечества — 2019 -
Мистер ГрГМУ — 2019 -
Предварительное распределение выпускников 2019 года -
Митинг-реквием у памятника воинам-интернационалистам -
Профориентация «Образование и карьера» (г.Минск) -
Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета -
Спартакиада «Здоровье — 2019» -
Итоговая научно-практическая конференция «Актуальные проблемы медицины».
-
Расширенное заседание Совета университета. -
Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы» -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
XVI съезд хирургов Республики Беларусь -
Итоговая практика -
Конкурс «Студент года-2018» -
Совет университета -
1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.) -
1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.) -
День знаний -
День независимости Республики Беларусь -
Церемония награждения победителей конкурса на соискание Премии СНГ -
День герба и флага Республики Беларусь -
«Стань донором – подари возможность жить» -
VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед» -
Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018» -
Окончательное распределение выпускников 2018 года -
Митинг-реквием, приуроченный к 75-летию хатынской трагедии -
Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год» -
Конкурсное шоу-представление «Мистер ГрГМУ-2018» -
Предварительное распределение выпускников 2018 года -
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
II Съезд учёных Республики Беларусь -
Круглый стол факультета иностранных учащихся -
«Молодежь мира: самобытность, солидарность, сотрудничество» -
Заседание выездной сессии Гродненского областного Совета депутатов -
Областной этап республиканского конкурса «Студент года-2017» -
Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым -
Конференция «Актуальные вопросы инфекционной патологии», 27. 10.2017
10.2017
-
XIX Всемирный фестиваль студентов и молодежи -
Республиканская научно-практическая конференция «II Гродненские аритмологические чтения» -
Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения» -
Праздник, посвящённый 889-летию города Гродно -
Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017) -
ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве -
1 сентября — День знаний -
Итоговая практика на кафедре военной и экстремальной медицины -
Квалификационный экзамен у врачей-интернов -
Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь -
Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем» -
День государственного флага и герба -
9 мая -
Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ» -
«Стань донором – подари возможность жить» -
«Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию -
Весенний кубок КВН «Юмор–это наука» -
Мисс ГрГМУ-2017 -
Распределение 2017 года -
Общегородской профориентационный день для учащихся гимназий, лицеев и школ -
Праздничный концерт, посвященный Дню 8 марта -
Конкурсное шоу-представление «Мистер ГрГМУ–2017» -
«Масленица-2017» -
Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества -
Лекция профессора, д. м.н. О.О. Руммо
м.н. О.О. Руммо
-
Итоговая научно-практическая конференция «Актуальные проблемы медицины» -
Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань -
Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ -
«Студент года-2016» -
Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ -
Конкурс первокурсников «Аlma mater – любовь с первого курса» -
День матери в ГрГМУ -
Итоговая практика-2016 -
День знаний -
Визит китайской делегации в ГрГМУ -
Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша) -
Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника -
Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию -
Республиканская университетская суббота-2016 -
Республиканская акция «Беларусь против табака» -
Встреча с поэтессой Яниной Бокий -
9 мая — День Победы -
Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь -
Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память» -
«Цветы Великой Победы» -
Концерт народного ансамбля польской песни и танца «Хабры» -
Суботнiк ў Мураванцы -
«Мисс ГрГМУ-2016» -
Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ» -
Визит иностранной делегации из Медицинского совета Мальдивской Республики -
«Кубок ректора Гродненского государственного медицинского университета по дзюдо» -
«Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь -
Распределение выпускников 2016 года -
Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ -
Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан -
Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ -
Состоялось открытие фотовыставки «По следам Библии» -
«Кубок декана» медико-диагностического факультета по скалолазанию -
Мистер ГрГМУ-2016 -
Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ -
Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года -
Визит Посла Республики Индия в УО «ГрГМУ» -
Торжественное собрание и концерт, посвященный Дню защитника Отечества -
Митинг-реквием, посвященный Дню памяти воинов-интернационалистов -
Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома -
Итоговая научно-практическая конференция Гродненского государственного медицинского университета -
Новогодний концерт -
Открытие профессорского консультативного центра -
Концерт-акция «Молодёжь против СПИДа» -
«Студент года-2015» -
Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича -
«Аlma mater – любовь с первого курса» -
Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб -
«Открытый Кубок по велоориентированию РЦФВиС» -
Совместное заседание Советов университетов г. Гродно
Гродно
-
Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко -
День города -
Дебаты «Врач — выбор жизни» -
День города -
Праздничный концерт «Для вас, первокурсники!» -
Акция «Наш год – наш выбор» -
День знаний -
Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет» -
Принятие военной присяги студентами ГрГМУ -
День Независимости Республики Беларусь -
Вручение дипломов выпускникам 2015 года -
Республиканская олимпиада студентов по педиатрии -
Открытие памятного знака в честь погибших защитников -
9 мая -
«Вторая белорусско-польская дерматологическая конференция: дерматология без границ» -
Мистер университет -
Мисс универитет -
КВН -
Гродненский государственный медицинский университет -
Чествование наших ветеранов -
1 Мая -
Cовместный субботник
-
-
Наши издания -
Медицинский календарь -
Университет в СМИ -
Видео-презентации
-
-
Общественные объединения -
Комиссия по противодействию коррупции -
Образовательная деятельность
-
-
Абитуриентам -
Студентам -
Выпускникам -
Слайдер -
Последние обновления -
Баннеры -
Иностранному гражданину -
Научная деятельность -
Поиск
Клеточная мембрана
Клеточная мембрана также называется плазматической (или цитоплазматической) мембраной и плазмалеммой.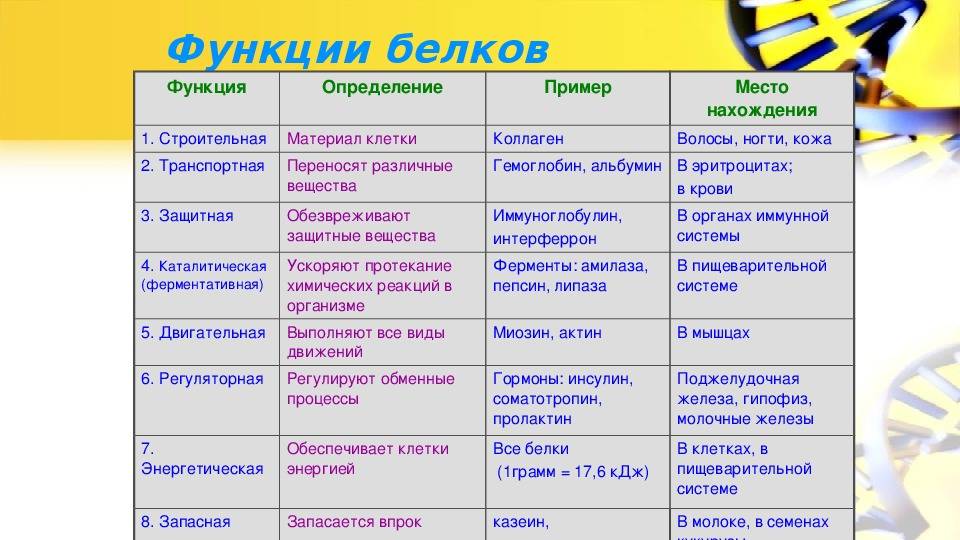 Данная структура не только отделяет внутреннее содержимое клетки от внешней среды, но также входит с состав большинства клеточных органелл и ядра, в свою очередь отделяя их от гиалоплазмы (цитозоля) — вязко-жидкой части цитоплазмы. Договоримся называть цитоплазматической мембраной ту, которая отделяет содержимое клетки от внешней среды. Остальными терминами обозначать все мембраны.
Данная структура не только отделяет внутреннее содержимое клетки от внешней среды, но также входит с состав большинства клеточных органелл и ядра, в свою очередь отделяя их от гиалоплазмы (цитозоля) — вязко-жидкой части цитоплазмы. Договоримся называть цитоплазматической мембраной ту, которая отделяет содержимое клетки от внешней среды. Остальными терминами обозначать все мембраны.
Строение клеточной мембраны
В основе строения клеточной (биологической) мембраны лежит двойной слой липидов (жиров). Формирование такого слоя связано с особенностями их молекул. Липиды не растворяются в воде, а по-своему в ней конденсируются. Одна часть отдельно взятой молекулы липида представляет собой полярную головку (она притягивается водой, т. е. гидрофильна), а другая — пару длинных неполярных хвостов (эта часть молекулы отталкивается от воды, т. е. гидрофобна). Такое строение молекул заставляет их «прятать» хвосты от воды и поворачивать к воде свои полярные головки.
В результате образуется двойной липидный слой, в котором неполярные хвосты находятся внутри (обращены друг к другу), а полярные головки обращены наружу (к внешней среде и цитоплазме). Поверхность такой мембраны гидрофильна, а внутри она гидрофобна.
Поверхность такой мембраны гидрофильна, а внутри она гидрофобна.
В клеточных мембранах среди липидов преобладают фосфолипиды (относятся к сложным липидам). Их головки содержат остаток фосфорной кислоты. Кроме фосфолипидов есть гликолипиды (липиды + углеводы) и холестерол (относится к стеролам). Последний придает мембране жесткость, размещаясь в ее толще между хвостами остальных липидов (холестерол полностью гидрофобный).
За счет электростатического взаимодействия, к заряженным головкам липидов присоединяются некоторые молекулы белков, которые становятся поверхностными мембранными белками. Другие белки взаимодействуют с неполярными хвостами, частично погружаются в двойной слой или пронизывают его насквозь.
Таким образом, клеточная мембрана состоит из двойного слоя липидов, поверхностных (периферических), погруженных (полуинтегральных) и пронизывающих (интегральных) белков. Кроме того, некоторые белки и липиды с внешней стороны мембраны связаны с углеводными цепями.
Это жидкостно-мозаичная модель строения мембраны была выдвинута в 70-х годах XX века. До этого предполагалась бутербродная модель строения, согласно которой липидный бислой находится внутри, а с внутренней и наружной стороны мембрана покрыта сплошными слоями поверхностных белков. Однако накопление экспериментальных данных опровергло эту гипотезу.
Толщина мембран у разных клеток составляет около 8 нм. Мембраны (даже разные стороны одной) отличаются между собой по процентному соотношению различных видов липидов, белков, ферментативной активности и др. Какие-то мембраны более жидкие и более проницаемые, другие более плотные.
Разрывы клеточной мембраны легко сливаются из-за физико-химических особенностей липидного бислоя. В плоскости мембраны липиды и белки (если только они не закреплены цитоскелетом) перемещаются.
Функции клеточной мембраны
Большинство погруженных в клеточную мембрану белков выполняют ферментативную функцию (являются ферментами). Часто (особенно в мембранах органоидов клетки) ферменты располагаются в определенной последовательности так, что продукты реакции, катализируемые одним ферментом, переходят ко второму, затем третьему и т. д. Образуется конвейер, который стабилизируют поверхностные белки, т. к. не дают ферментам плавать вдоль липидного бислоя.
Часто (особенно в мембранах органоидов клетки) ферменты располагаются в определенной последовательности так, что продукты реакции, катализируемые одним ферментом, переходят ко второму, затем третьему и т. д. Образуется конвейер, который стабилизируют поверхностные белки, т. к. не дают ферментам плавать вдоль липидного бислоя.
Клеточная мембрана выполняет отграничивающую (барьерную) от окружающей среды и в то же время транспортную функции. Можно сказать, это ее самое главное назначение. Цитоплазматическая мембрана, обладая прочностью и избирательной проницаемостью, поддерживает постоянство внутреннего состава клетки (ее гомеостаз и целостность).
При этом транспорт веществ происходит различными способами. Транспорт по градиенту концентрации предполагает передвижение веществ из области с их большей концентрацией в область с меньшей (диффузия). Так, например, диффундируют газы (CO2, O2).
Бывает также транспорт против градиента концентрации, но с затратой энергии.
Транспорт бывает пассивным и облегченным (когда ему помогает какой-нибудь переносчик). Пассивная диффузия через клеточную мембрану возможна для жирорастворимых веществ.
Есть особые белки, делающие мембраны проницаемыми для сахаров и других водорастворимых веществ. Такие переносчики соединяются с транспортируемыми молекулами и протаскивают их через мембрану. Так переносится глюкоза внутрь эритроцитов.
Пронизывающие белки, объединяясь, могут образовывать пору для перемещения некоторых веществ через мембрану. Такие переносчики не перемещаются, а образуют в мембране канал и работают аналогично ферментам, связывая определенное вещество. Перенос осуществляется благодаря изменению конформации белка, благодаря чему в мембране образуются каналы. Пример — натрий-калиевый насос.
Транспортная функция клеточной мембраны эукариот также реализуется за счет эндоцитоза (и экзоцитоза). Благодаря этим механизмам в клетку (и из нее) попадают крупные молекулы биополимеров, даже целые клетки.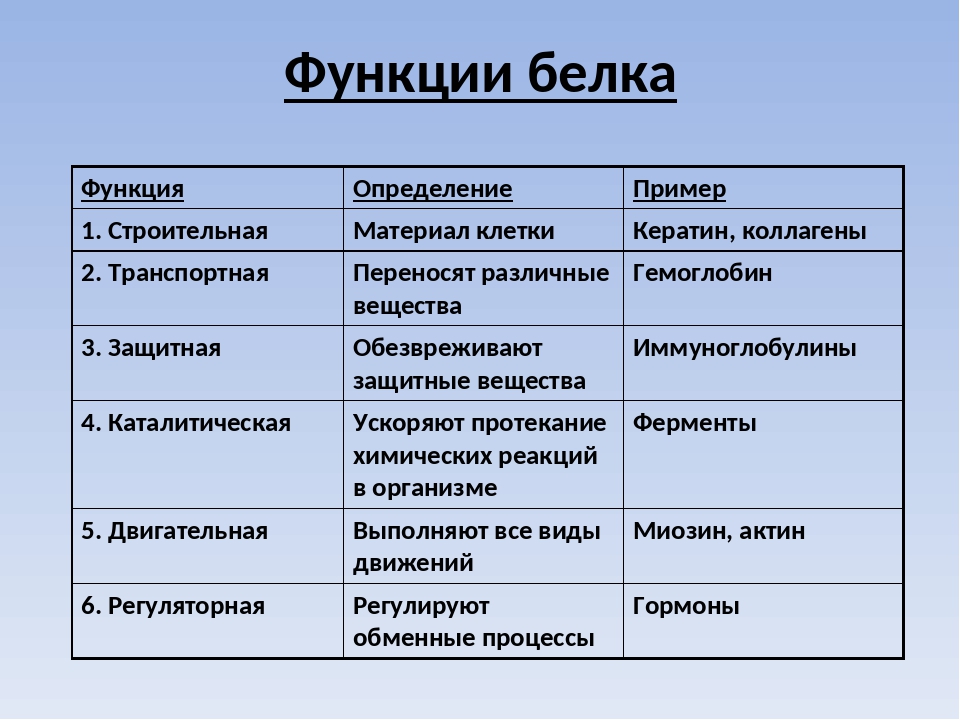 Эндо- и экзоцитоз характерны не для всех клеток эукариот (у прокариот его вообще нет). Так эндоцитоз наблюдается у простейших и низших беспозвоночны; у млекопитающих лейкоциты и макрофаги поглощают вредные вещества и бактерии, т. е. эндоцитоз выполняет защитную функцию для организма.
Эндо- и экзоцитоз характерны не для всех клеток эукариот (у прокариот его вообще нет). Так эндоцитоз наблюдается у простейших и низших беспозвоночны; у млекопитающих лейкоциты и макрофаги поглощают вредные вещества и бактерии, т. е. эндоцитоз выполняет защитную функцию для организма.
Эндоцитоз делится на фагоцитоз (цитоплазма обволакивает крупные частицы) и пиноцитоз (захват капелек жидкости с растворенными в ней веществами). Механизм этих процессов приблизительно одинаков. Поглощаемые вещества на поверхности клеток окружаются мембраной. Образуется пузырек (фагоцитарный или пиноцитарный), который затем перемещается внутрь клетки.
Экзоцитоз — это выведение цитоплазматической мембраной веществ из клетки (гормонов, полисахаридов, белков, жиров и др.). Данные вещества заключаются в мембранные пузырьки, которые подходят к клеточной мембране. Обе мембраны сливаются и содержимое оказывается за пределами клетки.
Цитоплазматическая мембрана выполняет рецепторную функцию. Для этого на ее внешней стороне располагаются структуры, способные распознавать химический или физический раздражитель. Часть пронизывающих плазмалемму белков с наружней стороны соединены с полисахаридными цепочками (образуя гликопротеиды). Это своеобразные молекулярные рецепторы, улавливающие гормоны. Когда конкретный гормон связывается со своим рецептором, то изменяет его структуру. Это в свою очередь запускает механизм клеточного ответа. При этом могут открываться каналы, и в клетку могут начать поступать определенные вещества или выводиться из нее.
Для этого на ее внешней стороне располагаются структуры, способные распознавать химический или физический раздражитель. Часть пронизывающих плазмалемму белков с наружней стороны соединены с полисахаридными цепочками (образуя гликопротеиды). Это своеобразные молекулярные рецепторы, улавливающие гормоны. Когда конкретный гормон связывается со своим рецептором, то изменяет его структуру. Это в свою очередь запускает механизм клеточного ответа. При этом могут открываться каналы, и в клетку могут начать поступать определенные вещества или выводиться из нее.
Рецепторная функция клеточных мембран хорошо изучена на основе действия гормона инсулина. При связывании инсулина с его рецептором-гликопротеидом происходит активация каталитической внутриклеточной части этого белка (фермента аденилатциклазы). Фермент синтезирует из АТФ циклическую АМФ. Уже она активирует или подавляет различные ферменты клеточного метаболизма.
Рецепторная функция цитоплазматической мембраны также включает распознавание соседних однотипных клеток. Такие клетки прикрепляются друг к другу различными межклеточными контактами.
Такие клетки прикрепляются друг к другу различными межклеточными контактами.
В тканях с помощью межклеточных контактов клетки могут обмениваться между собой информацией с помощью специально синтезируемых низкомолекулярных веществ. Одним из примеров подобного взаимодействия является контактное торможение, когда клетки прекращают рост, получив информацию, что свободное пространство занято.
Межклеточные контакты бывают простыми (мембраны разных клеток прилегают друг к другу), замковыми (впячивания мембраны одной клетки в другую), десмосомы (когда мембраны соединены пучками поперечных волокон, проникающих в цитоплазму). Кроме того, есть вариант межклеточных контактов за счет медиаторов (посредников) — синапсы. В них сигнал передается не только химическим, но и электрическим способом. Синапсами передаются сигналы между нервными клетками, а также от нервных к мышечным.
Источник:
http://biology.su/cytology/cell-membrane
Что такое клеточная мембрана
Клеточная стенка, если таковая у клетки имеется (обычно есть у растительных клеток), покрывает клеточную мембрану.
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7—8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Функции
- барьерная — обеспечивает регулируемый, избирательный, пассивный и активный обмен веществ с окружающей средой. Например, мембрана пероксисом защищает цитоплазму от опасных для клетки пероксидов. Избирательная проницаемость означает, что проницаемость мембраны для различных атомов или молекул зависит от их размеров, электрического заряда и химических свойств. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами.
- транспортная — через мембрану происходит транспорт веществ в клетку и из клетки. Транспорт через мембраны обеспечивает: доставку питательных веществ, удаление конечных продуктов обмена, секрецию различных веществ, создание ионных градиентов, поддержание в клетке оптимального pH и концентрации ионов, которые нужны для работы клеточных ферментов.
Частицы, по какой-либо причине неспособные пересечь фосфолипидный бислой (например, из-за гидрофильных свойств, так как мембрана внутри гидрофобна и не пропускает гидрофильные вещества, или из-за крупных размеров), но необходимые для клетки, могут проникнуть сквозь мембрану через специальные белки-переносчики (транспортеры) и белки-каналы или путем эндоцитоза.
При пассивном транспорте вещества пересекают липидный бислой без затрат энергии по градиенту концентрации путем диффузии. Вариантом этого механизма является облегчённая диффузия, при которой веществу помогает пройти через мембрану какая-либо специфическая молекула. У этой молекулы может быть канал, пропускающий вещества только одного типа.
Активный транспорт требует затрат энергии, так как происходит против градиента концентрации. На мембране существуют специальные белки-насосы, в том числе АТФаза, которая активно вкачивает в клетку ионы калия (K+) и выкачивают из неё ионы натрия (Na+). - матричная — обеспечивает определенное взаиморасположение и ориентацию мембранных белков, их оптимальное взаимодействие.
- механическая — обеспечивает автономность клетки, ее внутриклеточных структур, также соединение с другими клетками (в тканях). Большую роль в обеспечение механической функции имеют клеточные стенки, а у животных — межклеточное вещество.
- энергетическая — при фотосинтезе в хлоропластах и клеточном дыхании в митохондриях в их мембранах действуют системы переноса энергии, в которых также участвуют белки;
- рецепторная — некоторые белки, находящиеся в мембране, являются рецепторами (молекулами, при помощи которых клетка воспринимает те или иные сигналы).

Например, гормоны, циркулирующие в крови, действуют только на такие клетки-мишени, у которых есть соответствующие этим гормонам рецепторы. Нейромедиаторы (химические вещества, обеспечивающие проведение нервных импульсов) тоже связываются с особыми рецепторными белками клеток-мишеней. - ферментативная — мембранные белки нередко являются ферментами. Например, плазматические мембраны эпителиальных клеток кишечника содержат пищеварительные ферменты.
- осуществление генерации и проведения биопотенциалов.
С помощью мембраны в клетке поддерживается постоянная концентрация ионов: концентрация иона К+ внутри клетки значительно выше, чем снаружи, а концентрация Na+ значительно ниже, что очень важно, так как это обеспечивает поддержание разности потенциалов на мембране и генерацию нервного импульса. - маркировка клетки — на мембране есть антигены, действующие как маркеры — «ярлыки», позволяющие опознать клетку. Это гликопротеины (то есть белки с присоединенными к ним разветвленными олигосахаридными боковыми цепями), играющие роль «антенн».
 Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Это же позволяет иммунной системе распознавать чужеродные антигены.
Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Это же позволяет иммунной системе распознавать чужеродные антигены.
Структура и состав биомембран
Мембраны состоят из липидов трёх классов: фосфолипиды, гликолипиды и холестерол. Фосфолипиды и гликолипиды (липиды с присоединёнными к ним углеводами) состоят из двух длинных гидрофобных углеводородных «хвостов», которые связаны с заряженной гидрофильной «головой». Холестерол придаёт мембране жёсткость, занимая свободное пространство между гидрофобными хвостами липидов и не позволяя им изгибаться. Поэтому мембраны с малым содержанием холестерола более гибкие, а с большим — более жёсткие и хрупкие. Также холестерол служит «стопором», препятствующим перемещению полярных молекул из клетки и в клетку. Важную часть мембраны составляют белки, пронизывающие её и отвечающие за разнообразные свойства мембран. Их состав и ориентация в разных мембранах различаются.
Их состав и ориентация в разных мембранах различаются.
Клеточные мембраны часто асимметричны, то есть слои отличаются по составу липидов, переход отдельной молекулы из одного слоя в другой (так называемый флип-флоп) затруднён.
Мембранные органеллы
Это замкнутые одиночные или связанные друг с другом участки цитоплазмы, отделённые от гиалоплазмы мембранами. К одномембранным органеллам относятся эндоплазматическая сеть, аппарат Гольджи, лизосомы, вакуоли, пероксисомы; к двумембранным — ядро, митохондрии, пластиды. Строение мембран различных органелл отличается по составу липидов и мембранных белков.
Избирательная проницаемость
Клеточные мембраны обладают избирательной проницаемостью: через них медленно диффундируют глюкоза, аминокислоты, жирные кислоты, глицерол и ионы, причем сами мембраны в известной мере активно регулируют этот процесс — одни вещества пропускают, а другие нет. Существует четыре основных механизма для поступления веществ в клетку или вывода их из клетки наружу: диффузия, осмос, активный транспорт и экзо- или эндоцитоз. Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.
Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.
Избирательная проницаемость мембраны при пассивном транспорте обусловлена специальными каналами — интегральными белками. Они пронизывают мембрану насквозь, образовывая своего рода проход. Для элементов K, Na и Cl есть свои каналы. Относительно градиента концентрации молекулы этих элементов движутся в клетку и из неё. При раздражении каналы натриевых ионов раскрываются, и происходит резкое поступление в клетку ионов натрия. При этом происходит дисбаланс мембранного потенциала. После чего мембранный потенциал восстанавливается. Каналы калия всегда открыты, через них в клетку медленно попадают ионы калия.
Источник:
http://dic.academic.ru/dic.nsf/ruwiki/970083
Клеточная мембрана. Функции клеточной мембраны. Строение клеточной мембраны.
Содержание статьи
Клеточная мембрана
Клеточная мембрана или цитолемма или плазмалемма или плазматическая мембрана – эластическая молекулярная структура.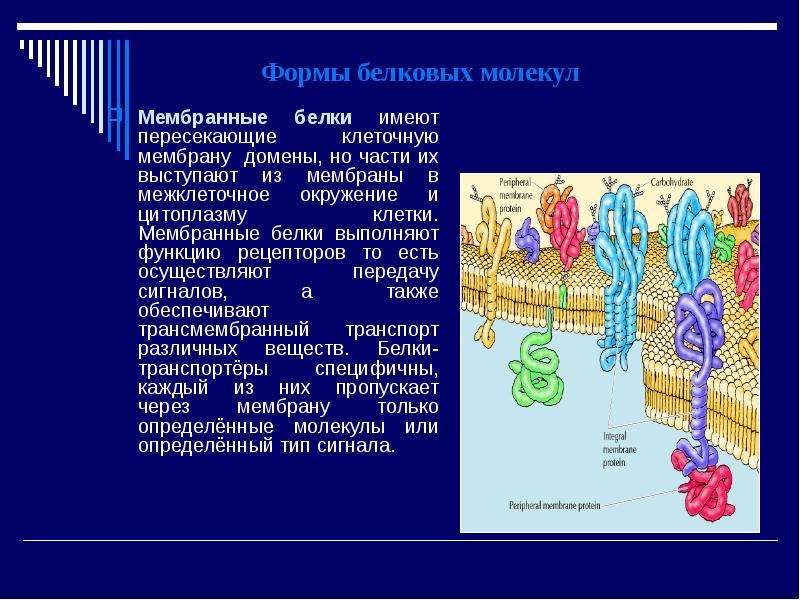 Её толщина составляет от 6 до 10 нм. Рассматривая строение клеточной мембраны, можно сказать, что она состоит из белков (около 40%) и липидов (около 60%).
Её толщина составляет от 6 до 10 нм. Рассматривая строение клеточной мембраны, можно сказать, что она состоит из белков (около 40%) и липидов (около 60%).
Функции клеточной мембраны
По функциональным особенностям клеточную мембрану можно разделить на 9 выполняемых ей функций.
Функции клеточной мембраны:
1. Транспортная. Производит транспорт веществ из клетки в клетку;
2. Барьерная. Обладает избирательной проницаемостью, обеспечивает необходимый обмен веществ;
3. Рецепторная. Некоторые белки находящиеся в мембране являются рецепторами;
4. Механическая. Обеспечивает автономность клетки и её механических структур;
5. Матричная. Обеспечивает оптимальное взаимодействие и ориентацию матричных белков;
6. Энергетическая. В мембранах действуют системы переноса энергии при клеточном дыхании в митохондриях;
7. Ферментативная. Мембранные белки иногда являются ферментами. Например мембраны клеток кишечника;
8. Маркировочная. На мембране есть антигены (гликопротеины), которые позволяют опознать клетку;
9. Генерирующая. Осуществляет генерацию и проведение биопотенциалов.
Генерирующая. Осуществляет генерацию и проведение биопотенциалов.
Посмотреть как выглядит клеточная мембрана можно на примере строения животной клетки или растительной клетки.
Cтроение клеточной мембраны
На рисунке приведено строение клеточной мембраны.
К компонентам клеточной мембраны можно отнести различные белки клеточной мембраны (глобулярный, переферический, поверхностный), а также липиды клеточной мембраны (гликолипид, фосфолипид). Таже в строении клеточной мембраны присутствуют углеводы, холестерол, гликопротеин и белковая альфа спираль.
Состав клеточной мембраны
К основному составу клеточной мембраны относятся:
1. Белки – отвечающие за разнообразные свойства мембраны;
2. Липиды трёх видов (фосфолипиды, гликолипиды и холестерол) отвечающих за жёсткость мембраны.
Белки клеточной мембраны:
1. Глобулярный белок;
2. Поверхностный белок;
3. Переферический белок.
Основное назначение клеточной мембраны
Основное назначение клеточной мембраны:
1. Регулировать обмен между клеткой и средой;
Регулировать обмен между клеткой и средой;
2. Отделять содержимое любой клетки от внешней среды тем самым обеспечивая её целостность;
3. Внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки – органеллы или компартменты, в которых поддерживаются определённые условия среды.
Структура клеточной мембраны
Структура клеточной мембраны представляют собой двумерный раствор глобулярных интегральных белков, растворенных в жидком фосфолипидном матриксе. Данная модель мембранной структуры была предложена двумя учёными Никольсоном и Сингером в 1972 году. Таким образом, основу мембран составляет бимолекулярный липидный слой, с упорядоченным расположением молекул, что вы могли видеть на этом рисунке.
Источник:
http://www.new-era.me/articles/kletochnaya-membrana-funkcii-stroenie.php
Мембрана строение функция
Мембрана строение функция
Основная структурная единица живого организма — клетка, являющаяся дифференцированным участком цитоплазмы, окружённым клеточной мембраной. Ввиду того что клетка выполняет множество важнейших функций, таких, как размножение, питание, движение, оболочка должна быть пластичной и плотной.
Ввиду того что клетка выполняет множество важнейших функций, таких, как размножение, питание, движение, оболочка должна быть пластичной и плотной.
История открытия и исследования клеточной мембраны
В 1925 году Гренделем и Гордером был поставлен успешный эксперимент по выявлению «теней|теней» эритроцитов, или пустых оболочек. Несмотря на несколько допущенных грубых ошибок, учёными было произведено открытие липидного бислоя. Их труды продолжили Даниэлли, Доусон в 1935 году, Робертсон в 1960 году. В результате многолетней работы и накопления аргументов в 1972 году Сингер и Николсон создали жидкостно-мозаичную модель строения мембраны. Дальнейшие опыты и исследования подтвердили труды учёных.
Что же представляет собой клеточная мембрана? Это слово стало использоваться более ста лет назад, в переводе с латинского оно означает «плёнка», «кожица». Так обозначают границу клетки, являющуюся естественным барьером между внутренним содержимым и внешней средой. Строение клеточной мембраны предполагает полупроницаемость, благодаря которой влага и питательные вещества и продукты распада свободно могут проходить сквозь неё. Эту оболочку можно назвать основной структурной составляющей организации клетки.
Эту оболочку можно назвать основной структурной составляющей организации клетки.
Рассмотрим основные функции клеточной мембраны
1. Разделяет внутреннее содержимое клетки и компоненты внешней среды|среды.
2. Способствует поддержанию постоянного химического состава клетки.
3. Регулирует правильный обмен веществ.
4. Обеспечивает взаимосвязь между клетками.
5. Распознает|Распознаёт сигналы.
6. Функция защиты.
Наружная клеточная мембрана, называемая также плазменной, представляет собой ультрамикроскопическую плёнку, толщина которой составляет от пяти до семи наномиллиметров. Она состоит преимущественно из белковых соединений, фосфолидов, воды|воды. Плёнка является эластичной, легко впитывает воду, а также стремительно восстанавливает свою целостность после повреждений.
Отличается универсальным строением. Эта мембрана занимает пограничное положение, участвует в процессе избирательной проницаемости, выведении продуктов распада, синтезирует их. Взаимосвязь с «соседями» и надёжная защита внутреннего содержимого от повреждения делает её важной составляющей в таком вопросе, как строение клетки. Клеточная мембрана животных организмов иногда оказывается покрытой тончайшим слоем – гликокаликсом, в состав которого входят белки|белки и полисахариды. Растительные клетки снаружи от мембраны защищены клеточной стенкой, выполняющей функции опоры и поддержания формы. Основной компонент её состава – это клетчатка (целлюлоза) – полисахарид, не растворимый в воде.
Взаимосвязь с «соседями» и надёжная защита внутреннего содержимого от повреждения делает её важной составляющей в таком вопросе, как строение клетки. Клеточная мембрана животных организмов иногда оказывается покрытой тончайшим слоем – гликокаликсом, в состав которого входят белки|белки и полисахариды. Растительные клетки снаружи от мембраны защищены клеточной стенкой, выполняющей функции опоры и поддержания формы. Основной компонент её состава – это клетчатка (целлюлоза) – полисахарид, не растворимый в воде.
Таким образом, наружная клеточная мембрана выполняет функцию восстановления, защиты и взаимодействия с другими клетками.
Строение клеточной мембраны
Толщина этой подвижной|подвижной оболочки варьируется в пределах от шести до десяти наномиллиметров. Клеточная мембрана клетки имеет особый состав, основой которого служит липидный бислой. Гидрофобные хвосты, инертные к воде, размещены с внутренней стороны|стороны, в то время как гидрофильные головки, взаимодействующие с водой, обращены наружу. Каждый липид представляет фосфолипид, который является результатом взаимодействия таких веществ, как глицерин и сфингозин. Липидный каркас тесно окружают белки|белки, которые расположены несплошным слоем. Некоторые из них погружены в липидный слой, остальные проходят сквозь него. В результате этого образуются проницаемые для воды|воды участки. Выполняемые этими белками|белками функции различны. Некоторые из них являются ферментами, остальные — транспортными белками|белками, которые переносят различные вещества из внешней среды|среды на цитоплазму и обратно.
Каждый липид представляет фосфолипид, который является результатом взаимодействия таких веществ, как глицерин и сфингозин. Липидный каркас тесно окружают белки|белки, которые расположены несплошным слоем. Некоторые из них погружены в липидный слой, остальные проходят сквозь него. В результате этого образуются проницаемые для воды|воды участки. Выполняемые этими белками|белками функции различны. Некоторые из них являются ферментами, остальные — транспортными белками|белками, которые переносят различные вещества из внешней среды|среды на цитоплазму и обратно.
Клеточная мембрана насквозь пронизана и тесно связана интегральными белками|белками, а с переферическими связь менее прочная. Эти белки|белки выполняют важную функцию, которая заключается в поддержании структуры мембраны, получении и преобразовании сигналов из окружающей среды|среды, транспорте веществ, катализации реакций, которые происходят на мембранах.
Состав
Основу клеточной мембраны представляет бимолекулярный слой. Благодаря его непрерывности клетка имеет барьерное и механическое свойства. На разных этапах жизнедеятельности данный бислой может нарушиться. Вследствие этого образуются структурные дефекты сквозных гидрофильных пор. В таком случае могут изменяться абсолютно всё|все функции такой составляющей, как клеточная мембрана. Ядро при этом может пострадать от внешних воздействий.
Благодаря его непрерывности клетка имеет барьерное и механическое свойства. На разных этапах жизнедеятельности данный бислой может нарушиться. Вследствие этого образуются структурные дефекты сквозных гидрофильных пор. В таком случае могут изменяться абсолютно всё|все функции такой составляющей, как клеточная мембрана. Ядро при этом может пострадать от внешних воздействий.
Свойства
Клеточная мембрана клетки имеет интересные особенности. Благодаря текучести эта оболочка не является жёсткой структурой, а основная часть белков и липидов, которые входят в её состав, свободно перемещается на плоскости мембраны.
В целом клеточная мембрана асимметрична, поэтому состав белковых и липидных слоёв различается. Плазматические мамбраны в животных клетках со своей наружной стороны|стороны имеют гликопротеиновый слой, который выполняет рецепторные и сигнальные функции, а также играет большую|большую роль в процессе объединения клеток в ткань. Клеточная мембрана является полярной, то есть на внешней стороне заряд положителен, а с внутренней стороны|стороны – отрицателен. Помимо всего перечисленного, оболочка клетки обладает избирательной проницательностью. Это означает, что кроме воды|воды в клетку пропускается только определённая группа молекул и ионов растворившихся веществ. Концентрация такого вещества, как натрий, в большинстве клеток значительно ниже, чем во внешней среде. Для ионов калия характерно другое соотношение: их количество в клетке намного выше, чем в окружающей среде. В связи с этим ионам натрия присуще стремление проникнуть в клеточную оболочку, а ионы калия стремятся освободиться наружу. При данных обстоятельствах мембрана активизирует особую систему, выполняющую «насосную» роль, выравнивая концентрацию веществ: ионы натрия откачиваются на поверхность клетки, а ионы калия накачиваются внутрь. Данная особенность входит в важнейшие функции клеточной мембраны.
Помимо всего перечисленного, оболочка клетки обладает избирательной проницательностью. Это означает, что кроме воды|воды в клетку пропускается только определённая группа молекул и ионов растворившихся веществ. Концентрация такого вещества, как натрий, в большинстве клеток значительно ниже, чем во внешней среде. Для ионов калия характерно другое соотношение: их количество в клетке намного выше, чем в окружающей среде. В связи с этим ионам натрия присуще стремление проникнуть в клеточную оболочку, а ионы калия стремятся освободиться наружу. При данных обстоятельствах мембрана активизирует особую систему, выполняющую «насосную» роль, выравнивая концентрацию веществ: ионы натрия откачиваются на поверхность клетки, а ионы калия накачиваются внутрь. Данная особенность входит в важнейшие функции клеточной мембраны.
Подобное стремление ионов натрия и калия переместиться внутрь с поверхности играет большую|большую роль в вопросе транспортировки сахара|сахара|сахара и аминокислот в клетку. В процессе активного удаления ионов натрия из клетки мембрана создаёт условия для новых поступлений глюкозы и аминокислот внутрь. Напротив, в процессе переноса ионов калия внутрь клетки пополняется число «транспортировщиков» продуктов распада изнутри клетки во внешнюю среду|среду.
В процессе активного удаления ионов натрия из клетки мембрана создаёт условия для новых поступлений глюкозы и аминокислот внутрь. Напротив, в процессе переноса ионов калия внутрь клетки пополняется число «транспортировщиков» продуктов распада изнутри клетки во внешнюю среду|среду.
Как происходит питание клетки через клеточную мембрану?
Многие клетки поглощают вещества посредством таких процессов, как фагоцитоз и пиноцитоз. При первом варианте гибкой наружной мембраной создаётся маленькое углубление, в котором оказывается захватываемая частица. Затем диаметр углубления становится больше, пока окружённая частица не попадёт в клеточную цитоплазму. Посредством фагоцитоза подпитываются некоторые простейшие, например амёбы, а также кровяные тельца|тельца — лейкоциты и фагоциты. Аналогичным образом клетки поглощают жидкость, которая содержит необходимые полезные вещества. Такое являние носит название пиноцитоз.
Наружная мембрана тесно соединена с эндоплазматической сетью клетки.
У многих типов основных составляющих ткани на поверхности мембраны расположены выступы, складки, микроворсинки. Растительные клетки снаружи этой оболочки покрыты ещё одной, толстой и отчётливо различимой в микроскоп. Клетчатка, из которой они состоят, помогает формировать опору тканям растительного происхождения, например, древесину. Клетки животных также обладают рядом внешних структур, которые находятся поверх клеточной мембраны. Они носят исключительно защитный характер, пример тому – хитин, содержащийся в покровных клетках насекомых.
Помимо клеточной, существует внутриклеточная мембрана. Её функция заключается в разделении клетки на несколько специализированных замкнутых отсеков – компартментов или органелл, где должна поддерживаться определённая среда.
Таким образом, невозможно переоценить роль такой составляющей основной единицы живого организма, как клеточная мембрана. Строение и функции предполагают значительное расширение общей площади поверхности клетки, улучшение обменных процессов.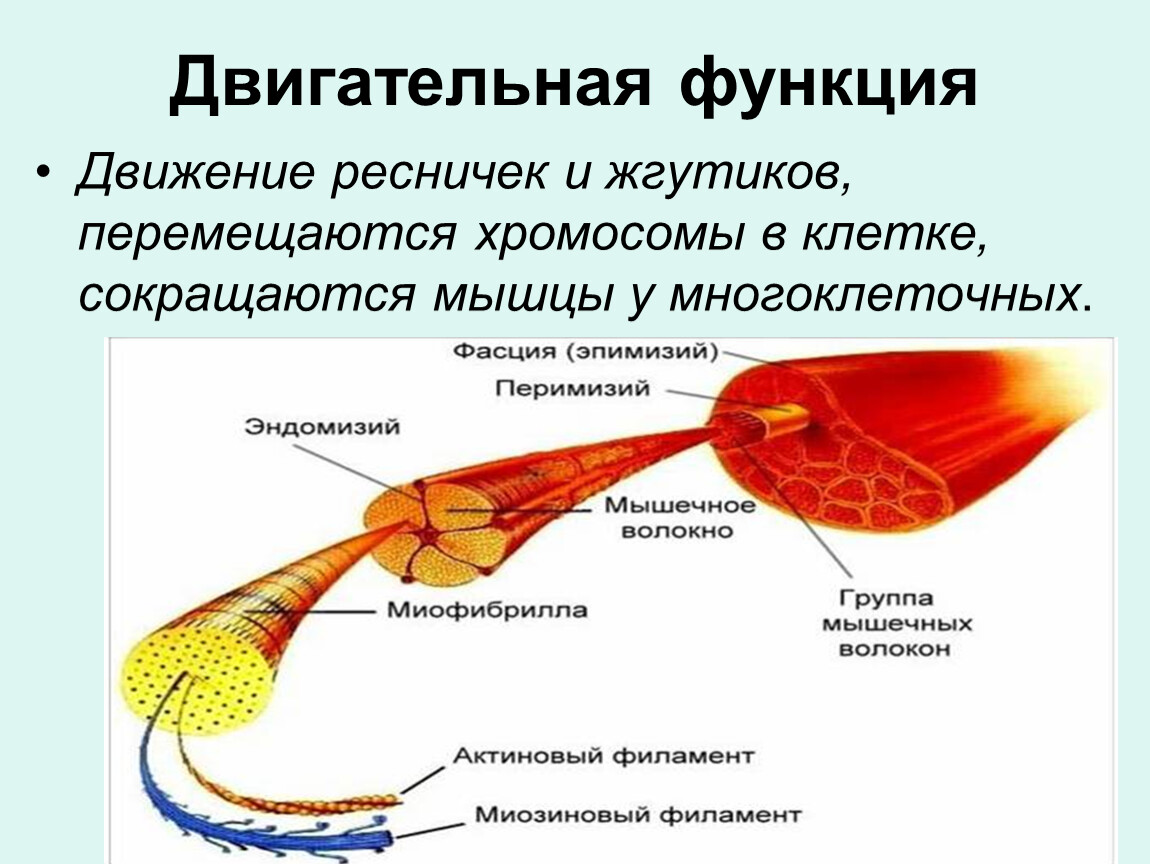 В состав этой молекулярной структуры входят белки|белки и липиды. Отделяя клетку от внешней среды|среды, мембрана обеспечивает её целостность. С её помощью межклеточные связи поддерживаются на достаточно крепком уровне, образовывая ткани. В связи с этим можно сделать вывод, что одну из важнейших ролей|ролей в клетке играет клеточная мембрана. Строение и функции, выполняемые ею, радикально отличаются в различных клетках, в зависимости от их предназначения. Посредством этих особенностей достигается разнообразие физиологической активности клеточных оболочек и их ролей|ролей в существовании клеток и тканей.
В состав этой молекулярной структуры входят белки|белки и липиды. Отделяя клетку от внешней среды|среды, мембрана обеспечивает её целостность. С её помощью межклеточные связи поддерживаются на достаточно крепком уровне, образовывая ткани. В связи с этим можно сделать вывод, что одну из важнейших ролей|ролей в клетке играет клеточная мембрана. Строение и функции, выполняемые ею, радикально отличаются в различных клетках, в зависимости от их предназначения. Посредством этих особенностей достигается разнообразие физиологической активности клеточных оболочек и их ролей|ролей в существовании клеток и тканей.
Мембрана строение функция
Природа создала множество организмов и клеток, но, несмотря на это, строение и большая|большая часть функций биологических мембран одинаковы, что позволяет рассматривать их структуру и изучать их ключевые свойства без привязанности к конкретному виду клеток.
Что такое мембрана?
Мембраны – это защитный элемент, который является неотъемлемой составляющей клетки любого живого организма.
Структурной и функциональной единицей всех живых организмов на планете является клетка. Жизнедеятельность её неразрывно связана с окружающей средой, с которой она обменивается энергией, информацией, веществом. Так, питательная энергия, необходимая для функционирования клетки, поступает извне и тратится на осуществление ею различных функций.
Структура простейшей единицы строения живого организма: мембрана клетки, ядро, органеллы, разнообразные включения. Она окружена мембраной, внутри которой располагается ядро и всё|все органеллы. Это митохондрии, лизосомы, рибосомы, аппарат Гольджи, эндоплазматический ретикулум. Каждый структурный элемент имеет свою мембрану.
Роль в жизнедеятельности клетки
Биологическая мембрана играет кульминационную роль в строении и функционировании элементарной живой системы. Только клетка, окружённая защитной оболочкой, по праву может называться организмом. Такой процесс, как обмен веществ, также осуществляется благодаря наличию мембраны. Если структурная целостность её нарушена, это приводит к изменению функционального состояния организма в целом.
Если структурная целостность её нарушена, это приводит к изменению функционального состояния организма в целом.
Клеточная мембрана и её функции
Она отделяет цитоплазму клетки от внешней среды|среды или от оболочки. Мембрана клетки обеспечивает должное выполнение специфических функций, специфику межклеточных контактов и иммунных проявлений, поддерживает трансмембранную разницу электрического потенциала. В ней имеются рецепторы, способные воспринимать химические сигналы – гормоны, медиаторы и другие биологические активные компоненты. Эти рецепторы наделяют её ещё одной способностью – изменять метаболическую активность клетки.
1. Активный перенос веществ.
2. Пассивный перенос веществ:
2.1. Диффузия простая.
2.2. Перенос через поры|поры.
2.3. Транспорт, осуществляемый за счёт диффузии переносчика вместе с мембранным веществом или посредством передачи по эстафете вещества по молекулярной цепи переносчика.
3. Перенос неэлектролитов благодаря простой и облегчённой диффузии.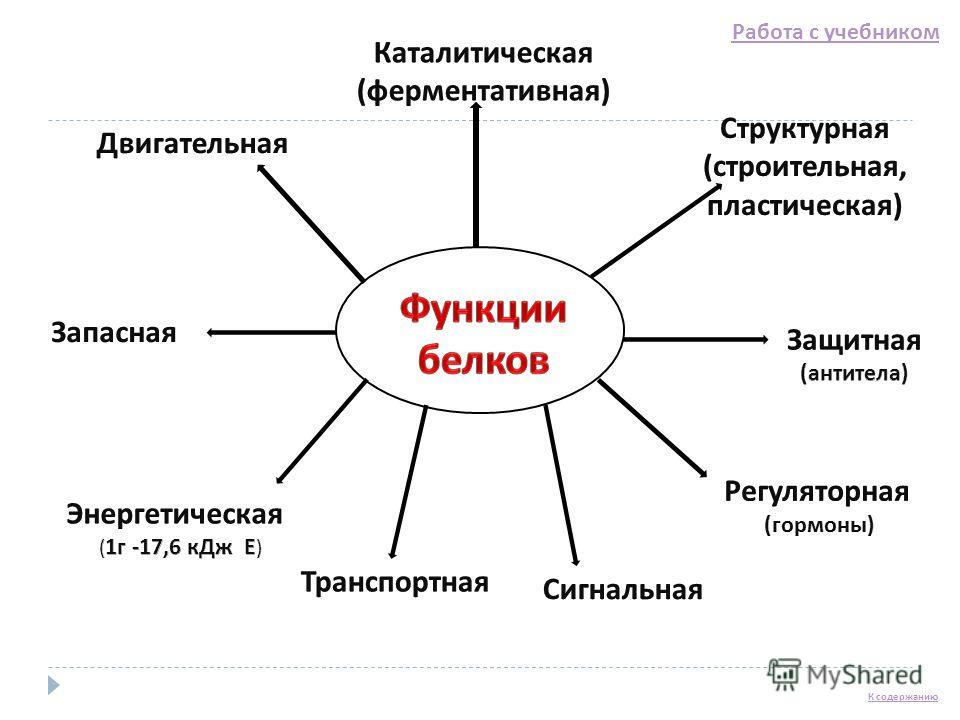
4. Активный транспорт ионов.
Строение мембраны клетки
Составляющие мембраны клетки – липиды и белки|белки.
Липиды: фосфолипиды, фосфатидилэтаноламин, сфингомиелин, фосфатидилинозит и фосфатидилсерин, гликолипиды. Доля липидов составляет 40-90 %.
Белки|Белки: периферические, интегральные (гликопротеины), спектрин, актин, цитоскелет.
Основной структурный элемент – двойной слой фосфолипидных молекул.
Кровельная мембрана: определение и типология
Немного статистики. На территории Российской Федерации мембрана в качестве кровельного материала используется не так уж и давно. Удельный вес мембранных кровель из общего числа|числа мягких перекрытий крыш составляет всего 1,5 %. Более широкое распространение в России получили битумные и мастичные кровли. А вот в Западной Европе на долю мембранных кровель приходится 87 %. Разница ощутимая.
Как правило, мембрана в роли основного материала при перекрытии крыши идеально подходит для плоских кровель. Для имеющих большой уклон она подходит в меньшей степени.
Объёмы производства и реализации мембранных кровель на отечественном рынке имеют положительную тенденцию роста|роста. Почему? Причины более чем ясны:
- Срок эксплуатации составляет около 60 лет. Представьте себе, только гарантийный срок использования, который устанавливается производителем, достигает 20 лет.
- Лёгкость в монтаже. Для сравнения: установка битумной кровли занимает в 1,5 раза больше времени, нежели монтаж мембранного перекрытия.
- Простота в обслуживании и проведении ремонтных работ.
Толщина кровельных мембран может составлять 0,8-2 мм, а средний показатель веса|веса одного метра квадратного равен 1,3 кг.
Свойства кровельных мембран:
Мембрана кровельная бывает трёх типов. Главный классификационный признак – вид полимерного материала, составляющего основание полотна|полотна. Итак, кровельные мембраны бывают:
Мембрана профилированная: характеристика, функции и преимущества
Профилированные мембраны – это инновация на строительном рынке. Такая мембрана эксплуатируется в качестве гидроизоляционного материала.
Вещество, используемое при изготовлении, – полиэтилен. Последний бывает двух типов: полиэтилен высокого давления (ПВД) и полиэтилен низкого давления (ПНД).
Техническая характеристика мембраны из ПВД и ПНД
Источник:
http://biologyinfo.ru/page/membrana-stroenie-funkcija/
СПАДИЛО.РУ
теория по биологии цитология
Теория для подготовки к блоку «Цитология»
Клеточная мембрана
Мембрана клетки = цитоплазматическая мембрана = плазматическая мембрана = плазмалемма
Образована двумя слоями фосфолипидов, которые имеют гидрофильные головки и гидрофобные хвосты. Головки расположены в сторону жидких сред: цитоплазма и внеклеточное вещество/ вещество окружающей среды, а хвосты – друг к другу. Так клеточная мембрана является достаточно плотной структурой, но в то же время пластичной и подвижной. Билипидный слой не дает содержимому клетки растекаться, а также препятствует проникновению внутрь клетки веществ, способных нанести ей вред.
Строение клеточной мембраны
Мембрана клеток частично проницаема. Это значит, что любое вещество не может в нее проникнуть, однако и закрытой ее назвать нельзя. Так как существуют константы гомеостаза (гомеостаз – постоянство внутренней среды), определяющие содержание веществ внутри клетки, то клетка выводит ненужные ей вещества и пропускает нужные. Для этого в клетках есть разные приспособления:
Белки-рецепторы для того, чтобы узнавать молекулы веществ, приближающихся к клетке.
Белки, образующие «тоннели» в клеточной мембране для пассивного тока воды и некоторых неорганических ионов.
Клеточная мембрана помимо выборочной проницаемости обладает свойством текучести. Для захвата пищевых частиц мембрана клетки впячивается, края этого участка мембраны как бы обнимают пищу. Потом края замыкаются и пища в пищевом пузырьке, который называется фагосомой, направляется в пищеварительную вакуоль, где специальные белки-ферменты расщепят пищу. Процесс захвата клеткой твердой пищи называется фагоцитозом. Если же клетка поглощает капельку, то процесс называется пиноцитозом, а пузырек, в котором капля транспортируется в вакуоль – везикулой. Когда клетка заканчивает свои пищеварительные процессы, то ей, как и многоклеточному сложному организму, нужно вывести наружу непереваренные остатки. Тогда происходит экзоцитоз (приставка «экзо-» означает наружу), процесс обратный фагоцитозу.
Мембрана клетки не представляет их себя непрерывную цепь липидов, она имеет включения в виде белков разных конфигураций. Они могут быть на поверхности мембраны, проходить сквозь нее, образовывать каналы, находиться в наружном или внутреннем слое липидов.
Во-первых, это отличительная черта эукариотических организмов. Ядро управляет процессами внутри клетки, а также хранит генетическую информацию, которая передается по наследству.
Мембрана ядра состоит из двух оболочек, пронизанных ядерными порами. Внешняя оболочка ядра шероховатая, она связана с эндоплазматической сетью клетки.
Строение ядра. * Ядерный сок = кариоплазма.
Через поры тРНК и иРНК выходят в цитоплазму клетки. Тем временем, пока клетка не делится, в ядре располагаются деспирализованные молекулы ДНК, или же хроматин. Хроматином называются молекулы ДНК, которые связаны с белками. В профазе митоза и в профазе первого деления мейоза хроматин спирализуется, то есть наматывается на специальные гистоновые белки как проволока на карандаш. В таком виде ДНК становится компактной. В интерфазе можно увидеть огромные политенные хромосомы. Они настолько большие, что их прекрасно можно рассмотреть и в обычный световой микроскоп, однако образуются такие хромосомы далеко не во всех клетках. 1 хромосома образована 1 молекулой ДНК. Хромосомы могут быть однохроматидными и двухроматидными. Как раз-таки двухроматидными, состоящими из 2х сестринских хроматид, хромосомы становятся после процесса репликации. В центре такие хромосомы соединены особой перетяжкой – центромерой. Каждая хроматида имеет по два плеча, они могут быть разной длины, а могут быть одинаковой. На концах хроматид располагаются теломеры. Интересный факт: старением организма связано с укорачиванием теломер с течением жизни.
Строение двухроматидной хромосомы
Внутрь клетки проникают неорганические ионы, АТФ, белки и ферменты и т.д. В ядре есть жидкая составляющая, как в клетке, кариоплазма. А в кариоплазме – ядрышки, в которых происходит синтез частей рибосом. В цитоплазме формируются целые рибосомы. В одном ядре могут находиться от 1 до 7 ядрышек, образованных близкими по отношению друг к другу петлями ДНК.
Обычно в клетках располагается одно ядро, но бывают и исключения: эритроциты в ходе созревания утрачивают свое ядро, а клетки мышечной ткани – миоциты, наоборот имеют много ядер.
Источник:
http://spadilo.ru/kletochnaya-membrana-i-yadro/
Что это такое Регуляторная функция белков. Энциклопедия
Пользователи также искали:
энергетическая функция белков,
ферментативная функция белков,
функции белков,
регуляторная функция белков примеры,
рецепторная функция белков,
сигнальная функция белков,
защитная функция белков,
функция,
белков,
энергетическая функция белков,
каталитическая функция белков,
функции белков,
сигнальная функция белков,
ферментативная функция белков,
защитная функция белков,
регуляторная,
рецепторная функция белков,
Регуляторная,
рецепторная,
энергетическая,
каталитическая,
функции,
сигнальная,
ферментативная,
защитная,
примеры,
Регуляторная функция белков,
регуляторная функция белков примеры,
регуляторная функция белков,
цитология. регуляторная функция белков,
Регуляторная функция белков — это… Что такое Регуляторная функция белков?
Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приёму и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают всё новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
- белки — рецепторы, воспринимающие сигнал
- сигнальные белки — гормоны и другие вещества, осуществляющие межклеточную сигнализацию (многие, хотя и далеко не все, из них является белками или пептидами)
- регуляторные белки, которые регулируют многие процессы внутри клеток.
Белки, участвующие в межклеточной сигнализации
Белки-гормоны (и другие белки, участвующие в межклеточной сигнализации) оказывают влияние на обмен веществ и другие физиологические процессы.
Гормоны — вещества, которые образуются в железах внутренней секреции, переносятся кровью и несут информационный сигнал. Гормоны распространяются безадресно и действуют только на те клетки, которые имеют подходящие белки-рецепторы. Гормоны связываются со специфическими рецепторами. Обычно гормоны регулируют медленных процессы, например, рост отдельных тканей и развитие организма, однако есть и исключения: например, адреналин (см. статью адреналин) — гормон стресса, производное аминокислот. Он выделяется при воздействии нервного импульса на мозговой слой надпочечников.При этом начинает чаще биться сердце, повышается кровяное давление и наступают другие ответные реакции. Также он действует на печень(расщепляет гликоген). Глюкоза выделяется в кровь, и ее используют мозг и мышцы как источник энергии.
Белки-рецепторы
К белкам с регуляторной функцией можно отнести также белки-рецепторы. Мембранные белки — рецепторы передают сигнал с поверхности клетки внутрь, преобразовывая его. Они регулируют функции клеток за счет связывания с лигандом, который «сел» на этот рецептор снаружи клетки; в результате активируется другой белок внутри клетки.
Большинство гормонов действуют на клетку, только если на ее мембране есть определенный рецептор — другой белок или гликопротеид. Например, β2- адренорецептор находится на мембране клеток печени. При стрессе молекула адреналина связывается с β2- адренорецептором и активирует его. Далее активированный рецептор активирует G-белок, который присоединяет ГТФ. После многих промежуточных этапов передачи сигнала происходит фосфоролиз гликогена. Рецептор осуществил самую первую операцию по передаче сигнала, ведущего к расщеплению гликогена. Без него не было бы последующих реакций внутри клетки.
Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
- взаимодействия с молекулами ДНК (транскрипционные факторы)
- при помощи фосфорилирования (протеинкиназы) или дефосфорилирования (протеинфосфатазы) других белков
- при помощи взаимодействия с рибосомой или молекулами РНК (факторы регуляции трансляции)
- воздействия на процесс удаления интронов (факторы регуляции сплайсинга)
- влияния на скорость распада других белков (убиквитины и др.)
Белки-регуляторы транскрипции
Транскрипционный фактор — это белок, который, попадая в ядро, регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция — синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг. Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфолирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки, которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главным механизмов регуляции большинства внутриклеточных процессов.
См. также
Ссылки
- [1] Контроль транскрипции
- [2] Белки против РНК — кто первым придумал сплайсинг?
- [3] Протеинкиназы
- [4] Трансляция и её регуляция
Литература
- Д.Тейлор, Н.Грин, У.Стаут. Биология (в 3-х томах).
Сигнальная функция
Сигнальная
функция белков —
способность белков служить сигнальными
веществами, передавая сигналы между
клетками, тканями, о́рганами и организмами.
Часто сигнальную функцию объединяют с
регуляторной, так как многие внутриклеточные
регуляторные белки тоже осуществляют
передачу сигналов.
Сигнальную
функцию выполняют белки-гормоны, цитокины, факторы
роста и
др.
Рецепторная
функция
Эта
функция заключается в избирательном
связывании гормонов, биологически
активных веществ и медиаторов на
поверхности мембран или внутри клеток.
Транспортная
функция
Только
белки осуществляют перенос веществ в
крови,
например, липопротеины (перенос
жира), гемоглобин (транспорт
кислорода), трансферрин (транспорт
железа). Белки транспортируют в крови
катионы кальция, магния, железа, меди и
другие ионы.Транспорт веществ через
мембраны осуществляют
белки — Na+,К+-АТ, Са2+-АТФаза , глюкозные
транспортеры.
Резервная
функция
В
качестве примера депонированного белка
можно привести производство и накопление
в яйце яичного
альбумина.
У
животных и человека таких специализированных
депо нет, но при длительном голодании
используются белки мышц,
лимфоидных органов, эпителиальных
тканей и печени.
Сократительная
функция
Существует
ряд внутриклеточных белков, предназначенных
для изменения формы клетки и движения
самой клетки или ее органелл
(тубулин, актин, миозин).
Защитная
функция
Защитную
функцию, предупреждая инфекционный
процесс и сохраняя устойчивость
организма, выполняют иммуноглобулины крови,
факторы системы комплемента, пропердин,
при повреждении тканей работают белки
свертывающей системы крови
— например, фибриноген, протромбин,
антигемофильный глобулин. Механическую защиту
и поддержку клеток осуществляют протеогликаны.
К
данной функции также можно отнести
поддержание постоянства коллоидно-осмотического
давления крови,
интерстиция и внутриклеточных пространств,
а также иные функции белков
крови.
Моторная (двигательная) функция
Миозин
— моторный белок
Целый
класс моторных
белков обеспечивает
движения организма, например, сокращение
мышц, в том числе локомоцию (миозин),
перемещение клеток внутри организма
(например, амебоидное движениелейкоцитов),
движение ресничек и жгутиков,
а также активный и направленный
внутриклеточный транспорт (кинезин, динеин).
Динеины и кинезины проводят транспортировку
молекул вдоль микротрубочек с
использованием гидролиза АТФ в
качестве источника энергии. Динеины
переносят молекулы и органоиды из
периферических частей клетки по
направлению к центросоме,
кинезины — в противоположном
направлении. Динеины также отвечают за
движение ресничек и жгутиков
эукариот. Цитоплазматические варианты
миозина могут принимать участие в
транспорте молекул и органоидов по
микрофиламентам.
Роль
белков в обмене веществ.
Обмен
Белков
Потребность
в белке определяется
минимальным количеством пищевого
белка, который будет уравновешивать
потери организмом азота, при сохранении
энергетического баланса. Белки находятся
в состоянии непрерывного обмена и
обновления. В организме здорового
взрослого человека количество распавшегося
за сутки белка равно количеству вновь
синтезированного. Животные существа
могут усваивать азот только в составе
аминокислот, поступающих в организм
с белками пищи. Десять аминокислот из
20 (валин, лейцин, изолейцин, лизин,
метионин, триптофан, треонин, фенилаланин,
аргинин и гистидин) в случае их
недостаточного поступления с пищей
не может быть синтезирована в организме.
Эти аминокислоты называют незаменимыми. Другие
десять аминокислот (заменимые) не менее
важны для жизнедеятельности, чем
незаменимые, но в случае недостаточного
поступления с пищей заменимых аминокислот
они могут синтезироваться в организме.
Важным фактором обмена белков организма
является повторное
использование (реутилизация) аминокислот,
образовавшихся при распаде одних
белковых молекул, для синтеза
других.
Из
аминокислот, источниками которых
являются белки пищи, и аминокислот,
образующихся в организме, синтезируются
свойственные ему белковые
молекулы,пептидные гормоны, коэнзимы.
В этом заключается пластическая роль
белков пищи.
Скорость
распада и обновления белков организма
различна. Полупериод распада гормонов
пептидной природы составляет минуты
или часы, белков плазмы крови и печени
около 10 суток, белков мышц около 180 суток.
В среднем белки организма человека
обновляются за 80 суток. О суммарном
количестве белка, подвергшегося распаду
за сутки, судят по количеству азота,
выводимого из организма человека. В
белке содержится около 16% азота или в
100 г белка — 16 г азота. Таким образом,
выделение организмом 1 г азота
соответствует распаду 6,25 г белка. За
сутки из организма взрослого человека
выделяется около 3,7 г азота. Из этих
данных следует, что масса белка,
подвергшегося за сутки полному разрушению
составляет 3,7 х 6,25 = 23 г или 0,028-0,075 г
азота на 1 кг массы тела в сутки (коэффициент
изнашивания по Рубнеру).
Если
количество азота, поступающего в организм
с пищей, равно количеству азота выводимого
из организма, принято считать, что
организм находится в состоянии азотистого
равновесия. В случаях, когда в организм
поступает азота больше, чем его выделяется,
говорят о положительном
азотистом балансе (задержка,
ретенция азота). Такие состояния
бывают при увеличении массы мышечной
ткани, в период роста организма,
беременности, выздоровления после
тяжелого истощающего заболевания.
Состояние,
при котором количество выводимого из
организма азота превышает его поступление
в организм, называют отрицательным азотистым
балансом. Оно
имеет место при питании неполноценными
белками, когда в организм не поступают
какие-либо из незаменимых аминокислот,
при белковом голодании или при полном
голодании.
Белки,
использующиеся в организме в первую
очередь в качестве пластических веществ,
в процессе их разрушения освобождают
энергию для синтеза АТФ и
образования тепла.
Урок биологии №6. Функции белков
Тест №1 «Строение и функции белков» — 1 вариант.
Зад. № 1 Ответьте на предложенные вопросы, выберите один правильные ответы.
I. Какие соединения являются мономерами молекул белка?
а) глюкоза б) глицерин в) жирные кислоты д) аминокислоты
2. Сколько из известных аминокислот участвуют в синтезе белка?
а) 20 б) 23 в) 100
3. Какая часть молекул аминокислот отличает их друг от друга?
а) радикал б) аминогруппа в) карбоксильная группа
4.Посредством какой химической связи соединены между собой аминокислоты в молекуле белка первичной структуры?
a) пептидная связь
б) водородная связь между группами -СО и -NH, расположенных в соседних завитках спирали
в) связи между радикалами аминокислот
5.О каком уровне структурной организации белка идёт речь :«Это трёхмерная, пространственная «упаковка» полипептидной цепи, в результате которой возникает — глобула»? а) первичная структура б) вторичная структура в) третичная структура
г) четвертичная структура
6.Простые белки состоят из:
а) только из аминокислот в)аминокислот и липидов
б) аминокислот и углеводов г) аминокислот и нуклеиновых кислот
7. О какой функции белка идёт речь: «Специальные белки способны ускорять биохимические реакции, идущие в клетке»?
а) пластическая г) защитная ж) рецепторная б) каталитическая д) сократительная з) энергетическая д) регуляторная
8.О какой функции белка идет речь: «Специальные белки поддерживают постоянную концентрацию веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах»?
а) пластическая б) каталитическая в) сократительная г) защитная д) рецепторная
е) энергетическая ж) регуляторная
9.Процесс потери белком своих свойств и нарушение структуры белковой молекулы – это:
а) ренатурация; б) репликация; в) денатурация; г) спирализация
10.Вторичная структура белка: а) глобула; б) конформация; в) свёрнута в спираль.
11.При обратимой денатурации нарушаются следующие структуры белка:
а) вторичная; б) первичная; в) третичная; г) четвертичная; д) все, кроме первичной.
Зад. № 2 Ответьте на предложенные вопросы, выберите два правильных ответа.
9. Что является общим для всех аминокислот?
а) радикал б) аминогруппа в) карбоксильная группа
Зад. № 3 Ответьте на предложенные вопросы, выберите три правильных ответа.
10.Какие структуры белка способны нарушаться, а затем восстанавливаться?
а) первичная структура б) вторичная структура в) третичная структура
г) четвертичная структура
Тест №1 «Строение и функции белков» — 2 вариант.
Зад. № 1 Ответьте на предложенные вопросы, выберите один правильные ответы.
1.Какие соединения являются мономерами молекул белков?
а) жирные кислоты б) глицерин в) аминокислоты г) глюкоза
2.Сколько из известных аминокислот участвуют в синтезе белка?
а) 150 6)5 в) 20
3.Какая часть молекул аминокислот отличает их друг
от друга? а) карбоксильная группа б) радикал в) аминогруппа
4.Посредством какой химической связи возникает третичная структура белка?
а) пептидная б) водородная связь между группами -СО и -NH, расположенными в соседних завитках спирали в) связи между радикалами аминокислот
5.О каком уровне структурной организации белка идёт речь: «Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс? а) первичная структура б) вторичная структура в) третичная структура
г) четвертичная структура
6.О какой функции белков идёт речь: «Специфические белки предохраняют организмы от вторжения чужеродных белков и организмов и от повреждения»?
а) пластическая б) каталитическая в) защитная г) транспортная д) сократительная ж) рецепторная е) регуляторная з) энергетическая
7. О какой функции белков идёт речь: «Специальные белки способны присоединять и переносить различные вещества».
а) пластическая б) каталитическая в) транспортная г) защитная ж) рецепторная
д) сократительная з) энергетическая е) регуляторная.
8.Первичная структура молекулы белка удерживается:
а) водородными связями; б) пептидными связями; в) гидрофобными связями; г) дисульфидными связями.
9.Ферменты от других белков отличаются тем, что они:
а) синтезируются на рибосомах; б) включают в свой состав витамины, металлы;
в) являются катализаторами химических реакций
10.Ренатурация – это процесс: а) нарушение естественной структуры белка;
б) восстановления естественной структуры белка
Зад. № 2 Ответьте на предложенные вопросы, выберите два правильных ответа
8.Что является общим для всех аминокислот?
а) карбоксильная группа б) радикал в) аминогруппа
Зад. № 3. Ответьте на предложенные вопросы, выберите три правильных ответа.
9.Какие структуры молекул белка способны нарушаться при денатурации, а затем вновь восстанавливаться? а) четвертичная структура б) третичная структура в) вторичная структура г) первичная структура
10.Сложные белки состоят из: а) только аминокислот б) аминокислот и углеводов в) аминокислот и липидов г) аминокислот и нуклеиновых кислот
Тест по биологии на тему «Молекулярный уровень» (9 класс)
Тест. Молекулярный уровень. 1 вариант. 9 класс.
А1.Какой из химических элементов содержится в клетках в наибольшем количестве:
1.азот
2.кислород
3.углегод
4.водород
А2.Назовите химический элемент, который входит в состав АТФ, всех мономеров белков и нуклеиновых кислот.
1)N 2)P 3)S 4)Fe
А3.Укажите химическое соединение, которое углеводом НЕ является.
1)лактоза 2)хитин 3)кератин 4)крахмал
А4.Как называется структура белка, которая представляет собой спираль из цепочки аминокислот, свернутую в пространстве клубком?
1)первичная 2)вторичная 3)третичная 4)четвертичная
А5.В клетках животных запасным углеводом является:
1.крахмал
2.целлюлоза
3.глюкоза
4.гликоген
А6.Основным источником энергии для новорожденных млекопитающих является:
1.глюкоза
2.крахмал
3.гликоген
4.лактоза
А7.Что является мономером РНК?
1)азотистое основание 2)нуклеотид 3)рибоза 4)урацил
А8.Сколько видов азотистых оснований входит в состав молекулы РНК?
1)5 2)2 3)3 4)4
А9.Какое азотистое основание ДНК комплиментарно цитозину?
1)аденин 2)гуанин 3)урацил 4)тимин
А10. Универсальным биологическим аккумулятором энергии являются молекулы
1).белков 2).липидов 3).ДНК 4).АТФ
А11. В молекуле ДНК количество нуклеотидов с гуанином составляет 5% от общего числа. Сколько нуклеотидов с тимином содержится в этой молекуле
1).40% 2).45% 3).90% 4).95%
А12.Какова роль молекул АТФ в клетке?
1-обеспечивают транспортную функцию 2-передают наследственную информацию
3-обеспечивают процессы жизнедеятельности энергией 4-ускоряют биохимические
реакции
Часть В ( выберите три верных ответа из шести предложенных)
В1. Какие функции в клетке выполняют углеводы?
Каталитическую 4) структурную
Энергетическую 5) запасающую
Двигательную 6) сократительную
В2. Какие структурные компоненты входят в состав нуклеотидов молекулы ДНК?
Азотистые основания: А,Т,Г,Ц.
Разнообразные кислоты
Липопротеины
Углевод дезоксирибоза
Азотная кислота
Фосфорная кислота
В3. Установите соответствие между строением и функцией органического вещества и его видом:
СТРОЕНИЕ И ФУНКЦИИ ВЕЩЕСТВА
А. состоят из остатков молекул глицерина и жирных кислот 1. липиды
Б. состоят из остатков молекул аминокислот 2. Белки
В. Участвуют в терморегуляции
Г. Защищают организм от чужеродных веществ
Д. образуются за счет пептидных связей.
Е. Являются наиболее энергоемкими.
С1. Решите задачу.
В молекуле ДНК находится 1250 нуклеотидов с аденином (А), что составляет 20% от их общего числа. Определите, сколько нуклеотидов с тимином (Т), цитозином (Ц) и гуанином (Г) содержится в отдельности в молекуле ДНК. Ответ поясните.
Часть А – 1 балл (максимальное количество 12 баллов)
Часть В – 2 балла (максимальное количество 6 баллов
)
Часть С – 3 балла (максимальное количество 3 балла)
Итого : 21 балл
Критерии оценивания:
19 -21 балл – «5»
13 – 18 баллов – «4»
9 – 12 баллов – «3»
1 – 8 баллов – «2»
Тест. Молекулярный уровень. 2 вариант. 9 класс
А1.На долю четырех химических элементов приходится 98%всего содержимого клетки. Укажите химический элемент, НЕ относящийся к ним.
1)О 2)Р 3)С 4)N
А2.У детей развивается рахит при недостатке:
1.марганца и железа
2.кальция и фосфора
3.меди и цинка
4.серы и азота
А3.Назовите дисахарид.
1)лактоза 2)фруктоза 3)крахмал 4)гликоген
А4. Как называется структура белка, представляющая собой спираль , которую свернута цепочка из аминокислот?
1)первичная 2)вторичная 3)третичная 4)четвертичная
А5.В клетках растений запасным углеводом является:
1.крахмал
2.целлюлоза
3.глюкоза
4.гликоген
А6.Наибольшее количество энергии выделяется при разложении 1 грамма:
1.жира
2.белка
3.глюкоза
4.углеводов
А7.Что является мономером ДНК?
1)азотистое основание 2)нуклеотид 3)дезоксирибоза 4)урацил
А8.Сколько полинуклеотидных нитей входит в состав одной молекулы ДНК?
1)1 2)2 3)3 4)4
А9.Назовите химическое соединение, которое имеется в РНК, но отсутствует в ДНК.
1)тимин 2)дезоксмирибоза 3)рибоза 4)гуанин
А10. Источником энергии клетки являются молекулы
1).белков 2).липидов 3).ДНК 4).АТФ
А11. В молекуле ДНК количество нуклеотидов с цитозином составляет 5% от общего числа. Сколько нуклеотидов с тимином содержится в этой молекуле
1).40% 2).45% 3).90% 4).95%
А12.Какие соединения входят в состав АТФ?
1-азотистое основание аденин,углевод рибоза,3 молекулы фосфорной кислоты
2-азотистое основание гуанин, сахар фруктоза, остаток фосфорной кислоты.
3-рибоза,глицерин и какая-либо аминокислота
Часть В ( выберите три верных ответа из шести предложенных)
В1. Липиды выполняют функции:
Ферментативную 4) транспортную
Энергетическую 5) запасающую
Гормональную 6) передача наследственной информации
В2. Какие структурные компоненты входят в состав нуклеотидов молекулы РНК?
Азотистые основания: А,У,Г,Ц.
Разнообразные кислоты
Азотистые основания: А,Т,Г,Ц.
Углевод рибоза
Азотная кислота
Фосфорная кислота
В3. Установите соответствие между особенностями и молекулами для которых они характерны.
ОСОБЕННОСТИ МОЛЕКУЛЫ
А) хорошо растворяются в воде 1) моносахариды
Б) имеют сладкий вкус 2) полисахариды
В) сладкий вкус отсутствуют
Г) глюкоза, рибоза, фруктоза
Д) в воде нерастворимы
Е) крахмал, гликоген, хитин.
С1. В молекуле ДНК находится 1100 нуклеотидов с цитозином (Ц) что составляет 20% от их общего числа. Определите, сколько нуклеотидов с тимином (Т), гуанином(Г), аденином (А) содержится в отдельности в молекуле ДНК, объясните полученный результат.
Часть А – 1 балл (максимальное количество 12 баллов)
Часть В – 2 балла (максимальное количество 6 баллов)
Часть С – 3 балла (максимальное количество 3 балла)
Итого : 21 балл
Критерии оценивания:
19 — 21 балл – «5»
13 – 18 баллов – «4»
9 – 12 баллов – «3»
1 – 8 баллов – «2»
Количественное определение числа копий моторных белков в сверхвысоком разрешении с использованием калибровки, инвариантной для визуализации.
Abstract
Моторные белки — это машины наноразмерного размера, которые преобразуют энергию гидролиза АТФ в механическое движение по филаментам цитоскелета. При этом они транспортируют органеллы и помогают поддерживать субклеточную организацию. Ранее мы разработали подход к калибровке на основе ДНК-оригами для извлечения количества копий белка из изображений сверхвысокого разрешения. Используя этот подход, мы показываем здесь, что ретроградный моторный белок динеин в основном присутствует как единственный мотор в цитозоле, тогда как небольшая популяция динеина вдоль цитоскелета микротрубочек формирует мультимеры более высокого порядка, организованные в наноразмерные домены.Мы также демонстрируем, используя динеин в качестве тестового образца, что ранее сгенерированные нами калибровочные данные на основе ДНК-оригами могут быть расширены до изображений сверхвысокого разрешения, полученных в различных экспериментальных условиях, что позволяет количественно оценить любой интересующий слитый с GFP белок. Наши результаты имеют значение для координации движений во время внутриклеточного движения, а также для использования сверхвысокого разрешения в качестве количественного метода для определения количества копий белка на наноуровне.
Введение
Внутриклеточная транспортировка — важный биологический процесс, который способствует поддержанию пространственной организации органелл.Цитоплазматический динеин является основным моторным белком, ответственным за внутриклеточный ретроградный транспорт. В то время как свойства одиночных динеиновых моторов широко изучены in vitro, механизмы, регулирующие множественные моторы, которые перемещают органеллы внутри переполненных клеток, только начинают открываться 1 . Несколько экспериментов, включая оптическое улавливание, одностадийное флюоресцентное фотообесцвечивание и темнопольную микроскопию, показали, что более чем один динеиновый мотор транспортирует органеллы в клетках 2 — 8 .Однако молекулярное расположение этих многомоторных групп на органеллах не было непосредственно визуализировано. Такое расположение является важным определяющим фактором того, как мотогруппы могут сотрудничать или участвовать в перетягивании каната во время транспортировки 4 , 5 , 9 . Также было высказано предположение, что он играет важную роль в подвижности, созревании и биогенезе органелл 8 , 10 — 12 . Исследования с помощью иммуно-электронной микроскопии показали, что моторные белки могут группироваться в кластеры на органеллах 13 .Совсем недавно исследования с использованием криоэлектронной микроскопии показали, что эндосомальные адаптерные белки могут вмещать два димера динеина, которые находятся в непосредственной физической близости на одном адапторном белке 14 . Эксперименты с одной молекулой in vitro показали, что когда два димера динеина связаны через адаптерный белок, они могут двигаться быстрее, чем один динеиновый мотор 14 . Кроме того, было показано, что динеин формирует микродомены на поздних фагосомоподобных компартментах, и образование микродоменов важно для созревания фагосом 11 .Эти эксперименты, объединенные вместе, предполагают, что двигатели, такие как динеин, могут образовывать кластерную организацию, содержащую несколько двигателей, и эта организация может быть важным регулятором внутриклеточного движения и клеточной функции. Кроме того, количество копий динеиновых моторов, которые присутствуют внутри микро- или нанодоменов на грузовых мембранах, может быть решающим параметром для тонкой настройки трафика 10 . Однако количественное определение числа копий моторных белков, таких как динеин, внутри клеточной среды на наноразмерном уровне является очень сложной задачей, учитывая их небольшой размер и высокую концентрацию.Пространственное разрешение в нанометровом масштабе необходимо для определения молекулярного расположения моторов и подсчета числа их копий на микротрубочках, в цитозоле и при прикреплении к органеллам.
Методы микроскопии сверхвысокого разрешения, такие как микроскопия стохастической оптической реконструкции (STORM), преодолевают дифракционный предел и позволяют визуализировать субклеточное распределение белков с пространственным разрешением в наномасштабе. 15 . Однако количественное определение количества копий белка на изображениях сверхвысокого разрешения является очень сложной задачей из-за сложной фотофизики флуорофоров и того факта, что стехиометрия маркировки часто не является однозначной, особенно при использовании антител 16 — 18 .Ранее разреженные изображения отдельных антител, неспецифически адсорбированных на клетках, использовались в качестве эталона для количественной оценки количества копий белка на изображениях с высоким разрешением 19 , 20 , однако этот метод не учитывает неизвестную стехиометрию мечения. . Чтобы решить эту проблему, мы и другие специалисты сосредоточились на разработке калибровочных стандартов, которые можно использовать в сочетании с микроскопией сверхвысокого разрешения 21 — 23 . В частности, недавно мы разработали универсальный подход, который использует четко определенную структуру ДНК-оригами в качестве калибровочного стандарта для микроскопии сверхвысокого разрешения 24 .В этом подходе мы функционализировали ДНК-оригами с помощью определенного количества белков GFP, пометили GFP с помощью антител и выполнили визуализацию сверхвысокого разрешения. Определив количество локализаций на белок GFP в изображении STORM, мы построили калибровочную кривую, которая связала количество локализаций с числом копий GFP. Мы дополнительно разработали статистический метод, который основан на подборе распределения локализаций с помощью калибровочной функции и позволяет количественно определять процентное содержание различных олигомерных разновидностей в нанодоменах с высоким разрешением.
Здесь мы использовали этот подход для количественной оценки количества копий динеина с наноразмерным пространственным разрешением как в цитозоле, так и вдоль цитоскелета микротрубочек клеток HeLa, стабильно экспрессирующих промежуточную цепь динеина (DIC), слитую с GFP (клетки HeLa IC74) 25 . Полностью собранный динеиновый мотор в его функциональной форме представляет собой димер, содержащий две копии DIC 26 . Изображения сверхвысокого разрешения показали, что цитозольные нанокластеры DIC содержат большую долю мономерных DIC, вероятно, соответствующих субъединицам, не включенным в полностью собранный моторный комплекс.Кроме того, в цитозоле также присутствовали димерные DIC, которые, вероятно, соответствуют полностью собранному моторному комплексу динеина. Интересно, что вдоль микротрубочек доля мономерного ДИК существенно снижалась. Кроме того, было обнаружено, что небольшая популяция мультимерных динеинов, состоящая из 2 или более моторных комплексов, группируется в наноразмерные домены вдоль микротрубочек. Эти исследования представляют собой доказательную демонстрацию того, что двигатели, такие как динеин, действительно могут существовать в виде наноразмерных кластеров, содержащих несколько двигательных комплексов в физиологическом контексте.
В дополнение к применению нашего подхода к калибровке для демонстрации организации динеиновых моторов на молекулярном уровне внутри клеток, мы еще больше расширили возможности нашего метода. Когда мы разработали подход к калибровке ДНК-оригами, мы предположили, что для использования данных калибровки, которые мы сгенерировали, визуализация интересующего белка должна быть выполнена с использованием тех же условий визуализации, что и при калибровочном эксперименте. Здесь, используя динеин в качестве известного эталонного тестового образца, мы также показываем, что можно определить правильные функции калибровки, подходящие для различных условий визуализации.С помощью этого подхода мы можем расширить данные калибровки от одной серии экспериментов до новой серии экспериментов, проводимых в различных экспериментальных условиях, тем самым расширяя его универсальность.
Материалы и методы
Подготовка образцов для микроскопии сверхвысокого разрешения
Стабильно трансфицированная линия клеток HeLa IC74-mfGFP (из лаборатории Такаши Мураямы, кафедра фармакологии, Медицинская школа Университета Дзюнтендо, Токио, Япония), высевали на 8-луночные планшеты. Камера Lab-tek 1 из покровного стекла (Nunc) и выращивание в стандартных условиях (DMEM, высокое содержание глюкозы, пируват (Invitrogen 41966052) с добавлением 10% FBS, 2 мМ глутамина и отбор с использованием гигромицина 400 мкг / мл).
Клетки
фиксировали PFA (3% в PBS) при комнатной температуре в течение 7 минут. Затем клетки инкубировали при комнатной температуре с блокирующим буфером (3% (вес / объем) BSA (Sigma) в PBS и 0,2% тритона). В клетках, стабильно трансфицированных HeLa IC74-mfGFP, иммуноокрашивали зеленым флуоресцентным белком с промежуточной цепью динеина (GFP) с помощью первичные антитела (куриные поликлональные анти-GFP, Abcam 13970), разведенные 1: 2000 в блокирующем буфере в течение 45 минут при комнатной температуре. Клетки промывали 3 раза в блокирующем буфере и инкубировали в течение 45 минут. ШТОРМ (Alexa Fluor 405-Alexa Fluor 647).
Клетки U2OS остеосаркомы человека (из ATCC, # HTB-96) высевали на планшет LabTek с камерным покровным стеклом (Nunc) и выращивали в стандартных условиях (DMEM, высокое содержание глюкозы, пируват (Invitrogen 41966052) с добавлением 10% FBS. Для GFP-меченного Nup133 клетки трансфицировали с использованием Fugene (реагент для трансфекции FUGENE HD, Roche 04709705001) конструкциями (плазмида от Jan Ellenberg, EMBL, Heidelberg, pmEGFP-Nup133-s31401res, плазмида Euroscarf, ссылка P30728). Включение в пору GFP с меткой GFP. Nup облегчалось истощением эндогенного белка, осуществляемым посредством РНК-интерференции, трансфекции через 24 часа клеток совпадающей миРНК (Nup133 SiRNA s31401, Thermo Fisher, Silencer Select siRNA s31401) и использовалось 3 пикомола миРНК на лунку.Через 60 часов клетки промывали фиксированными PFA (3%) в течение 7 минут.
Штормовая микроскопия
Визуализация выполнялась с масляным иммерсионным объективом (Nikon, CFI Apo TIRF 100x, NA 1.49, Oil), повторяющимися циклами активации (лазер 405 нм) и считыванием (линия лазера 647 нм) с использованием освещения TIRF. Во время экспериментов фокусировка фиксировалась с помощью системы Perfect Focus System (Nikon), а визуализация производилась на камере EMCCD (Andor iXon X3 DU-897, Andor Technologies).
Условие получения изображения 1: Для получения 85 000 кадров с частотой кадров 25 Гц использовалась настроенная на заказ установка флуоресценции полного внутреннего отражения (TIRF), построенная на инвертированном микроскопе Nikon Eclipse Ti (Nikon Instruments).Использовались интенсивность возбуждения ~ 1 кВт / см 2 для считывания с длиной волны 647 нм (500 мВт MPB Communications, Канада) и интенсивность активации ~ 25 Вт / см 2 (100 мВт, OBIS Coherent, CA). Излучаемый сигнал флуоресценции спектрально фильтровали с помощью четырехполосного фильтра (ZT405 / 488/561 / 647rpc-UF2, Chroma Technology) и отбирали с помощью фильтра излучения (ZET405 / 488/561 / 647m-TRF, Chroma).
Условие получения изображения 2: коммерческий микроскоп N-STORM (Nikon Intruments) использовался для получения 40 000 кадров с частотой кадров 33 Гц.Использовались интенсивность возбуждения ~ 0,9 кВт / см 2 для считывания с длиной волны 647 нм (300 мВт MPB Communications, Канада) и интенсивность активации ~ 35 Вт / см 2 (100 мВт, Cube Coherent, Калифорния).
STORM использовали буфер для визуализации, содержащий раствор GLOX в качестве системы поглощения кислорода (40 мг / мл -1 каталазы [Sigma], 0,5 мг / мл -1 глюкозооксидазы, 10% глюкозы в PBS) и MEA 10 мМ ( Цистеамин MEA [SigmaAldrich, # 30070-50G] в 360 мМ трис-HCl).
Анализ данных STORM
Локализация и реконструкция изображений STORM были выполнены с использованием специального программного обеспечения (Insight3, любезно предоставленного Бо Хуанг, Калифорнийский университет) путем гауссовой подгонки изображений одиночных молекул для получения координат локализации.На окончательном изображении каждая идентифицированная молекула отображается как гауссово пятно с шириной, соответствующей точности локализации (10 нм), с поправкой на дрейф.
Специально написанный код, написанный в Matlab 11 , реализующий алгоритм кластеризации на основе расстояния, использовался для идентификации пространственных кластеров локализаций. Список локализаций сначала был разделен на изображения с размером пикселя 20 нм, которые были отфильтрованы с помощью квадратного ядра (7 x 7 пикселей 2 ) и установлены пороговые значения для получения двоичного изображения.Для дальнейшего анализа рассматривались только локализации, лежащие на соседних (6-связанных соседей) ненулевых пикселях бинарного изображения. Для выбора разреженного вклада динеина большие кластеры были отфильтрованы, установив порог максимального количества локализаций (1000 локализаций / кластер).
Для оценки количества копий динеина мы затем использовали метод на основе ДНК-оригами, ранее опубликованный 8 , и процедуру, кратко описанную ниже. Количественный подход использует ДНК-оригами в качестве калибровочного стандарта и позволяет оценить количество копий данного белка из общего распределения количества локализаций путем подгонки распределения к линейной комбинации «калибровочных» функций.
Из-за своей стохастической природы процедура визуализации STORM может быть описана как отображение молекулы в случайную величину, состоящую из номера локализации N 1 через распределение вероятностей f 1 . Форма этой функции распределения может быть определена с помощью калибровочных экспериментов, таких как визуализация большого количества разреженных молекул и подсчет связанного количества локализаций на молекулу.
Это рассуждение может быть распространено на кластеры белков, состоящие из большего числа молекул.С двумя молекулами A и B, расположенными на расстоянии, меньшем, чем точность локализации, процедура визуализации предоставит для каждой молекулы случайное количество локализаций N 1A и N 1B , взятых из распределения f 1 . Поскольку две молекулы не могут быть пространственно разрешены, невозможно связать локализации с разными молекулами. Поэтому димеру мы связываем номер локализации N 2 = N 1A + N 1B .Распределение, полученное в результате повторения этой процедуры по большому количеству димеров, будет связано с суммой двух идентичных случайных величин.
где символ * представляет свертку. Те же рассуждения можно итеративно распространить на более крупные олигомеры, получив, что f N = f N -1 * f 1 .
Форма распределения для димеров и более крупных олигомеров может быть определена с помощью калибровочного эксперимента 24 .
Если мы проведем эксперимент, направленный на визуализацию данного белка, образующего гетерогенную популяцию олигомерных видов, из процедуры, описанной выше, мы получим распределение количества локализаций на кластер, заданное следующим образом:
где α i — доли i-меров и. Подгонка экспериментального распределения с известными функциями f i дает значения коэффициентов α i , обеспечивая оценку числа копий данного белка 24 .
В принципе, разные условия сбора данных обеспечивают разные функции f i , даже если изображение одной и той же молекулы. Если мы рассмотрим два микроскопа ( M1 и M2 ) с одинаковой точностью локализации, системы можно калибровать отдельно, чтобы получить два разных набора функций калибровки f i, M1 и f i, M2 . В качестве альтернативы, если была откалибрована только одна из двух систем (например,грамм. M1 ), визуализируя простой стандартный эталонный образец на обеих установках, мы можем получить функции калибровки другой установки (например, M2 ).
Визуализация одного и того же эталонного образца в разных установках даст
где — набор функций калибровки, зависящих от микроскопа. Если функциональная форма известна (в данном случае логарифмически-нормальная), аппроксимация экспериментальных данных, полученных для одного и того же образца, отображаемого с помощью различных установок, должна давать одинаковые α i в пределах экспериментальной и статистической неопределенности.Следовательно, в случае, если у нас есть калибровка только для одной из установок, отображение того же стандартного эталонного образца можно использовать для получения функций калибровки для другой установки. Как только функция калибровки для новых условий визуализации получена путем наложения тех же выходных значений для коэффициентов α i , эту новую функцию калибровки можно использовать для соответствия новым данным, полученным с помощью второй настройки.
Для реализации этого подхода мы рассчитали коэффициенты α i для промежуточной цепи динеина (DIC), полученной с помощью микроскопа 1 ( M1 ), используя калибровочные функции, полученные для M1 с помощью подхода ДНК-оригами.Поскольку полностью собранный моторный комплекс динеина является гомодимерным и содержит 2 копии DIC, в эту процедуру мы включили все виды, соответствующие четным множествам DIC, а также рассмотрели существование гибкой популяции мономерных субъединиц DIC. Для ДИК, полученного на микроскопе 2 ( M2 ) с различными настройками сбора данных, подгонка к линейной комбинации функций калибровки была выполнена путем наложения коэффициентов α i , соответствующих полностью собранным двигательным комплексам, такими же, как те, которые определены на M1 с погрешностью 10%.Мы проводим аппроксимацию свободных параметров µ и σ и, таким образом, получаем логнормальную калибровочную функцию для нового микроскопа.
Результаты
Небольшая популяция динеина сгруппирована в наноразмерные домены, состоящие из множества динеиновых моторов вдоль микротрубочек
Для определения наноразмерного распределения и числа копий динеина мы использовали клетки HeLa, стабильно экспрессирующие слитые промежуточные цепи динеина (DIC). в GFP (HeLa IC74). Изображения с высоким разрешением динеина, меченного первичными и вторичными антителами против GFP, выявили кластеры наноразмеров (, рис. 1, ).Эти кластеры были похожи независимо от того, фиксировали ли клетки с помощью PFA или метанол-этанол ( Рисунок S1 , Методы), что позволяет предположить, что организация динеина не зависит от метода фиксации. Мы сегментировали эти кластеры, используя алгоритм идентификации кластеров на основе расстояния, который мы ранее разработали 27 . Наложение изображений сверхвысокого разрешения с широкопольными изображениями микротрубочек показало, что некоторые из этих кластеров перекрываются с цитоскелетом микротрубочек ( Рисунок 1a, ), тогда как другие были распределены в пространстве между микротрубочками и, скорее всего, были цитозольными ( Рисунок 1b). ).Используя широкоугольное изображение микротрубочек в качестве маски, мы вручную сегментировали и классифицировали субрегионы в изображении динеина в сверхвысоком разрешении на две категории: перекрывающиеся с микротрубочками ( Рисунок 1a и вставка ) и цитозольные ( Рисунок 1b и вставка ). Поскольку для этого анализа использовалось ограниченное дифракцией изображение микротрубочек, а изображения с широким полем и сверхвысоким разрешением представляют собой 2D-проекции, популяция динеина, перекрывающаяся с микротрубочками, вероятно, содержит смешанную популяцию ассоциированных с микротрубочками и цитозольных двигателей динеина.Цитозольная популяция, с другой стороны, должна состоять из моторов, преимущественно не связанных с микротрубочками.
Рисунок 1: Визуализация в сверхвысоком разрешении и количественная оценка организации динеина в клетках выявляют присутствие мультимеров динеина, организованных в нанокластеры вдоль микротрубочек:
( a, b ) STORM визуализация промежуточной цепи динеина, слитой с GFP и иммуноокрашенной анти-GFP первичные и вторичные антитела, меченные AlexaFluor405 / AlexaFluor647 (пурпурный). Широкопольные изображения микротрубочек (зеленые) использовали для отделения динеина, перекрывающегося с цитоскелетом микротрубочек ( a ) (n = 6 независимых экспериментов, n = 6958 кластеров), от цитозольного динеина, не связанного с микротрубочками ( b ) (n = 6 независимых экспериментов, n = 6345 кластеров).Масштабирование областей внутри белых прямоугольников показано в виде вставок после кластерного анализа для сегментирования отдельных нанокластеров динеина. Масштабные линейки: 2 мкм ( a, b ), 200 нм ( вставок, ). Распределения, показывающие количество локализаций на один нанокластер динеина, не перекрывающийся (c) и перекрывающийся с микротрубочками ( d ). Распределения соответствовали линейной комбинации калибровочных функций (черные линии). Качество подгонки оценивалось с помощью теста с уменьшенным χ 2 (см. , рисунок S3a, b ).( e ) Число копий для динеина, перекрывающегося с (красными) и не перекрывающегося (черными) микротрубочками, полученное из подгонки и нормализованное, чтобы показать только гомодимерные, полностью собранные моторные комплексы. Максимальное количество моторов было рассчитано с минимизацией целевой функции как для динеина, перекрывающегося (, фиг. S2a, ), так и для неперекрывающегося (, фиг. S2b, ) с микротрубочками.
Чтобы количественно определить количество копий динеиновых моторов в кластерах, мы использовали данные калибровки, которые мы ранее создали 24 .Динеин — гомодимер, содержащий две копии ДИК. Наши предыдущие калибровочные данные были получены с использованием очищенного, модифицированного димерного динеинового двигателя, в котором GFP был слит с грузовым связывающим доменом двигателя 24 . Таким образом, мы могли определить калибровочное распределение ( f 1, M1 , в котором M1 относится к настройке сбора данных микроскопа 1), описывающее распределение вероятностей количества локализаций для полностью собранного динеинового двигателя, имеющего две копии GFP. 24 .Мы также вывели калибровочную функцию для мономера, содержащего только одну копию GFP ( f 0,5, M1 ). Поскольку часть ДИК может не быть включена в полностью собранный функциональный моторный комплекс динеина и может существовать в виде мономера, мы подгоняем количество локализаций на кластер к линейной комбинации калибровочных распределений f i, M2 (, рис. 1c и d ) со значениями i = 0,5, 1, 2, 3…. В этом случае номер копии 0.5 будет соответствовать мономерному ДВС, число копий 1 будет соответствовать гомодимерному ДВС, представляющему полностью собранный моторный комплекс динеина, число копий 2 будет соответствовать 2 полностью собранным моторным комплексам динеина и т.д. = N max , для которого целевая функция была минимизирована (, рисунок S2, ), а степень соответствия оценивалась с использованием значения уменьшенного χ 2 (, рисунок S3a и рисунок S3b ). Эта количественная оценка показала, что цитозольные кластеры динеина представляли собой комбинацию мономерного DIC (вероятно, не включенного в моторный комплекс) и гомодимерного DIC (единственная копия моторного комплекса динеина) ( Рисунок S4a ).Популяция мономеров резко сократилась в популяции кластеров динеина, перекрывающихся с микротрубочками (, фиг. S4b, ). Кроме того, эта популяция также содержала мультимерные моторные комплексы динеина, состоящие из 2 или более динеинов внутри нанокластера (рисунок 1e, красные столбцы) , который отсутствовал в цитозольной популяции ( Рисунок 1e, черные столбцы ). Эти результаты предполагают, что вдоль микротрубочек DIC преимущественно включается в гомодимерный полный моторный белковый комплекс в отличие от цитозольной популяции, и эти полные моторные комплексы могут в дальнейшем кластеризоваться вместе в наноразмерные домены, формирующие динеиновые мультимеры более высокого порядка ( Рисунок 2e ).Для дальнейшей оценки достоверности анализа колокализации, в котором широкоугольные изображения микротрубочек использовались в качестве масок, мы определили количество копий динеина из областей, которые были выбраны случайным образом. Мы предположили, что эти случайно выбранные области должны напоминать цитозольную популяцию, поскольку микротрубочки занимают незначительную часть цитозоля. Действительно, число копий динеина в нанокластерах из случайно выбранных областей было идентично цитозольным нанокластерам (, рис. S4b и c ).Хотя этот анализ не исключает, что нанокластеры, перекрывающиеся с микротрубочками, могут быть смешанной популяцией цитозольного и ассоциированного с микротрубочками динеина, он подтверждает, что различия между цитозольными и перекрывающимися микротрубочками нанокластерами действительно связаны с динеином, связанным с микротрубочками. Мы, вероятно, недооцениваем реальную разницу в этих двух популяциях нанокластеров динеина.
Рис. 2: Новые функции калибровки могут быть получены для различных условий визуализации с использованием количественного определения динеина в качестве эталона.
Изображения в сверхвысоком разрешении промежуточной цепи динеина, слитой с GFP и иммуноокрашенной первичными анти-GFP и вторичными антителами, меченными AlexaFluor405 / AlexaFluor647, при различных условиях визуализации ( a, b ) и соответствующем кластерном анализе ( c, d ). Распределения, показывающие количество локализаций, количественно определяемых из нанокластеров во всей ячейке, и соответствующее соответствие линейной комбинации функций калибровки для различных условий визуализации ( e, f ).Качество подгонки оценивалось с помощью теста с уменьшенным χ 2 (см. , рисунок S3c и d ). Функции калибровки для старых (M1) ( г, черный ) и для новых (M2) условий визуализации ( г, красный ). Шкала 2 мкм.
Калибровочные функции могут быть получены для различных условий визуализации с использованием эталонного образца
Для того, чтобы количественно определить количество копий комплексов моторных белков динеина во внутриклеточной среде, изображения с высоким разрешением были получены с использованием точно таких же условий визуализации (i .е. M1 ), которые использовались для получения данных калибровки ДНК-оригами. Чтобы определить влияние настроек получения изображения на количественную оценку, мы записали новый набор изображений динеина со сверхвысоким разрешением, снова пометив DIC антителами против GFP и изменив настройки получения ( M2, см. Методы) ( Рисунок 2а-д ). Измененные параметры получения изображения действительно изменили распределение количества локализаций на кластер, извлеченных из изображений сверхвысокого разрешения (, рис. 2e, f ).Следовательно, согласование этого нового набора экспериментальных данных (, рис. 2f, ) с предыдущей функцией калибровки (полученной для M1 ) приведет к неточным результатам для распределения числа копий динеина в нанокластерах. Мы ожидаем, что изменение протокола визуализации должно также привести к другой функции калибровки, в то время как эквивалентные «эталонные» образцы для визуализации должны давать такое же распределение числа копий с теми же коэффициентами α i (т.е. пропорция каждого i-мерного вида должна оставаться неизменной). Последнее предположение можно использовать для получения функции калибровки для нового условия визуализации (, рис. 2g, красный цвет ) путем наложения аналогичных значений для α i в пределах экспериментальной неопределенности в качестве ограничения и извлечения параметров для функции калибровки ( т.е. µ и σ логнормального распределения) из подгонки. Количество локализаций, полученных для одиночных кластеров динеина в клетках HeLa, хорошо согласуется с линейной комбинацией функций калибровки как в старых ( M1, , рис. 2e, ), так и в новых условиях визуализации ( M2, , рис. 2f, ), поскольку также показаны уменьшенными значениями качества подгонки — χ 2 ( Рисунок S3c, d ).Изучая кривизну функции логарифмического правдоподобия вокруг значений оценки, мы могли определить стандартную ошибку свободных параметров, показывая, что они хорошо ограничены (mu = 3,227 ± 0,007, сигма = 0,569 ± 0,007). Соответствие между результатами распределения числа копий, полученными для двух различных условий визуализации, было дополнительно проверено a posteriori с помощью теста × 2 , предоставив p-значение ≃1, тем самым исключив существенные различия между двумя наборами ( Рис. S5 ).Этот результат является ожидаемым, поскольку два распределения числа копий должны быть одинаковыми в пределах экспериментальной неопределенности.
Чтобы проверить метод, мы извлекли количество копий динеина с помощью новой функции калибровки на новом наборе изображений ДВС в условиях визуализации M2 (, рис. 3a, ). Важно отметить, что эти новые изображения представляют собой независимый набор данных, не перекрывающийся с тем, который использовался для извлечения функции калибровки M2 .Кроме того, поскольку в этом случае мы не получили изображения микротрубочек, количественная оценка была проведена для нанокластеров динеина во всей клетке, и этот анализ был повторен для изображений, полученных с использованием M1 для сравнения. Хотя мы рассмотрели существование мономерной популяции ДВС в подборе, мы сосредоточились на определении и сравнении распределения числа копий полностью собранных гомодимерных моторных комплексов динеина, поскольку они являются более биологически значимой популяцией. И снова мы получили большую долю динеина в единственной копии и меньшую долю мультимерных моторных комплексов динеина (, рис. 3b, черные полосы ).Небольшие различия в количестве копий динеина по сравнению с предыдущей количественной оценкой с использованием условий визуализации M1 ( Рисунок 3b, красные столбцы ) ожидаются от клеточной изменчивости в организации динеина, а также экспериментальных неопределенностей. Тест χ 2 не показал существенной разницы между двумя результатами (p-значение 1), что еще раз подтвердило наш подход.
Рис. 3. Проверка новой функции калибровки с использованием динеина и комплекса ядерных пор.
( a ) Распределение, показывающее количество локализаций на кластер, полученных из изображений DIC со сверхвысоким разрешением, которые не использовались для определения новой функции калибровки, показанной на рисунке 2. Соответствующее соответствие линейной комбинации новых (M2) функция калибровки показана черной линией. Качество подгонки оценивалось с помощью теста с уменьшенным χ 2 (см. , рисунок S3e ). ( b ) Распределение числа копий динеина во всей клетке, количественно определенное с использованием функций калибровки M1 (красный) (n = 7 независимых экспериментов, n = 25427 кластеров) и M2 (черный) (n = 3 независимых эксперимента, n = 18490 кластеров) .Число копий нормализовали, чтобы показать гомодимерные, полностью собранные двигательные комплексы. Соответствие между распределением числа копий динеина, полученным в условиях M1 и M2, определяли с помощью теста χ 2 (значение χ 2 , равное 0,0313, дает значение p = 1). Изображение сверхвысокого разрешения ( c ) и кластерный анализ ( d ) NUP133, экспрессирующего GFP, иммуноокрашенного с помощью вторичных антител, меченных AlexaFluor405 / AlexaFluor647, и полученных с использованием условий визуализации M2.Показано увеличение области внутри белого поля ( d, вставка ). (e) Распределение числа локализаций для каждого кластера, соответствующего одной складке NPC, и соответствующее соответствие линейной комбинации функций калибровки для условия построения изображения M2. Качество подгонки оценивалось с помощью теста с уменьшенным χ 2 (см. , рисунок S3 f). ( d ) Распределения числа копий GFP, оцененные для отдельных кластеров Nup133, соответствующих одной кратности NPC.(N = 1 эксперимент, общее количество проанализированных кластеров n = 4982).
Для дальнейшего тестирования характеристик метода и подтверждения его применения мы количественно оценили распределение числа копий NUP133 (субъединица комплекса ядерных пор), слитого с GFP. Число копий субъединицы NUP133 широко охарактеризовано рядом методов 28 . Комплекс ядерных пор представляет собой кольцевую структуру с 8-кратной симметрией. Каждый сгиб содержит 4 копии NUP133. Следовательно, при сверхэкспрессии NUP133, слитого с GFP, мы ожидаем, что каждая складка будет содержать от 1 до 4 копий GFP вместе с эндогенным, немаркированным NUP133.Мы иммуноокрашивали GFP в клетках, сверхэкспрессирующих NUP133-GFP, получали изображения со сверхвысоким разрешением, используя новые условия визуализации ( M2 ) ( Рисунок 3c, ) и выполнили кластерный анализ ( Рисунок 3d ), чтобы сегментировать одну складку NPC ( рис. 3d, врезка ). Чтобы определить количество копий GFP в каждом кластере NUP133, мы подгоняем распределение количества локализаций на кластер (, рис. 3e, ) к линейной комбинации новых калибровочных распределений ( f i, M2 ) .Эта количественная оценка показала, что большинство кластеров NUP действительно состояли из 1-4 копий GFP, как и ожидалось (, рис. 3f, ).
Обсуждение
Внутриклеточный транспорт — это фундаментальный биологический процесс, регулируемый многими механизмами, включая регуляцию через цитоскелет микротрубочек 29 , адаптерные и вспомогательные белки 1 , а также количество копий моторных белков и молекулярное расположение моторных белков на мембране пузырьков 10 — 12 , 14 .Действительно, предыдущие работы по моделированию предсказывали, что количество копий и расположение двигателей являются важными параметрами для регулирования транспорта 10 . Однако определение точной молекулярной организации и числа копий моторов в клеточном контексте было трудным из-за небольшого размера субклеточных компартментов и моторных белков, а также тесноты внутриклеточной среды. Здесь, используя микроскопию сверхвысокого разрешения и подход калибровки на основе ДНК-оригами, который мы ранее разработали 24 , мы показываем, что динеин может кластеризоваться в наноразмерные домены, содержащие несколько моторных комплексов динеина, в частности, вдоль микротрубочек.Наши результаты согласуются с данными криоЭМ, показывающими, что эндосомальные адаптерные белки могут рекрутировать две копии динеина в очень близкой пространственной близости друг к другу 14 . Эти нанокластеры были меньше микродоменов динеина, наблюдаемых на очищенных фагосомах 11 . В будущем было бы интересно определить, связаны ли эти кластеры динеина со специфическими субклеточными пузырьками, могут ли моторы семейства кинезина также кластеризоваться и как кластеризация множественных моторов может влиять на транспорт внутри клетки.Кроме того, было бы интересно определить механизмы, которые опосредуют кластеризацию моторных белков, таких как динеин. Кластеризация может быть опосредована самим цитоскелетом, липидным составом везикул 11 или адапторными и вспомогательными белками 14 . Методы, которые мы описываем здесь, позволяют проводить эти будущие механистические и функциональные исследования.
Далее мы показываем, что для использования данных калибровки на основе ДНК-оригами, которые мы сгенерировали ранее, не обязательно строго следовать тем же условиям визуализации, что и калибровочный эксперимент, или повторять калибровочный эксперимент с использованием новых условий визуализации.Вместо этого достаточно изобразить эталонный образец при двух условиях визуализации в качестве эталонного стандарта. Если такой эксперимент проводится, можно выделить новую функцию калибровки, установив, что эталонный образец, отображаемый при различных условиях визуализации, должен содержать одинаковое распределение числа копий. Затем эту новую функцию калибровки можно применить для определения количества копий любого интересующего белка, меченного GFP, отображаемого с использованием новых настроек сбора данных. Мы подтвердили этот подход путем визуализации и определения количества копий как динеина, так и субъединицы NUP133 комплекса ядерных пор, отображаемых в различных условиях визуализации.Здесь мы использовали клетки HeLa IC74, стабильно экспрессирующие промежуточную цепь динеина, слитую с GFP, в качестве «эталонного образца», поскольку мы количественно определили количество копий динеиновых комплексов в этой клеточной линии. Однако наш подход не ограничивается использованием этой клеточной линии в качестве эталона, и можно использовать другие, более стандартные эталонные образцы, такие как коммерчески доступные репортерные клеточные линии GFP с редактированием генов. Мы обнаружили, что как µ, так и σ логнормального калибровочного распределения были хорошо ограничены подгонкой. Мы ожидаем, что степень ограничения этих двух параметров будет зависеть от формы распределения олигомеров в эталонном образце, и, следовательно, это соображение следует учитывать при выборе подходящего эталонного образца.
Наш подход учитывает не только любые различия в настройках получения изображений, но также различия в маркировке антител (например, количество флуорофоров на антитело) или буфере изображения. Сопоставление этих экспериментальных условий в разных лабораториях может быть сложной задачей. Кроме того, проведение калибровочного эксперимента с использованием ДНК-оригами требует обширной подготовки образцов, включая очистку белка и функционализацию ДНК-оригами. Также были разработаны альтернативные калибровочные стандарты, в которых используются белковые комплексы с известным числом копий, выраженных в клетках 21 , 22 , 30 , 31 .Использование этих калибровочных стандартов также требует особой осторожности, поскольку экспрессия этих белковых комплексов в клетках таким образом, чтобы они были полностью собраны и созрели без образования агрегатов, является сложной задачей. Таким образом, описанный здесь подход, заключающийся в использовании простого, легкодоступного и легкого в приготовлении эталонного стандарта для калибровки и согласования различных настроек сбора данных, поможет сделать количественную оценку стехиометрии более универсальной.
Благодарности
Клеточная линия HeLa IC74 была любезным подарком Такаши Мураямы, кафедра фармакологии, Медицинская школа университета Дзюнтендо, Токио, Япония.Мы благодарим доктора Ангела Сандоваля Альвареса за помощь в поддержании клеток и трансфекции. М.Л. выражает признательность за финансирование со стороны Медицинской школы Перельмана Пенсильванского университета, Fundació Cellex Barcelona, Седьмой рамочной программы Европейского Союза в рамках грантов Европейского исследовательского совета 337191-MOTORS и Министерства экономики и конкурентоспособности Испании и гранта Fondo Europeo de Desarrollo Regional (FEDER) FIS2015-63550-R (MINECO / FEDER). F.C.Z. выражает признательность за финансирование из программы «Северо-Очоа» для центров передового опыта в области исследований и разработок (SEV-2015-0522).СМ. выражает признательность Министерству экономики и конкурентоспособности Испании и Европейскому социальному фонду за финансирование в рамках программы «Ramón y Cajal» 2015 г. (грант RYC-2015-17896) и «Programa Estatal de I + D + i Orientada a los Retos de la Sociedad» »(Грант BFU2017-85693-R).
Детские неврологии — клетки нервной системы
Типы нейронов (нервных клеток)
Человеческое тело состоит из триллионов клеток. Клетки нервной
система, называемая нервными клетками или нейронами , специализируется на
переносить «сообщения» с помощью электрохимического процесса.Человеческий мозг имеет
примерно 86 миллиардов нейронов. Чтобы узнать, как нейроны передают сообщения,
прочитать о потенциале действия.
Нейроны бывают разных форм и размеров. Одни из самых маленьких
нейроны имеют клеточные тела шириной всего 4 микрона. Несколько из
самые большие нейроны имеют клеточные тела шириной 100 микрон. (Помнить
что 1 микрон равен одной тысячной миллиметра!).
Нейроны похожи на другие клетки тела, потому что:
- Нейроны окружены клеточной мембраной.
- Нейроны имеют ядро, содержащее гены.
- Нейроны содержат цитоплазму, митохондрии и другие органеллы.
- Нейроны осуществляют основные клеточные процессы, такие как белок
синтез и производство энергии.
Однако нейроны отличаются от других клеток тела, потому что:
- Нейроны имеют специализированные части клетки, называемые дендритами
и аксонов . Дендриты передают электрические сигналы к
тело клетки и аксоны забирают информацию от тела клетки. - Нейроны связываются друг с другом посредством электрохимического
процесс. - Нейроны содержат некоторые специализированные структуры (например, синапсы)
и химические вещества (например, нейромедиаторы).
Нейрон
Один из способов классификации нейронов — по количеству расширений, которые
простираются от тела клетки нейрона (сомы).
Биполярные нейроны имеют два отростка
выходящие из тела клетки (примеры: клетки сетчатки,
клетки обонятельного эпителия).
Псевдоуниполярные клетки (пример: дорсальные
клетки корневых ганглиев). На самом деле эти клетки имеют 2 аксона, а не
аксон и дендрит. Один аксон проходит по центру к спинному мозгу,
другой аксон простирается к коже или мышце.
Мультиполярные нейроны имеют множество отростков, которые простираются от
тело клетки. Однако у каждого нейрона есть только один аксон (примеры: спинномозговая
мотонейроны, пирамидные нейроны, клетки Пуркинье).
Нейроны также можно классифицировать по направлению, которое они посылают.
Информация.
- Сенсорные (или афферентные) нейроны: отправки
информация от сенсорных рецепторов (например, кожи, глаз, носа, языка,
уши) НАПРАВЛЕНИЕ центральной нервной системы. - Двигательные (или эфферентные) нейроны: отправить информацию
прочь от центральной нервной системы к мышцам или
железы. - Интернейроны: передают информацию между сенсорными
нейроны и мотонейроны. Большинство интернейронов расположено в центральной
нервная система.
Загляните в Галерею нейронов, чтобы увидеть
картинки реальных нейронов или «Тротуар»
Клетки »для просмотра фотографий нейронов на ул.
Есть несколько различий между аксонами и
дендриты:
| Аксоны | Дендриты |
|
|
Что внутри нейрона? В нейроне много того же
органелл , таких как митохондрии, цитоплазма и
ядро, как и другие клетки тела.
- Ядро — содержит генетический материал
(хромосомы), включая информацию для развития клеток и синтеза
белки, необходимые для поддержания и выживания клеток. Покрыт
мембрана. - Nucleolus — производит необходимые рибосомы
для трансляции генетической информации в белки - Тела Ниссля — используемые группы рибосом
для синтеза белка. - Эндоплазматический ретикулум (ЭР) — система
трубы
для транспортировки материалов внутри цитоплазмы.Может иметь рибосомы (грубая ER)
или без рибосом (гладкий ER). В случае рибосом ER важен для
синтез белка. - Аппарат Гольджи — мембраносвязанный
структура важна для упаковки пептидов и белков (включая
нейротрансмиттеры) в пузырьки. - Микрофиламенты / нейротрубочки — система
транспорт материалов внутри нейрона и может использоваться для структурных
служба поддержки. - Митохондрии —
производить энергию для подпитки клеточной деятельности.
Знаете ли вы? | Нейроны — самые старые и длинные клетки в организме! У тебя есть Нейроны могут быть довольно большими — в некоторых нейронах, например, в кортикоспинальном С Днем Рождения аппарата Гольджи, 121 -й ! В 1898 году знаменитый |
Авторские права © 1996-2019, Эрик Х. Чадлер. Все права
Зарезервированный.
ученых решают загадку о том, как двигательные молекулы кинезина ходят — или хромают — по клеткам: 12/03
НОВОСТИ
05.12.03
Марка
Шварц, служба новостей: (650) 723-9296, [email protected]
РЕДАКТОРЫ :
Исследование от 4 декабря «Кинезин движется
Асимметричный передаточный механизм »,
можно получить в Управлении по связям с общественностью AAAS:
(202) 326-6440, scipak @ aaas.org
. Тезисы можно скачать в Интернете по адресу: http://scienceexpress.org
. Область изображений доступна на сайте http://www.sciencemag.org
.
Соответствующие веб-адреса:
http://www.stanford.edu/group/blocklab/ScienceLimping
http://www.proweb.org/kinesin//index.html
Ученые
решить загадку того, как движутся молекулы кинезина —
или хромает — по ячейкам
Биофизики
в Стэнфордском университете наконец-то ответили на один из
самые фундаментальные вопросы молекулярной биологии:
Как крошечная моторная молекула, известная как кинезин,
перемещаться по живой клетке? Согласно
исследователей, решение этой давней
проблема позволит по-новому взглянуть на то, как двигатель
белки функционируют и могут открыть новые возможности
исследование для лечения рака и различных
нейродегенеративные заболевания, такие как болезнь Альцгеймера и
Хантингтона.
исследование, опубликованное 4 декабря в онлайн-издании журнала
журнал Science , соавтором которого является Стивен М.
Блок, профессор прикладной физики и
биологические науки в Стэнфорде.
«Движение
на клеточном уровне — признак того, что
живы, — сказал Блок. — Фундаментальный вопрос
как живые организмы научились двигаться?
Ответ в том, что они разработали кинезин и несколько
другие очень эффективные белковые моторы.Если бы кинезин был
полностью потерпеть неудачу, вы даже не дойдете до
стадия эмбриона, потому что ваши клетки не выживают.
Это так важно ».
Обнаружено
в 1984 году кинезин признан рабочей лошадкой
клетки, переносящие хромосомы, нейротрансмиттеры
и другой жизненно важный груз по крошечным молекулярным дорожкам
называется «микротрубочки». Многие виды
кинезин и родственные кинезину белки были
открыты за последние два десятилетия в широком диапазоне
организмы — от дрожжей до человека.
«Кинезин
функционирует как локомотив в камерах для переправы груза
вперед и назад, — сказал Блок. — В мозг
клеток, например, он захватывает эти крошечные мешочки, называемые
везикулы, которые загружены нейротрансмиттерами
которые необходимы для функционирования нейронов, и движутся
их очень большие расстояния вдоль микротрубочек ».
Просто
три миллионных дюйма в длину, типичный кинезин
молекула имеет хвост на одном конце, который тащит груз
и две шаровидные головки на другом конце, которые
поочередно хватать микротрубочку и тянуть груз
вперед.Одна голова должна быть прикреплена к
микротрубочка все время для продвижения кинезина
против нагрузок. «Это как тянуть себя
прямо вверх по лестнице руками «Блок
объяснил. «Если бы ты отпустил обе руки,
ты бы упал, и все. «
Кинезин
ходьба
Подробнее
более десяти лет лаборатория Блока и другие
пытаясь выяснить точные детали того, как
Движение двух голов кинезина — исследователи процесса
называют кинезин ходьбой.
«Там
две конкурирующие модели движения кинезина:
«inchworm and hand-over-hand», — сказал Блок.
«В модели дюймового червя ведущая головка удерживает
на микротрубочку, и задняя головка движется вверх
чтобы встретить это. Вторая возможность — это
ручное движение, которое больше похоже на способ
Мы идем по улице попеременно
каждый шаг ».
В своих
эксперимент, Блок и его коллеги использовали специально
разработанный микроскоп, названный зажимом оптической силы —
наноразмерный инструмент, который позволяет исследователям
наблюдайте, как молекула кинезина движется по
микротрубочек со скоростью примерно до 100 шагов на
второй.К своему удивлению, исследователи обнаружили
что вместо обычных шагов кинезин
на самом деле ходит прихрамывая.
«Автор:
«хромать» мы имеем в виду, что время каждого чередования
шаг отличается от промежуточного »
— сказал Блок. «Предположим, у вас болит нога,
заставляет вас хромать, и вам приходится идти по
река по ступенькам, так что у вас нет
выбор о том, где поставить ноги.Ты не хочешь
проводить много времени с больной ногой, поэтому вы
положите ее и быстро пересядьте на другую ногу. Как
в результате время на каждом втором шаге короткое,
тогда как если бы у вас были две совершенно здоровые ноги, вы бы
потратьте равное время на каждую ногу, и ваш шаг будет
обычный, не вяленый. «
Это
открытие предоставило немедленное решение одной части
головоломки кинезин-ходьба.
«As
как только мы увидели хромоту, мы сказали: «Ага!» »
вспоминал Чарльз Л. Эсбери, докторант в
Лаборатория Блока и ведущий автор исследования Science .
«Дюймовому червю невозможно хромать,
потому что одна голова всегда впереди. Следовательно
кинезин должен использовать движение руки через руку, когда
он ходит «.
Что
заставляя его хромать?
«Мы
не уверен, — сказал Блок, — но мы предполагаем
что, возможно, спиральная шея кинезина становится
перематывать и поднаживать немного каждый раз, когда это
делает шаг.«
Симметрия
в сравнении с асимметрией
открытие ручного движения привело к
исследователей, чтобы попытаться решить еще одну безответную
Вопрос: Есть ли симметрия в походке кинезина?
«Это
оказывается, что на самом деле существует два вида
ручные модели — асимметричные и
симметричный, — пояснил Блок.»Нормальный
человеческая походка асимметрична, потому что всегда заканчивается одна нога
перед другим, поэтому в конце каждого
шаг, я в другом — то есть асимметричный
положение относительно оси моего тела. В
симметричная ходьба, я в той же геометрии на
конец каждого шага ».
An
Примером может служить циркуль с карандашом на одной руке,
используется для обозначения расстояний на карте. если ты
«пройтись» компасом по листу.
бумаги, вращая одну руку перед другой,
компас всегда оказывается в той же симметрии после
каждый шаг.
«Но
хромая, по определению, означает, что каждый второй шаг
должен быть другим », — добавил он.
движения кинезина должны быть асимметричными, чтобы мы могли
отвергнуть как модель дюймового червя, так и симметричный
ручная модель. «
Потенциал
терапии
система кинезин-микротрубочка участвует в
несколько серьезных заболеваний, что является одной из причин, почему
медицинские исследователи особенно интересуются
понимание мелких деталей того, как ходят кинезины
через микротрубочки.
«А
ряд заболеваний — таких как болезнь Хантингтона и
Болезнь Альцгеймера — связаны белками, объединенными в
ячейку способами, которых они не должны, «Блокировать
сказал. «Клетка пытается избавиться от этих плохих
белковые агрегаты, транспортируя их в другое место
с использованием моторных молекул, таких как кинезин. Если бы мы могли
понять кое-что о транспорте белка
сделано правильно, тогда, может быть, мы сможем узнать что-нибудь о
как это сделано неправильно.Возможно, удастся разработать
методы лечения, которые блокируют движение кинсейна и предотвращают
плохие вещи происходят. В будущем может даже
возможно разработать менее токсичные методы лечения, которые
нацелены на специфические кинезины в раковых клетках, без
вредят здоровым «.
Для
например, таксол, препарат, обычно используемый для лечения груди
рак, работает за счет стабилизации микротрубочек, которые
кинезины ходят и не дают им
Деполимеризация, отметил Блок.
Последние
исследования также показали, что некоторые вирусы,
включая оспу и герпес, заражают клетки
— проехался на кинезине, — добавил Адриан Н. Фер,
аспирант прикладной физики Стэнфорда и
соавтор исследования Science .
«Обычно кинезин перемещает груз из одной части
ячейку в другую, — сказал он.
у вирусов есть химические рецепторы, кинезиновые
распознает, что позволяет им захватить кинезин
и получите бесплатную поездку по камере.«
исследование финансировалось Национальным институтом общей
Медицинские науки и Стэнфордский университет.
-30-
Марк
Шварц
Снижение выживаемости белка моторного нейрона (SMN) в предшественниках моторных нейронов, автономно функционирующих в клетке, вызывая спинальную мышечную атрофию у модельных мышей, экспрессирующих центромерный ген человека (SMN2)
Введение
Проксимальная спинальная мышечная атрофия (СМА) — распространенное, часто смертельное, детское нейродегенеративное заболевание, вызванное мутациями в выживании гена моторного нейрона 1 ( SMN1 ) (Lefebvre et al., 1995). Почти идентичный копируемый ген, SMN2 , не может компенсировать потерю SMN1 из-за трансляционно молчащего изменения нуклеотида C → T в экзоне 7 (Lorson et al., 1999; Monani et al., 1999), который нарушает правильный сплайсинг гена (Cartegni and Krainer, 2002; Kashima and Manley, 2003). Таким образом, SMN2 продуцирует только ~ 10% полноразмерного функционального белка, производного от SMN1 , и неспособен, за исключением множественных копий, защищать от дегенерации двигательных нейронов и фенотипа SMA у пораженных людей (Monani, 2005).
Повсеместная экспрессия белка SMN согласуется с важной ролью в биогенезе частиц U snRNP (малый ядерный рибонуклеопротеин) (Fischer et al., 1997; Liu et al., 1997). В самом деле, сборка этих частиц, которая является критическим шагом в правильном сплайсинге пре-мРНК, серьезно нарушается как в клеточных, так и в животных моделях SMA (Gabanella et al., 2007). Тем не менее, в отсутствие идентифицированного транскрипта или группы генов, выборочно неправильно сплайсированных в пораженных тканях, вызывает недоумение, как нарушение функции домашнего хозяйства приводит в основном к нервно-мышечному фенотипу.Также существует неопределенность относительно точных клеточных участков действия белка SMN. К очевидным подозреваемым относятся скелетные мышцы и двигательные нервы, поскольку фенотип заболевания в основном имеет нервно-мышечное происхождение. В предыдущих попытках выяснить, где уровни SMN дикого типа необходимы для предотвращения SMA, белок был выборочно отключен в этих и других тканях (Frugier et al., 2000; Cifuentes-Diaz et al., 2001; Vitte et al. , 2004). Хотя мышечные и нейрональные мыши с нокаутом развили фенотип и в конечном итоге умерли от болезни, результаты не удивительны.SMN важен для выживания клеток, и мыши с нокаутом были сконструированы таким образом, чтобы белок подавлялся, а не уменьшался, как при болезни человека. Более того, эксперименты по нацеливанию на нервы уничтожили SMN без разбора во всех нейронах, включая моторные и сенсорные нейроны. Используя обратный подход для исследования тканевой специфичности SMN, белок был трансгенно восстановлен в нервной ткани сильно пораженных модельных мышей (Gavrilina et al., 2008). Однако эктопическая экспрессия трансгена у мышей привела к невозможности однозначно определить, требуется ли SMN исключительно в нервах, мышцах и / или других тканях для предотвращения фенотипа SMA.В более поздних работах аденоассоциированные вирусные векторы были использованы для восстановления SMN глобально или конкретно в нервной ткани мышей с моделью SMA (Foust et al., 2010; Passini et al., 2010; Valori et al., 2010). Хотя во всех трех исследованиях сообщалось о выраженном положительном эффекте, степень пользы значительно различалась. Кроме того, сравнение результатов двух отчетов (Foust et al., 2010; Passini et al., 2010) позволяет предположить, что может быть улучшен эффект, если белок восстанавливается повсеместно, а не избирательно в нервах.
Чтобы внести дополнительную ясность в тканеспецифические требования к белку SMN и уточнить предыдущие попытки выяснить его клеточный сайт действия, мы выбрали выборочное истощение, но не уничтожение белка в двигательных нейронах здоровых мышей. Наши результаты показывают, что целевого истощения SMN в предшественниках моторных нейронов достаточно, чтобы вызвать нейромышечный фенотип, напоминающий человеческий SMA, подразумевая, что эти клетки в первую очередь участвуют в развитии болезненных состояний.Однако болезнь менее серьезна, чем у мышей, экспрессирующих повсеместно низкие уровни SMN, и, что интересно, функциональные дефекты, очевидные у новорожденных, были значительно уменьшены на второй постнатальной неделе жизни. Эти результаты подчеркивают абсолютную необходимость нацеливания на двигательные нервы при разработке эффективных методов лечения, но также подчеркивают способность окружающих типов клеток модулировать в течение болезни патологию, которая возникает клеточно-автономным образом в двигательных нейронах.
Результаты
Olig2-Cre управляет рекомбинацией индуцибельного аллеля
Smn избирательно в нервной ткани и экспрессируется на высоком уровне в моторных нейронах спинного мозга
Для исследования тканевой специфичности белка SMN мы использовали floxed Smn (Smn F7 ), индуцибельный нокаут-аллель, который инактивируется при рекомбинации, опосредованной Cre (Miniou et al., 1999). Чтобы инактивировать аллель в двигательных нервах, мы первоначально рассматривали возможность использования трансгенной линии NSE-Cre, в которой экспрессия рекомбиназы Cre управляется регуляторными элементами гена нейрон-специфической энолазы (NSE) крысы (Frugier et al., 2000). Однако ген NSE экспрессируется пан-нейронально, и конкретная линия, которую мы рассмотрели, подобно другим трансгенам NSE-Cre (Kwon et al., 2006), также экспрессирует Cre на низких уровнях вне нервной системы. Поэтому мы решили использовать трансгенную линию Olig2-Cre, в которой кассета Cre выбита в локус предшественника моторного нейрона, экспрессирующего ген Olig2 (Dessaud et al., 2007; Novitch et al., 2001). Эндогенный ген Olig2 экспрессируется в эмбриональный день 9,5 (E9.5) в вентральном спинном мозге мыши (Zhou et al., 2000), а экспрессия Cre из линии делетеров Olig2-Cre наблюдается уже на E10.5 (Dessaud et al., 2007). Чтобы установить тканевую специфичность Cre-опосредованной рекомбинации с использованием этой трансгенной линии, мы скрестили мышей с животными, несущими индуцибельный аллель floxed Smn , и отобрали двойных трансгенных ( Olig2-Cre ; Smn F7 / + ) мышей. для анализа. ПЦР для обнаружения Cre-опосредованной рекомбинации аллеля Smn F7 в широкой панели типов тканей показала, что инактивация аллеля ограничивалась нервной тканью (головной и спинной мозг) (рис.1 А ). Важно отметить, что рекомбинации в ткани скелетных мышц двойных трансгенных мышей обнаружено не было.
Рис. 1.
-специфичность рекомбинации Smn F7 , управляемой Olig2-Cre, в нервной ткани. A , Праймеры, специфичные для аллеля Smn Δ7 , обнаруживают событие рекомбинации в геномной ДНК, выделенной только из спинного мозга и ткани мозга взрослого человека (PND30) Olig2-Cre ; Smn F7 / + , но не Smn F7 / + мышей.Присутствие полос, соответствующих аллелю Smn F7 в нервной ткани двойных трансгенных растений, отражает клетки, не экспрессирующие Olig2-Cre. Амплификация аллеля дикого типа служит внутренним контролем. B , Обнаружение флуоресценции GFP в ChAT-позитивных моторных нейронах вентрального рога мышей Olig2-Cre, экспрессирующих ROSA26-flox-STOP-flox-YFP, свидетельствует о сильной экспрессии Cre-рекомбиназы в этих клетках. Отсутствие детектируемой флуоресценции GFP в сенсорных нейронах DRG, экспрессирующих нейронный кадгерин, мышей указывает на то, что экспрессия Olig2-Cre не является паннейрональной.Мыши ROSA26-flox-STOP-flox-YFP, лишенные трансгена Olig2-Cre, не могут экспрессировать флуоресценцию GFP в клетках вентрального рога. Шкала 100 мкм.
Чтобы дополнительно охарактеризовать специфичность клеточного типа трансгенной линии Olig2-Cre и определить, ограничивается ли экспрессия Cre большими двигательными нейронами вентрального рога спинного мозга или является пан-нейрональной, мы скрестили мышей с ROSA26-flox. -STOP-flox-YFP репортерные животные (Srinivas et al., 2001). Срезы спинного мозга мышей ROSA26YFP, несущих трансген Olig2-Cre, были приготовлены и исследованы на наличие флуоресценции YFP.Наши результаты показывают, что большие ChAT-положительные нейроны вентрального рога также экспрессируют YFP, в то время как сенсорные нейроны DRG этого не делают (Fig. 1 B ). Мы оценили, что около 98% ChAT-положительных клеток ( N = 887 клеток; n = 3 мыши) коэкспрессировали YFP по длине спинного мозга, что свидетельствует об эффективности рекомбинации, опосредованной Olig2-Cre. YFP-экспрессирующие клетки, лежащие вне вентрального рога, вероятно, являются олигодендроцитами, т.к. известно, что Olig2 функционирует последовательно в спецификации судьбы двигательных нейронов и олигодендроцитов.Тем не менее, наши результаты демонстрируют, что Olig2-Cre-опосредованная рекомбинация не только специфична для нервной ткани, но также ограничивается среди нейронов спинными моторными, а не сенсорными нейронами.
Истощение SMN в предшественниках двигательных нейронов достаточно, чтобы вызвать фенотип SMA
Подтвердив, что экспрессия Cre в трансгенной линии Olig2-Cre ограничена нервной системой и влияет на эффективную рекомбинацию в спинномозговых моторных, но не сенсорных нейронах DRG, мы приступили к определению фенотипического эффекта снижения уровня SMN до уровней болезненного состояния у клетки переднего рога.В предыдущем исследовании экспрессия Cre в нервной ткани приводила к полному нокауту белка SMN в клетках-мишенях из-за использованной специфической стратегии. Ожидается, что такой исход будет летальным для тех клеток, в которых происходит рекомбинация индуцибельного аллеля Smn и никогда не наблюдается в человеческом СМА, который характеризуется постоянными низкими уровнями белка SMN. Чтобы гарантировать, что мы истощили, но не уничтожили SMN в моторных нейрональных клетках, трансген SMN2 (Monani et al., 2000) был введен в генетический фон всех мышей, впоследствии полученных для этого исследования (рис. 2 A ). Чтобы свести к минимуму количество событий рекомбинации, необходимых для истощения белка SMN в двигательных нейронах до релевантных для заболевания уровней, мы также ввели нулевой мышиный аллель Smn (Schrank et al., 1997) в наши генетические скрещивания. Это позволило нам создать гетерозиготы с флокированным аллелем Smn на одной хромосоме и нулевым аллелем ( Smn F7 / — ) на его гомологе. Smn F7 / — мышей, коэкспрессирующих Olig2-Cre и гомозиготных по SMN2 ( Olig2-Cre ; SMN2 + / + ; Smn F7 / — ), далее Olig2. Cre SMA мутанты, были получены с ожидаемой частотой 12,5% и были неотличимы от контрольных ( Olig2-Cre ; SMN2 + / + ; Smn F7 / + ) однопометников при рождении. Однако по PND2 появилась значительная разница в весе между мутантами и контрольными однопометниками (контроль, 2.38 ± 0,07 г; мутант, 2,02 ± 0,04 г; n ≥ 10, p <0,01, t test), и эта разница сохранялась на протяжении всей жизни животных (рис. 2 B ).
Рисунок 2.
Olig2-Cre мутанты SMA экспрессируют белок SMN в нервной ткани и проявляют нейромышечный фенотип. A , Генетические скрещивания для получения мышей с мутантным Olig2-Cre SMA. B , Разница в весе становится очевидной у мутантов Olig2-Cre SMA на PND2 и остается значительной (* p <0.05; ** p <0,01; *** p <0,001) во взрослую жизнь; n ≥ 10 для каждого генотипа. C , Ранняя и тяжелая нервно-мышечная слабость у мутантов Olig2-Cre SMA смягчается в зависимости от возраста, в то время как фенотип остается очевидным по мере прогрессирования заболевания у мутантов мышей Δ7 SMA и значительно ухудшается (средняя разница 3,001, p <0,001, однофакторный дисперсионный анализ), чем предыдущая когорта в PND6; n ≥ 12 для каждого генотипа. D , Увеличение тяжести заболевания мутантов Δ7 SMA, экспрессирующих повсеместно низкий SMN, по сравнению с мышами Olig2-Cre SMA, избирательно истощенными по белку в нервной ткани. Кривые выживаемости Каплана-Мейера, цензурированные на PND340, значительно различаются между двумя мутантными группами (лог-ранговый тест, χ 2 = 26,09, p <0,0001, n ≥ 10 для каждого генотипа). Кроме того, мутанты Olig2-Cre SMA ( n = 11), гемизиготные по SMN2 , имеют значительно сниженную выживаемость (средняя выживаемость, 1.81 ± 0,7 г) по сравнению с мутантами Olig2-Cre, гомозиготными по трансгену. Примечание: * p <0,01; ** p <0,001. E , Общий фенотип мутантов Olig2-Cre SMA, демонстрирующих относительно тяжелую (1) и более легкую (2) формы нервно-мышечного заболевания. Тяжелые мутанты часто демонстрируют заметный кифоз (стрелка) позвоночника. F , Серьезное и избирательное снижение белка SMN в нервной ткани мутантов Olig2-Cre SMA (Mut) и контрольных (Con) однопометников.α-Туба, α-Тубулин. G , Оценка SMN в экстрактах спинного мозга (10, 20 и 30 мкг) PND15 Δ7 SMA, Olig2-Cre SMA и контрольных животных указывает на значительное истощение белка у мутантов. Как и ожидалось, избирательное истощение предшественников двигательных нейронов приводит к более высоким уровням в спинном мозге, мутантном по Olig2-Cre, по сравнению с тканью Δ7 SMA. Контроль: SMN2 + / + ; Olig2-Cre +/- ; Smn F7 / + ; Olig2-Cre SMA: SMN2 + / + ; Olig2-Cre +/- ; Smn F7 / — ; Δ7 SMA: SMN2 + / + ; SMN Δ 7 + / + ; Смн — / — .
Принимая во внимание скромную (~ 15%) начальную разницу в массе тела, мутанты были заметно слабыми при PND2 из-за нарушения способности выпрямляться, когда животных переворачивали на спину. Слабость все еще была очевидна в PND7 (дополнительное видео 1, доступно на www.jneurosci.org в качестве дополнительного материала). Однако, что весьма примечательно, нарушенный рефлекс выпрямления постепенно угас, так что к концу второй недели жизни разница между пораженными животными и контрольными однопометниками была незначительной (рис.2 С ). Напротив, симптомы заболевания у мышей с Δ7 SMA ( SMN2 + / + ; SMN Δ 7 + / + ; Smn — / — ) мышей, экспрессирующих повсеместно низкие уровни SMN. белка неумолимо ухудшается с возрастом и мышечной слабостью, что оценивается по нарушению выпрямления, и остается значимым до смерти на ∼PND13 (Рис. 2 C , D ) (Le et al., 2005). В соответствии с постепенным ослаблением тяжелой слабости новорожденных Olig2-Cre SMA, большинство (~ 70%) мутантов дожили до возраста ~ 12 месяцев по сравнению со 100% контрольных однопометников и 0% мутантов Δ7 SMA, экспрессирующих повсеместно низкий SMN (рис.2 D ). Тем не менее, даже во взрослом возрасте мутанты Olig2-Cre SMA четко отличались от контрольных однопометников по размеру, уменьшенной мышечной массе (дополнительный рис. S1, доступный на www.jneurosci.org в качестве дополнительного материала) и в некоторых случаях очевидному кифозу позвоночник (рис. 2 E ). Кроме того, несмотря на ослабление нарушенной способности выпрямления, зрелые мутанты Olig2-Cre SMA продолжали демонстрировать значительную слабость, что оценивалось по силе захвата (данные не показаны) и тесту открытого поля (пройденное расстояние за 60 мин: контроль, 7225 ± 378 см; мутант 4771 ± 226 см; n ≥ 4 в каждом случае, p <0.01, т тест). Интересно, что мутанты Olig2-Cre SMA, гемизиготные по трансгену SMN2 , были гораздо более серьезно затронуты в зависимости от выживаемости, чем мыши, гомозиготные по трансгену (фиг. 2 D ). Этот результат, который согласуется с другим исследованием (McGovern et al., 2008), предполагает, что даже одна дополнительная копия SMN2 может иметь глубокое влияние на общий фенотип заболевания. Однако ранняя летальность гемизиготных мутантов Olig2-Cre SMN2 не позволила провести обширный анализ этих животных, и поэтому все последующие эксперименты были проведены на гомозиготных мутантах SMN2 ( Olig2-Cre ; SMN2 + / + ; Смн F7 / — ).
Для определения уровней SMN в мутантах Olig2-Cre SMA были выполнены вестерн-блот-анализы ткани из мутантов ( Olig2-Cre ; SMN2 + / + ; Smn F7 / — ) и сопоставимых по возрасту элементы управления ( Olig2-Cre ; SMN2 + / + ; Smn F7 / + ). Как и ожидалось, произошло резкое снижение белка в спинном и головном мозге, но не в других тканях (рис. 2 F ). Важно отметить, что скелетные мышцы мутантных мышей экспрессировали уровни белка SMN дикого типа, что согласуется с отсутствием какой-либо детектируемой рекомбинации в локусе floxed Smn (рис.1 А ). Сравнительный анализ уровней SMN в Δ7 SMA, SMN2 + / + Olig2-Cre SMA и контрольных животных также продемонстрировал поразительную разницу между мутантами и контрольными животными, что свидетельствует об эффективности, с которой Olig2-Cre истощает белок. в ткани спинного мозга (рис. 2 G ). Однако разница в SMN между двумя мутантами была более скромной с более высокими уровнями у мутанта Olig2-Cre SMA. Этого результата можно было бы ожидать, если бы клетки, не экспрессирующие Olig2-Cre, такие как астроциты и интернейроны в спинном мозге мышей Olig2-Cre SMA, продолжали экспрессировать уровни SMN дикого типа.В совокупности описанные здесь результаты демонстрируют, что истощение SMN в моторных нейронах спинного мозга достаточно, чтобы вызвать SMA. Однако ранний, тяжелый фенотип заболевания мутантов Olig2-Cre SMA несколько смягчается в зависимости от возраста, и быстро прогрессирующее заболевание, которое приводит к преждевременной смерти мышей Δ7 ‘SMA, экспрессирующих сниженный SMN во всех тканях, гораздо менее очевидно. после селективного нокдауна моторных нейронов SMN. Это говорит о том, что типы ненервных клеток модулируют общий фенотип СМА либо напрямую, внося свой вклад в заболевание, либо косвенно, воздействуя на двигательные нейроны и ускоряя их возможную гибель.
SMN функционирует автономно внутри мотонейронов, вызывая нейродегенерацию, мышечную атрофию и потерю мышечных волокон
Установив, что мутанты Olig2-Cre SMA экспрессируют значительно сниженный белок SMN в ткани спинного мозга, мы попытались изучить его патологические последствия для нервно-мышечной системы. Количественная оценка числа мотонейронов у PND7 Olig2-Cre SMA мутантов и контрольных однопометников выявила умеренное, но статистически незначимое снижение количества мотонейронов поясницы и шейки матки у пораженных мышей (дополнительный рис.S2, доступно на www.jneurosci.org в качестве дополнительных материалов). Однако у мутантов PND40 было на ∼40% (шейный) и ∼25% (поясничный) меньше мотонейронов, чем у контрольных однопометников (рис. 3 A , B ). Этот результат предоставляет важные доказательства для системы млекопитающих, что нейродегенерация при СМА, скорее всего, является клеточно-автономным следствием снижения SMN в предшественниках двигательных нейронов и, вполне возможно, в двигательных нейронах, которые из них возникают. Результат также согласуется с представлением о том, что потеря тел клеток двигательных нейронов в спинном мозге модельных мышей и, предположительно, пациентов также является относительно поздним событием (Monani et al., 2000). Чтобы исследовать уровни экспрессии SMN в оставшихся двигательных нейронах, срезы спинного мозга были дважды помечены антителами против SMN и против ChAT. Как ожидалось и согласуется с результатами вестерн-блоттинга, экспрессия SMN была значительно снижена в клетках вентрального рога и интенсивность окрашивания SMN, аналогичная таковой для мотонейронов у мышей модели Δ7 SMA (фиг. 3 C ).
Рисунок 3.
Нервно-мышечная патология мутантов Olig2-Cre SMA. A , B , Потеря двигательных нейронов значительна в поясничном отделе (** p <0.01, n > 5, t test) и шейный (*** p <0,001, n > 5, t test) спинной мозг мутантных животных. C , Выжившие (ChAT-положительные) мотонейроны мутантов Olig2-Cre SMA экспрессируют уровни белка SMN, сравнимые с таковыми у мышей Δ7 SMA и заметно меньше, чем в клетках в контрольных однопометниках. На вставках показаны увеличенные примеры отдельных двигательных нейронов у разных мышей. Интенсивность окрашивания мотонейронов Olig2-Cre была значительно снижена по сравнению с таковыми у контрольных мышей, но не отличалась от таковой у мутантов Δ7 SMA ( n ≥ 50 клеток; *** p <0.001 между контролем и мутантами; Н.С. p > 0,05 между мутантами Olig2-Cre и Δ7, однофакторный дисперсионный анализ ANOVA). D , Мышечная патология мутантов Olig2-Cre SMA, по оценке на поперечном срезе проксимальных и дистальных мышц, окрашенных H & E, характеризуется атрофическими волокнами (стрелки), центрально расположенными ядрами (стрелки). и гипертрофия. E , Частотное распределение площади отдельных мышечных волокон указывает на значительную гипертрофию как проксимальных, так и дистальных групп мышц у мутантов Olig2-Cre SMA ( n ≥ 4 каждого генотипа).Масштабные линейки, B , 100 мкм; C , 100 мкм, вставки, 25 мкм, D , 50 мкм.
Атрофия мышц является признаком СМА человека и также наблюдается у модельных мышей (Le et al., 2005; Monani et al., 2003; Bowerman et al., 2009). Предполагается, что он имеет преимущественно нейрогенное происхождение. Мы смогли проверить это предположение на мутантах Olig2-Cre SMA, потому что эти животные экспрессируют сниженный SMN только в предшественниках моторных нейронов. Проксимальные (трицепс) и дистальные (икроножные) мышцы были получены от взрослых мутантов и контрольных однопометников, а отдельные волокна были исследованы в поперечном срезе.Как и ожидалось, было множество случаев атрофических волокон у пораженных мышей (рис. 3 D ), что дает самое четкое свидетельство того, что одной потери двигательных нейронов достаточно, чтобы вызвать атрофию мышц при СМА. Интересно, что небольшая, но значительная часть волокон также имеет центрально расположенные ядра (икроножная мышца: контроль, 1,26 ± 0,17; мутант, 6,67 ± 0,815, p <0,01; трицепс: контроль, 1,57 ± 0,26; мутант, 15,62 ± 2,64, ). p <0,05 t тест, n ≥ 4 в каждом случае) (рис.3 D ), что свидетельствует о продолжающемся регенеративном процессе в мутантной мышце. Самое интересное, что, несмотря на присутствие атрофических волокон, средний размер мутантных волокон был значительно больше, чем у контролей (рис. 3 E ). Учитывая, что общая мутантная мышечная масса была значительно уменьшена как в передних, так и в задних конечностях (рис. S1, доступный на www.jneurosci.org в качестве дополнительного материала), мы предсказали снижение количества волокон у мутантных животных. Количественная оценка количества волокон у мутантов Olig2-Cre SMA показала, что это действительно так (gastrocnemius: контроль, 670 ± 28; мутант, 428 ± 31, p <0.01; Трицепс: контроль, 703 ± 37; мутант, 545 ± 49, p <0,05, t тест, n ≥ 4 в каждом случае). Поскольку размеры контрольных икроножных и трицепсов на ~ 30 и ~ 24% больше, чем у эквивалентных мутантных мышц, количество волокон на единицу площади является недооценкой реальной разницы между двумя группами животных. Тем не менее, этот результат предполагает, что уменьшение SMN в двигательных нейронах либо влияет на развитие соответствующего количества мышечных волокон, либо приводит к их постепенной потере постнатально.Чтобы различать две возможности, мы количественно определили количество волокон мутантов PND7 Olig2-Cre SMA и контрольных однопометников. Не было очевидной значимой разницы в числах (контрольный трицепс, 1035 ± 11; мутантный трицепс, 953 ± 34, p > 0,05, тест t ; n = 3), что позволяет предположить, что развитие мышц у мутантных мышей является нормальным и потеря клетчатки происходит между неонатальным (PND7) и взрослым этапами жизни. Вместе полученные результаты демонстрируют, что SMN функционирует клеточно-автономным образом, обеспечивая здоровье и поддержание двигательных нейронов.Истощение SMN моторных нейронов не только вызывает дегенерацию этих клеток, но также приводит к атрофии и потере мышц, которые вместе обеспечивают клеточную основу нервно-мышечной слабости, очевидной у мутантов Olig2-Cre SMA.
Периферические, а также центральные синаптические дефекты в ответ на истощение SMN моторных нейронов
Мы и другие ранее продемонстрировали, что дефекты нервно-мышечных соединений являются определяющей характеристикой СМА у пациентов, а также у модельных мышей (Kariya et al., 2008; Kong et al., 2009). Чтобы определить, достаточно ли избирательного истощения SMN в предшественниках двигательных нейронов для возникновения этих глубоких периферических аномалий, мы исследовали проксимальную (трицепс) и дистальную (икроножную мышцу) группы мутантов PND7 Olig2-Cre SMA. Ранее мы показали, что мыши Δ7 SMA одного возраста имеют тяжелую патологию НМС (Kariya et al., 2008). В соответствии с более мягким фенотипом мутантов Olig2-Cre SMA, мы не нашли доказательств агрегатов нейрофиламентов или аномалий кластеров ацетилхолиновых рецепторов в их НМС (данные не показаны).Однако к 2-недельному возрасту пресинаптические, а также постсинаптические дефекты стали очевидными. В пресинапсе агрегаты NF имели инфильтрацию нервных окончаний, а конечные ветви были заметно раздутыми. Постсинаптически были четкие доказательства отсроченного созревания кластеров AChR в характерные «крендели» (рис. 4 A ). У мышей Δ7 SMA невозможно оценить патологию НМС у полностью зрелых взрослых мышей из-за серьезности фенотипа заболевания и, как следствие, летальности в течение второй постнатальной недели жизни.С другой стороны, мутанты Olig2-Cre SMA поддаются этому анализу, поскольку они доживают до зрелого возраста, но экспрессируют «тяжелые» уровни SMA SMA в своих моторных нейронах. Поэтому мы извлекли и исследовали мышцы 5-недельных мутантов Olig2-Cre SMA. Наш анализ показывает, что аномальные количества белка NF сохраняются в нервных окончаниях как проксимальных, так и дистальных мышц. Однако, в отличие от плохого конечного ветвления, наблюдаемого в НМС мышей поздней стадии Δ7 SMA (Kariya et al., 2008), ветвление в синапсах взрослых мутантов Olig2-Cre SMA оказалось обширным, и белок нейрофиламента занимал значительно большую долю НМС, чем в контрольной группе однопометников (рис.4 B , C ). В постсинапсе> 75% кластеров гастрокнемиальных AChR приобрели конформацию, подобную кренделю, но более половины из них выглядели сильно фрагментированными, часто плохо окрашивались и были заметно крупнее (мутант gastrocnemius, 1052 ± 78 мкм 2 ; контроль, gastrocnemius, 625 ± 25 мкм 2 ; n > 3, p <0,01, t тест), чем у контрольных НМС, вероятно, следствие рассредоточения рецепторов (рис.4 B , D ; Рисунок.S3, доступно на www.jneurosci.org в качестве дополнительных материалов). Тем не менее области внутри фрагментированных кренделей без AChR были перекрыты NF-положительными окончаниями, создавая вид рецепторных кластеров, удерживаемых вместе нервными окончаниями. Напротив, NMJs дикого типа образуют «интактные» крендели, внутри которых нервные окончания неизменно располагаются на AChRs (Fig. 4 B ). Интересно, что мутантные кластеры AChR трицепса не смогли достичь уровня сложности своих гастрокнемиальных аналогов.Скорее, преобладание НМС в этой мышце оказалось меньше (мутантный трицепс, 464 ± 24 мкм 2 ; контрольный трицепс, 745 ± 62 мкм 2 ; мутантная икроножная мышца, 1052 ± 78 мкм 2 , односторонний ANOVA , p <0,01), заметно деформированы и менее зрелы (рис. 4 B , D ), чем нервно-мышечные синапсы мутантной икроножной мышцы или трицепса дикого типа, что свидетельствует о дифференциальной уязвимости проксимальных и дистальных мышц для уменьшение SMN мотонейронов.Сводка этих результатов представлена в виде таблицы (Таблица 1). Из нашего анализа нервно-мышечных синапсов у мутантов Olig2-Cre SMA можно сделать несколько выводов. Во-первых, истощение SMN в предшественниках двигательных нейронов при сохранении неповрежденной мышцы достаточно, чтобы вызвать структурные аномалии как пресинаптических, так и постсинаптических специализаций. Во-вторых, прогрессирование заболевания, основанное на патологии НМС, не такое быстрое у мышей, экспрессирующих SMN дикого типа в ненервной ткани, как у мутантов, экспрессирующих повсеместно низкий SMN.В-третьих, несмотря на серьезное сокращение белка SMN моторных нейронов по мере прогрессирования заболевания, НМС действительно разветвляются и созревают, хотя и не полностью. Однако кластеры AChR в конечном итоге регрессируют и становятся фрагментированными, скорее всего, из-за смерти и / или серьезной дисфункции иннервирующих мотонейронов. Наконец, в соответствии с избирательной уязвимостью определенных групп мышц при СМА человека, НМС проксимально расположенных трицепсов, по-видимому, значительно задерживаются в своем созревании по сравнению с таковыми из дистального отдела икроножной мышцы, несмотря на присутствие фрагментированных НМС в обеих группах мышц.
Рисунок 4.
Периферические и центральные синаптические дефекты у мутантов Olig2-Cre SMA. A , Избирательного истощения SMN в двигательных нейронах достаточно, чтобы вызвать дефекты пресинаптических, а также постсинаптических специализаций нервно-мышечных синапсов к 2-недельному возрасту. Нервные окончания, как видно на трицепсе, кажутся инфильтрованными аномальными уровнями белка NF (стрелки). В среднем интенсивность флуоресценции NF была вдвое выше как в проксимальных, так и в дистальных мышцах мутантных животных, в то время как кластеры AChR в постсинапсе не могли развиться в так называемые крендели (стрелки).Накопление NF: ** p <0,01; N = 3 мыши, n ≥ 40 НМС; Сложность АЧР: * р <0,05; N = 3 мыши, n ≥ 70 НМС, t тест в обоих случаях. B , НМС в дистальных мышцах (икроножная мышца) взрослых мышей Olig2-Cre SMA зрелые, но преимущественно фрагментированы и продолжают демонстрировать заметные опухоли NF (стрелки), которые часто не перекрываются с AChR (стрелки). Напротив, НМС проксимального отдела трицепса выглядят в основном плохо развитыми с меньшим количеством перфораций и агрегатов NF. C , Количественная оценка накопления NF в пресинапсах взрослой мутантной мышцы на основе степени перекрытия между NF-положительными нервными окончаниями и окрашенными α-BT AChR, p <0,01; N = 3, n ≥ 100 НМС, t тест. D , Количественная оценка постсинаптических дефектов в мышцах взрослых мышей Olig2-Cre SMA на основе степени сложности кластеров AChR. Изображены примеры бляшкообразных кластеров AChR, интактных и фрагментированных кренделей (было исследовано ≥ 100 НМС). E , Истощение SMN моторных нейронов нарушает связь между проприоцептивными нейронами DRG и мотонейронами у взрослых мутантов Olig2-Cre SMA. Количество vGlut1-положительных сенсорных бутонов и площади этих бутонов на мотонейронах (см. Стрелки на ChAT-положительных клетках) значительно уменьшены ( p <0,001; N = 3, n ≥ 15 мотонейронов) несмотря на умеренное увеличение общего количества точек vGlut1 в мутантном спинном мозге. F , G , Проприоцептивная сенсомоторная связь аналогичным образом нарушается на PND7 в ответ на избирательное истощение моторных нейронов и повсеместное истощение SMN и распространяется на уменьшение общего количества точек vGlut1 в вентральном спинном мозге ( Ф ).Масштабные линейки, B , 20 мкм; E , 25 мкм.
Таблица 1.
Дефекты нервно-мышечного соединения у взрослых мышей с мутантом Olig2-Cre SMA
Нарушение двигательной функции может быть следствием нарушений не только нервно-мышечного синапса, но также и центральных синапсов. Например, потеря функции фактора транскрипции ETS Er81 нарушает формирование сенсомоторных связей в спинном мозге и приводит к тяжелому моторному фенотипу (Arber et al., 2000). Понятно, что периферические дефекты НМС являются важным аспектом патологии, характерной для СМА. Чтобы исследовать центральные связи в SMA и сенсомоторных синапсах в частности, мы исследовали сенсорные афферентные входы Ia на моторные нейроны. Для визуализации проприоцептивных сенсорных окончаний на моторных нейронах срезы спинного мозга взрослых мутантов Olig2-Cre SMA и контрольных однопометников были обработаны антителами против ChAT и везикулярного транспортера глутамата 1 (vGlut1).Ранее было показано, что vGlut1 локализуется в терминалах афферентов Ia на моторных нейронах (Oliveira et al., 2003). Интересно, что несмотря на умеренное увеличение общего количества точек vGlut1 в вентральных рогах мышей Olig2-Cre SMA, количество бутонов, расположенных рядом с ChAT-положительными мотонейронами у мутантов, было значительно снижено (фиг. 4 E ). Кроме того, средняя площадь этих синаптических бутонов была уменьшена (рис. 4 E ). Это указывает на глубокое изменение синаптического покрытия мотонейронов вентрального рога сенсорными окончаниями Ia.Однако, поскольку проприоцептивные нейроны DRG в мутантах Olig2-Cre SMA экспрессируют уровни SMN дикого типа, эти дефекты вряд ли являются следствием нарушений, которые присущи сенсорным нейронам. Для дальнейшего изучения времени появления этого нового центрального синаптического дефекта, а также того, что аномалия, как ожидается, будет возникать также в условиях повсеместно низкого SMN, мы исследовали спинной мозг мутантов PND7 Olig2-Cre SMA, мышей Δ7 SMA и контролировать однопометников.Интересно, что у новорожденных Olig2-Cre SMA, помимо уменьшения количества бутонов vGlut1 и их площадей на мотонейронах, общее количество количественно определяемых точек в вентральном роге было уменьшено (Рис.4 F , G ; дополнительный Рис. S4, доступный на www.jneurosci.org в качестве дополнительного материала), предполагая еще более острую аберрацию в проекции проприоцептивных сенсорных нейронов на клетки вентрального рога на этой ранней стадии заболевания. Однако морфологические данные согласуются с частичным смягчением фенотипа заболевания в зависимости от возраста у мутантов Olig2-Cre SMA.Количественная оценка синаптического покрытия мотонейронов у мышей Δ7 SMA выявила аналогичные аберрации в условиях повсеместно низкого SMN (рис. 4 F , G ). В самом деле, аномалия более серьезна, чем у мутантов Olig2-Cre SMA, что позволяет предположить, что даже если дефект возникает в двигательных нейронах, другие типы клеток могут модулировать степень общего фенотипа. Таким образом, эти результаты предполагают, что периферические синапсы — не единственные, на которые влияет снижение SMN моторных нейронов.Центральные синапсы также затронуты, но, скорее всего, как следствие событий, которые инициируются клеткой автономно внутри α-мотонейронов.
Зависимое от возраста ослабление ранних функциональных дефицитов у мышей Olig2-Cre SMA
Мы и другие ранее показали, что мышечная слабость у мышей с Δ7 SMA предшествует потере тел мотонейронных клеток в спинном мозге, но появляется одновременно с дистальными дефектами двигательной единицы (Kariya et al., 2008; Kong et al., 2009) . Наши поведенческие анализы мутантов Olig2-Cre SMA также позволили предсказать ранние дефекты нервно-мышечных синапсов.Тем не менее, что интересно, мы не смогли наблюдать у этих мутантов поразительную патологию NF, которая характеризует аномальные НМС у новорожденных мышей с Δ7 SMA. Кроме того, мы были удивлены, обнаружив, что раннее серьезное нарушение способности восстанавливать положение, которое у мутантов Δ7 в конечном итоге прогрессирует до полного паралича, постепенно уменьшалось к концу второй недели жизни мышей Olig2-Cre SMA (рис. 2 C). ), после чего животные перешли в относительно стабильное болезненное состояние. Чтобы исследовать очевидное ослабление ранней моторной дисфункции у мутантов Olig2-Cre SMA, мы оценили нервно-мышечную функцию электрофизиологически на PND8, когда фенотип был очевиден, на PND10 и, наконец, на PND12-13, к тому времени нарушения уже не было. очевидный.Для этого были произведены измерения напряжения и внутриклеточные записи преимущественно быстрых (Rafuse et al., 2000) полусухожильных мышц бедра мутантных и контрольных однопометников. Мышечные волокна мыши полинейронально иннервируются при рождении, но иннервируются по отдельности в процессе элиминации синапсов где-то между первой и второй постнатальной неделей, в зависимости от мышцы. С помощью PND6 в трапециевидной мышце (Colman et al., 1997) и PND8 в грудино-сосцевидной мышце (Balice-Gordon and Lichtman, 1993) только 30% волокон иннервируются полинейронально.При использовании метода натяжения окклюзии было показано, что полусухожильная мышца у мышей дикого типа демонстрирует обширную полинейрональную иннервацию на PND3 и PND4, но не проявляет никакой на PND9, PND10 и PND11 (Rafuse et al., 2000) (V. Rafuse и Л. Т. Ландмессер, неопубликованные наблюдения). Таким образом, в начале наших физиологических экспериментов на PND8 элиминация синапсов должна быть в основном завершена. Однако по мере того, как мышечные волокна продолжают расти в диаметре, происходит компенсационное увеличение размера соединений и среднего количественного содержания, которое требуется для поддержания эффективной передачи.
Сообщалось о снижении количественного содержания квантов в нескольких различных мышцах мутантов Δ7 SMA в ранний постнатальный период (Kong et al., 2009; Ruiz et al., 2010). Однако из-за относительно большого запаса прочности в НМС грызунов (Wood and Slater, 2001) неясно, могут ли сообщаемые сокращения квантового содержания предотвратить активацию достаточного количества мышечных волокон до порогового значения, способствующего моторным дефектам. обнаруживается поведенчески. Чтобы рассмотреть эту возможность, мы измерили мышечное напряжение в ответ на одиночные стимулы и на двухсекундные тренировки с частотой 10, 20, 50 и 100 Гц.Сначала сокращения были вызваны сверхмаксимальной стимуляцией мышечного нерва. Затем значения нервных сокращений и напряжения при столбняке сравнивали со значениями, вызванными прямой стимуляцией мышцы с помощью биполярных проволочных электродов, которые должны активировать большинство мышечных волокон. На PND8 максимальное напряжение во время вызванных нервом последовательностей происходило при 50 Гц как у SMA, так и у контрольных мышей, со снижением напряжения на 20-30% при 100 Гц. Однако, поскольку снижение аналогичной амплитуды на частоте 100 Гц также происходит при прямой стимуляции мышц, это должно отражать свойство мышцы PND8, а не неспособность соединений активировать мышцу.На PND8 стимуляция нервов контрольных мышц с частотой 100 Гц была способна вызвать 72% напряжения, вызванного прямой стимуляцией мышцы. Напротив, нервная стимуляция мышей Olig2-Cre SMA была способна вызывать только 34% напряжения, создаваемого прямой мышечной стимуляцией (фиг. 5 A , B ). Эти наблюдения предполагают, что многие из соединений SMA не смогли активировать мышечные волокна до порогового уровня, что также наблюдалось при стимуляции 50 Гц (соотношение нервного / мышечного напряжения 36%).Примечательно, что с помощью PND12 стимуляция нерва 100 Гц как у мутанта SMA, так и у контрольного однопометника была способна активировать все мышечные волокна (рис. 5 B ). Эти результаты предполагают, что мыши Olig2-Cre SMA рождаются или развивают ранние дефекты нервно-мышечной передачи, но что между PND8 и PND12 существует гомеостатическая компенсация, которая преодолевает эти дефекты. Утомляемость во время 2-секундных тренировок с частотой 100 Гц, определяемая как снижение напряжения от начала до конца тренировки, составляла 10–20% для PND12 SMA и контролировалась либо нервной, либо прямой мышечной стимуляцией.Мышца с мутантом PND8 демонстрировали немного большее снижение напряжения (26%), чем при PND12, но, как это было видно при стимуляции как мышц, так и нервов (Рис. дело. Таким образом, этот результат предполагает, что даже при том, что нервная стимуляция мутантной мышцы PND8 неспособна активировать подавляющее большинство (~ 65%) мышечных волокон, передача в оставшихся соединениях нормальна при лишь умеренном утомлении даже при 100 Гц.
Рисунок 5.
Зависимое от возраста ослабление дефицита нервно-мышечной передачи у мутантов Olig2-Cre SMA между PND8 и PND12. A , Напряжение, вызванное одиночными стимулами и 2-секундными последовательностями 100 Гц. Ответ натяжения на стимуляцию нерва (красный след) был меньше, чем ответ, вызванный прямой стимуляцией мышцы (черный след) как в мутантных, так и в контрольных мышцах на PND8, но эта разница была значительно больше для мутантной мышцы SMA. B , Коэффициенты натяжения, вызванные нервом, по сравнению с прямой мышечной стимуляцией в ответ на последовательность 100 Гц в PND8 и PND12.В то время как нервная стимуляция была способна активировать только 34% мышечных волокон у мутанта PND8, с помощью PND12 все мышечные волокна в мутанте и контрольной мышце были активированы после стимуляции нерва 100 Гц. C , Количественное содержание рассчитано из EPP / средних амплитуд mEPP в PND8, PND10 и PND12. Квантовое содержание в соединениях SMA было резко снижено по сравнению с контролем на PND8, но PND10 увеличилось до значений дикого типа. Однако количественное содержание не смогло в дальнейшем увеличиваться в мутантных соединениях, как это было в контрольных НМС, и, таким образом, в PND12 оно имело значительно более низкие значения.(** p <0,01, t тест). D , Средняя амплитуда mEPP в мутантных соединениях SMA между PND8 и PND12 была значительно больше, чем в контрольных соединениях. (* p <0,05; ** p <0,01, t тест). E , EPP тренируется в ответ на стимуляцию 50 Гц в мутантных и контрольных НМС. Элементы управления (верхний график) показали умеренное изменение амплитуды и некоторое асинхронное высвобождение (стрелка), но без сбоев передачи.Мутантные соединения демонстрировали прерывистые сбои передачи (звездочка), асинхронное высвобождение (стрелки) и большее изменение амплитуды. F , EPP тренируется после стимуляции 100 Гц. Контрольные соединения (верхний график) демонстрировали некоторую депрессию и значительное асинхронное высвобождение, которое было очевидно даже после стимула. Однако они показали только случайные сбои в передаче. Мутантные соединения (нижний след) также демонстрировали асинхронное высвобождение, но, кроме того, имели многочисленные сбои в передаче. G , иммуноокрашивание SV2 и α-бунгаротоксина на мутантном PND8 Olig2-Cre SMA и контрольных соединениях. Постсинаптические кластеры AChR не отличались у мутантных мышей. Иммуноокрашивание SV2 было диффузно распределено в большинстве контрольных окончаний (внизу) с редкими концевыми пластинами, показывающими более точечное окрашивание (вверху). Напротив, большинство мутантных соединений характеризовались большими, интенсивно окрашивающимися точками (стрелки), вкрапленными в области, в основном лишенные окрашивания SV2 (особенно см. Верхний пример).Шкала 10 мкм.
Чтобы дополнительно охарактеризовать синаптическую передачу, мы провели внутриклеточные записи между PND8 и PND12. На PND8 мы обнаружили, что хотя частота mEPP не различалась между мутантом и контролем (Olig2-Cre SMA, 1,01 ± 0,20 / с; контроль, 0,81 ± 0,95 / с), наблюдалось резкое снижение (рис. 5 C ). среднее количественное содержание соединений SMA по сравнению с контролем, 1,35 против 11,26, соответственно, что, вероятно, вносит вклад в неспособность многих волокон активироваться до порогового значения у мутанта.Однако как у PND10, так и у PND12 мутантных НМС количественное содержание значительно увеличилось, 8,85 и 6,13, соответственно, что восстановило значения до (PND10) или до (PND12) контрольных уровней. Интересно, что мы обнаружили, что во всех трех временных точках средняя амплитуда mEPP в мутантных NMJs была на 50–100% больше, чем в контрольных соединениях (Fig. 5 D ). Этого можно было бы ожидать, если бы произошло увеличение входного сопротивления мышечных волокон SMA. С другой стороны, количество ацетилхолина на везикулу или постсинаптический ответ на определенное количество нейромедиатора могло увеличиться как гомеостатический ответ на сниженную эффективность передачи, наблюдаемую при PND8 (Davis and Goodman, 1998; Wang et al., 2005). Хотя мы не измеряли входное сопротивление, мы сравнивали мутантные и контрольные участки мышечных волокон, чтобы обнаружить изменения, которые могли привести к изменению входного сопротивления. На PND8 мы обнаружили умеренное, но статистически значимое уменьшение площади мутантных волокон (Olig2-Cre SMA, 574,2 ± 1,2 мкм 2 , n = 225; контроль, 754,0 ± 14,9 мкм 2 , n = 299 ). Однако этого было недостаточно для объяснения увеличения амплитуды mEPP. Оценка плотности AChR, основанная на средней интенсивности пикселей после иммуноокрашивания α-бунгаротоксином, продемонстрировала снижение на ~ 10% в НМС СМА (Olig2-Cre SMA, 10844 ± 322, n = 162; контроль, 12160 ± 423, n = 122).Однако, поскольку это было бы связано с уменьшением амплитуды mEPP, а не с увеличением, наши результаты предполагают либо изменение входного сопротивления, не связанное с диаметром мышечных волокон, либо увеличение количества ацетилхолина, высвобождаемого на везикулу у мышей с мутантным SMA. Последний ранее использовался для объяснения увеличения размера кванта в ответ на блокаду активности в НМС мышей (Wang et al., 2006). При PND10 и PND12 увеличение размера mEPP вместе с увеличением квантового содержания способно восстанавливать амплитуды EPP мутантных НМС до ≥5 мВ.Амплитуда ПОП в НМС мутанта PND8, с другой стороны, оставалась <1 мВ. В совокупности этот набор результатов свидетельствует о глубоком дефиците нервно-мышечной передачи при PND8 и значительном улучшении между PND10 и PND12, что согласуется с восстановлением после тяжелого нарушения двигательной дисфункции, оцениваемого поведенчески.
В соответствии со значительно сниженными значениями количественного содержания и неспособностью активировать адекватные волокна во время анализов измерения натяжения, мутантные НМС PND8 также продемонстрировали значительное увеличение сбоев нейротрансмиссии.Мы наблюдали их как в ответ на одиночные стимулы, так и во время последовательностей с частотой 10, 20 и 50 Гц (рис. 5 E , нижняя кривая, звездочка), тогда как сбои на контрольных переходах были довольно редкими (рис. 5 E ; Таблица 2). Асинхронное высвобождение, которое мы также количественно оценили (подробности см. В разделе «Материалы и методы»), было очевидным как у мутантных, так и у контрольных НМС (рис. 5 E , стрелки) и, в отличие от результатов у мышей с Δ7 SMA (Ruiz et al. al., 2010), существенно не различались между двумя когортами мышей при любой из используемых частот стимуляции (контроль: при 10 Гц: 1.4 ± 0,4; при 20 Гц — 4,1 ± 1,29; при 50 Гц 20,9 ± 3,11; Olig2-Cre SMA: при 10 Гц, 2,22 ± 0,49; при 20 Гц — 6,22 ± 0,7; при 50 Гц — 24,61 ± 3,61). Это указывает на то, что гомеостаз Ca 2+ в пресинаптических окончаниях Olig2-Cre SMA мутантов не изменен, как сообщалось для levator auris longus и поперечных мышц живота у мышей Δ7 SMA (Ruiz et al., 2010). При 100 Гц асинхронное высвобождение значительно увеличивалось в контрольных точках, особенно после поезда (рис. 5 F ), но исчезало в SMA, подвергающихся многочисленным сбоям, что позволяет предположить, что во время этих событий в нерв мало поступает Ca 2+ . терминалы мутантных мышей.
Таблица 2.
Количественная оценка сбоев нейротрансмиссии у мышей PND8-12 Olig2-Cre SMA
Поскольку наш анализ квантового содержания на стыках SMA показал такое резкое снижение и поскольку расчеты соотношений EPP: mEPP не всегда точны, мы пересмотрели этот параметр на основе наших экспериментов с повторяющейся стимуляцией. Когда вероятность высвобождения и, следовательно, количественное содержание снижается у взрослых НМС дикого типа за счет снижения внеклеточной концентрации Ca 2+ , статистика высвобождения передатчика соответствует распределению Пуассона.Мы использовали статистику Пуассона, чтобы определить, что квантовое содержание (ln N / f ; N , общее количество нервных стимулов; f , количество неудач) в НМС мутанта PND8 в ответ на одиночные стимулы и последовательности 10 Гц составляло 1,7. . Это хорошо соответствовало значению ~ 1,4, полученному из отношения EPP: mEPP, и подтверждало степень дефицита нейротрансмиссии у мутантных мышей PND8. Важно отметить, что распределение EPP в данном синапсе на одно, два или большее количество квантовых событий (более подробную информацию см. В разделе «Материалы и методы») на основе наблюдений также соответствовало тому, что ожидалось от статистики Пуассона, что добавляло уверенности расчетам квантового содержания.Кроме того, эти результаты показывают, что сбои, наблюдаемые в ответ на одиночные стимулы, могут возникать либо из-за уменьшения вероятности высвобождения, либо из-за уменьшения количества участков высвобождения, и, таким образом, предполагают, что для их объяснения не требуются дополнительные механизмы. Напротив, большое количество неудач, наблюдаемых в мутантных соединениях при стимуляции 100 Гц, как указано ниже, указывает на дополнительные пресинаптические дефекты передачи. Интересно, что в отличие от одиночных стимулов, мутантные соединения, стимулированные при 10-50 Гц, демонстрируют снижение количества неудач, что указывает на облегчение, которое увеличивает вероятность высвобождения из-за увеличения Ca 2+ в нервном окончании.С другой стороны, стимуляция с частотой 100 Гц приводила к резкому увеличению количества неудач (Рис. 5 F ; Таблица 2), отражая неспособность этих мутантных соединений следовать с высокой частотой. Отдельные перекрестки демонстрировали значительную изменчивость: некоторые имели случайные отказы в течение всего поезда, а другие — более длительные периоды в течение поезда без каких-либо вызванных реакций. В то время как контрольные соединения PND8 также демонстрировали некоторые отказы при 100 Гц, они были значительно меньше, чем у мутантных НМС.Примечательно, что к PND12 мутанты SMA стали похожи на контрольные, практически без сбоев на одиночные стимулы и с небольшим количеством сбоев, которые статистически не отличались от контрольных переходов при 10, 20 и 50 Гц (Таблица 2). Неясно, почему и контрольные, и мутантные НМС демонстрируют большее количество отказов при 100 Гц, чем контрольные НМС на PND8, но это может быть из-за продолжающихся изменений созревания в синапсе, которые характерны для этой стадии развития мышей.
Определив, что существуют глубокие дефекты нервно-мышечной передачи по оценке НМС полусухожильной мышцы мутантов PND8 Olig2-Cre SMA, мы попытались повторно оценить наличие морфологических коррелятов. Поэтому мы подвергли мышцы, которые использовались для электрофизиологии, процедурам иммуногистохимического окрашивания. Хотя мы не обнаружили заметных дефектов постсинаптических кластеров AChR, мы обнаружили поразительные изменения в распределении белка синаптических пузырьков (SV2) (рис.5 G ). В частности, белок SV2 оказался локализованным во множестве интенсивно окрашивающихся точек на концах мутантных замыкательных пластинок (фиг. 5 G , стрелки), с некоторыми участками, лишенными окрашивания, тогда как он был диффузно распределен по всей замыкательной пластинке контрольных животных. Это указывает на аномальную локализацию синаптических пузырьков в Olig2-Cre SMA терминалах и, как следствие, неспособность большей части мутантных терминалов подвергаться экзоцитозу везикул. Аномальная локализация согласуется с тем, что мы и другие сообщали у мышей, экспрессирующих повсеместно низкий белок SMN (Kariya et al., 2008; Kong et al., 2009). К PND12 неправильная локализация SV2 у мутантного полусухожильного сустава больше не была очевидной (рис. S5, доступный на www.jneurosci.org в качестве дополнительного материала), что еще раз соответствует смягчению ранних поведенческих и функциональных аномалий, наблюдаемых при выборочном использовании SMN истощены, но не удалены из предшественников моторных нейронов. Таким образом, наши функциональные и морфологические анализы НМС Olig2-Cre SMA в раннем постнатальном периоде продемонстрировали серьезный дефицит нервно-мышечной передачи в PND8, который согласуется с и обеспечивает основную основу для глубокого нарушения двигательной дисфункции на этой стадии заболевания.Примечательно, что по мере прогрессирования заболевания дефицит значительно уменьшается, и это может дать хотя бы частичное объяснение смягчения двигательной дисфункции к 2-недельному возрасту.
Стойкий дефицит нервно-мышечной передачи у взрослых мышей Olig2-Cre SMA
Несмотря на ослабление ранних дефектов нервно-мышечной передачи с помощью PND12 и одновременное очевидное восстановление двигательной дисфункции, оцениваемой по способности выравнивания, мутанты Olig2-Cre SMA продолжали демонстрировать слабость во взрослом возрасте.Более того, у мышей наблюдались явные признаки нервно-мышечной патологии (рис. 3). Поэтому мы расширили наш функциональный анализ на полусухожильную мышцу 3-месячных животных с мутантами Olig2-Cre. Внутриклеточные записи показали увеличение амплитуды mEPP (рис.6 A ), несмотря на снижение входного сопротивления (контроль, 25,13 ± 0,61 МОм; Olig2-Cre SMA, 20,51 ± 0,44 МОм; p <0,01), что позволяет предположить, что, возможно, у мутанта наблюдалось увеличение плотности AChR. Однако количество рецепторов, основанное на окрашивании α-BT, существенно не различается между мутантными и контрольными НМС (данные не показаны).Частоты mEPP, как правило, были выше у мутантных НМС, но статистически не отличались от таковых на контрольных концевых пластинах (фиг. 6 B ). Интересно то, что EPP и, следовательно, измерения количественного содержания показали значительное увеличение значений в мутантных соединениях (Рис.6 C , D ), предполагая, что механизмы, которые восстанавливают пониженное количественное содержание до почти нормальных уровней с помощью PND10-12, в конечном итоге чрезмерно компенсируются взрослые животные. Однако распределение значений квантового содержания на стыках СМА взрослых, которое оказалось бимодальным, а не унимодальным (рис.6 E ), предполагает, что только некоторые НМС имеют значения количественного содержания выше нормального, в то время как остальная часть популяции находится в диапазоне дикого типа. Морфологически мутантные НМС оказались очень похожими на таковые в икроножной мышце и трицепсе, которые мы исследовали, и существенно не отличались от контрольных соединений в отношении локализации SV2 (Рис. S6, доступный на www.jneurosci.org в качестве дополнительного материала). Вместе эти результаты расширяют наши выводы на PND12 Olig2-Cre SMA мышей, но также указывают на механизмы в мутантном NMJ, которые чрезмерно компенсируют по мере прогрессирования заболевания недостатки, которые проявляются на ранних стадиях неонатального развития.
Рисунок 6.
дефекты нервно-мышечной передачи сохраняются в НМС взрослых мышей Olig2-Cre SMA. A — D , Параметры передачи в контрольных и мутантных НМС. A , амплитуда mEPP. B , частота mEPP. C , амплитуда EPP в ответ на одиночный надпороговый нервный стимул. D , Среднее количественное содержание. Не было обнаружено существенной разницы в частоте mEPP между контрольными и мутантными соединениями ( N.S. p > 0,05, односторонний дисперсионный анализ). Однако амплитуда mEPP, амплитуда EPP и количественное содержание были значительно увеличены на мутантных соединениях (** p <0,01, односторонний дисперсионный анализ). E , Гистограммы распределений квантового содержания для контрольных ( n = 16) и мутантных SMA ( n = 14) переходов. В то время как контрольные соединения демонстрировали нормальное распределение, мутантные соединения SMA демонстрировали более бимодальное распределение, что указывает на субпопуляцию НМС, у которых EPP по размеру аналогичны контрольным.
Обсуждение
Учитывая повсеместную потребность в белке SMN, есть два вопроса, которые продолжают ставить в тупик ученых, занимающихся изучением SMA. (1) Почему мотонейроны избирательно дегенерируют при заболевании человека? (2) Каков основной участок действия белка SMN, вызывающий эту избирательную потерю клеток? В этом исследовании мы воспользовались технологией Cre-lox для разработки новых модельных мышей, которые экспрессируют сниженный белок SMN конкретно в предшественниках двигательных нейронов и, таким образом, позволяют нам ответить на второй из этих двух важных вопросов.Наши основные результаты показывают следующее: (1) Селективного истощения, но не отмены белка SMN в предшественниках спинномозговых мотонейронов, которые экспрессируют репрессор транскрипции Olig2, достаточно, чтобы вызвать SMA-подобный фенотип. (2) Избирательное истощение не только вызывает ранние дистальные дефекты НМС, но также и возможную дегенерацию мотонейронов и последующую атрофию мышц, предполагая, что патология моторных нейронов при СМА является, по крайней мере частично, клеточно-автономным эффектом недостаточности SMN. (3) Помимо воздействия на периферические нервно-мышечные синапсы, истощение SMN моторных нейронов серьезно нарушает центральную синаптическую целостность.Важно отметить, что это новое открытие также характерно для мышей модели Δ7, экспрессирующих повсеместно низкий SMN. (4) Истощение SMN только в двигательных нейронах не так вредно морфологически или фенотипически, как повсеместное истощение белка, что позволяет предположить, что другие типы клеток могут вносить вклад в патологию SMA. Частичное восстановление фенотипа SMA после избирательного восстановления SMN в нервной ткани (Passini et al., 2010) подтверждает этот вывод. (5) Ранние функциональные дефекты нервно-мышечного синапса, наблюдаемые у мышей Olig2-Cre SMA, вероятно, лежат в основе соответствующего тяжелого моторного фенотипа.Однако функциональные, а также фенотипические аномалии у мутантов были ослаблены в зависимости от возраста, что наводит на мысль о гомеостатическом компенсаторном механизме, возможно, опосредованном ненервной тканью, экспрессирующей уровни белка SMN дикого типа. Хотя мы не можем исключить возможность того, что ослабленный фенотип полностью обусловлен моторными нейронами, в которых Cre-опосредованная инактивация SMN не происходит, такая вероятность мала, учитывая небольшое количество (<2%) этих клеток, по оценке мышей-репортеров YFP. .
Хотя общепризнано, что SMA избирательно влияет на двигательные нейроны спинного мозга, никогда не было убедительно продемонстрировано, что их потеря могла быть вызвана главным образом потерей функции SMN внутри них. Эту гипотезу нельзя проверить на существующей когорте модельных мышей SMA (Park et al., 2010), потому что они экспрессируют сниженный белок SMN в каждом типе клеток, и все они в конечном итоге могут вносить вклад в фенотип заболевания. Исследования очищенных мотонейронов этих мышей также не позволяют однозначно ответить на этот вопрос, поскольку они удалены из внутренней среды интактного организма и, в любом случае, не могут дегенерировать (Rossoll et al., 2003), как и in vivo . В единственной предыдущей попытке проверить, достаточно ли истощения SMN моторных нейронов для того, чтобы вызвать SMA, белок в нервной системе был устранен, а не уменьшен, как при заболевании человека (Frugier et al., 2000). Результат эксперимента лишь подтвердил то, что уже было установлено: SMN необходим для выживания всех клеток. Здесь мы впервые показываем в системе млекопитающих, что истощение, а не уничтожение белка в клетках-предшественниках спинномозговых мотонейронов является адекватным и достаточным для того, чтобы вызвать многие морфологические, функциональные и фенотипические характеристики СМА человека.Остаточный белок SMN в целевых двигательных нейронах спинного мозга экспрессируется трансгеном SMN2 , таким образом гарантируя точную имитацию заболевания. Хотя мы не можем однозначно исключить способствующий эффект истощения SMN в олигодендроцитах, которые также экспрессируют трансген Olig2-Cre (Novitch et al., 2001), который мы использовали для достижения нокдауна белка, ясно, что снижение SMN в не нервной ткани и даже В DRG проприоцептивные сенсорные нейроны не обязаны вызывать нейромышечный фенотип, характерный для СМА человека.Эффекты снижения SMN в олигодендроцитах потребуют замены Olig2-Cre другой клеточно-специфической линией Cre, такой как MPB-Cre (где MPB является основным белком миелина) (Niwa-Kawakita et al., 2000).
Два неожиданных результата текущего исследования подчеркивают, сколько еще предстоит узнать о человеческом СМА. Во-первых, мы показали, что, несмотря на явный SMA-подобный нервно-мышечный фенотип после избирательного истощения SMN моторных нейронов, тяжесть заболевания у животных Olig2-Cre SMA значительно ниже, чем у мышей Δ7 SMA, которые экспрессируют сниженный белок во всех тканях.Двигательная дисфункция стала очевидной у обеих линий мутантных мышей на PND2, но в то время как болезнь быстро прогрессировала и неумолимо ухудшалась, приводя к смерти на ∼PND13 у мутантов Δ7 SMA, моторный фенотип мутантов Olig2-Cre SMA постепенно уменьшался и, несмотря на При сохранении морфологических, физиологических и поведенческих аномалий большинство мышей вошли в относительно стабильное болезненное состояние, во многом схожее с фазой плато у людей (Sumner, 2007). Хотя такого результата можно ожидать, если мутанты Olig2-Cre SMA экспрессируют более высокие уровни белка SMN моторных нейронов, чем мыши Δ7 SMA, второе правдоподобное объяснение различных фенотипов происходит из экспрессии уровней SMN дикого типа в не-мышах. Olig2-Cre экспрессирующие клетки бывшей трансгенной линии.Наши результаты показывают, что истощение SMN моторных нейронов у мышей Olig2-Cre SMA является чрезвычайно эффективным, а уровни белка эквивалентны таковым в моторных нейронах мутантов Δ7 SMA. Таким образом, одна интригующая возможность заключается в том, что несоответствие общих фенотипов между двумя линиями мутантных животных обусловлено состоянием здоровья ненервной ткани «дикого типа» у мышей Olig2-Cre SMA. Вклад немоторных нейрональных клеток в патологию СМА, особенно в свете экспериментальных данных на плодовой мушке (Chang et al., 2008), продолжает активно обсуждаться, и, даже если и скромные, удовлетворительно разрешить можно будет только путем выборочного и эффективного воздействия на них в модельных организмах.
В соответствии с представлением о множестве типов клеток, вносящих вклад в фенотип SMA, мы были заинтересованы в том, чтобы обнаружить, что мыши Olig2-Cre SMA не только достигают значительного выздоровления от ранней двигательной дисфункции, которую они проявляют, но также демонстрируют заметное ослабление нервно-мышечной передачи. дефекты между ПНД8 и ПНД12.Такое восстановление может быть связано с синаптическими гомеостатическими компенсаторными механизмами, которые активируются в ответ на нарушения синаптической силы во время нормального развития и болезни (Davis and Bezprozvanny, 2001). Например, в НМС Drosophila снижение иннервации мышц в конечном итоге приводит к увеличению квантового размера (Davis and Goodman, 1998), а в нервно-мышечных синапсах пациентов с миастенией измененная постсинаптическая активность вызывает увеличение высвобождения пресинаптического нейротрансмиттера (Cull -Candy et al., 1980).
Альтернативное объяснение восстановления нервно-мышечной передачи у мутантов Olig2-Cre SMA происходит из-за быстрого прорастания ответа с участием здоровых мотонейронов, в которых рекомбинация не удалась, что делает возможным экспрессию нормального белка SMN. Мы считаем это маловероятным по нескольким причинам. Во-первых, если бы здоровые двигательные нейроны лежали в основе восстановления, мы бы наблюдали некоторые соединения в мутантной мышце PND8, которые имели значения квантового содержания дикого типа. Напротив, все значения были равномерно уменьшены (рис.5 С ). Во-вторых, если бы несколько мотонейронов выросли, чтобы создать большие двигательные единицы с помощью PND10-12, мы бы наблюдали скачки значений подергивания и напряжения по мере увеличения интенсивности стимула, но этого не наблюдалось. В-третьих, если бы восстановление передачи в полусухожильной мышце и восстановление двигательного поведения происходило из-за того, что здоровые двигательные нейроны иннервируют большинство мышечных волокон, нельзя было бы ожидать найти большое количество соединений взрослых с измененной морфологией, которые наблюдались в разных исследуемые мышцы, в том числе полусухожильная (рис.4 D , дополнительный рис. S6, доступен на www.jneurosci.org в качестве дополнительного материала). Наконец, никаких морфологических признаков прорастания не наблюдалось ни в одной из исследованных мышц. Таким образом, наши результаты кажутся более совместимыми с гомеостатическими изменениями, наблюдаемыми во многих системах при изменении передачи, которые произошли в мутантных мотонейронах SMA.
У Drosophila было показано, что ряд пресинаптических молекул обеспечивает восстановление синаптической силы, наиболее заметной из них является субъединица Ca V 2.1 (тип P / Q) кальциевый канал. Интересно, что кальциевые каналы N-типа, которые экспрессируются эмбрионально, оказались неправильно локализованными в моторных нейронах SMA мышей (Jablonka et al., 2007). В то время как многие из пресинаптических молекул считаются частью пресинаптического автономного гомеостатического компенсаторного механизма (Frank et al., 2009; Dickman and Davis, 2009), другие, например, рецептор глутамата GluRIIA, считаются постсинаптически расположенными. триггеры, которые инициируют ретроградный сигнал, который в конечном итоге восстанавливает синаптическую силу до заданного уровня (Petersen et al., 1997). Точная идентичность этих сигналов до сих пор ускользает от исследователей, но их роль в более крупном не-клеточно-автономном компенсаторном пути, который требует SMN дикого типа в мышечных клетках и служит для ослабления дефектов нейротрансмиссии в мутантных НМС Olig2-Cre SMA, имеет большое значение. С этим предположением согласуются результаты Ruiz et al. (2010), указывая на то, что значения квантового содержания остаются неизменными между PND7 и PND15 у мышей Δ7 SMA, у которых все типы клеток являются «мутантными». В свете их результатов и нашего текущего исследования роль немоторных нейрональных клеток, таких как мышечные и, возможно, даже терминальные шванновские клетки, в возникновении всего спектра физиологических дефектов является провокационной.Тем не менее, наши результаты ясно показывают, что снижение SMN в этих типах клеток не является требованием для фенотипа SMA и что недостатка белка в двигательных нейронах достаточно, чтобы вызвать заболевание.
Появление дефекта сенсомоторной связи у мутантов Δ7 и Olig2-Cre SMA также было несколько неожиданным, но устанавливает два важных момента. Во-первых, хотя на основе анализа только мутантов Δ7 можно было утверждать, что дефект возникает в клетках, которые синапсируют с двигательными нейронами, это маловероятно.Напротив, это, скорее, следствие событий в двигательных нейронах. Во-вторых, нельзя исключить возможность того, что снижение сенсорно-моторной связи усугубляет нервно-мышечный фенотип SMA, но, учитывая стойкость пониженного синаптического покрытия у взрослых мутантов Olig2-Cre SMA в сочетании с возрастным ослаблением как моторной дисфункции, так и электрофизиологии НМС, крайне маловероятно, что мышечная слабость при СМА полностью вызвана этим дефектом ЦНС. Тем не менее, снижение количества афферентов Ia на моторных нейронах явно возникает на ранних стадиях заболевания, и, следовательно, будет интересно определить, во-первых, были ли когда-либо установлены соединения или дефект отражает несоответствующую проприоцептивную ретракцию аксонов, а во-вторых, является ли дефект вызвано измененной экспрессией сигнальных молекул, таких как Sema3e, которая необходима афферентам для распознавания гомонимных мотонейронов (Pecho-Vrieseling et al., 2009).
Таким образом, это исследование предоставляет убедительные доказательства того, что основным клеточным участком действия белка SMN в определении фенотипа SMA является двигательный нейрон. Остается точно определить, вызван ли фенотип заболевания исключительно дефектами в этом типе клеток. Тем не менее, наши эксперименты служат дополнительной платформой, с которой можно приступить к исследованиям для определения возможных клеточных функций SMN в различных типах клеток. В нашем отчете также описывается новая линия мышей с моделями СМА, которые могут служить не только новым инструментом для разделения роли нервной и мышечной ткани в нейромышечной патологии, лежащей в основе СМА, но также и в качестве реагента в усилиях по разработке лекарств, особенно тех, которые сосредоточены на нацеливание на нервную ткань при более легких формах заболевания.
Структура Vibrio FliL, нового стоматиноподобного белка, который помогает бактериальной жгутиковой моторной функции
РЕФЕРАТ
Многие подвижные бактерии плавают или роятся, используя нитевидную вращающуюся органеллу, жгутик. Известно, что FliL, компонентный белок жгутикового мотора, улучшает моторные характеристики некоторых бактерий в условиях высокой нагрузки. Здесь мы определили структуру периплазматической области FliL (FliL Peri ) полярного жгутика Vibrio alginolyticus.FliL Peri демонстрирует замечательное структурное сходство с доменом устьица / запретитин / флотилин / HflK / C (SPFH) белков семейства устьиц, некоторые из которых участвуют в модуляции активности ионных каналов у различных организмов. FliL Peri образует кольцевую сборку в кристалле с внутренним диаметром около 8 нм, что сопоставимо с размером блока статора. Мутационный анализ указывает на то, что кольцо FliL образует комплекс с блоком статора и что длина периплазматических линкеров FliL и B-субъединицы статора важна для образования комплекса.Мы предлагаем модель комплекса FliL-статор, чтобы обсудить, как Vibrio FliL модулирует функцию статора в бактериальном жгутичном двигателе в условиях высокой вязкости.
ВАЖНО Некоторые жгутиковые бактерии регулируют крутящий момент двигателя в ответ на изменение внешней нагрузки. Такое поведение имеет решающее значение для выживания, но механизм остается неизвестным. Здесь мы сосредоточились на ключевом белке, FliL из Vibrio alginolyticus, и решили кристаллическую структуру его периплазматической области (FliL Peri ).FliL Peri обнаруживает поразительное структурное сходство с консервативным доменом стоматина, который участвует в регуляции ионных каналов у некоторых организмов, включая млекопитающих. FliL Peri образует кольцо с внутренним диаметром, сопоставимым по размеру с блоком статора. Мутационный анализ показал, что присутствие кольцеобразной сборки FliL вокруг блока статора усиливает скопление на поверхности клеток Vibrio . Данные нашего исследования также предполагают, что структурный элемент регуляции ионных каналов сохраняется от бактерий до млекопитающих.
ВВЕДЕНИЕ
Многие бактерии перемещаются в физически различных средах, таких как почва, слизь, поверхность клетки-хозяина и планктонная среда, чтобы выжить в природе, используя жгутик. Жгутик является одной из наиболее распространенных органелл, отвечающих за подвижность бактерий, и состоит из нитевидной структуры пропеллера, выступающей из поверхности клетки, и вращательного двигателя, встроенного в клеточную оболочку. Чтобы приспособить свою подвижность к различным физическим условиям, некоторые бактерии, такие как Escherichia coli и Bacillus subtilis, изменяют мощность моторики жгутиков в соответствии с внешней нагрузкой (1–3).Однако не совсем понятно, как они определяют внешние условия и оптимизируют выход двигателя на окружающую среду.
Жгутиковый двигатель состоит примерно из 20 различных типов белков и состоит из двух функционально различных частей: ротора и статора. Двигатель приводится в действие электрохимическим потенциалом на клеточной мембране. Связанный поток ионов (например, поток H + , Na + или K + ) через канал в статоре вызывает взаимодействие ротора и статора для создания крутящего момента (4–6).Ротор состоит из штока, MS-кольца и С-образного кольца. MS-кольцо встроено в клеточную мембрану, а C-кольцо расположено под MS-кольцом. MS-кольцо представляет собой гомомультимер двухтрансмембранного белка FliF. С-кольцо состоит из трех цитоплазматических растворимых белков: FliG, FliM и FliN. Статор представляет собой гетерогексаметрический комплекс, состоящий из четырех субъединиц А и двух субъединиц В, PomA 4 PomB 2 в полярном жгутичном двигателе, управляемом Na + , Vibrio alginolyticus и MotA 4 Mot128 2 жгутиковый двигатель с приводом от H + E.coli и Salmonella и латеральный жгутиковый мотор V. alginolyticus (7, 8). Ротор окружает около десятка статорных блоков (9, 10).
Крутящий момент двигателя создается за счет электростатического взаимодействия между FliG и A-субъединицей статора (11). B-субъединица статора взаимодействует со слоем пептидогликана через периплазматическую область, чтобы закрепить блок статора (12, 13). Периплазматическая область B-субъединицы содержит область заглушки, которая регулирует приток ионов через статор (14).Узлы статора не статичны, а динамически собираются и разбираются с двигателя (11, 15). Хотя каждый отдельный блок статора генерирует достаточный крутящий момент для вращения нити накала в условиях низкой нагрузки, несколько статоров собираются вокруг ротора в условиях высокой нагрузки для создания достаточного крутящего момента, что свидетельствует о том, что жгутиковый двигатель каким-то образом воспринимает нагрузку и регулирует свой крутящий момент в соответствии с нагрузки за счет изменения количества статоров вокруг ротора (1–3, 16, 17). Недавнее мутационное исследование показало, что длинная область цитоплазматической петли A-субъединицы отвечает за зависимую от нагрузки сборку статора у Salmonella (18).
Жгутиковый белок, FliL, который представляет собой одинарный трансмембранный белок с большой периплазматической областью и ассоциируется с базальным телом жгутика, как было обнаружено, важен для функции мотора в условиях высоких нагрузок, таких как вязкая среда у некоторых видов. FliL необходим для плавания Caulobacter crescentus и Rhodobacter sphaeroides, а также для скопления на поверхности E. coli и Salmonella , тогда как делеция FliL не сильно влияет на подвижность E.coli, Salmonella , B. subtilis, Borrelia burgdorferi, Proteus mirabilis и V. alginolyticus (19–26). Анализ криоэлектронной томографии B. burgdorferi показал, что FliL расположен близко к ротору и статору (22). FliL взаимодействует с различными моторными компонентами, такими как белки статора, белок MS-кольца FliF и периплазматический кольцевой компонент FlgT (20, 21, 24, 27). Среди них взаимодействие со статором, по-видимому, является наиболее важным для функции FliL, поскольку некоторые из дефектов плавания, вызванных мутациями fliL , подавлялись мутациями в области пробки B-субъединицы статора (21, 24).Более того, FliL не собирался в двигатель без статора (25). Другие мутационные исследования выявили различные роли FliL в дополнение к двигательной функции, включая стабилизацию стержневой структуры в двигателе, правильное расположение жгутика и поверхностное зондирование (20, 22, 23, 28). Однако большинство фенотипов этих мутантов были разнообразными и видоспецифичными. Недавно был опубликован противоречивый результат, который показал, что крутящий момент двигателя E. coli не изменяется при удалении FliL (29).Таким образом, конкретная функция FliL не совсем ясна.
В этом исследовании мы провели структурный и мутационный анализ FliL, чтобы выяснить его молекулярный механизм у V. alginolyticus. Эта бактерия имеет два разных набора жгутиков, то есть полярный жгутик и несколько боковых жгутиков, и каждый набор жгутиков имеет свой собственный ген fliL . Полярный жгутик используется для плавания в жидкости с низкой вязкостью (например, в морской воде), тогда как боковые жгутики используются для роения на поверхности в условиях очень высоких нагрузок (например,г., рыбная слизь) (30). Удаление полярного жгутика fliL не оказывало сильного влияния на подвижность полярного жгутика в условиях низкой нагрузки, но снижало скорость плавания, обеспечиваемую полярным жгутиком в условиях высокой нагрузки (25). С другой стороны, функция бокового FliL неизвестна. Здесь мы определили структуру периплазматической области полярного FliL (FliL Peri ). FliL Peri образует кольцо или спиральную сборку в кристалле, а структура субъединицы напоминает домен SPFH суперсемейства устьиц, который включает белки, участвующие в механосенсорной трансдукции и регуляции ионных каналов, что означает, что FliL участвует в регуляции иона. -канальная активность статора в ответ на некоторые виды механических сигналов.Мы также обнаружили, что FliL важен для роения, обеспечиваемого боковыми жгутиковыми моторами. На основе структуры и последующего мутационного анализа мы предлагаем модель того, как FliL связывается со статором и регулирует моторную функцию жгутика.
РЕЗУЛЬТАТЫ
Длина гибкого линкера PomB важна для локализации FliL вокруг двигателя. FLIL взаимодействует с белками статора и локализуется в двигателе. Делеция генов статора, то есть pomA и pomB , полностью нарушила локализацию полярного FliL на полярном жгутичном двигателе в V.alginolyticus (25). Здесь мы ввели внутренние делеционные мутации в периплазматический гибкий линкер (остатки от 60 до 121) PomB (рис. 1A и B). Было показано, что гибкая линкерная область не важна для моторной функции, но участвует в моторной эффективности (31). Мы подготовили серию мутантов с делецией в рамке считывания, в которых отсутствовали 20 аминокислотных остатков в линкерной области, и наблюдали подвижность клеток, а также внутриклеточную локализацию полярного FliL, слитого с зеленым флуоресцентным белком (GFP) на его цитоплазматическом N-конце (GFP-FliL). ) методом флуоресцентной микроскопии (рис.1С). Как описано ранее, GFP-FliL был обнаружен в виде точки на полюсе флагеллированных клеток в штамме, экспрессирующем PomB дикого типа (рис. 1C) (25). Напротив, GFP-FliL не был локализован на полюсе клетки во всех мутантах с делецией в рамке считывания PomB, даже несмотря на то, что эти мутанты демонстрировали плавающие кольца, которые были аналогичны по размеру тем, которые наблюдались у дикого типа в чашке с мягким агаром. (Рис. 1D). Эти результаты показывают, что линкерная область PomB важна для локализации FliL в двигателе, и предполагают, что не конкретная область, а длина линкера важна для локализации FliL.
Рис. 1.
Влияние делеции в рамке считывания линкерной области PomB и FliL на подвижность клеток и локализацию FliL. (A) Молекулярная архитектура PomB и его мутантов с делецией в рамке считывания. TM, трансмембранная область. (B) Схематический чертеж блока статора B. Периплазматический домен PomB (PDB ID: 3WPW) представлен в виде модели ленты. IM, внутренняя мембрана. (C) Флуоресцентные изображения клеток, экспрессирующих GFP-FliL с делецией в рамке кадра в PomB. (D) Влияние делеций в рамке PomB на подвижность в пластине с мягким агаром.Показаны диаметры кольца подвижности относительно штамма дикого типа. Планки погрешностей, стандартные отклонения. Ночные культуры ZSW2, несущие плазмиду pZSW81 с или без делеций в pomB , наносили на чашки с мягким агаром VPG и инкубировали при 30 ° C в течение 4 часов. (E) Схематический рисунок FliL. (F) Молекулярная архитектура мутантов FliL с делецией линкера в рамке считывания. (G) Флуоресцентные изображения клеток, экспрессирующих GFP-FliL с делециями в кадре.
Периплазматическая область FliL состоит из N-концевого линкера и C-концевой сердцевинной области.Polar FliL состоит из N-концевой короткой цитоплазматической области (остатки с 1 по 17), одной трансмембранной области (TM) (остатки с 18 по 40) и периплазматической области (FliL Peri ) (остатки с 41 по 167) ( 25). Чтобы определить центральную область FliL Peri , мы выполнили ограниченный протеолиз очищенного FliL Peri трипсином. FliL Peri был немедленно расщеплен до фрагмента, состоящего из остатков с 58 по 167, который получил название FliL C , а FliL C обладает высокой устойчивостью к расщеплению трипсином (см.рис.От S1A до C в дополнительном материале). Таким образом, мы пришли к выводу, что FliL C является коровой областью FliL Peri и что 17 N-концевых остатков (остатки с 41 по 58; FliL L ) действуют как линкер, соединяющий область TM с FliL C . (Рис. 1E). Чтобы оценить важность FliL L для функции FliL, мы приготовили мутанты с различными делециями в FliL L и наблюдали локализацию FliL на полюсе клетки (рис. 1F и G). FliL Δ40-59 не локализовался на полюсе клетки, в то время как FliL Δ40-49 , FliL Δ46-55 и FliL Δ50-59 .Эти результаты показывают, что FliL L важен для локализации FliL, но предполагают, что достаточно любых 7 из 17 остатков.
Структура периплазматической области FliL. Мы кристаллизовали и определили структуры FliL C и FliL Peri с разрешением 2,1 Å и 3,4 Å соответственно (рис. 2A – D; см. Также рис. S2A и B и Таблица S1 в дополнительном материале). Начальная фаза была получена путем молекулярного замещения с использованием структуры FliL C , предсказанной сервером Robetta (32), потому что не было получено никаких кристаллов, меченных Se-Met, или кристаллов, содержащих тяжелые атомы.Кристалл FliL C принадлежит пространственной группе P 6 1 и содержит две молекулы в асимметричной единице. Окончательные значения R-фактора уточнения и свободного R-фактора составляли 20,6% и 25,8% соответственно. FliL C состоит из одного домена в форме боба, содержащего четыре α-спирали (от α1 до α4) и одного β-листа, состоящего из четырех β-нитей (от β1 до β4). Β-лист сильно скручен в середине и поэтому может быть разделен на два подлиста: подлист 1 (S1) и S2 (рис.2Б). S1 состоит из β1, β3 и β4, а S2 состоит из β2, β3 и β4. Кристалл FliL Peri принадлежит пространственной группе P 4 2 2 1 2 и содержит 20 молекул в асимметричной единице. FliL Peri на 17 остатков длиннее на своем N-конце, чем FliL C , но эти остатки не видны на карте электронной плотности FliL Peri . Таким образом, мы определили структуру FliL Peri с той же областью, что и FliL C .Все молекулы в асимметричных звеньях кристаллов FliL C и FliL Peri не показали значительных структурных различий, за исключением небольших различий в N-концевой области (остатки 58-63) и в петле между β2 и β3 (остатки 77 по 84) (рис. S2C).
FIG 2
Структура периплазматической области FliL. (A) Схематическое изображение молекулярной архитектуры FliL, FliL Peri и FliL C . (B) Рисунок ленты FliL 58-167 (FliL C ), окрашенный в виде радуги от конца N (синий) до конца C (красный).(C и D) Структура высшего порядка FliL C в кристалле. Показаны ленточные изображения двух декамерных колец в кристалле P 4 2 2 1 2 (C) и спиральной сборки 12 1 в кристалле P 6 1 (D). Одиночная субъединица окрашена в красный цвет. (E) Картирование сайтов мутаций, которые нарушают сборку FliL. L109, L115 и L160 обозначены красными шарами. (F) Разрез интерфейса субъединицы, обозначенный синей пунктирной линией на панели E.L109, L115 и L160 окрашены в оранжевый цвет, а другие гидрофобные остатки окрашены в желтый цвет. (G) Флуоресцентные изображения клеток, экспрессирующих GFP-FliL или GFP-FliL с мутацией L109D, L115K или L160D.
FliL Peri образует кольцевой комплекс. FL Peri образует прямую стопку двух декамерных колец в кристаллической асимметричной единице (рис. 2C). Субблоки в форме бобов расположены в кольце вертикально параллельно. Два кольца слабо взаимодействуют друг с другом через α1.Конец N находится рядом с интерфейсом «кольцо-кольцо» и указывает на внешнюю сторону кольца. C-конец каждой субъединицы расположен на внутренней поверхности кольца на противоположной стороне межкольцевого интерфейса. Петля между β2 и β3, окружающая отверстие кольца, вносит вклад в контакты кристалла с соседним кольцом, связанные кристаллографической симметрией. Поскольку N-конец FliL Peri соединен с трансмембранной спиралью, декамерное кольцо может образовываться на внутренней мембране (рис.S2D).
Побочное взаимодействие субъединиц в кольце в первую очередь гидрофобное. Интерфейс субъединицы образован характерными гидрофобными поясами с обеих сторон субъединицы вдоль продольного направления молекулы (рис. 2E и F; см. Также рис. S2E). P108, L109 и L115 на α2 образуют гидрофобный пояс на одной стороне поверхности субъединицы, а Y66 и M93 на подлисте S1 и L160, F161 и F164 на β4 образуют другой на противоположной поверхности (рис. 2F; см. Также рис. . S2E). L109, L115 и L160 вносят вклад в межсубъединицу в основном за счет гидрофобного взаимодействия.L115 взаимодействует с F161 и F164. L109 тесно взаимодействует с L160 и немного с M93 и Y66. Параллельное взаимодействие дополнительно стабилизируется водородными связями вокруг гидрофобных лент (рис. S2E). N76 образует водородную связь с NH-группой основной цепи I166. Q71, Y105 и D163 образуют водородные связи с карбонильной группой основной цепи, состоящей из T162, I64 и V74 соответственно. Боковая цепь h206 образует водородные связи с группой OH Y66. Подобные взаимодействия субъединиц можно наблюдать в кристалле FliL C .Две молекулы в асимметричном блоке кристалла FliL C связаны вращением на 30 ° вокруг кристаллографической оси винта 6 1 с перемещением 1/12 повтора вдоль оси c ; таким образом, молекулы образуют спиральную трубку с винтовой симметрией 12 1 вдоль оси c в кристалле FliL C (рис. 2D). Взаимодействие между субъединицами, связанными винтовой симметрией 12 1 , почти такое же, как в кольце FliL Peri , за исключением отсутствия водородных связей между T162 и Q71 и между D163 и V74.Соседняя субъединица в кристалле FliL C немного наклонена по сравнению с таковой в кольце FliL Peri , что приводит к образованию спиральной трубки, а не кольца (рис. S2F).
Обычное взаимодействие субъединиц бок о бок подразумевает, что формирование сборки через гидрофобный пояс важно для функции FliL. Чтобы проанализировать значимость гидрофобного взаимодействия, мы заменили остатки, которые в основном вносят вклад в гидрофобное взаимодействие, на гидрофильные остатки (L109D, L115K или L160D) и наблюдали локализацию GFP-FliL (рис.2E — G). Эти мутации полностью нарушили полярную локализацию GFP-FliL. Другие мутации остатков на внешней, верхней и нижней поверхностях кольца FliL не влияли на полярную локализацию FliL (рис. S3A и B). Мы также подтвердили, что FliL взаимодействует с самим собой без какой-либо помощи со стороны других жгутиковых белков в клетке с помощью двухгибридного анализа (рис. S3C). Эти результаты показывают, что образование кольца FliL за счет гидрофобного взаимодействия важно для сборки FliL в двигателе.
Структура FliL C напоминает SPFH домен устьица. Поиск в базе данных Dali показал, что FliL C демонстрирует замечательное структурное сходство (Z-балл 9,5) с устьицами / запретитином / флотилином / HflK / C (SPFH). домен устьиц из Mus musculus (Mm-стомататин) (рис. 3A и B) (идентификатор PDB [ID]: 4FVJ) (33), хотя идентичность аминокислотной последовательности составляет только 17% (рис. 3C). Домен SPFH консервативен в различных ассоциированных с мембранами белках эукариот, архей и бактерий, таких как стоматин, запретитин, флотилин, HflK / C и подоцин (34).Домен SPFH состоит из четырех альфа-спиралей и сильно скрученного β-листа, и его топология складывания точно такая же, как у FliL C (Fig. 3B and C).
Рис. 3.
Сравнение FliL с доменом SPFH. (A) Молекулярная архитектура стоматина FliL и Mus musculus (MmStomatin). Трансмембранные области (TM) обозначены темно-серым цветом. FliL C и домен SPFH показаны черным. (B) Рисунок ленты FliL C (аминокислоты с 63 по 167), домена SPFH MmStomatin (аминокислоты с 98 по 200) (PDB ID: 4FVJ), стаматина Pyrococcus horikoshii (PhStomatin; аминокислоты с 55 по 169). ) (PDB ID: 3BK6), Mus musculus flotillin-2 (MmFlotillin; аминокислоты с 14 по 121) (PDB ID: 1WIN) и белка главного свода Rattus norvegicus (RnMVP; аминокислоты с 519 по 646) (PDB ID: 4В60).Гидрофобная поверхность, взаимодействующая с N-концевой петлей соседней субъединицы в мультимере MmStomatin, показана черным кружком. (C) Выравнивание последовательностей на основе структуры FliL C (верхняя последовательность) и домена SPFH Mm-стоматина (нижняя последовательность). Цилиндр, α-спираль; стрелка, β-нить.
Домен SPFH часто участвует в формировании мультимеров белков суперсемейства SPFH. Несмотря на структурное сходство, расположение субъединиц и интерфейс субъединиц в мультимере FliL C отличаются от таковых в мультимере белка семейства SPFH.Mm-стоматин собирается в димер от хвоста к хвосту, образуя межсубъединичный β-лист через С-концевые β-тяжи (Fig. S4A) (33). Однако FliL C не образует димер «хвост к хвосту». Димеры Mm-стоматина образуют спиральную сборку более высокого порядка в кристалле за счет взаимодействия между N-концевой петлей и гидрофобной поверхностью соседней субъединицы. Хотя FliL C также образует спиральную сборку в кристалле P 6 1 , сборка FliL C формируется за счет взаимодействия латеральных субъединиц, и соответствующая гидрофобная поверхность FliL C недоступна, поскольку она недоступна. покрыта N-концевой β-цепью (рис.3Б). Стоматин из Pyrococcus horikoshii (Ph-стоматин) собирается в тример, образованный взаимодействием «голова к хвосту» уникальной N-концевой β-цепи, β0, с C-концевой β-цепью соседней субъединицы (рис. S4B). ) (35). Однако FliL C не образует тример и не имеет аналога β0. Домены SPFH основного белка свода расположены латерально в частице свода аналогично тому, как это видно с субъединицами FliL C в кольцевой структуре, но поверхность взаимодействия с соседней субъединицей отличается (рис.S4C) (36). Следовательно, положения соседних молекул различаются примерно на 60 градусов.
ОБСУЖДЕНИЕ
Гибкий линкер B-субъединицы статора, следующий за областью штекера, не важен для вращения двигателя (31), но необходим для управления количеством активных блоков статора вокруг ротора в ответ на внешнюю нагрузку (3 , 16). Поскольку линкер в PomB необходим для локализации FliL в двигателе, ожидается, что FliL будет напрямую взаимодействовать с областью линкера PomB для регулирования выходной мощности двигателя.С другой стороны, все мутанты с делециями по 20 остатков в различных областях линкера PomB утратили способность локализации FliL в двигателе. Это говорит о том, что FliL не взаимодействует со специфической областью линкера PomB и что длина линкера важна для взаимодействия с FliL. FliL также имеет гибкий линкер (FliL L ), который необходим для локализации FliL. FliL L соединяет трансмембранную спираль с FliL C . Анализ различных делеционных мутантов в FliL L предполагает, что не конкретная область в FliL L , а длина линкера, которая является критической для локализации FliL, как в случае линкера PomB.Вероятно, что позиционная гибкость периплазматических доменов PomB и FliL, приписываемая линкерным областям соответствующей длины, необходима для взаимодействия PomB-FliL.
Нами определена структура области периплазматического ядра полярного FliL (FliL C ). FliL C демонстрирует замечательное структурное сходство с доменом SPFH, несмотря на низкое сходство аминокислотной последовательности (фиг. 3B и C). Хотя физиологическая функция домена SPFH еще недостаточно изучена, известно, что некоторые из белков семейства SPFH взаимодействуют с различными ионными каналами и переносчиками, чтобы модулировать их активность (33, 37, 38).Эти белки участвуют в механосенсорной трансдукции в сенсорных нейронах млекопитающих и в формировании механосенсоров у Caenorhabditis elegans (39, 40), но механизм механочувствительности все еще неизвестен (41). Структурное сходство между FliL C и доменом SPFH означает, что FliL участвует в механочувствительности жгутиков и в регуляции активности каналов статора. Фактически, FliL P. mirabilis участвует в пути механочувствительности (23, 28). Возможно, что FliL и эти белки семейства SPFH имеют общий механизм механочувствительности и механоответа.
Периплазматический домен FliL образует декамерное кольцо или комплекс спиральной трубки с винтовой симметрией 12 1 в кристаллах, и два комплекса имеют сходные взаимодействия латеральных субъединиц. Мутации гидрофобных остатков на границе субъединицы в гидрофильные нарушили локализацию FliL в двигателе. Это предполагает, что FliL образует кольцеобразный олигомер на клеточной мембране (см. Рис. S2D в дополнительном материале) и что олигомеризация важна для функции FliL.Идея формирования сборки FliL также подтверждается результатами двухгибридных анализов (рис. S3C). Более того, это согласуется с нашими предыдущими сообщениями о находках, указывающих на то, что периплазматическая область FliL олигомеризуется при высоких концентрациях (42). Сходные кольцевые структуры описаны в белках семейства SPFH, таких как человеческий стоматин и митохондриальный запрет Saccharomyces cerevisiae (43, 44). Они образуют кольцевые комплексы, состоящие из 9–12 субъединиц на клеточной мембране.С другой стороны, некоторые др. Белки семейства SPFH, чьи структуры известны, демонстрируют различные состояния сборки и расположение субъединиц в мультимерах (Fig. S4). Mm-стоматин собирается в тубулярный комплекс, состоящий из антипараллельных димеров (Fig. S4A) (33), а Ph-стоматин образует треугольный комплекс из трех молекул (Fig. S4B) (35). Домен SPFH свода печени крыс образует 39-кратное кольцо посредством латерального взаимодействия в своде (Рис. S4C) (36). Субъединичные взаимодействия FliL C полностью различаются в этих доменах SPFH (рис.2C и D). Домены SPFH не имеют гидрофобных поясов на границе раздела, что важно для образования кольца FliL (рис. S4D). Расположение субъединиц и способ взаимодействия доменов SPFH можно оптимизировать для их индивидуальной функции и / или их белков-партнеров по регуляции.
FliL модулирует крутящий момент двигателя путем прямого взаимодействия с белками статора у E. coli и Salmonella (24) и требует, чтобы статор локализовался в двигателе у V. alginolyticus (25).Нарушение подвижности R. sphaeroides, вызванное мутацией fliL , подавлялось мутацией в области вилки MotB (21). Эти данные свидетельствуют о том, что FliL образует комплекс со статором. Наша кристаллическая структура показала, что FliL C образует кольцо с внутренним диаметром около 8 нм (рис. 2C), что сопоставимо с размером блока статора. Затем мы построили комплексную модель FliL-статор, подгоняя кольцевую структуру FliL к модели статора, построенной с помощью электронной микроскопии (ЭМ) плотности MotA с разрешением 25 Å (EMDB ID: 3417) (45) и кристаллической структуры периплазматический домен PomB (PDB ID: 3WPW) (46).Статор был удобно размещен внутри кольца FliL (рис. 4A), а область заглушки B-субъединицы статора располагалась в непосредственной близости от внутренней поверхности кольца FliL (рис. 4B).
FIG 4
Правдоподобная модель сборки и функционирования FliL (A) Модель комплекса FliL-статор. Кольцевая структура FliL Peri соответствует модели статора, построенной с помощью электронно-микроскопической структуры MotA (ортолога PomA) (EMDB ID: 3417) и кристаллической структуры периплазматического домена PomB (PomB C ) ( PDB ID: 3WPW).IM, внутренняя мембрана. (B) Модель для сборки FliL. Белые двусторонние стрелки указывают на белок-белковые взаимодействия, а красная стрелка указывает на активацию статора. (C) Положения консервативных остатков валина (V74 и V165) в кольце FliL. (D) Флуоресцентные изображения клеток, экспрессирующих GFP-FliL с мутациями консервативного валина. (E) In vivo фото-перекрестное связывание между FliL и PomB. WT, дикий тип. (F) Влияние мутаций консервативного валина на скопление поверхности латеральными жгутиками.Латеральные белки FliL с мутациями или без них экспрессировались из pZSW91 в NMB342. Ночную культуру наносили на чашки с твердым агаром VC, содержащим 0,02% (вес / объем) арабинозы, и инкубировали при 30 ° C в течение 9 часов.
Эта модель подтверждается результатами анализа мутаций остатков на внутренней поверхности кольца (рис. 4C-F). Мы заменили консервативные остатки валина на внутренней поверхности кольца FliL (V74 и V165) на гидрофильные и проанализировали локализацию FliL. Эти мутации не повлияли на локализацию GFP-FliL (рис.4D). Затем мы заменили эти остатки валина на p -бензоил-1-фенилаланин ( p Bpa), который является фотореактивной неприродной аминокислотой и образует ковалентную связь с соседними молекулами белка при УФ-облучении. Мутированный белок FliL коэкспрессировался с белками V. alginolyticus PomA / PomB в клетках E. coli BL21 (DE3), и УФ-свет использовали для облучения клеток для фото-перекрестного связывания. Мутант FliL был сшит с PomB с помощью УФ-света (фиг. 4E), что указывает на то, что V74 и V165 в FliL близки к PomB in vivo .Поскольку клетки E. coli BL21 (DE3) не имеют жгутика, этот результат предполагает, что FliL может собираться вокруг статора без базального тела жгутика. Мы также исследовали влияние соответствующей мутации латерального FliL на подвижность поверхности в условиях высокой нагрузки. Делеция латерального fliL в штамме YM19, который формирует только боковые жгутики, привела к потере способности к роению на пластине с агаром 1,25% (рис. 4F; см. Также рис. S5A), но не оказала сильного влияния на плавание в штамме 0,25%. пластина с агаром (рис.S5A). Мы подтвердили, что на формирование латерального жгутика не повлияла делеция fliL в штамме дикого типа (штамм 138-2) с помощью электронной микроскопии и вестерн-блоттинга (фиг. S5B и C). Замена соответствующих остатков валина латеральных FliL (V73 и V164) на гидрофильные нарушает подвижность роения латеральными жгутиками (рис. 4F). Эти результаты предполагают, что консервативные остатки валина, расположенные на внутренней стороне кольца FliL, не существенны для образования комплекса со статором, но близки к PomB и важны для активации статора в роящихся клетках.
Недавний флуоресцентный микроскопический анализ с использованием FliL, слитого с GFP на своем N-конце (GFP-FliL), показал, что стехиометрия статора и белка FliL в функциональном двигателе будет 1: 1 (47), что несовместимо с Модель представлена в данном исследовании. Однако мы обнаружили, что GFP-FliL нарушает двигательную функцию (рис. S5D). Мутантные клетки, экспрессирующие GFP-FliL, снижали подвижность меньше, чем мутантные клетки Δ fliL . Это снижение подвижности подавлялось мутацией L109D или L160D, каждая из которых нарушает локализацию FliL (рис.S5D). Возможно, что количество статоров вокруг двигателя уменьшится из-за наличия GFP. Следовательно, было бы трудно оценить количество белков FliL в функциональном двигателе с помощью GFP-FliL.
Предыдущее криоэлектронное томографическое исследование in situ базального тела жгутика B. burgdorferi привело к сообщению о том, что FliL расположен между статором и ротором (22). Однако статор B. burgdorferi окружен воротником, который является компонентом базального тела, специфичным для спирохет.Следовательно, мы не можем напрямую сравнивать базальную структуру тела Borrelia со структурой Vibrio , но другая дополнительная плотность присутствует на внешней стороне плотности статора на их томограмме (22), что согласуется с нашей кольцевой моделью.
На основе наших результатов вместе с предыдущими отчетами мы предлагаем модель механизма регулирования выходной мощности двигателя с помощью FliL (рис. 4B). Молекулы FliL могут окружать статор, образуя комплекс FliL-статор в двигателе.Конформационная гибкость, приписываемая линкерным областям FliL и PomB, может быть важна для регулировки каждой субъединицы в соответствующем положении с образованием комплекса FliL-статор. Остатки на внутренней поверхности кольца FliL C могут затем взаимодействовать с периплазматической областью PomB, предположительно представляя область пробки, которая присутствует для поддержания притока ионов и увеличения крутящего момента двигателя, особенно в условиях роения. Структурное сходство с доменами SPFH белков семейства устьиц означает, что FliL может регулировать активность ионных каналов статора в ответ на некоторые механические сигналы.Однако механочувствительный механизм до сих пор неизвестен для всех белков семейства устьиц. Другой возможный механизм регулирования выходной мощности двигателя состоит в том, что кольцо FliL действует как улавливающее соединение, предложенное Nord et al. (17). FliL может способствовать связыванию B-субъединицы со слоем пептидогликана в условиях высокой нагрузки и, таким образом, может предотвратить отделение статорного блока от двигателя. Требуются дальнейшие исследования для уточнения механизма регулирования выходной мощности двигателя в ответ на внешнюю нагрузку, а также механизма измерения нагрузки.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы, среды и плазмиды. Бактериальные штаммы и плазмиды, использованные в этом исследовании, перечислены в Таблице S2 в дополнительном материале. V. alginolyticus культивировали при 30 ° C в среде VC (0,5% [вес / объем] полипептон, 0,5% [вес / объем] дрожжевой экстракт, 0,4% [вес / объем] K 2 HPO 4 , 3% [вес / объем] NaCl, 0,2% [вес / объем] глюкоза) или среда VPG (1% [вес / объем] полипептон, 0,4% [вес / объем] K 2 HPO 4 , 3% [вес / объем] об.] NaCl, 0.5% [вес / объем] глицерина). При необходимости добавляли хлорамфеникол в конечной концентрации 2,5 мкг / мл -1 для культуры Vibrio . E. coli культивировали в среде LB (Lennox; Nacalai Tesque, Киото, Япония). При необходимости добавляли хлорамфеникол или ампициллин до конечной концентрации 25 мкг мл -1 или 50 мкг мл -1 для культуры E. coli.
Для конструирования плазмид фрагменты ДНК, амплифицированные с помощью ПЦР, клонировали в каждый плазмидный вектор с использованием ДНК-лигазы Т4 (New England Biolabs) или in vivo клонированием (48).
Чтобы удалить гены fliL в V. alginolyticus, предшествующую последовательность (примерно 500 п.н.) и нижестоящую последовательность (примерно 500 п.н.) гена fliL клонировали в pSW7848 и проводили гомологичную рекомбинацию, как описано ранее. (49). Точечные мутации и мутации с внутренней делецией в плазмидах были введены с помощью сайт-направленного мутагенеза QuikChange (Agilent Technologies).
Трансформацию E. coli проводили стандартным методом теплового шока.Трансформацию V. alginolyticus проводили с использованием метода электропорации, описанного ниже. Ночные культуры, выращенные на среде VC, инокулировали в 100-кратном разведении в 5 мл среды VC и культивировали в течение 90 мин при 30 ° C. Клетки собирали и суспендировали в 1 мл ледяного буфера SNT (30 мМ Трис-HCl [pH 8,0], 20% [вес / объем] сахароза, 0,4 М NaCl, 1 мМ EDTA) с последующим легким встряхиванием в течение 10 минут. мин при 4 ° C. Клетки осаждали и промывали 1 мл ледяного буфера SP (14% [вес / объем] сахарозы, 3.5 мМ K 2 HPO 4 , 3,5 мМ NaH 2 PO 4 ). Клетки снова осаждали, суспендировали в 40 мкл ледяного буфера SP, содержащего плазмиду, и переносили в кювету для электропорации с зазором 0,1 см. Электропорацию проводили с помощью генератора импульсов генов (MicroPulse Electroporator; Bio-Rad Laboratories, Геркулес, Калифорния, США) при напряженности электрического поля 7 кВ см -1 . После электропорации немедленно добавляли 1 мл среды VC и инкубировали при 30 ° C в течение 45 минут.Клетки осаждали, помещали на селективный планшет, содержащий антибиотики, и инкубировали в течение ночи при 30 ° C.
Анализы подвижности в чашках с мягким и жестким агаром. 2 мкл ночной культуры наносили на чашки с мягким агаром VPG (VPG, содержащий 0,25% [вес / объем] агара) или чашки с твердым агаром VC (VC содержащий 1,25% [вес / объем] агара) с последующей инкубацией при 30 ° C в течение различных периодов времени, как описано в тексте. Диаметр подвижных колец измеряли относительно диаметров клеток дикого типа.Усредненные значения и стандартные отклонения данных из более чем трех независимых экспериментов были нанесены на графики.
Наблюдение субклеточной локализации GFP-FliL с помощью флуоресцентной микроскопии. Ночные культуры, выращенные в среде VC, инокулировали в 100-кратном разведении в среду VPG, содержащую 0,006% (вес / объем) арабинозы, и культивировали в течение 4 часов при 30 ° C. Клетки собирали центрифугированием и ресуспендировали в буфере TMN500 (50 мМ Tris-HCl [pH 7,5], 5 мМ MgCl 2 , 5 мМ глюкоза, 500 мМ NaCl).Затем клетки загружали в пространство между покровным стеклом и предметным стеклом микроскопа, оба из которых покрыты поли-1-лизином, и инкубировали в течение 10 мин для прикрепления к поверхности покровного стекла. После отмывания несвязавшихся клеток буфером TMN500 клетки наблюдали с помощью флуоресцентного микроскопа (BX53; Olympus, Япония), оснащенного ртутной лампой высокого давления мощностью 100 Вт (U-RFL-T; Olympus ). Изображения были записаны с использованием цифровой камеры с зарядовой связью (CCD) и программы сбора данных (INFINITY2-1RM и INFINITY CAPTURE; Argo Corporation, Япония).Штамм ZSW1, несущий pZSW6, использовали для наблюдения за мутантными клетками FliL, а штамм ZSW2, несущий pZSW81, использовали для наблюдения за мутантными клетками PomB.
Очистка периплазматических фрагментов FliL. Экспрессию и очистку FliL Peri выполняли, как описано ранее (42). FliL C был получен из FliL Peri путем ограниченного протеолиза (50). His 6 -FliL Peri , очищенный аффинной хроматографией на никель-нитрилотриуксусной кислоте (Ni-NTA), расщепляли с использованием трипсина при соотношении протеаза / белок 1/100 (вес / вес) в течение 30 мин при 27 ° C. , и продукты разделяли с помощью эксклюзионной хроматографии (Superdex 75 10/300 GL; GE Healthcare, Чикаго, Иллинойс, США).
Кристаллизация и определение структуры. Кристаллизация проводилась методом диффузии паров сидя-капля. Подробности скрининга кристаллизации были описаны ранее (42). Кристаллы FliL Peri , используемые для сбора рентгеновских данных, выращивали при 20 ° C из капель, приготовленных путем смешивания 0,5-1 мкл раствора белка (70 мг / мл -1 ), содержащего 20 мМ трис-HCl (pH 8,0) и 150 мкл. мМ NaCl с эквивалентным объемом резервуарного раствора, содержащего 0,1 М ацетат натрия (pH 6.0), 25% (об. / Об.) Полиэтиленгликоля (ПЭГ) 200, 0,15 М CaCl 2 и 1,4% (об. / Об.) Этилового спирта (EtOH). Кристаллы принадлежат пространственной группе P 4 2 2 1 2 с размерами элементарной ячейки a = b = 162,2 и c = 302,2 Å. Кристаллы FliL C , используемые для сбора рентгеновских данных, были получены при 20 ° C из капель, приготовленных путем смешивания 0,5-1 мкл раствора белка (10 мг / мл -1 ), содержащего 20 мМ трис-HCl (pH 8.0) и 150 мМ NaCl с эквивалентным объемом резервуарного раствора, содержащего 0,1 М ацетата натрия (pH 4,4), 22,5% (вес / объем) ПЭГ 4000 и 0,2 М сульфата аммония. Кристаллы принадлежат пространственной группе P 6 1 с размерами элементарной ячейки a = b = 104,2 и c = 40,1 Å.
Данные дифракции рентгеновских лучей были собраны на синхротронном канале BL41XU в SPring-8 (Харима, Япония) с одобрения Японского научно-исследовательского института синхротронного излучения (JASRI) (предложение №2015A1084, 2015B1084, 2016A2541, 2016B2541, 2017A2588 и 2017B2588). Кристаллы замораживали в жидком азоте и помещали в поток газообразного азота при 100 К для сбора рентгеновских данных. Дифракционные данные обрабатывались с помощью MOSFLM (51) и масштабировались с помощью AIMLESS (52). Статистика дифракционных данных сведена в Таблицу S1.
Начальная фаза кристалла FliL C была рассчитана с использованием метода молекулярного замещения с программным обеспечением Phenix (53) и предсказанной структурной модели FliL C , созданной сервером Robetta (http: // robetta.bakerlab.org/) (32) в качестве модели поиска. Атомная модель FliL C была создана с помощью Coot (54) и уточнена до разрешения 2,1 Å с помощью Phenix (53). Структура FliL Peri была определена путем молекулярного замещения на Phenix с использованием атомной модели FliL C в качестве модели поиска. Модель была модифицирована с помощью Coot (54) и уточнена до разрешения 3,4 Å с помощью Phenix. Статистика уточнения сведена в Таблицу S1.
In vivo фото-сшивание.Клетки BL21 (DE3), несущие две разные плазмиды, pEVOL- p BpF и pNT70 с мутациями V74amber или V165amber или без них, культивировали в среде LB, содержащей 1 мМ p -бензоил-1-фенилаланин ( p Bpa). (Bachem AG, Швейцария) в течение 2,5 ч при 30 ° C от начальной оптической плотности 600 нм 0,1. Затем добавляли арабинозу и изопропил-β-d-тиогалактопиранозид (IPTG) для достижения конечных концентраций 0,02% (вес / объем) и 0,1 мМ, соответственно, и культивирование продолжали в течение 4 часов.Клетки собирали центрифугированием (3000 × г ), суспендировали в буфере PBS (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4 , 1,76 мМ KH 2 PO 4 ), собирали снова центрифугированием и ресуспендировали в буфере PBS. УФ-облучение проводили УФ-лампой B-100AP (Analytik Jena US, Апланд, Калифорния, США) в течение 5 мин. Затем клетки разрушали обработкой ультразвуком и центрифугировали при 15000 × g в течение 5 минут. Супернатант ультрацентрифугировали при 100000 × g в течение 30 мин.Осадок суспендировали в буфере TN (20 мМ трис-HCl [pH 8,0], 150 мМ NaCl), содержащем 1% (вес / объем) н-додецил-β-d-мальтопиранозид (DDM), и инкубировали при 4 ° C в течение 1 час Солюбилизированную мембранную фракцию смешивали с Ni-NTA агарозой (Qiagen, Hilden, Германия) при 4 ° C в течение 1 ч. Связанную с белком агарозу дважды промывали буфером TN, содержащим 0,1% (мас. / Об.) DDM и 10 мМ имидазола, а затем белки элюировали буфером TN, содержащим 0,1% (мас. / Об.) DDM и 300 мМ имидазол. Белки осаждали осаждением трихлоруксусной кислотой и суспендировали в загрузочном буфере додецилсульфата натрия (SDS) (62.5 мМ трис-HCl [pH 6,8], 2% [вес / объем] SDS, 10% [вес / объем] глицерина, 0,01% [вес / объем] бромфенолового синего), содержащий 5% (объем / объем) β-меркаптоэтанола и кипятили при 95 ° C в течение 3 мин. Образцы разделяли электрофорезом в SDS-полиакриламидном геле (SDS-PAGE) и переносили на поливинилидендифторидную мембрану. Белки детектировали с помощью мышиных антител против His и кроличьих антител против PomB C (55).
Бактериальный двугибридный тест. Использовали бактериальную двугибридную систему, разработанную Каримовой и соавт.(56). Клетки DHM1, несущие плазмиды, полученные из pKT25 и pUT18C, выращивали в среде LB, содержащей 50 мкг мл -1 ампициллина и 50 мкг мл -1 канамицина при 37 ° C в течение примерно 24 ч, и культуры клеток помещали на планшет BacTH (LB, содержащий 1,25% [вес / объем] агара, 0,5 мМ IPTG [изопропил-β-d-тиогалактопиранозид], 40 мкг мл -1 5-бром-4-хлор-3-индолил-β-d -галактопиранозид [X-Gal], 50 мкг мл -1 ампициллина и 50 мкг мл -1 канамицина) и инкубировали при 30 ° C в течение примерно 24 часов.
Просвечивающая электронная микроскопия. Клетки штамма V. alginolyticus NMB338 или штамма NMB339 отбирали из свежих колоний на чашках с агаром и смешивали с 2% (мас. / Об.) Раствором фосфовольфрамата калия (pH 7). Раствор помещали на покрытую углеродом медную сетку и наблюдали с помощью электронного микроскопа (JEM-2010; JEOL, Япония).
Обнаружение латеральных жгутиков методом иммуноблоттинга. Ночные культуры, выращенные на среде VC, инокулировали в среду VPG в 100-кратном разведении и культивировали при 30 ° C в течение 4 часов.Клетки собирали центрифугированием, суспендировали до 10 оптической плотности при 660 нм в загрузочном буфере SDS, содержащем 5% (об. / Об.) Β-меркаптоэтанола, и кипятили при 95 ° C в течение 5 мин. Образцы разделяли с помощью SDS-PAGE и переносили на нитроцеллюлозную мембрану. Белки детектировали с использованием кроличьих поликлональных антител против латерального жгутика, индуцированных против очищенного латерального флагеллина.
Доступность данных. Координаты атомов размещены в банке данных Protein Data Bank (www.pdb.org) (ID PDB: 6AHP и 6AHQ).
БЛАГОДАРНОСТИ
Мы благодарим Kazuya Hasegawa из SPring-8 за техническую помощь в использовании каналов пучка, Kimika Maki за техническую поддержку в электронной микроскопии, Peter G. Schultz за любезный подарок pEVOL- p BpF для фото- перекрестное связывание и Дидье Мазель за предоставление бактериального штамма и плазмид для создания мутантов с делецией генов у V. alginolyticus.
Работа выполнена при поддержке JSPS KAKENHI (гранты JP15H02386 [К.I.], JP16J01859 [для N.T.], JP18K07108 [для H.T.] и JP18K19293 [для S.K.]) и MEXT KAKENHI (предоставляет JP23115008 [для K.I.] и JP24117004 [для M.H.]).
СНОСКИ
- Получено 1 февраля 2019 г.
- Принято 5 февраля 2019 г.
- Опубликовано 19 марта 2019 г.
- Авторские права © 2019 Takekawa et al.
Белок двигательного нейрона выживания (SMN): роль в росте нейритов и нервно-мышечном созревании во время дифференцировки и развития нейронов | Молекулярная генетика человека
Аннотация
Детская спинальная мышечная атрофия (SMA) — распространенное нервно-мышечное заболевание, вызванное отсутствием или дефицитом белка полноразмерных мотонейронов выживания (SMN).Клинические исследования и модели на животных предполагают, что СМА является пороком развития нервно-мышечного взаимодействия; однако роль SMN в этом процессе остается неясной. В настоящем исследовании мы определили субклеточную локализацию SMN во время индуцированной ретиноевой кислотой нейрональной дифференцировки эмбриональных клеток тератокарциномы P19 мыши, а также в скелетных мышцах во время критического периода нервно-мышечного созревания. Мы впервые демонстрируем накопление SMN в структурах, подобных конусу роста и филоподиям, как в нейрональных, так и в глиальных клетках, идентифицируя SMN как маркер нового конуса роста.В самом деле, SMN присутствует на переднем крае разрастаний нейритов, что позволяет предположить, что SMN могут играть роль в этом процессе. Кроме того, SMN были обнаружены в виде небольших точечных частиц в цитоплазме скелетных мышц в течение первых 2 недель после рождения, но их количество достигло пика на P6. Интенсивное окрашивание SMN в нервно-мышечных соединениях наблюдалось на протяжении всего исследуемого постнатального периода. Взятые вместе, эти результаты предполагают, что SMN действительно может выполнять специфические для нейронов и мышц функции, обеспечивая более правдоподобный механизм, объясняющий дегенерацию двигательных нейронов и связанную с ней атрофию денервации скелетных мышц при SMA.Первичная патология СМА, скорее всего, инициируется в периферическом аксоне — результат недостаточного роста нейритов и / или нервно-мышечного созревания.
ВВЕДЕНИЕ
Спинальная мышечная атрофия (СМА) — аутосомно-рецессивное заболевание, характеризующееся дегенерацией альфа-мотонейронов спинного мозга и мышечной атрофией конечностей и туловища. СМА — второе по распространенности нервно-мышечное заболевание, которым страдает примерно 1 из 10 000 живорожденных (1).В зависимости от возраста начала и тяжести симптомов различают три клинических типа: тип I — наиболее тяжелый, тип II — средней степени тяжести, а тип III — наиболее легкая форма заболевания (2, 3). Ген причинного выживания мотонейрона ( SMN ) был выделен в 1995 году из сложной области хромосомы 5q13, которая содержит инвертированную дупликацию размером около 500 т.п.н. (4). Ген SMN1 является теломерным из гена SMN2 , а SMN1 удален или мутирован более чем у 90% всех пациентов с СМА (4, 5).Кроме того, был задокументирован ряд небольших внутригенных мутаций, обеспечивающих убедительные доказательства того, что мутации SMN1 и являются необходимой и достаточной причиной 5q-SMA (6, 7). Соответственно, белок SMN значительно снижен в клеточных линиях фибробластов и лимфобластов от пациентов с тяжелым поражением СМА (8, 9). Хотя был достигнут большой прогресс в описании геномной структуры (4, 10–12), причинных мутаций (5) и взаимосвязи фенотип / генотип (13), функция SMN до конца не изучена, и поэтому патогенез SMA остается неясным.SMN взаимодействует или связывается с несколькими белками, включая SMN-взаимодействующий белок 1 (SIP1 / Gemin2), сплайсосомный U snRNP-белок, предполагаемую геликазу Gemin3, Gemin4 и многие другие (14 — 17). Большой, высокостабильный комплекс SMN можно найти как в цитоплазматическом, так и в ядерном компартментах (9, 14, 17). Цитоплазматический комплекс играет важную роль в биогенезе сплайсосомных snRNP и необходим для транспорта комплекса snRNP в ядро (17). Внутри ядра SMN впервые был обнаружен в сильно окрашенных очагах (названных драгоценными камнями от «Близнецов свернутых тел») в тесной ассоциации, но отличных от свернутых тел (18).Cajal (свернутые) тельца (CBs) являются зависимыми от транскрипции ядерными органеллами размером 0,5–1 мкм, наблюдаемыми как клубки свернутых электронно-плотных нитей (19), и, как полагают, участвуют в биогенезе, транспорте или циклическом движении snRNP (20). С тех пор было продемонстрировано, что по большей части SMN совместно локализуется в CBs (19-22). В ядре SMN необходим для регенерации активного комплекса сплайсинга (23, 24). В соответствии с функцией домашнего хозяйства SMN, он экспрессируется повсеместно (8, 25), и отключение единственной копии (26) гена Smn мыши вызывает задержку развития и гибель эмбриона (27, 28).В то время как субклеточное распределение SMN широко изучалось в культивируемых клетках (8, 9, 22, 29-31), а также в тканях плода (22, 25, 29) и взрослых (29, 32, 33), никакие другие Функция, за исключением ее хозяйственной роли в пути сплайсинга, еще не открыта.
Если SMN — это просто ген домашнего хозяйства, почему нейроны являются основной мишенью дефицита SMN? Требуются ли двигательные нейроны в больших количествах SMN сверх того, что требуется для других типов клеток, или SMN выполняет специфическую для нейронов функцию? Основная особенность, отличающая нейроны от других типов клеток, заключается в том, что они обладают дендритами и аксонами, которые передают сообщения от одного нейрона к другому или нацелены на мышечные клетки с помощью химических и электрических процессов.Мы предположили, что SMN может иметь по крайней мере две функции: первая — это ранее идентифицированная служебная функция; второй может быть специфическим для нейронов. Что еще более важно, эта специфическая для нейрона функция может быть связана с развитием нейронов, поскольку было показано, что SMN регулируется в процессе развития (34, 35), а SMA вполне может быть дефектом развития (36). На сегодняшний день исследования, касающиеся функции SMN, были выполнены с использованием культивируемых клеточных линий (8, 9, 22, 29-31), нейронов (29) или тканей (22, 25, 29, 32, 33).Используемые клеточные линии (например, фибробласты, амниоциты или клетки HeLa) не были нейрональными по происхождению и не могли быть индуцированы для дифференцировки в типы нейрональных клеток. Нейрональные клетки, выделенные из спинного мозга, уже дифференцированы; следовательно, невозможно изучить локализацию SMN на ранних стадиях дифференцировки нейронов. В исследованиях с использованием тканей человека, мыши или крысы разрешение детальных межклеточных взаимодействий ограничено. Следовательно, мы использовали модель in situ эмбриональных клеток тератокарциномы P19 мыши (37) для изучения субклеточной компартментализации SMN во время дифференцировки нейронов.Клетки P19 могут быть индуцированы к дифференцировке в нейроны, глиальные клетки и фибробласты при воздействии аналога витамина А ретиноевой кислоты (RA) в диапазоне 10 -8 -10 -6 мкм (38, 39) и RA- индуцированная нейрональная дифференцировка очень похожа на ту, что наблюдается для эмбриональной нейроэктодермы in vivo (40, 41). Чтобы лучше понять роль SMN во время созревания двигательных нейронов и мышц, мы проанализировали нервно-мышечные соединения (НМС) скелетных мышц мышей, выделенных в постнатальный период.Наши данные впервые демонстрируют, что SMN накапливаются в структурах, подобных конусам роста, во время дифференцировки нейронов, что делает SMN новым маркером конусов роста. Кроме того, мы демонстрируем, что в мышцах содержание цитоплазматических SMN достигло пика на 6-й постнатальный день, непосредственно перед созреванием НМС. Эти наблюдения предполагают, что SMN действительно может выполнять специфические для нейронов и мышц функции во время созревания нейронов, мышц и НМС.
РЕЗУЛЬТАТЫ
Изобилие SMN-положительных CB связано с клеточным циклом и клеточным происхождением
В качестве первого шага к исследованию экспрессии SMN во время ранней дифференцировки нейрональных клеток мы проанализировали недифференцированные клетки P19 на наличие белка SMN путем непрямого иммунофлуоресцентного окрашивания с использованием моноклональных антител против аминокислот 14–174 человеческого SMN.Мы обнаружили диффузное окрашивание SMN в цитоплазме (рис. 1 A, C), а также от одного до трех очагов интенсивного окрашивания SMN в среднем внутри ядра (рис. 1 A, таблица 1). Чтобы определить, присутствует ли SMN в драгоценных камнях или CB, было предпринято двойное мечение SMN и p80 коилина, поскольку p80 коилин является маркером CB. Распределение CBs совпадает с SMN-положительными ядерными фокусами, подтверждая, что оба белка совместно локализованы внутри CBs (Fig. 1 B, Table 1). Интересно, что 0,1–1% клеток содержали 15 или более SMN-положительных CB в ядре, а также интенсивное диффузное окрашивание SMN в цитоплазме (рис.1 В, Г). Поскольку CBs связываются и диссоциируют во время клеточного цикла (18, 20), мы сначала попытались определить, коррелирует ли присутствие обильных SMN-положительных CBs с определенной стадией клеточного цикла. С этой целью клетки P19 были лишены сыворотки на 18 часов, чтобы арестовать клетки в состоянии G 0 . Сортировка клеток с активацией флуоресценции (FACS) показала, что 44% клеток в это время находились в G 0 –G 1 . В целом, мы наблюдали в среднем 0–1 очагов SMN / коилин в момент времени 0 и в среднем 1–3 очага SMN / коилин через 4 и 6 часов после того, как клетки были освобождены от сывороточного голодания (Таблица 1).Редкие клетки, содержащие многочисленные SMN-положительные CB, появлялись через 6 часов, а окрашивание DAPI показало конденсированный хроматин, указывающий на митотические клетки. Поскольку количество клеток с многочисленными очагами SMN не зависело от состояния клеток, мы использовали GFAP и NF-антитела в качестве маркеров глиальных и нейроноподобных клеток соответственно, чтобы идентифицировать специфический клон этой субпопуляции клеток. После RA-индуцированной дифференцировки в цитоплазме также были обнаружены многочисленные очаги SMN (рис. 1 E), и эти клетки оказались положительными по GFAP (рис.1 F, G), что указывает на их глиальное происхождение. В очагах SMN в цитоплазме отсутствовал коилин p80 (данные не представлены).
Динамическое распределение белка SMN во время дифференцировки нейронов P19
Чтобы изучить экспрессию SMN во время ранней дифференцировки нейронов, клетки P19 обрабатывали RA, который запускает эти клетки для дифференцировки в несколько различных типов клеток. После 10 дней лечения появились нейрональные и глиальные клетки. Белок SMN присутствовал по всей цитоплазме всех исследованных клеток, и, что интересно, белок SMN накапливался в структурах, подобных конусу роста, и варикозу нейроноподобных клеток во время формирования отростков нейритов (рис.2 А, Б). Мы подтвердили, что эти клетки действительно были подобны нейронам по происхождению, поскольку они были положительными на присутствие NF-L (рис. 2 C, D). Не только SMN и белок NF-L были в изобилии в структурах, подобных конусу роста, но также в некоторых клетках мы обнаружили ряд интенсивно окрашивающих агрегатов SMN в соме (рис. 2 E, F). Учитывая обилие актина в нейритах и конусах роста, распределение SMN и актина оценивали путем наложения изображений SMN и окрашивания фаллоидином Texas Red-X — более позднего связывания F-актина.В отличие от изображения F-актина, которое показывает, что окрашивание фаллоидином постепенно становится слабым по направлению к верхушке конусообразной структуры (рис. 2 G, H), окрашивание SMN было более интенсивным на переднем крае роста. -конусообразная структура (рис. 2 I, J). На 20-й день после лечения РА нейриты сформировали плотную сеть, и мы больше не обнаруживали интенсивного накопления SMN, что согласуется с потерей конусов роста во время созревания нейронов. Интересно, что мы также обнаружили интенсивное окрашивание SMN в структурах филоподий некоторых глиальных клеток (данные не показаны).Наконец, поликлональные антитела, индуцированные против ассоциированного с ростом белка 43 (GAP-43), основного компонента подвижных конусов роста (42), использовали для подтверждения присутствия SMN в структурах, подобных конусам роста. Наложенное изображение дифференцированной клетки P19, меченной антителами SMN (фиг. 3 A) или GAP-43 (фиг. 3 B), показало, что SMN и GAP-43 локализованы внутри конусов роста (фиг. 3 C).
Подавление белка SMN в мышцах происходит при созревании нервно-мышечного соединения
Чтобы выяснить, может ли белок SMN также участвовать в созревании НМС, были проведены иммунофлуоресцентные исследования для обнаружения SMN в скелетных мышцах и, более конкретно, в НМС в период новорожденности.DAPI использовали для окрашивания ядер, а конъюгированный с родамином α-бунгаротоксин (α-BT) использовали для окрашивания НМС (рис. 4). Иммуноцитохимия выявила интенсивное диффузное окрашивание SMN и маленькие точечные частицы по всей цитоплазме мышечных клеток и вокруг ядерной оболочки на 1, 3, 6 и 15 дни после рождения. В день 1 в центре незрелых мышечных клеток располагались многочисленные большие круглые ядра (рис. 4 А). Мы также наблюдали мелкие точечные частицы SMN на фоне диффузного окрашивания SMN в цитоплазме.Количество SMN-частиц увеличивалось на 3-й день (фиг. 4 B) и достигало максимума на 6-й день (фиг. 4 C), а к 15-му дню мы наблюдали резкое снижение интенсивности диффузного окрашивания цитоплазмы, а также количество SMN-частиц в зрелых мышечных клетках, содержащих уплощенные периферически расположенные ядра (рис. 4 D). Двойное мечение антителом SMN и α-BT показало, что SMN всегда высоко экспрессировался в NMJ на протяжении всех тестируемых этапов (фиг. 4).
ОБСУЖДЕНИЕ
Клинические исследования (рассмотренные в 36) в сочетании с данными недавно разработанных животных моделей (43–45) указывают на возможность того, что СМА является пороком развития нервно-мышечного взаимодействия (46).Однако доказательства причастности SMN к этому процессу были затруднены из-за того, что в большинстве исследований на сегодняшний день использовались ненейрональные клеточные линии (14, 15, 17) или из-за ограниченной способности разрешать межклеточные взаимодействия из срезов ткани ( 22, 25, 29, 31, 32, 47 — 50). Следовательно, мы исследовали субклеточную локализацию SMN во время дифференцировки нейронов и нервно-мышечного созревания, чтобы определить, обладает ли SMN специфической для нейронов и / или мышц функцией. Для достижения этой цели мы проанализировали недифференцированные и индуцированные RA клетки P19, а также срезы ткани скелетных мышц в критический период созревания НМС.Как и в других типах клеток, SMN были разбросаны по цитоплазме, а в ядре SMN совпадали с CB в клетках P19. Количество CB на клетку не было статическим, но варьировалось на протяжении клеточного цикла. В недифференцированных клетках P19 мы обнаружили в среднем 0–1 очагов SMN / коилин сразу после 18 часов сывороточного голодания по сравнению с 2–3 очагами SMN / коилин, обнаруженными через 4 и 6 часов после того, как клетки были выпущены в полностью дополненную среду. Это согласуется с наблюдаемыми зависимыми от клеточного цикла вариациями в распределении p80 коилина, маркера CBs, в фибробластах 3T3 мыши и клетках HeLa S3 — количество CBs наиболее распространено в конце G 1 (51) .Наши данные согласуются с предыдущими исследованиями, показывающими, что SMN обычно обнаруживается в CBs (19-22), и эта субклеточная локализация, скорее всего, связана с домашней функцией SMN в биогенезе snRNP и регенерации комплекса сплайсинга (17, 23). Учитывая, что глиальные клетки составляют по крайней мере 50% от общей популяции клеток, одним неожиданным наблюдением было присутствие более 15 фокусов SMN / коилин в цитоплазме и / или ядре только в 0,1–1% глиальных клеток. Необходимы дальнейшие исследования, чтобы определить, являются ли эти клетки просто артефактом клеточной культуры или они представляют собой отдельную субпопуляцию глиальных клеток, экспрессирующих большое количество SMN.
Нашим наиболее поразительным открытием было перераспределение и накопление цитоплазматических SMN на периферии тела клетки и в структурах, подобных конусам роста и филоподиям, как в нейрональных, так и в глиальных клетках. Субклеточная локализация в конусах роста была подтверждена путем демонстрации присутствия GAP-43, белка, участвующего в росте нейритов (42), вдоль отростков нейритов и локализации SMN и GAP-43 внутри конусов роста. Поскольку иммуноэлектронная микроскопия предполагает, что частицы SMN могут быть связаны с микротрубочками в дендритах (48), мы предполагаем, что SMN могут транспортироваться по микротрубочкам, перемещая их в конусы роста.Конусы роста — это динамические структуры, которые реагируют на внутри- и внеклеточные сигналы, чтобы направлять нейриты к соответствующей цели во время развития нейронов (52). Ростовые конусы с простейшей морфологией — это те, чьи нейриты быстро расширяются (53) и наиболее похожи на простые формы, которые мы наблюдали в наших обработанных RA клетках P19. Наложенные изображения F-актина и окрашивания SMN показали SMN на переднем крае отростков нейритов, предполагая, что SMN могут играть роль в этом процессе.Хорошо известно, что SMN взаимодействует с рядом белков, многие из которых еще не идентифицированы (17). Интересно, что профилин II, актин-связывающий белок, связанный с мотонейрон-специфическими микрофиламентами, участвующий в полимеризации актина (54, 55), взаимодействует напрямую с SMN через эволюционно консервативный Pro 5 -X 17 -Pro 10 -X 17 -Pro 5 мотив (56), кодируемый экзонами 4, 5 и 6 гена SMN (4, 26).Это взаимодействие может опосредовать транспорт актина и SMN в отростках нейритов. Эти данные предполагают, что дефицит SMN может привести к нарушению созревания мотонейронов, что, в свою очередь, повлияет на созревание мышц. В соответствии с этим было установлено, что атрофия мышц предшествует потере двигательных нейронов с использованием двух различных животных моделей СМА (43, 44). В первой модели мышей SMN F7 / Δ7 , Cre + , гомозиготных по делециям экзона 7 SMN только в нейронах, показали, что НМС были морфологически аномальными к 2-недельному возрасту, но количество двигательных движений спинного мозга нейроны были нормальными, что указывает на нейрогенное происхождение наблюдаемого мышечного фенотипа (43).К 4-недельному возрасту мотонейроны заметно деформировались. Во второй модели человеческий ген SMN2 был введен в фон Smn — / — ( Smn — / — , SMN2 ), в результате чего были получены мыши с генотипом, наиболее близким к этому генотипу. пациентов со СМА I типа (44). Сходным образом количество двигательных нейронов изначально было нормальным, и потеря двигательных нейронов началась после P3 у мышей с низким уровнем копий Smn — / — , SMN2 ; однако мышечная слабость была очевидна при рождении.Основываясь на этих результатах, мы предполагаем, что патология СМА начинается в дистальных отростках, прогрессирует в сторону сомы развивающихся нейронов, а гибель клеток двигательных нейронов, скорее всего, является результатом отсутствия SMN в конусах роста и неправильного созревания НМС. В соответствии со способностью SMN связывать как белки (17), так и РНК (57, 58), мы также предполагаем, что SMN могут участвовать в транспорте этих молекул к периферии нейритов, тем самым обеспечивая адекватный пул белков с высоким содержанием белка. потребность во время формирования конуса роста и раннего развития нейронов.Появляется все больше свидетельств того, что нацеливание мРНК на синапсы и локальный синтез белка вовлечены в нейрональную полярность, синаптическую пластичность и, возможно, долгосрочную память (59 — 62). Эта гипотеза согласуется с недавней идентификацией двух дополнительных партнеров SMN (63, 64), а именно, РНК-связывающих белков hnRNP-R и hnRNP-Q, в сочетании с демонстрацией того, что SMN и hnRNP-R совместно локализуются в дистальных аксонах эмбриональные мотонейроны (64).
Количество и субклеточная локализация SMN варьировались во время раннего развития скелетных мышц мышей, что согласуется с предыдущими сообщениями, указывающими на подавление экспрессии SMN во время миогенеза in vitro (25) и при сравнении скелетных мышц плода и взрослого человека (32).Мы обнаружили диффузное окрашивание и многочисленные мелкие точечные частицы SMN в цитоплазме скелетных мышц, а также интенсивное окрашивание SMN в НМС в течение первых 2 недель постнатальной жизни; однако после созревания интенсивность цитоплазматического окрашивания и количество точечных частиц SMN резко снизились, в то время как SMN оставались концентрированными в НМС. Эти результаты предполагают, что присутствие SMN в мышцах также может быть важным в этот критический период. У грызунов сложный процесс, соединяющий моторные нейроны и скелетные мышцы, занимает 2–3 недели и начинается примерно на 13-й день эмбриона, когда моторные аксоны входят в развивающиеся мышечные массы, и завершается около P14, когда зрелое мышечное волокно иннервируется одним моторным аксоном ( 65 — 67).Блокирование этого процесса вызывает ретракцию аксона и приводит к гибели клеток двигательного нейрона (46). Следовательно, функциональное взаимодействие между двигательным нейроном и его мышцей-мишенью имеет решающее значение для определения того, будет ли данный двигательный нейрон созревать в достаточной степени, чтобы вносить вклад в ЦНС. Это, а также наши данные, локализующие SMN в структурах, подобных конусу роста, во время дифференцировки нейрональных клеток, предполагают, что SMN могут играть роль во время созревания NMJ. Эта гипотеза подтверждается предыдущими демонстрациями резкого уменьшения SMN спинного и мышечного мозга у грызунов в течение первых 2 недель жизни (50, 68) и, кроме того, подтверждается моделями SMA на животных, указывающими на то, что мышечная атрофия предшествует потере двигательных нейронов (43, 44). ), наличие мышечной атрофии у мышей, лишенных SMN конкретно в мышцах (45), и более тяжелого фенотипа у мышей с низким уровнем копий SMN — / — , SMN2 мышей с дефицитом SMN как в нейронах, так и в мышцах (28 , 44).
Таким образом, наше настоящее исследование предоставляет убедительные доказательства накопления SMN в конусах роста и НМС во время дифференцировки нейронов и нервно-мышечного созревания, предполагая, что цитоплазматический SMN действительно может обладать специфической для нейронов и мышц функцией. Поскольку RA-индуцированные клетки P19 имитируют нормальную дифференцировку нейрональных клеток (40, 41), мы полагаем, что эти результаты точно отражают перемещение SMN во время этого процесса, и эта предпосылка дополнительно подтверждается преобладанием SMN в цитоплазме мотонейронов ( 25, 32, 47), наличие SMN в аксонах и дендритах (29, 31, 50, 64), а также независимая локализация SMN в NMJ (49).Эта функция связана с полноразмерным SMN, учитывая происхождение клеток P19 от мыши. Существование нейрональной и мышечной специфической роли SMN обеспечивает более правдоподобный механизм, объясняющий дегенерацию двигательных нейронов и связанную с ней атрофию денервации скелетных мышц при СМА. Действительно, тяжесть заболевания может отражать состояние созревания мышц и степень гибели двигательных нейронов во время развития, как предполагалось ранее (69). В заключение, дефицит SMN в нейронах, глиальных клетках и мышцах может вносить свой вклад в патогенез SMA, и будущие исследования должны быть сосредоточены на цитоплазматической функции SMN в этих клеточных линиях, если мы хотим добиться дальнейшего прогресса в нашем понимании этиологии SMA.
МАТЕРИАЛЫ И МЕТОДЫ
Синхронизация ячеек P19
Клетки эмбриональной карциномы мыши P19 (ATCC CRL-1825) поддерживали в α-минимальной эссенциальной среде (α-MEM) с добавлением 10% (об. / Об.) Фетальной бычьей сыворотки (FBS) при 37 ° C в 5% CO . 2 инкубатора . Синхронизацию клеток P19 осуществляли путем депривации сыворотки. Клетки выращивали до 50% конфлюэнтности и помещали в α-MEM, содержащую 0,5% FBS, и после 18 часов голодания среду с дефицитом сыворотки заменяли на α-MEM, содержащую 10% FBS.Клетки фиксировали каждый час в течение более 10 ч после пополнения клеток 10% FBS. 100 клеток исследовали в каждый момент времени, чтобы определить долю митотических клеток в общей популяции клеток, а также количество очагов SMN и CB на клетку. Митоз контролировали окрашиванием 4 ‘, 6-диамидино-2-фенилиндола дигидрохлоридом (DAPI; Sigma-Aldrich Co., Онтарио). Очаги SMN и CB были выявлены с помощью двойной иммунофлуоресцентной метки с использованием моноклонального антитела против SMN (BD PharMingen, Ontario) и кроличьего поликлонального антитела R288 против p80 коилина (подарок доктора Эдварда К.Л. Чан; см. 51). Состояние клеток в конце периода голодания по сыворотке, а также через 4 и 6 часов после пополнения клеток 10% FBS устанавливали путем пропускания 3,6 × 10 6 клеток в растворе Кришана через FACS.
Дифференциация клеток P19
Дифференциация клеток P19 ретиноевой кислотой была основана на методе, описанном ранее (70). Вкратце, клетки P19 (5 × 10 5 на чашку Петри) индуцировали к дифференцировке путем добавления 2 мкМ all- trans -ретиноевой кислоты (RA; Sigma-Aldrich Co., Онтарио). Клетки агрегировали в бактериальных чашках Петри, и после 48 ч инкубации агрегаты диспергировали с 0,125% (вес / объем) трипсином и 1 мМ ЭДТА перед повторным нанесением на бактериальные чашки Петри, содержащие α-MEM со свежим RA, в течение следующих 24 часов. Небольшие клеточные агрегаты (около 50 клеток) собирали с помощью стерильных наконечников пипеток, высевали на покрытые поли-лизином покровные стекла микроскопа в α-MEM с 10% FBS и выращивали в течение 3 дней. Затем клетки обрабатывали 13 мкг / мл 5-фтор-2′-дезоксиуридина и 33 мкг / мл уридина для подавления чрезмерного роста глиальных и фибробластоподобных клеток и через 48 часов возвращали к не содержащему глутамина α-MEM, содержащему 10% FBS.Среду меняли каждые 3-4 дня, а клетки собирали на 5, 10 и 20 дни после лечения RA. Для недифференцированных контролей необработанные клетки P19 высевали на покрытые поли-лизином покровные стекла микроскопа и культивировали в течение 24 часов перед иммуноцитохимическим анализом.
Непрямая иммунофлуоресценция клеток P19
Клетки
P19 дважды промывали фосфатно-солевым буфером (PBS, pH 7,2) и фиксировали в течение 10 минут при комнатной температуре, используя свежеприготовленный ледяной 4% (мас. / Об.) Параформальдегид в PBS, с последующими тремя 2-минутными промывками в PBS.Сайты неспецифического связывания блокировали инкубацией с 3% (об. / Об.) Нормальной козьей сывороткой в течение 1 ч при комнатной температуре. Затем образцы инкубировали в течение ночи при 4 ° C с первичными антителами с последующими четырьмя 5-минутными отмывками в PBS. Первичные антитела, используемые в этих исследованиях, представляли собой моноклональные антитела против человеческого SMN (созданные против полипептида, соответствующего аминокислотам 14–174 SMN) и кроличьи поликлональные антитела против p80 коилина (R288), нейрофиламента 68 кДа (NF-L; Chemicon International , Inc., CA), глиальный фибриллярный кислый белок (GFAP; DAKO, CA) и связанный с ростом белок 43 (GAP-43; Chemicon International, Inc., CA). Вторичные антитела применяли в течение 2 часов при комнатной температуре индивидуально для экспериментов с однократным мечением или в виде смеси для экспериментов с двойным мечением с последующими четырьмя 5-минутными отмывками в PBS. Вторичные антитела включали козий антимышиный IgG (H + L), связанный с Cy2, а также козий антикроличий IgG (H + L), связанный с Cy3 (Jackson ImmunoResearch Laboratories, PA). Чтобы пометить F-актин, клетки инкубировали в течение 1 ч с фаллоидином Texas Red-X (Molecular Probes, OR) вместе со вторичным антителом при комнатной температуре.Первичные и вторичные антитела, а также маркер F-актина разводили в PBS в присутствии 3% (мас. / Об.) Бычьего сывороточного альбумина (BSA). Ядра клеток контрастировали с помощью 50 нМ DAPI в PBS в течение 5 минут с последующими четырьмя 5-минутными промывками в PBS. Контроли выполняли с использованием нормальной кроличьей сыворотки или без первого антитела. Наконец, образцы помещали в раствор глицерина (разведение 1/9 в PBS) и исследовали с помощью флуоресцентной микроскопии (Nikon ECLIPSE E600, Япония) с использованием программного обеспечения Zeiss (AxioVision 2.05, Carl Zeiss GmbH, Германия). Длины волн возбуждения были установлены на 540–580 нм для Cy3, 460–500 нм для Cy2 и 330–380 нм для окрашивания DAPI. Никаких дополнительных изменений на флуоресцентных изображениях не производилось; однако изображения были наложены с помощью программного обеспечения Zeiss в случае экспериментов с двойной меткой.
Непрямая иммунофлуоресценция мышц
Постнатальных мышей (дни 1, 3, 6 и 15) были убиты шейным смещением. Прямые мышцы бедра и икроножные мышцы отсекали от задней лапы.Поперечно-полосатую мышцу промывали несколько раз в PBS перед фиксацией в течение ночи 4% (мас. / Об.) Параформальдегидом. Фиксированные образцы промывали в PBS и обезвоживали 5-минутными инкубациями с использованием серий 70%, 80%, 90%, 95% и 100% этанола и абсолютного толуола с последующим заделыванием в парапласт (Sigma-Aldrich Co., Онтарио). . Образцы были разрезаны на 6 мкм; парапласт удаляли путем погружения предметных стекол на 15 мин в толуол, а срезы регидратировали при понижении серийных концентраций этанола. Затем образцы инкубировали с 1% SDS в трис-буферном физиологическом растворе в течение 5 минут, и двойное мечение NMJ было выполнено путем инкубации с первичным антителом против SMN с последующей обработкой 0.5 мкг / мл конъюгированного с тетраметилродамином α-бунгаротоксина (молекулярные зонды) и вторичный козий антимышиный IgG (H + L), связанный с Cy2. Длина волны возбуждения для тетраметилродамина составляла 540–580 нм. Ядра контрастировали с DAPI.
БЛАГОДАРНОСТИ
Мы благодарны докторам Э.М.Тану и Э.К. Chan для получения поликлонального антитела против коилина p80. Мы благодарим C. Rochette за техническую помощь, доктора A. Pshezhetsky за советы по компьютерной микроскопии, Marie Blagdon за анализ FACS и доктора P.Уилсу, Б. Ки и М. Эмонду за полезное обсуждение. Эта работа была поддержана грантами семей SMA и Канадских институтов исследований в области здравоохранения. L.R.S. является стипендиатом Фонда исследований в Санте-дю-Квебек.
Фигура 1. Непрямая иммунофлуоресценция эндогенного SMN в недифференцированных ( A — D ) и обработанных RA ( E — G ) клетках эмбриональной карциномы P19 мыши (EC). Клетки дважды окрашивали моноклональным антителом против SMN и либо кроличьим поликлональным антителом R288 против р80 коилина, либо поликлональным антителом против GFAP.Ядра окрашивали DAPI (синий). (A) Интенсивное окрашивание SMN (зеленый) было обнаружено в ядре и диффузное окрашивание SMN в цитоплазме. (B) Подобное количество коилин-положительных CB (красный) было обнаружено в тех же клетках, что свидетельствует о том, что SMN и p80 коилин локализованы в одной и той же структуре. (C) Около 0,1–1% клеток несли многочисленные очаги SMN (зеленый), и (D) их распределение совпадало с CB (красный), показанным в том же поле. (E) После лечения РА в цитоплазме также были обнаружены многочисленные очаги SMN (зеленый) (стрелка).(F) Поликлональные антитела против GFAP (красный) использовали для мечения глиальных клеток. (G) Наложенное изображение клетки, окрашенной анти-SMN (зеленый) и анти-GFAP (красный), маркером глиальных клеток, показало, что клетки с 15 или более очагами SMN имеют глиальное происхождение. Масштабные линейки: 10 мкм.
Фигура 1. Непрямая иммунофлуоресценция эндогенного SMN в недифференцированных ( A — D ) и обработанных RA ( E — G ) клетках эмбриональной карциномы мыши P19 (EC) мыши.Клетки дважды окрашивали моноклональным антителом против SMN и либо кроличьим поликлональным антителом R288 против р80 коилина, либо поликлональным антителом против GFAP. Ядра окрашивали DAPI (синий). (A) Интенсивное окрашивание SMN (зеленый) было обнаружено в ядре и диффузное окрашивание SMN в цитоплазме. (B) Подобное количество коилин-положительных CB (красный) было обнаружено в тех же клетках, что свидетельствует о том, что SMN и p80 коилин локализованы в одной и той же структуре. (C) Около 0,1–1% клеток несли многочисленные очаги SMN (зеленый), и (D) их распределение совпадало с CB (красный), показанным в том же поле.(E) После лечения РА в цитоплазме также были обнаружены многочисленные очаги SMN (зеленый) (стрелка). (F) Поликлональные антитела против GFAP (красный) использовали для мечения глиальных клеток. (G) Наложенное изображение клетки, окрашенной анти-SMN (зеленый) и анти-GFAP (красный), маркером глиальных клеток, показало, что клетки с 15 или более очагами SMN имеют глиальное происхождение. Масштабные линейки: 10 мкм.
Рисунок 2. SMN в дифференцирующихся нейроноподобных клетках P19 объединяется в структуры, подобные конусам роста.Клетки иммуноокрашивали моноклональным антителом против SMN и либо кроличьим поликлональным антителом против нейрофиламента 68 кДа (NF-L), либо маркером F-актина, фалоидином Texas Red-X. Ядра контрастировали DAPI (синий). ( A , B ) SMN (зеленый) накапливается в структурах, подобных конусу роста (стрелка) и на периферии сомы. ( C , D ) Диффузное окрашивание NF-L (красный) наблюдали по всей цитоплазме, причем мечение было более интенсивным на периферии сомы, а также на концах отростков нейритов.( E , F ) Наложенные изображения клеток с двойной меткой против SMN и NF-L, демонстрирующие, что SMN агрегированы в соме и структурах, подобных конусу роста, и что эти клетки богаты NF-L ( желтый). ( G , H ) Обильный F-актин был обнаружен за исключением кончика структур, подобных конусу роста (стрелка). ( I , J ) Наложенные изображения, показывающие SMN (зеленый) и F-актин (красный) в теле клетки и структуру, подобную конусу роста (стрелка), где совместная локализация SMN и F-актина проявляется в желтый.Масштабные линейки: 10 мкм.
Рис. 2. SMN в дифференцирующихся нейроноподобных клетках P19 собираются в структуры, подобные конусам роста. Клетки иммуноокрашивали моноклональным антителом против SMN и либо кроличьим поликлональным антителом против нейрофиламента 68 кДа (NF-L), либо маркером F-актина, фалоидином Texas Red-X. Ядра контрастировали DAPI (синий). ( A , B ) SMN (зеленый) накапливается в структурах, подобных конусу роста (стрелка) и на периферии сомы.( C , D ) Диффузное окрашивание NF-L (красный) наблюдали по всей цитоплазме, причем мечение было более интенсивным на периферии сомы, а также на концах отростков нейритов. ( E , F ) Наложенные изображения клеток с двойной меткой против SMN и NF-L, демонстрирующие, что SMN агрегированы в соме и структурах, подобных конусу роста, и что эти клетки богаты NF-L ( желтый). ( G , H ) Обильный F-актин был обнаружен за исключением кончика структур, подобных конусу роста (стрелка).( I , J ) Наложенные изображения, показывающие SMN (зеленый) и F-актин (красный) в теле клетки и структуру, подобную конусу роста (стрелка), где совместная локализация SMN и F-актина проявляется в желтый. Масштабные линейки: 10 мкм.
Фигура 3. Распределение SMN и GAP-43 в обработанных RA клетках P19. ( A ) Диффузное окрашивание SMN (зеленый) обнаруживалось по всей цитоплазме и накапливалось в структурах, подобных конусам роста. ( B ) GAP-43 (красный) агрегирован на периферии сомы и вдоль отростков нейритов.Как и ожидалось, мечение было наиболее интенсивным в конусе роста. ( C ) Наложенное изображение, показывающее совпадающее окрашивание (желтый) SMN и GAP-43 с интенсивным мечения конуса роста. Стрелки указывают на структуры, похожие на конус роста. Шкала шкалы: 10 мкм.
Фиг. 3. Распределение SMN и GAP-43 в обработанных RA клетках P19. ( A ) Диффузное окрашивание SMN (зеленый) обнаруживалось по всей цитоплазме и накапливалось в структурах, подобных конусам роста. ( B ) GAP-43 (красный) агрегирован на периферии сомы и вдоль отростков нейритов.Как и ожидалось, мечение было наиболее интенсивным в конусе роста. ( C ) Наложенное изображение, показывающее совпадающее окрашивание (желтый) SMN и GAP-43 с интенсивным мечения конуса роста. Стрелки указывают на структуры, похожие на конус роста. Шкала шкалы: 10 мкм.
Рисунок 4. Двойное иммунофлуоресцентное мечение SMN в постнатальный день 1 ( A ), 3 ( B ), 6 ( C ) и 15 ( D ) мышцы. SMN был выявлен с помощью моноклональных антител к SMN (зеленый), тогда как NMJ были помечены α-бунгаротоксином (α-BT: красный).SMN агрегированы в многочисленные яркие точечные частицы (стрелки) в цитоплазме мышечных клеток. Обратите внимание, что пик экспрессии произошел на 6 день (C). ( E ) Мышца-3 дня, демонстрирующая диффузную цитоплазматическую маркировку в дополнение к интенсивному накоплению SMN (зеленый) в НМС. ( F ) Те же мышечные клетки, окрашенные α-BT (красный) для маркировки NMJ. ( G ) Наложенное изображение одной и той же мышечной клетки, показывающее, что SMN и α-BT совпадают (желтый). Ядра окрашивали DAPI (синий).Стрелками отмечены участки НМС, а желтый цвет указывает на то, что SMN накапливается в этих структурах. Масштабные линейки: 10 мкм.
Рисунок 4. Двойное иммунофлуоресцентное мечение SMN в постнатальный день 1 ( A ), 3 ( B ), 6 ( C ) и 15 ( D ) мышцы. SMN был выявлен с помощью моноклональных антител к SMN (зеленый), тогда как NMJ были помечены α-бунгаротоксином (α-BT: красный). SMN агрегированы в многочисленные яркие точечные частицы (стрелки) в цитоплазме мышечных клеток.Обратите внимание, что пик экспрессии произошел на 6 день (C). ( E ) Мышца-3 дня, демонстрирующая диффузную цитоплазматическую маркировку в дополнение к интенсивному накоплению SMN (зеленый) в НМС. ( F ) Те же мышечные клетки, окрашенные α-BT (красный) для маркировки NMJ. ( G ) Наложенное изображение одной и той же мышечной клетки, показывающее, что SMN и α-BT совпадают (желтый). Ядра окрашивали DAPI (синий). Стрелками отмечены участки НМС, а желтый цвет указывает на то, что SMN накапливается в этих структурах.Масштабные линейки: 10 мкм.
Таблица 1.
Число очагов SMN и коилинов в недифференцированных клетках P19
| Часов после периода сывороточного голодания a . | очагов SMN на ячейку б . | Фокусов спирали на ячейку c . |
|---|---|---|
| 0 | 0,00 ± (0,1) | 0,00 ± (0,1) |
| 4 | 1.00 ± (0,5,2) д | 2,00 ± (1,2) д |
| 6 | 1,00 ± (0,1,5) д | 1,00 ± (0,2) д |
| Часы после периода сывороточного голодания a . | очагов SMN на ячейку б . | Фокусов спирали на ячейку c . |
|---|---|---|
| 0 | 0.00 ± (0,1) | 0,00 ± (0,1) |
| 4 | 1,00 ± (0,5,2) d | 2,00 ± (1,2) d |
| 6 | 1,00 ± (0,1,5) d | 1,00 ± (0,2) d |
Таблица 1.
Число очагов SMN и коилинов в недифференцированных клетках P19
| часов после периода сывороточного голодания a . | очагов SMN на ячейку б . | Фокусов спирали на ячейку c . |
|---|---|---|
| 0 | 0,00 ± (0,1) | 0,00 ± (0,1) |
| 4 | 1,00 ± (0,5,2) d | 2,00 ± (1,2 ) d |
| 6 | 1,00 ± (0,1,5) d | 1,00 ± (0,2) d |
| Часы после периода голодания по сыворотке a . | очагов SMN на ячейку б . | Фокусов спирали на ячейку c . |
|---|---|---|
| 0 | 0,00 ± (0,1) | 0,00 ± (0,1) |
| 4 | 1,00 ± (0,5,2) d | 2,00 ± (1,2 ) d |
| 6 | 1,00 ± (0,1,5) d | 1,00 ± (0,2) d |
Литература
1
Пирн, Дж.(
1978
) Исследования заболеваемости, распространенности и частоты генов хронической мышечной атрофии позвоночника у детей.
J. Med Genet.
,
15
,
409
–413.
2
Мунсат, Т. и Дэвис, К. (
1992
) Отчет о встрече: Встреча Международного Консорциума SMA.
Neuromusc.Disord.
,
2
,
423
–428.
3
Дубовиц, В. (
1995
) Диагностика и классификация нервно-мышечных расстройств. В Дубовиц, В. (ред.),
Заболевания мышц у детей
. W.B. Сондерс, Филадельфия, стр.
2
–3.
4
Лефевр, С., Bürglen, L., Reboullet, S., Clermont, O., Burlet, P., Viollet, L., Benichou, B., Cruaud, C., Millasseau, P., Zeviani, M.
et al.
(
1995
) Идентификация и характеристика гена, определяющего мышечную атрофию позвоночника.
Ячейка
,
80
,
55
–165.
5
Вирт, Б.(
2000
) Обновление спектра мутаций гена выживания мотонейрона (SMN1) при аутосомно-рецессивной спинальной мышечной атрофии (SMA).
Hum. Мутат.
,
15
,
228
–237.
6
Bussaglia, E., Clermont, O., Tizzano, E., Lefebvre, S., Bürglen, L., Cruaud, C., Urtizberea, J.A., Colomer, J., Munnich, A., Baiget, M.и Мелки, Дж. (
1995
Делеция со сдвигом рамки считывания в гене выживания двигательного нейрона у пациентов с мышечной атрофией в Испании.
Nat. Genet.
,
1
,
335
–337.
7
Рошетт, К.Ф., Сур, Л.С., Рэй, П.Н., МакЭндрю, П.Е., Прайор, Т.В., Берджес, А.Х., Ванасс, М., и Симард, Л.Р. (
1997
) Молекулярная диагностика пациентов с СМА без делеции с использованием количественной ПЦР экзона 7 SMN.
Нейрогенетика
,
1
,
141
–147.
8
Covert, D.D., Le, T.T., McAndrew, P.E., Strasswimmer, J., Crawford, T.O., Mendell, J.R., Coulson, S.E., Androphy, E.J., Prior, T.W. и Burghes, A.H.M. (
1997
) Белок выживания мотонейрона при спинальной мышечной атрофии.
Hum. Мол. Genet.
,
6
,
1205
–1214.9
Лефевр, С., Бурле, П., Лю, К., Бертранди, С., Клермон, О., Мюнхен, А., Дрейфус, Г. и Мелки, Дж. (
1997
) Корреляция между тяжестью и уровнем белка SMN при спинальной мышечной атрофии.
Nat. Genet.
,
16
,
265
–269.
10
Чен, К., Бэрд, С.Д., Махадеван, М., Беснер-Джонстон, А., Farahani, R., Xuan, J., Kang, X., Lefebvre, C., Ikeda, J.E., Korneluk, R.G. и MacKenzie, A.E. (
1998
) Последовательность участка 5q13.1 размером 131 т.п.н., содержащего гены-кандидаты на спинальную мышечную атрофию SMN и NAIP.
Геномика
,
48
,
121
–127.
11
Монани У.Р., Лорсон К.Л., Парсонс Д.У., Прайор Т.W., Androphy, E.J., Burghes, A.H., McPherson, J.D. (
1999
) Разница в один нуклеотид, изменяющая паттерны сплайсинга, отличает ген SMA SMN1 от гена копии SMN2.
Hum. Мол. Genet.
,
8
,
1177
–1183.
12
Рошетт, К.Ф., Гилберт, Н., Симард, Л. (
2001
) Дупликация гена SMN и появление гена SMN2 произошли у разных гоминидов: SMN2 уникален для
Homo sapiens .
.
Hum. Genet.
,
108
,
255
–266.
13
Simard, L.R., Rochette, C., Semionov, A., Morgan, K. и Vanasse, M. (
1997
) Мутации SMN (T) и NAIP в канадских семьях со спинальной мышечной атрофией (SMA): корреляция генотипа / фенотипа с тяжестью заболевания.
г. J. Med. Genet.
,
72
,
51
–58.14
Лю К., Фишер У., Ван Ф. и Дрейфус Г. (
1997
Продукт гена мышечной атрофии позвоночника, SMN, и связанный с ним белок SIP1 находятся в комплексе со сплайсосомными белками snRNP.
Ячейка
,
90
,
1013
–1021.
15
Шарру, Б., Пеллиццони, Л., Перкинсон, Р.А., Шевехенко А., Манн М. и Дрейфус Г. (
1999
Gemin3: новый белок DEAD box, который взаимодействует с SMN, продуктом гена мышечной атрофии позвоночника, и является компонентом драгоценных камней.
J. Cell. Биол.
,
147
,
1181
–1194.
16
Шарру, Б., Пеллиццони, Л., Перкинсон, Р.А., Йонг, Дж., Шевченко, А., Манн, М.и Дрейфус, Г. (
2000
) Близнецы4. Новый компонент комплекса SMN, который содержится как в драгоценных камнях, так и в ядрышках.
J. Cell. Биол.
,
148
,
1177
–1186.
17
Мейстер, Г., Бюлер, Д., Лаггербауэр, Б., Зобава, М., Лотцпайх, Ф. и Фишер, У. (
2000
) Характеристика ядерного 20S-комплекса, содержащего белок выживания мотонейронов (SMN) и специфическую подгруппу сплайсосомных белков Sm.
Hum. Мол. Genet.
,
9
,
1977
–1986.
18
Лю, К. и Дрейфус, Г. (
1996
) Новая ядерная структура, содержащая выживающий белок моторных нейронов.
EMBO J.
,
15
,
3555
–3565.
19
Пена, Э., Берчано, М.Т., Фернандес, Р., Охеда, Дж. Л. и Лафарга, М. (
2001
Размер тела нейрона коррелирует с количеством ядрышек и телец Кахаля, а также с организацией аппарата сплайсинга в нейронах тройничного ганглия крыс.
J. Comp. Neurol.
,
430
,
250
–263.
20
Карвалью Т., Алмейда Ф., Калапес А., Лафарга, М., Берчиано, М. и Кармо-Фонсека, М. (
1999
Продукт гена мышечной атрофии позвоночника, SMN: связь между биогенезом snRNP и телом Кахаля (свернутым в спираль).
J. Cell. Биол.
,
147
,
715
–728.
21
Матера, А.Г. и Фрей, М.Р. (
1998
) Свернутые тела и драгоценные камни: Янус или Близнецы?
г.J. Hum. Genet.
,
63
,
317
–321.
22
Янг П.Дж., Ли Т.Т., Ти Ман Н., Берджес А.Х. и Моррис Г.Э. (
2000
) Взаимосвязь между SMN, белком мышечной атрофии позвоночника и ядерными спиральными телами в дифференцированных тканях и культивируемых клетках.
Exp. Клетка. Res.
,
256
,
365
–374.23
Пеллиццони, Л., Катаока, Н., Шарру, Б. и Дрейфус, Г. (
1998
) Новая функция SMN, продукта гена мышечной атрофии позвоночника, в сплайсинге пре-мРНК.
Ячейка
,
95
,
615
–624.
24
Фишер У., Лю К. и Дрейфус Г. (
1997
) Комплекс SMN-SIP1 играет важную роль в биогенезе сплайсосомных snRNP.
Ячейка
,
90
,
1023
–1029.
25
Бурлет П., Хубер К., Бертранди С., Людоски М.А., Цваенепол И., Клермон О., Роум Дж., Делезоид А.Л., Картаод Дж., Мюнних А. и Лефевр. С. (
1998
) Распределение белкового комплекса SMN в тканях плода человека и его изменение при спинальной мышечной атрофии.
Hum.Мол. Genet.
,
7
,
1927
–1933.
26
ДиДонато, К.Дж., Чен, X.N., Нойя, Д., Коренберг, Дж. Р., Надо, Дж. Х. и Симард, Л. (
1997
) Клонирование, характеристика и число копий гена моторного нейрона выживаемости мышей: гомолог гена, определяющего спинальную мышечную атрофию.
Genome Res.
,
7
,
339
–352.27
Шранк, Б., Гетц, Р., Гуннерсен, Дж. М., Юре, Дж. М., Тойка, К. В., Смит, А. Г. и Сендтнер, М. (
1997
) Инактивация гена выживания мотонейрона, гена-кандидата для спинальной мышечной атрофии человека, приводит к массовой гибели клеток у ранних эмбрионов мыши.
Proc. Natl Acad. Sci. США
,
94
,
9920
–9925.28
Се-Ли, H.M., Чанг, J.G., Jong, Y.J., Wu, M.H., Wang, N.M., Tsai, C.H. и Ли, Х. (
2000
) Мышиная модель мышечной атрофии позвоночника.
Nat. Genet.
,
24
,
66
–70.
29
Фрэнсис, Дж. У., Сандрок, А. В., Бхайд, П. Г., Вонсаттель, Дж. П. и Браун Р. Х. младший, (
1998
) Неоднородность субклеточной локализации и электрофоретической подвижности белка выживания мотонейрона (SMN) в нервных клетках и тканях млекопитающих.
Proc. Natl Acad. Sci. США
,
95
,
6492
–6497.
30
Патрици, А.Л., Тициано, Ф., Заппата, С., Донати, М.А., Нери, Г. и Браге, К. (
1999
) Анализ белка SMN в культурах фибробластов, амниоцитов и сердечно-сосудистой системы от пациентов с мышечной атрофией позвоночника и его значение для диагностики.
евро. J. Hum.Genet.
,
7
,
301
–309.
31
Ла Белла В., Калленбах С. и Петманн Б. (
2000
) Экспрессия и субклеточная локализация двух изоформ белка выживания мотонейрона в разных типах клеток.
J. Neurosci. Res.
,
62
,
346
–356.32
Уильямс, Б.Ю., Виннакота, С., Сойер, К.А., Уолдреп, Дж. К., Гамильтон, С.Л. и Саркар, Х.К. (
1999
) Дифференциальная субклеточная локализация белка двигательного нейрона выживания в спинном мозге и скелетных мышцах.
Biochem. Биофиз. Res. Commun.
,
254
,
10
–14.
33
Янг, П.J., Le, T.T., Dunckley, M., Nguyen, T.M., Burghes, A.H. и Morris, G.E. (
2001
) Ядерные камни и тельца Кахаля (свернутые в спираль) в тканях плода: ядрышковое распределение белка спинальной мышечной атрофии, SMN.
Exp. Клетка. Res.
,
265
,
252
–261.
34
Ла Белла, В., Систерни, К., Салаун, Д. и Петманн, Б. (
1998
Белок моторного нейрона выживания (SMN) у крыс экспрессируется в различных молекулярных формах и регулируется в процессе развития.
евро. J. Neurosci.
,
10
,
2913
–2923.
35
Жермен-Деспре, Д., Брун, Т., Рошетт, К., Семенов, А., Руже, Р., Симар, Л. (
2001
) Гены SMN подвергаются регуляции транскрипции во время клеточной дифференцировки.
Джин
,
279
,
109
–117.36
Кроуфорд, Т. и Пардо, К.А. (
1996
) Нейробиология детской спинальной мышечной атрофии.
Neurobiol. Дис.
,
3
,
97
–110.
37
Макберни, М.В. и Роджерс, Б.Дж. (
1982
) Выделение мужских эмбриональных клеток карциномы и паттернов их хромосомной репликации.
Dev. Биол.
,
89
,
503
–508.
38
Макберни, М.В., Рейл, К.Р., Элли, А.И., Насипури, С., Белл, Дж. К. и Крейг, Дж. (
1988
) Дифференциация и созревание нейронов, происходящих от эмбриональной карциномы, в культуре клеток.
J. Neurosci.
,
8
,
1063
–1073.39
Стейнс, В.А., Морассутти, Д.Дж., Реухи, К.Р., Элли, А.И. и Макберни, M.W. (
1994
) Нейроны, полученные из клеток эмбриональной карциномы P19, имеют различную морфологию и нейротрансмиттеры.
Неврология
,
58
,
735
–751.
40
Стейнс, В.А., Крейг, Дж., Реухи, К. и Макберни, М.W. (
1996
Клетки эмбриональной карциномы Р19, обработанные ретиноевой кислотой, дифференцируются в олигодендроциты, способные к миелинизации.
Неврология
,
71
,
845
–853.
41
Бэйн, Г., Рэй, У.Дж., Яо, М., Готтлиб, Д.И. (
1994
) От клеток эмбриональной карциномы к нейронам: путь P19.
Биологические исследования
,
16
,
343
–348.
42
Айгнер, Л. и Карони, П. (
1995
) Отсутствие стойкого распространения, ветвления и адгезии в конусах роста, истощенных по GAP-43.
J. Cell. Биол.
,
128
,
647
–660.43
Фругье, Т., Тициано, Ф.Д., Сифуэнтес-Диас, К., Миниу, П., Робло, Н., Диерих, А., Ле Мер, М. и Мелки, Дж. (
2000
) Дефект нацеливания на ядро SMN без С-конца в мышиной модели спинальной мышечной атрофии.
Hum. Мол. Genet.
,
9
,
849
–858.
44
Монани, У.Р., Сендтнер, М., Куверт, Д. Д., Парсонс, Д. В., Андреасси, К., Ле, Т. Т., Яблонка, С., Шранк, Б., Россол, В., Прайор, Т.
et al.
(
2000
Ген мотонейрона центромерного выживания человека (SMN2) спасает эмбриональную летальность в Smn
— / —
мышей и приводит к мышечной атрофии спинного мозга.
Hum. Мол. Genet.
,
9
,
333
–339.45
Сифуэнтес-Диас, К., Фругье, Т., Тициано, Ф.Д., Ласен, Э., Роблот, Н., Джоши, В., Моро, М.Х. и Мелки, Дж. (
2001
Делеция экзона 7 мышиного SMN, направленного на скелетные мышцы, приводит к тяжелой мышечной дистрофии.
J. Cell. Биол.
,
152
,
1107
–1114.
46
Гринсмит, Л.и Врбова Г. (
1997
) Нарушения нервно-мышечного взаимодействия могут способствовать мышечной слабости при спинальной мышечной атрофии.
Neuromuscul. Disord.
,
7
,
369
–372.
47
Батталья, Г., Принцивалле, А., Форти, Ф., Лизье, К. и Зевиани, М. (
1997
) Экспрессия гена SMN, гена, определяющего мышечную атрофию позвоночника, в центральной нервной системе млекопитающих.
Hum. Мол. Genet.
,
6
,
1961
–1971.
48
Бешад, К., Ростен, П., Систерни, К., Калиш, Р., Ла Белла, В., Петтманн, Б. и Триллер, А. (
1999
) Субклеточное распределение белка выживания мотонейрона (SMN): возможное участие в ядерно-цитоплазматическом и дендритном транспорте.
евро.Я Neurosci.
,
11
,
293
–304.
49
Брокколини А., Энгель В.К. и Асканас В. (
1999
) Локализация белка двигательного нейрона выживания в апоптотических и регенерирующих мышечных волокнах человека и нервно-мышечных соединениях.
Нейроотчет
,
10
,
1637
–1641.50
Пальярдини, С., Джавацци, А., Сетола, В., Лизье, К., Ди Лука, М., ДеБиази, С. и Батталья, Г. (
2000
) Субклеточная локализация и аксональный транспорт белка выживания мотонейрона (SMN) в развивающемся спинном мозге крысы.
Hum. Мол. Genet.
,
9
,
47
–56.
51
Андраде, Л.Э., Тан Э.М., Чан Э.К. (
1993
) Иммуноцитохимический анализ свернутого тела в клеточном цикле и во время пролиферации клеток.
Proc. Natl Acad. Sci. США
,
90
,
1947
–1951.
52
Берман, С.А., Мосс, Д. и Бурштайн, С. (
1993
) Разветвление аксонов и структура конуса роста зависят от клеток-мишеней.
Dev. Биол.
,
159
,
153
–162.
53
Рэпер, Дж. и Тесье-Лавин М. (
1999
) Конусы роста и поиск пути аксонов. В Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L. и Squire, L.R. (ред.).
Фундаментальная неврология.
Academic Press, Нью-Йорк, стр.
520
–521.54
Ламбрехтс, А., Фершельде, Ж.-Л., Йонкхере, В., Гётальс, М., Вандекеркхове, Дж. И Ампе, К. (
1997
Изоформы профилина млекопитающих проявляют комплементарную аффинность к PIP.
2
и последовательности, богатые пролином.
EMBO J.
,
16
,
484
–494.
55
Ламбрехтс, А., Браун, А., Йонкхере, В., Асзоди, А., Ланье, Л.М., Роббенс, Дж., Ван Колен, И., Вандекеркхов, Дж., Фесслер, Р. и Ампе, К. (
2000
) Пролифин II подвергается альтернативному сплайсингу, в результате чего изоформы пролифина экспрессируются по-разному и обладают различными биохимическими свойствами.
Мол. Клетка. Биол.
,
20
,
8209
–8219.
56
Гиземанн, Т., Rathke-Hartlieb, S., Rothkegel, M., Bartsch, J.W., Buchmeier, S., Jockusch., B.M. и Jockusch., H. (
1999
) Роль полипролиновых мотивов в протеине SMN мышечной атрофии позвоночника.
J. Biol. Chem.
,
274
,
37 908
–37 9l4.
57
Лорсон, К. и Андрофи, Э. (
1998
) Домен, кодируемый экзоном 2 белка двигательного нейрона выживания, опосредует связывание нуклеиновой кислоты.
Hum. Мол. Genet.
,
7
,
1269
–1275.
58
Бертранди, С., Бурле, П., Клермон, О., Хубер, К., Фондрат, К., Тьерри-Миг, Д., Мюнних, А. и Лефевр, С. (
1999
) РНК-связывающие свойства SMN: делеционный анализ ортолога рыбок данио определяет домены, законсервированные в процессе эволюции.
Hum.Мол. Genet.
,
8
,
775
–782.
59
Крино, П. и Эбервайн, Дж. (
1996
) Молекулярная характеристика конуса роста дентрита: регулируемый транспорт мРНК и локальный синтез белка.
Нейрон
,
17
,
1173
–1187.60
Аронов, С., Аранда, Г., Бехар, Л., Гинзбург, И. (
2001
) Локализация аксональной мРНК тау-белка совпадает с тау-белком в живых нейрональных клетках и зависит от нацеленного на аксоны сигнала.
J. Neuroscience
,
21
,
6577
–6587.
61
Чжан Х.Л., Эом Т., Олейников Ю., Шеной С.М., Либельт, Д.А., Диктенберг, Дж. Б., Сингер, Р. Х. и Басселл, Г. Дж. (
2001
) Нейротрофин-индуцированный транспорт комплекса мРНП β-актина увеличивает уровни β-актина и стимулирует рост, потерявший подвижность.
Нейрон
,
31
,
261
–275.
62
Киблер М.А. и ДесГрозейлерс Л. (
2000
) Молекулярное понимание транспорта мРНК и локальной трансляции в нервной системе млекопитающих.
Нейрон
,
25
,
19
–28.
63
Мурелатос, З., Абель, Л., Йонг, Л., Катаока, Н., Дрейфус, Г. (
2001
) SMN взаимодействует с новым семейством hnRNP и сплайсосомных белков.
EMBO J.
,
20
,
5443
–5452.64
Россолл В., Крёнинг А.-К., Ондорф У.-М., Стигборн К., Яблонка С. и Сендтнер М. (
2002
) Специфическое взаимодействие Smn, продукта гена, определяющего мышечную атрофию позвоночника, с hnRNP-R и gry-rbp / hnRNP-Q: роль Smn в процессинге РНК в моторных аксонах?
Hum. Мол. Genet.
,
11
,
93
–105.65
Паттерсон, П. (
1992
) Взаимодействия нейронов с мишенью. В Холле Z.W. (ред.),
Введение в молекулярную нейробиологию
. Синауэр Сандерленд, Массачусетс, стр.
430
–431.
66
Гринсмит, Л., Врбова, Г. (
1996
) Выживание мотонейронов: функциональный подход.
Trends Neurosci.
,
19
,
450
–455.
67
Лихтман, Дж. У., Бёрден, С. Дж., Куличан, С. и Вонг, Р.О.Л. (
1999
) Формирование и устранение синапсов. В Zigmond, M.J., Bloom, F.E., Landis, S.C., Roberts, J.L. и Squire, L.R. (ред.),
Фундаментальная неврология
. Academic Press, Нью-Йорк, стр.
561
–562.68
Яблонка С., Бандилла М., Визе С., Бюлер Д., Вирт Б., Сендтнер М. и Фишер У. (
2001
) Совместная регуляция выживаемости белка мотонейрона (SMN) и его интерактора SIP1 во время развития и при спинальной мышечной атрофии.
Hum. Мол. Genet.
,
10
,
497
–505.
69
Бен Хамида, К., Сусси-Яникостас, Н., Батлер-Браун, Г.С., Бежауи, К., Хентати, Ф. и Бен Хамида, М. (
1994
) Биохимический и иммуноцитохимический анализ при хронической проксимальной мышечной атрофии позвоночника.
Мышечный нерв
,
17
,
400
–410.
70
Лин, П., Кусано, К., Чжан, К., Фельдер, К.С., Гейгер, П.М. и Махан, Л. (
1996
) ГАМК
A
рецепторы модулируют раннюю спонтанную возбуждающую активность в дифференцирующихся нейронах P19.
J. Neurochem.
,
66
,
233
–242.
Строение и функция белковых комплексов митохондриальной мембраны | BMC Biology
Риццуто Р., Де Стефани Д., Рафаэлло А., Маммукари С. Митохондрии как сенсоры и регуляторы передачи сигналов кальция. Nat Rev Mol Cell Biol. 2012; 13 (9): 566–78.
CAS
Статья
PubMed
Google Scholar
Пеллегрино MW, Хейнс CM. Митофагия и митохондриальный развернутый белковый ответ при нейродегенерации и бактериальной инфекции. BMC Biol. 2015; 13:22.
PubMed Central
Статья
PubMed
Google Scholar
Chandel NS. Митохондрии как сигнальные органеллы. BMC Biol. 2014; 12:34.
PubMed Central
Статья
PubMed
Google Scholar
Bratic A, Larsson NG. Роль митохондрий в старении. J Clin Invest. 2013. 123 (3): 951–7.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Gray MW, Lang BF, Cedergren R, Golding GB, Lemieux C, Sankoff D, et al. Структура генома и содержание генов в митохондриальной ДНК протистов. Nucleic Acids Res. 1998. 26 (4): 865–78.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Amunts A, Brown A, Bai X, Llacer JL, Hussain T., Emsley P, et al. Структура большой рибосомной субъединицы митохондрий дрожжей. Наука. 2014; 343 (6178): 1485–9.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Шмидт О., Пфаннер Н., Мейзингер С. Импорт митохондриального белка: от протеомики к функциональным механизмам. Nat Rev Mol Cell Biol. 2010. 11 (9): 655–67.
CAS
Статья
PubMed
Google Scholar
Lackner LL. Формирование динамической митохондриальной сети. BMC Biol. 2014; 12:35.
PubMed Central
Статья
PubMed
Google Scholar
Detmer SA, Chan DC. Функции и нарушения митохондриальной динамики. Nat Rev Mol Cell Biol. 2007. 8 (11): 870–9.
CAS
Статья
PubMed
Google Scholar
Хоппинс С., Лакнер Л., Нуннари Дж.Машины, которые делят и объединяют митохондрии. Анну Рев Биохим. 2007. 76: 751–80.
CAS
Статья
PubMed
Google Scholar
Alexandre A, Reynafarje B, Lehninger AL. Стехиометрия векторных движений H +, связанных с транспортом электронов и синтезом АТФ в митохондриях. Proc Natl Acad Sci U S. A. 1978; 75 (11): 5296–300.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Meeusen S, McCaffery JM, Nunnari J. Промежуточные продукты слияния митохондрий, обнаруженные in vitro. Наука. 2004; 305: 1747–52.
CAS
Статья
PubMed
Google Scholar
Гутман М., Котляр А.Б., Боровок Н., Нахлиэль Э. Реакция объемных протонов с препаратом внутренней митохондриальной мембраны: измерения с временным разрешением и их анализ. Биохимия. 1993. 32 (12): 2942–6.
CAS
Статья
PubMed
Google Scholar
Перкинс Г.А., Фрей Т.Г. Недавние исследования структуры митохондрий с помощью микроскопии. Микрон. 2000. 31 (1): 97–111.
CAS
Статья
PubMed
Google Scholar
Liao M, Cao E, Julius D, Cheng Y. Структура ионного канала TRPV1, определенная с помощью электронной криомикроскопии. Природа. 2013; 504 (7478): 107–12.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Кюльбрандт В. Революция в разрешении. Наука. 2014; 343 (6178): 1443–4.
Артикул
PubMed
Google Scholar
Дэвис К.М., Штраус М., Даум Б., Киф Дж. Х., Осевач HD, Рыковска А. и др. Макромолекулярная организация АТФ-синтазы и комплекса I в целых митохондриях. Proc Natl Acad Sci U S. A. 2011; 108 (34): 14121–6.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Бхарат Т.А., Дэйви Н.Э., Ульбрих П., Ричес Д.Д., де Марко А., Румлова М. и др. Структура незрелого ретровирусного капсида при разрешении 8 A с помощью криоэлектронной микроскопии. Природа. 2012. 487 (7407): 385–9.
CAS
Статья
PubMed
Google Scholar
Байрхубер М., Майнс Т., Хабек М., Беккер С., Гиллер К., Виллингер С. и др. Структура человеческого потенциалзависимого анионного канала. Proc Natl Acad Sci U S. A. 2008; 105 (40): 15370–5.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Ллопис Дж., Маккаффери Дж. М., Мияваки А., Фаркуар М. Г., Цзянь Р. Я. Измерение цитозольного, митохондриального и рН Гольджи в отдельных живых клетках с зелеными флуоресцентными белками. Proc Natl Acad Sci U S. A. 1998; 95 (12): 6803–8.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Kukat C, Wurm CA, Spahr H, Falkenberg M, Larsson NG, Jakobs S. Микроскопия со сверхвысоким разрешением показывает, что митохондриальные нуклеоиды млекопитающих имеют одинаковый размер и часто содержат единственную копию мтДНК. Proc Natl Acad Sci U S. A. 2011; 108 (33): 13534–9.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Кукат С., Дэвис К., Вурм К.А., Спер Х., Бонекамп Н.А., Кюль И. и др. Перекрестное связывание TFAM с одной молекулой мтДНК образует митохондриальный нуклеоид.Proc Natl Acad Sci U S A. 2015. В печати.
Pfeffer S, Woellhaf MW, Herrmann JM, Forster F. Организация митохондриального механизма трансляции, изученная in situ с помощью криоэлектронной томографии. Nat Commun. 2015; 6: 6019.
CAS
Статья
PubMed
Google Scholar
Шлейер М., Нойперт В. Транспорт белков в митохондрии: промежуточные соединения транслокации, охватывающие места контакта между внешней и внутренней мембранами.Клетка. 1985. 43 (1): 339–50.
CAS
Статья
PubMed
Google Scholar
Перкинс Г., Ренкен С., Мартоне М.Э., Янг С.Дж., Эллисман М., Фрей Т. Электронная томография митохондрий нейронов: трехмерная структура и организация крист и мембранных контактов. J. Struct Biol. 1997. 119 (3): 260–72.
CAS
Статья
PubMed
Google Scholar
Gold VA, Ieva R, Walter A, Pfanner N, van der Laan M, Kuhlbrandt W. Визуализация активных мембранных белковых комплексов с помощью электронной криотомографии. Nat Commun. 2014; 5: 4129.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Pebay-Peyroula E, Dahout-Gonzalez C, Kahn R, Trezeguet V, Lauquin GJ, Brandolin G. Структура митохондриального носителя ADP / ATP в комплексе с карбоксиатрактилоидом. Природа. 2003. 426 (6962): 39–44.
CAS
Статья
PubMed
Google Scholar
Sjostrand FS. Электронная микроскопия митохондрий и двойных мембран цитоплазмы. Природа. 1953, 171 (4340): 30–2.
CAS
Статья
PubMed
Google Scholar
Palade GE. Электронно-микроскопическое исследование структуры митохондрий. J Histochem Cytochem. 1953; 1 (4): 188–211.
CAS
Статья
PubMed
Google Scholar
Дэвис К.М., Ансельми С., Виттиг И., Фаральдо-Гомес Дж. Д., Кюльбрандт В. Структура димера дрожжевой F1Fo-АТФ-синтазы и его роль в формировании митохондриальных крист. Proc Natl Acad Sci U S. A. 2012; 109 (34): 13602–7.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Pfanner N, van der Laan M, Amati P, Capaldi RA, Caudy AA, Chacinska A, et al. Единая номенклатура сайта контакта митохондрий и системы организации крист.J Cell Biol. 2014. 204 (7): 1083–6.
PubMed Central
CAS
Статья
PubMed
Google Scholar
von der Malsburg K, Muller JM, Bohnert M, Oeljeklaus S, Kwiatkowska P, Becker T, et al. Двойная роль митофилина в организации митохондриальной мембраны и биогенезе белков. Dev Cell. 2011. 21 (4): 694–707.
Артикул
PubMed
Google Scholar
Vogel F, Bornhovd C, Neupert W, Reichert AS. Динамическая субкомпартментализация внутренней мембраны митохондрий. J Cell Biol. 2006. 175 (2): 237–47.
PubMed Central
CAS
Статья
PubMed
Google Scholar
фон Баллмос С., Виденманн А., Димрот П. Основы синтеза АТФ с помощью АТФ-синтаз F1F0. Анну Рев Биохим. 2009. 78: 649–72.
Артикул
Google Scholar
Ватт IN, Монтгомери MG, Рансуик MJ, Leslie AG, Walker JE. Биоэнергетическая стоимость создания молекулы аденозинтрифосфата в митохондриях животных. Proc Natl Acad Sci U S. A. 2010; 107 (39): 16823–7.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Stock D, Leslie AGW, Walker JE. Молекулярная архитектура вращательного двигателя в АТФ-синтазе. Наука. 1999; 286: 17701705.
Артикул
Google Scholar
Allen RD, Schroeder CC, Fok AK. Исследование внутренних мембран митохондрий методами быстрого замораживания и глубокого травления. J Cell Biol. 1989. 108 (6): 2233–40.
CAS
Статья
PubMed
Google Scholar
Strauss M, Hofhaus G, Schroder RR, Kühlbrandt W. Димерные ленты АТФ-синтазы формируют внутреннюю митохондриальную мембрану. EMBO J. 2008; 27 (7): 1154–60.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Allegretti M, Klusch N, Mills DJ, Vonck J, Kühlbrandt W, Davies KM. Горизонтальные присущие мембране альфа-спирали в а-субъединице статора АТФ-синтазы F-типа. Природа. 2015; 521 (7551): 237–40.
CAS
Статья
PubMed
Google Scholar
Кюльбрандт В., Карен Д. АТФ-синтазы: новый поворот для древней машины. Trends Biochem Sci. 2015. В печати.
Paumard P, Vaillier J, Coulary B, Schaeffer J, Soubannier V, Mueller DM, et al.АТФ-синтаза участвует в формировании морфологии митохондриальных крист. EMBO J. 2002; 21 (3): 221–30.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Bornhövd C, Vogel F, Neupert W, Reichert AS. Потенциал митохондриальной мембраны зависит от олигомерного состояния супракомплексов F1F0-АТФ-синтазы. J Biol Chem. 2006. 281 (20): 13990–8.
Артикул
PubMed
Google Scholar
Джорджио В., фон Штокум С., Антониэль М., Фаббро А., Фоголари Ф., Форте М. и др. Димеры митохондриальной АТФ-синтазы образуют поры перехода проницаемости. Proc Natl Acad Sci U S. A. 2013; 110 (15): 5887–92.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Hunte C, Koepke J, Lange C, Roßmanith T., Michel H. Структура комплекса цитохрома bc1 дрожжевого Saccharomyces cerevisiae, совместно кристаллизованного с Fv-фрагментом антитела, с разрешением 2,3 Å.Состав. 2000. 8: 669–84.
CAS
Статья
PubMed
Google Scholar
Цукихара Т., Аояма Х., Ямасита Э., Томизаки Т., Ямагути Х., Синдзава-Ито К. и др. Вся структура 13-субъединицы окисляется цитохром с оксидазой при 2,8 А. Наука. 1996. 272 (5265): 1136–44.
CAS
Статья
PubMed
Google Scholar
Цикерманн В., Вирт С., Насири Х., Зигмунд К., Швальбе Х., Хант С. и др.Механистическое понимание кристаллической структуры митохондриального комплекса I. Наука. 2015; 347 (6217): 44–9.
CAS
Статья
PubMed
Google Scholar
Ефремов Р.Г., Барадаран Р., Сазанов Л.А. Архитектура дыхательного комплекса I. Природа. 2010. 465 (7297): 441–5.
CAS
Статья
PubMed
Google Scholar
Виноткумар К.Р., Чжу Дж., Херст Дж.Архитектура респираторного комплекса млекопитающих I. Природа. 2014. 515 (7525): 80–4.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Schägger H, Pfeiffer K. Суперкомплексы в дыхательных цепях митохондрий дрожжей и млекопитающих. EMBO J. 2000; 19 (8): 1777–83.
PubMed Central
Статья
PubMed
Google Scholar
Schäfer E, Seelert H, Reifschneider NH, Krause F, Dencher NA, Vonck J.Архитектура активных суперкомплексов дыхательной цепи млекопитающих. J Biol Chem. 2006. 281 (22): 15370–5.
Артикул
PubMed
Google Scholar
Althoff T, Mills DJ, Popot JL, Kühlbrandt W. Расположение компонентов цепи переноса электронов в митохондриальном суперкомплексе крупного рогатого скота I1III2IV1. EMBO J. 2011; 30 (22): 4652–64.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Lapuente-Brun E, Moreno-Loshuertos R, Acin-Perez R, Latorre-Pellicer A, Colas C, Balsa E, et al. Сборка суперкомплекса определяет поток электронов в митохондриальной цепи переноса электронов. Наука. 2013; 340 (6140): 1567–70.
CAS
Статья
PubMed
Google Scholar
Mileykovskaya E, Penczek PA, Fang J, Mallampalli VK, Sparagna GC, Dowhan W. Расположение комплексов дыхательной цепи в суперкомплексе Saccharomyces cerevisiae III2IV2, выявленное с помощью криоэлектронной микроскопии одиночных частиц.J Biol Chem. 2012. 287 (27): 23095–103.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Блаза Дж. Н., Серрели Р., Джонс А. Дж., Мохаммед К., Херст Дж. Кинетические доказательства против разделения пула убихинона и каталитической значимости суперкомплексов дыхательной цепи. Proc Natl Acad Sci U S. A. 2014; 111 (44): 15735–40.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Li P, Nijhawan D, Budihardjo I., Srinivasula SM, Ahmad M, Alnemri ES, et al. Цитохром c и dATP-зависимое образование комплекса Apaf-1 / каспаза-9 запускает каскад апоптотических протеаз. Клетка. 1997. 91 (4): 479–89.
CAS
Статья
PubMed
Google Scholar
Даум Б., Вальтер А., Хорст А., Осиевач HD, Кюльбрандт В. Возрастозависимая диссоциация димеров АТФ-синтазы и потеря крист внутренней мембраны в митохондриях.Proc Natl Acad Sci U S. A. 2013; 110 (38): 15301–6.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Наварро А., Боверис А. Система митохондриальной трансдукции энергии и процесс старения. Am J Physiol Cell Physiol. 2007; 292 (2): C670–86.
CAS
Статья
PubMed
Google Scholar
Dröse S, Brandt U. Молекулярные механизмы производства супероксида дыхательной цепью митохондрий.Adv Exp Med Biol. 2012; 748: 145–69.
Артикул
PubMed
Google Scholar
Twig G, Ширихай О.С. Взаимодействие митохондриальной динамики и митофагии. Антиоксидный окислительно-восстановительный сигнал. 2011. 14 (10): 1939–51.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Scheckhuber CQ, Erjavec N, Tinazli A, Hamann A, Nyström T., Osiewacz HD.Уменьшение деления митохондрий приводит к увеличению продолжительности жизни и пригодности двух моделей старения грибов. Nat Cell Biol. 2007. 9 (1): 99–105.
CAS
Статья
PubMed
Google Scholar
Calvo SE, Mootha VK. Митохондриальный протеом и болезнь человека. Анну Рев Геномикс Хум Генет. 2010; 11: 25–44.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Хендерсон Р. Возможности и ограничения нейтронов, электронов и рентгеновских лучей для микроскопии с атомным разрешением неокрашенных биологических молекул. Q Rev Biophys. 1995; 28: 171–93.
CAS
Статья
PubMed
Google Scholar
Рис Д.М., Лесли А.Г., Уокер Дж. Э. Структура внешней части мембраны АТФ-синтазы крупного рогатого скота.

 Интеллектуальная игра «Что?Где?Когда?»
Интеллектуальная игра «Что?Где?Когда?»
 Общество. Медицина»
Общество. Медицина»
 Барановичи)
Барановичи)

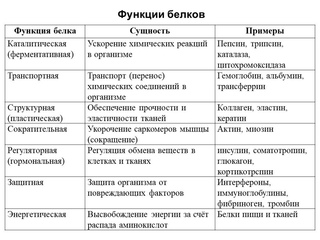 10.2017
10.2017
 м.н. О.О. Руммо
м.н. О.О. Руммо
 Гродно
Гродно


 Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Это же позволяет иммунной системе распознавать чужеродные антигены.
Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Это же позволяет иммунной системе распознавать чужеродные антигены.