Функции яичного альбумина: Яичный альбумин
Альбумины | это… Что такое Альбумины?
Альбумин
Альбумины (лат.: albus, белый) — простые растворимые в воде белки, умеренно растворимые в концентрированных растворах соли и свёртывающиеся при нагревании (денатурация белка). Их относительная молекулярная масса составляет примерно 65000, не содержат углеводов. Вещества, содержащие альбумин, такие как яичный белок, называются альбуминоиды. Альбуминоидами являются также сыворотка крови, семена растений.
Содержание
|
Физические и химические свойства
Кроме воды растворимы в солевых растворах, кислотах и щелочах; при гидролизе распадаются на различные аминокислоты. Альбумины могут быть получены в кристаллическом виде.
Биологические свойства и функции
Проявляют высокую связывающую способность по отношению к различным низкомолекулярным соединениям, содержат гидрофильные и липофильные связи.
Сывороточный альбумин
Наиболее известный вид альбумина — сывороточный альбумин. Он содержится в крови в сыворотке (отсюда название), но он также может встречаться в других жидкостях (например, в спинно-мозговой жидкости).
Сывороточный альбумин синтезируется в печени и составляет большую часть среди всех сывороточных белков. Альбумин, содержащийся в крови человека, называется человеческий сывороточный альбумин, он составляет около 55 % от всех белков, содержащихся в плазме крови.
Поскольку концентрация альбумина высока, а размеры его молекулы невелики, этот белок на 80 % определяет коллоидно-осмотическое давление плазмы.
Общая площадь поверхности множества мелких молекул сывороточного альбумина очень велика, поэтому они особенно хорошо подходят для выполнения функции переносчиков многих транспортируемых кровью и плохо растворимых в воде веществ. К веществам, связываемым сывороточным альбумином, относятся билирубин, уробилин, жирные кислоты, соли желчных кислот, некоторые экзогенные вещества — пенициллин, сульфамиды, ртуть, липидные гормоны, некоторые лекарства, такие как варфарин, фенобутазон, хлофибрат и фенитоин и т. д. Одна молекула альбумина может одновременно связать 25—50 молекул билирубина (молекулярная масса 500). По этой причине сывороточный альбумин иногда называют «молекулы-такси». Соревнования между лекарствами при использовании ими «посадочных мест» на молекуле альбумина может вызвать увеличение их активности и лечебного действия.
К веществам, связываемым сывороточным альбумином, относятся билирубин, уробилин, жирные кислоты, соли желчных кислот, некоторые экзогенные вещества — пенициллин, сульфамиды, ртуть, липидные гормоны, некоторые лекарства, такие как варфарин, фенобутазон, хлофибрат и фенитоин и т. д. Одна молекула альбумина может одновременно связать 25—50 молекул билирубина (молекулярная масса 500). По этой причине сывороточный альбумин иногда называют «молекулы-такси». Соревнования между лекарствами при использовании ими «посадочных мест» на молекуле альбумина может вызвать увеличение их активности и лечебного действия.
На мембранах клеток имеются рецепторы к альбуминам — альбандины.
Наиболее широко используются человеческий сывороточный альбумин и бычий сывороточный альбумин, часто применяемый в медицинских и молекулярно-биологических лабораториях.
Нормальный уровень сывороточного альбумина у взрослых составляет от 35 до 50 г/л. Для детей в возрасте менее 3-х лет нормальный уровень — в пределах 25—55 г/л.
Низкий уровень альбумина (гипоальбуминемия) может возникать из-за болезни печени, нефритического синдрома, ожогов, энтеропатии с потерей белка, недоедания, на поздних сроках беременности, злокачественных новообразований. Приём ретинола (витамина А) в некоторых случаях может повысить уровень альбумина до высоких субнормальных значений(49 г/л). Лабораторные эксперименты показали, что приём ретинола регулирует синтез человеческого альбумина.
Высокий уровень альбумина (гиперальбуминемия) почти всегда возникает в результате обезвоживания.
Другие типы альбуминов
Другие типы включают в себя альбумины яичного белка (кональбумин, овальбумин, авидин), C-реактивный белок, лактальбумин (альфа-лактальбумин), парвальбумин, рицин.
Измерение уровня альбумина
Изменение уровня альбумина является компонентом теста функции печени. Измерение уровня альбумина может проводиться и как самостоятельный анализ.
Применение
Яичный, молочный, сывороточный альбумины применяются в кондитерском и текстильном производстве, в фармации и медицине. По методу академика Б. Патона альбумин применяется в качестве сварочного материала в хирургических операциях, по методике плазменной сварки живых тканей кишечника и желудка человека.
По методу академика Б. Патона альбумин применяется в качестве сварочного материала в хирургических операциях, по методике плазменной сварки живых тканей кишечника и желудка человека.
См. также
- Бычий сывороточный альбумин
Исследовательский проект «Белковая форма жизни и выявление яичного белка альбумина» • Наука и образование ONLINE
Главная Работы на конкурс Предметное образование Естественно-научные дисциплины Исследовательский проект «Белковая форма жизни и выявление яичного белка альбумина»
Автор: Утебов Максим Сергеевич
Место работы/учебы (аффилиация): МБОУ г. Астрахани «Лицей №3», 10 класс
Научный руководитель: Чичирова Ольга Павловна
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком
вызвано наличием у белка определённых функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности. На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. В каждой клетке находится более 3 000 молекул белков. В человеческом организме насчитывается выше 10 млн. белков. Функционирование белка служит прототипом важнейших процессов жизнедеятельности организма. Размен веществ (пищеварение, дыхание и др.), мышечное сокращение, сердитая проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов высокоспецифичных катализаторов биохимических реакций, являющихся белками. Базу костной и соединительной тканей, роговых образований сочиняют структурные белки. Они же сформировывают остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при разделении клеточки, работа мускул осуществляются по единичному механизму при посредстве белков сократительной системы. Белки оберегают организм от инфекции. Контакты клеточки с внешней средой делают разнородные белки, умеющие различать форму молекул, регистрировать температурные конфигурации, ничтожные примеси веществ, отличать один цвет от иного.
На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. В каждой клетке находится более 3 000 молекул белков. В человеческом организме насчитывается выше 10 млн. белков. Функционирование белка служит прототипом важнейших процессов жизнедеятельности организма. Размен веществ (пищеварение, дыхание и др.), мышечное сокращение, сердитая проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов высокоспецифичных катализаторов биохимических реакций, являющихся белками. Базу костной и соединительной тканей, роговых образований сочиняют структурные белки. Они же сформировывают остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при разделении клеточки, работа мускул осуществляются по единичному механизму при посредстве белков сократительной системы. Белки оберегают организм от инфекции. Контакты клеточки с внешней средой делают разнородные белки, умеющие различать форму молекул, регистрировать температурные конфигурации, ничтожные примеси веществ, отличать один цвет от иного.
Актуальность. Белки являются одними из четырех основных органических веществ живой материи (белки, нуклеиновые кислоты, углеводы, жиры), но по своему значению и
биологическим функциям они занимают в ней особое место.
Цель: выяснение роли белков в органическом мире, в жизни человека. Изучение и экспериментальное получение белка альбумина.
Теоретическая значимость работы: рассмотрение, изучение темы «Белковая форма жизни» и выявление яичного белка альбумина»; выяснение роли белков в органическом мире, в жизни человека.
Практическая значимость работы: изучение теоретического материала по данной теме и проведение практической части, в котором я проведу опыт, эксперимент, связанный с видимым проявлением яичного белка альбумина.
Задачи:
- Проанализировать имеющиеся литературные источники и информационные ресурсы по объекту исследования.
- Выяснить, что такое белки, и каково их строение, функции и свойства.

- Провести эксперимент по определению состава и свойств белка.
- Сделать вывод о проделанной работе.
Метод исследования: теория, эксперимент, наблюдение.
Объект исследования — куриный белок.
Индивидуальный проект «Павловния — дерево будущего»
Доступна к просмотру полнотекстовая версия работы
Деревья – это неотъемлемая часть нашей экосистемы. Живая природа попросту не сможет существовать без этих удивительных представителей флоры, а человечество — тем более. Все деревья выделяют кислород. Из-за этого лесные массивы довольно часто называют…
Посмотреть работу
Исследовательская работа «Изучение бытовых средств антигрибковой активности»
Доступна к просмотру полнотекстовая версия работы
Выполненная работа носит исследовательский характер, в работе рассматриваются бытовые общедоступные средства, обладающие антигрибковой активностью. Цель нашей исследовательской работы заключается в изучении влияния некоторых бытовых веществ на жизнед…
Цель нашей исследовательской работы заключается в изучении влияния некоторых бытовых веществ на жизнед…
Посмотреть работу
Исследовательская работа «Лекарство у нас под ногами»
Цель исследования: найти целебные травы нашего села и окрестностей, проверить их целебные свойства в действии. В ходе выполнения работы я поставил перед собой следующие задачи: Собрать и изучить информацию о целебных травах. Узнать где растут целебны…
Посмотреть работу
ОВАЛЬБУМИН | Биосевтика®
Введите условия для поиска.
Поиск
Наиболее широко охарактеризованные и наиболее изученные антигены
Сублимированный лиофилизированный порошок, очищенный в кристаллической форме
Диагностика
Функциональные продукты
Яичные белки
ОВАЛЬБУМИН является преобладающим белком яичного белка, составляющим 54% от общего количества. Гликопротеин с молекулярной массой 43 кДа, также известный как альбумин из куриного яичного белка или OVA; ОВАЛЬБУМИН состоит из 385 аминокислот и является одним из двух белков, которые адекватно удовлетворяют все диетические потребности в аминокислотах. Было высказано предположение, что это его нормальная физиологическая функция в яйце, служащая хранилищем питательных веществ для развивающегося цыпленка. Другая потенциальная роль заключается в хранении и транспортировке ионов металлов. Несмотря на то, что основная физиологическая роль остается неопределенной, свойства ОВАЛЬБУМИНА нашли широкое применение в биологических исследованиях и за их пределами.
Гликопротеин с молекулярной массой 43 кДа, также известный как альбумин из куриного яичного белка или OVA; ОВАЛЬБУМИН состоит из 385 аминокислот и является одним из двух белков, которые адекватно удовлетворяют все диетические потребности в аминокислотах. Было высказано предположение, что это его нормальная физиологическая функция в яйце, служащая хранилищем питательных веществ для развивающегося цыпленка. Другая потенциальная роль заключается в хранении и транспортировке ионов металлов. Несмотря на то, что основная физиологическая роль остается неопределенной, свойства ОВАЛЬБУМИНА нашли широкое применение в биологических исследованиях и за их пределами.
Области применения
Как один из первых белков, выделенных в кристаллическую форму, ОВАЛЬБУМИН был одним из первых белков, доступных в изобилии. Это способствовало тому, что ОВАЛЬБУМИН стал одним из наиболее широко охарактеризованных и лучше всего изученных антигенов, способствуя нашему пониманию структурно-функциональных отношений взаимодействий антиген-антитело. В настоящее время картированы эпитопы как для В-, так и для Т-клеток, а ген OVA (OVAL) был одним из первых генов антигена, использованных при получении трансгенных мышей.
В настоящее время картированы эпитопы как для В-, так и для Т-клеток, а ген OVA (OVAL) был одним из первых генов антигена, использованных при получении трансгенных мышей.
Его использование в иммунологических исследованиях продолжается до сих пор, OVA является стандартным экспериментальным антигеном для моделей индуцированной IgE-опосредованной пищевой аллергии 1 и в моделях гиперреактивности дыхательных путей (AHR) астмы у животных 2,3 . В моделях экспериментального атопического дерматита (АД, экземы) также используются аллергенные свойства OVA, благодаря чему повторное применение приводит к утолщению дермы и эпидермиса у подвергшихся воздействию мышей 4 .
Использование помимо иммунологических исследований; Другие приложения OVA включают в себя:
- Структурное сравнение для изучения функции ингибирования серин-протеазы белков семейства SERPIN
- Маркер молекулярной массы для калибровки геля электрофореза SDS-PAGE
- Эталонный стандарт для количественного определения белка; Анализ Брэдфорда, анализ белка бицинхониновой кислоты (BCA)
- Заменитель бычьего сывороточного альбумина (BSA) и альтернатива альбумину человеческого происхождения; позволяет избежать фоновых проблем с бычьим IgG и риска заболевания
- Блокирующий пептид/белок для биохимических анализов; вестерн-блоттинг (WB), иммуногистохимия (ICC), иммуноцитохимия (ICC) и ELISA
- Стабилизация расщепления ферментами рестрикции
- Обнаружение модифицированного белка яичного белка
- Конъюго-иммуноопределения
- Производство лекарств и фармацевтических препаратов
- Животные модели кожных заболеваний
- Гормональный контроль экспрессии генов в тканях
- Повышение чувствительности иммунных реакций
- Ингибирование миграции нейтрофилов
- Лечение отравления тяжелыми металлами: OVA способен хелатировать тяжелые металлы (включая железо), предотвращая всасывание в желудочно-кишечном тракте
- Вакцины и иммуногенные конъюгаты
- Исследования воспаления дыхательных путей, вызванного аллергеном (астма)
- Экспрессия генов COUP-TF при заболеваниях человека
- Модельный антиген в экспериментальных системах доставки вакцин 5
- Альтернативный клей для дерева при производстве инженерных изделий из древесины, включая фанеру и клееный брус 6
Преимущества и выгоды
Компания Bioseutica ® уже более 40 лет пользуется доверием клиентов и является одним из крупнейших мировых производителей белков яичного белка. Благодаря нашим передовым процессам экстракции и очистки мы получаем продукты, которые неизменно выигрывают у конкурентов.
Благодаря нашим передовым процессам экстракции и очистки мы получаем продукты, которые неизменно выигрывают у конкурентов.
Мы также предлагаем полный спектр услуг технической поддержки и поддержки приложений, отвечающих уникальным требованиям наших клиентов. Свяжитесь с нами сегодня, чтобы обсудить характеристики вашего продукта.
Наш ОВАЛЬБУМИН доступен в виде высокочистого кристаллического лиофилизированного лиофилизированного порошка:
- ОВАЛЬБУМИН 90: чистота ≥ 90 %
Примечание: 5X Кристаллический порошок, найденный в другом месте, обычно имеет чистоту ≥80%. Мол. Нутр. Еда Рез. 2011
 BMC Легочная медицина 2019
BMC Легочная медицина 2019 Отсутствие гарантии: Информация, содержащаяся в данном документе, предоставлена добросовестно и, насколько нам известно, является достоверной и правильной. Однако никакие гарантии не подразумеваются и не подразумеваются, и информация может быть изменена без предварительного уведомления. Продукция Biosutica® продается с пониманием того, что покупатель проведет испытания, чтобы определить пригодность этих продуктов для их конкретного использования.
Сопутствующие товары
Высокоосновной тетрамер гликопротеина, каждый белок AVIDIN представляет собой набор из четырех идентичных субъединиц, состоящих из 128 аминокислот. Каждая из этих субъединиц связывается с биотином (витамин H, кофермент R, витамин B7) с чрезвычайной аффинностью.
ОВОТРАНФЕРРИН: нутрицевтический белок с антимикробными, антиоксидантными и иммуномодулирующими свойствами.
Антитриптический раствор Biosutica®, содержащий 11% яичного белка, OVOMUCOID защищает развивающийся цыпленок от роста бактерий, ингибируя протеазы.
Показать в сетке
На
Дополнительная информация
Тема
— Выбрать — Запрос ОбразцаРазместить ЗаказЗапрос Документации
Имя
Компания
Электронная почта
Телефон
Адрес
Город
Почтовый индекс
Country
— Select -AfghanistanAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntarcticaAntigua & BarbudaArgentinaArmeniaArubaAscension IslandAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBoliviaBosnia & HerzegovinaBotswanaBouvet IslandBrazilBritish Indian Ocean TerritoryBritish Virgin IslandsBruneiBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCanary IslandsCape VerdeCaribbean NetherlandsCayman IslandsCentral African RepublicCeuta & MelillaChadChileChinaChristmas IslandClipperton IslandCocos (Keeling) IslandsColombiaComorosCongo — BrazzavilleCongo — KinshasaCook IslandsCosta RicaCroatiaCubaCuraçaoCyprusCzechiaCôte d’IvoireDenmarkDiego GarciaDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEswatiniEthiopiaFalkland IslandsFaroe IslandsFijiFinlandFranceFrench GuianaFrench PolynesiaFrench Southern TerritoriesGabonGambiaGeorgiaGermanyGhanaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHeard & McDonald IslandsHondurasHong Kong SAR ChinaHungaryIcelandIndiaIndonesiaIranIraqIrelandIsle of ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKosovoKuwaitKyrgyzstanLaosLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacao SAR ChinaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMicronesiaMoldovaMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmar (Burma)NamibiaNauruNepalNetherlandsNetherlands AntillesNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorthern Mariana IslandsNorth KoreaNorth MacedoniaNorwayOmanOutlying OceaniaPakistanPalauPalestinian TerritoriesPanamaPapua New GuineaParaguayPeruPhilippinesPitcairn IslandsPolandPortugalPuerto RicoQatarRomaniaRussiaRwandaRéunionSamoaSan MarinoSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint MaartenSlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Georgia & South Sandwich IslandsSouth KoreaSouth SudanSpainSri LankaSt . Бартелеми Св. ЕленаСв. Китс и НевисСент. Люсия Св. МартинСт. Пьер и МикелонСв. Винсент и ГренадиныСуданСуринамШпицберген и Ян-МайенШвецияШвейцарияСирияСан-Томе и ПринсипиТайваньТаджикистанТанзанияТаиландТимор-ЛештиТогоТокелауТонгаТринидад и ТобагоТристан-да-КуньяТунисТурцияТуркменистанОстрова Теркс и КайкосТувалуСША. Отдалённые островаСША Виргинские островаУгандаУкраинаОбъединенные Арабские ЭмиратыВеликобританияСоединенные ШтатыУругвайУзбекистанВануатуВатиканВенесуэлаВьетнамУоллис и ФутунаЗападная СахараЙеменЗамбияЗимбабвеАландские острова
Бартелеми Св. ЕленаСв. Китс и НевисСент. Люсия Св. МартинСт. Пьер и МикелонСв. Винсент и ГренадиныСуданСуринамШпицберген и Ян-МайенШвецияШвейцарияСирияСан-Томе и ПринсипиТайваньТаджикистанТанзанияТаиландТимор-ЛештиТогоТокелауТонгаТринидад и ТобагоТристан-да-КуньяТунисТурцияТуркменистанОстрова Теркс и КайкосТувалуСША. Отдалённые островаСША Виргинские островаУгандаУкраинаОбъединенные Арабские ЭмиратыВеликобританияСоединенные ШтатыУругвайУзбекистанВануатуВатиканВенесуэлаВьетнамУоллис и ФутунаЗападная СахараЙеменЗамбияЗимбабвеАландские острова
Choose product
— Select -API LysozymeAQUATRYP™AVIDINEntegard®Entegard® AquaEntegard® PoultryEntegard® SwineInovapure®LYSOBIER®LYSOLAC®LYSOVINLYSOZYMENA2R®OVALBUMINOVOMUCOIDOVOTRANSFERRINPHOSPHOLIPASE A2TRYPSINTRYPSIN 1:250TRYPSIN ITRYPSIN IITRYPSIN IVTRYPSIN SE (Pancreatin)TRYPSIN VI
Количество
Сообщение
Использование по назначению
Конфиденциальность
Используя эту форму заказа, вы подтверждаете свое согласие с Заявлениями о конфиденциальности.
ОбразецКонфиденциальность
Используя эту службу формы заказа, вы соглашаетесь оставить отзыв об использовании запрошенного образца.
Структура и функция овальбумина
| ✅ Тип бумаги: Бесплатное эссе | ✅ Предмет: Биология |
| ✅ Количество слов: 2075 слов | ✅ Опубликовано: 15 мая 2017 г. |
Ссылка на это
Поделись этим:
Фейсбук
Логотип Facebook
Твиттер
Логотип Твиттера
Реддит
Логотип Reddit
LinkedIn
Логотип LinkedIn
WhatsApp
Логотип WhatsApp
Белки представляют собой очень важные сложные молекулы, которые выполняют важные биологические функции в клетках, наиболее важные для роста, восстановления, регенерации и т. д. Белки представляют собой полимеры, состоящие из аминокислот (строительных блоков), которые отличаются от других молекул из-за их азота и связаны пептидными связями. Структура белка зависит от аминокислотной последовательности (первичная структура), которая определяет конформацию молекулы (вторичная и третичная структуры). Аминокислоты очень хорошо растворимы, из-за присутствия в них кислорода и азота они очень электроотрицательны (аминокислоты легко переносятся в водном состоянии). Белки также могут встречаться в виде четвертичных структур. Первичная структура дает линейную последовательность аминокислот в полипептиде. цепь, в то время как вторичная структура показывает расположение цепи в пространстве (полипептидная цепь, свернутая в спираль или спираль, чтобы иметь трехмерную структуру, альфа-спираль). Белки с третичной (дисульфидной связью) (спиральная молекула полипептида свернута сама на себя в виде шара или палочки) и четвертичной структурой можно разделить на две группы по конформационному признаку; фиброзные или склеропротеины и глобулярные или складчатые белки.
Аминокислоты очень хорошо растворимы, из-за присутствия в них кислорода и азота они очень электроотрицательны (аминокислоты легко переносятся в водном состоянии). Белки также могут встречаться в виде четвертичных структур. Первичная структура дает линейную последовательность аминокислот в полипептиде. цепь, в то время как вторичная структура показывает расположение цепи в пространстве (полипептидная цепь, свернутая в спираль или спираль, чтобы иметь трехмерную структуру, альфа-спираль). Белки с третичной (дисульфидной связью) (спиральная молекула полипептида свернута сама на себя в виде шара или палочки) и четвертичной структурой можно разделить на две группы по конформационному признаку; фиброзные или склеропротеины и глобулярные или складчатые белки.
В этом эссе я начну с обсуждения структуры белков и перейду к обсуждению их функций. Будут использованы три основных примера белков; казеин, овальбумин и коллагеновый белок.
Структура белков
Первичная структура белка определяет ключевое место, называемое активным центром, областью, связанной с первичной активностью белка, даже если она часто состоит из небольшого числа остатков. Следовательно, уникальная линейная последовательность аминокислот в полипептидной цепи определяет первичную структуру белка. Первичная структура состоит из различных аминокислот, соединенных пептидными связями.
Следовательно, уникальная линейная последовательность аминокислот в полипептидной цепи определяет первичную структуру белка. Первичная структура состоит из различных аминокислот, соединенных пептидными связями.
Получите помощь в написании эссе
Если вам нужна помощь в написании эссе, наша профессиональная служба написания эссе всегда готова помочь!
Служба написания эссе
Вторичная структура составляет 60% структуры белка, состоящей из конформации альфа-спирали или бета-цепи (пластов). Это наиболее распространенная спиральная структура белков, образующая правую спираль (правостороннее расположение). На каждый виток альфа-спирали приходится 3,6 аминокислоты. Эта спиральная структура локально стабилизирована водородной связью, которая возникает между группой C=O одной аминокислоты и группой NH четвертой аминокислоты в цепи, дисульфидной связью, притяжением между положительными и отрицательными зарядами, а также гидрофобным и гидрофильным радикалом, которые ответственны за для устойчивости конструкции. Все аминокислоты в полипептидной цепи имеют L-конфигурацию, которая может привести к стабильной спирали, если она имеет правостороннюю структуру. В отличие от белков овальбумина, белки казеина не взаимодействуют внутримолекулярно с третичной структурой. Локальные взаимодействия могут происходить внутри молекулы
Все аминокислоты в полипептидной цепи имеют L-конфигурацию, которая может привести к стабильной спирали, если она имеет правостороннюю структуру. В отличие от белков овальбумина, белки казеина не взаимодействуют внутримолекулярно с третичной структурой. Локальные взаимодействия могут происходить внутри молекулы
в бета-листе, но взаимодействия между отдаленными частями одной и той же молекулы не происходит. Молекула имеет гидрофобное ядро. В β-складке конформация представляет собой линейную пептидную цепь и стабилизируется за счет водородных связей с соседними параллельными цепями того же типа. Объемный заместитель в боковой цепи дестабилизирует это расположение из-за стерической скученности, поэтому эта конформация бета-листа обычно ограничивается пептидами, содержащими большое количество глицина и аланина. Стерические взаимодействия вызывают легкое изгибание пептидных цепей, что приводит к образованию морщин (складчатый лист). Большинство белков и больших пептидов, таких как овальбумин, могут иметь сегменты альфа-спирали и бета-слоя, их третичные структуры могут состоять из менее высокоорганизованных витков, нитей и клубков. Повороты меняют направление пептидной цепи и считаются третьим общим паттерном вторичной структуры. Примерно треть всех остатков в глобулярных белках (например, овальбумин) находится в витках. Бета-листы в овальбумине скручиваются примерно на 5–25° на остаток; таким образом, плоскости листов не параллельны. Скручивание всегда одинаковое и обычно больше для антипараллельных листов. В-складчатые листы, образованные отдельными или одиночными полипептидными цепями, а две соседние цепи удерживаются межмолекулярными
Повороты меняют направление пептидной цепи и считаются третьим общим паттерном вторичной структуры. Примерно треть всех остатков в глобулярных белках (например, овальбумин) находится в витках. Бета-листы в овальбумине скручиваются примерно на 5–25° на остаток; таким образом, плоскости листов не параллельны. Скручивание всегда одинаковое и обычно больше для антипараллельных листов. В-складчатые листы, образованные отдельными или одиночными полипептидными цепями, а две соседние цепи удерживаются межмолекулярными
водородные связи, расположенные параллельно (в одном направлении) или антипараллельно. Вторичная структура белка является результатом взаимодействия боковых цепей, расположенных в пределах нескольких остатков друг от друга. Белки достаточно длинные, чтобы в конечном итоге они могли сворачиваться, позволяя остаткам, которые находятся дальше друг от друга в первичной структуре, взаимодействовать друг с другом. Эти взаимодействия приводят к третичной структуре белка.
Рис. 1.1 Вторичная структура (альфа-спираль)
1.1 Вторичная структура (альфа-спираль)
В третичной структуре складка белка является трехмерной. Молекулы очень компактны в этой структуре. Различные аминокислоты взаимодействуют (гидрофобное взаимодействие или дисульфидные связи) с образованием кластера в центре белка, который полностью сгибает и изгибает белок, придавая ему свою форму. примеры требуемой третичной структуры включают белок коллагена и овальбумина. Яичный альбумин представляет собой глобулярное питательное вещество и запасной гликопротеин, который играет жизненно важную роль в хранении аминокислот в организме. Овальбумин, например, представляет собой белок, присутствующий в яичном белке (368 аминокислот), который присутствует на 70% в яичном белке. Последовательность включает шесть цистеинов с одинарной дисульфидной связью между Cys74 и Cys121. Аминоконец белка ацетилирован. Овальбумин не имеет классической N-концевой лидерной последовательности, хотя является секреторным белком. Вместо этого гидрофобная последовательность может действовать как внутренняя сигнальная последовательность, участвующая в трансмембранном расположении. Этот белок нейтрален и растворим в воде. (Хантингтон и др., 2001). Овальбумин богат глутаматом и
Этот белок нейтрален и растворим в воде. (Хантингтон и др., 2001). Овальбумин богат глутаматом и
аспартат аминокислот. Он имеет третичную структуру и имеет гидрофобное ядро в центре сферической формы (растворим в воде). Структура небольшая по длине и ширине и поэтому имеет яйцевидную или шаровидную форму. Белки овальбумина имеют более сложную конформацию, чем белки коллагена.
Белок коллагена представляет собой структуру, подобную длинному волокну (параллельный полипептид), которая содержит три пептидные цепи, образующие тройную спиральную структуру за счет внутримолекулярных водородных связей, что придает структуре ее стабильность. Дополнительные остатки ОН боковой цепи обеспечивают дополнительную прочность благодаря Н-связям, а остатки глицена позволяют белку скручиваться более плотно, поскольку они помещаются внутри спирали. Содержит высокое содержание глицина, пролина и не содержит цистина. В коллагеновом волокне три из этих спиралей скручены вместе, образуя подобную веревке структуру, называемую суперспиральной спиралью. Именно эта структура придает коллагену большую прочность. Вторичная структура (альфа-спиральная конформация) далее сворачивается в третичную структуру. Гидрофобные цепи удерживаются внутри, тогда как гидрофильные цепи располагаются снаружи, что сворачивает и скручивает структуру, придавая молекуле стабильность. Эта третичная структура поддерживается водородными связями, дисульфидными связями, ионными связями и гидрофобными взаимодействиями. Эта структура сближает отдаленные боковые цепи аминокислот. Ковалентные связи образуются между лизиновыми остатками, которые укрепляют структуру белка, позволяя ему растягиваться и возвращаться к исходной длине, когда это необходимо. Коллаген содержит больше глицина (33%) и производных пролина (от 20 до 24%), чем другие белки, но очень мало цистина. Первичная структура коллагена имеет часто повторяющийся паттерн, Gly-Pro-X (где X представляет собой гидроксил, несущий Pro или Lys). Коллагеновые цепи имеют длину примерно 1000 звеньев и принимают вытянутую левозакрученную спиральную конформацию из-за влияния пролиновых колец.
Именно эта структура придает коллагену большую прочность. Вторичная структура (альфа-спиральная конформация) далее сворачивается в третичную структуру. Гидрофобные цепи удерживаются внутри, тогда как гидрофильные цепи располагаются снаружи, что сворачивает и скручивает структуру, придавая молекуле стабильность. Эта третичная структура поддерживается водородными связями, дисульфидными связями, ионными связями и гидрофобными взаимодействиями. Эта структура сближает отдаленные боковые цепи аминокислот. Ковалентные связи образуются между лизиновыми остатками, которые укрепляют структуру белка, позволяя ему растягиваться и возвращаться к исходной длине, когда это необходимо. Коллаген содержит больше глицина (33%) и производных пролина (от 20 до 24%), чем другие белки, но очень мало цистина. Первичная структура коллагена имеет часто повторяющийся паттерн, Gly-Pro-X (где X представляет собой гидроксил, несущий Pro или Lys). Коллагеновые цепи имеют длину примерно 1000 звеньев и принимают вытянутую левозакрученную спиральную конформацию из-за влияния пролиновых колец. Три такие цепи намотаны друг на друга с правозакрученным кручением, образуя канатообразную сверхспиральную четвертичную структуру, стабилизированную межцепочечной водородной связью (Woster, n.d)
Три такие цепи намотаны друг на друга с правозакрученным кручением, образуя канатообразную сверхспиральную четвертичную структуру, стабилизированную межцепочечной водородной связью (Woster, n.d)
Функции
Казеин, молочный фосфопротеин, содержащий сложные эфиры фосфорной кислоты серина и треонина, эти белки важны для зубов и костей. Белки казеина присутствуют в молоке на 70-80% и состоят из большого количества пролиновых пептидов и не имеют дисульфидных связей. Поэтому там он имеет умеренно мало вторичной или третичной структуры. Казеин плохо растворим в воде, но хорошо растворяется в щелочах и сильных кислотах, проявляя гидрофобные свойства, появляется в молоке в виде взвеси частиц. Казеин также используется в производстве клеев, связующих веществ, защитных покрытий, пластмасс (например, рукояток ножей и вязальных спиц), тканей и пищевых добавок, он нетоксичен и очень стабилен. Эти белки богаты лизином, который является одной из незаменимых аминокислот в молоке. Казеиновые белки различаются в молоке разных млекопитающих, таких как животные и люди, и бывают трех типов; α, β и γ Они отличаются друг от друга своей молекулярной массой, скоростью миграции в электрическом поле и содержанием фосфора (Horne, 2002; Wang et al, 2009).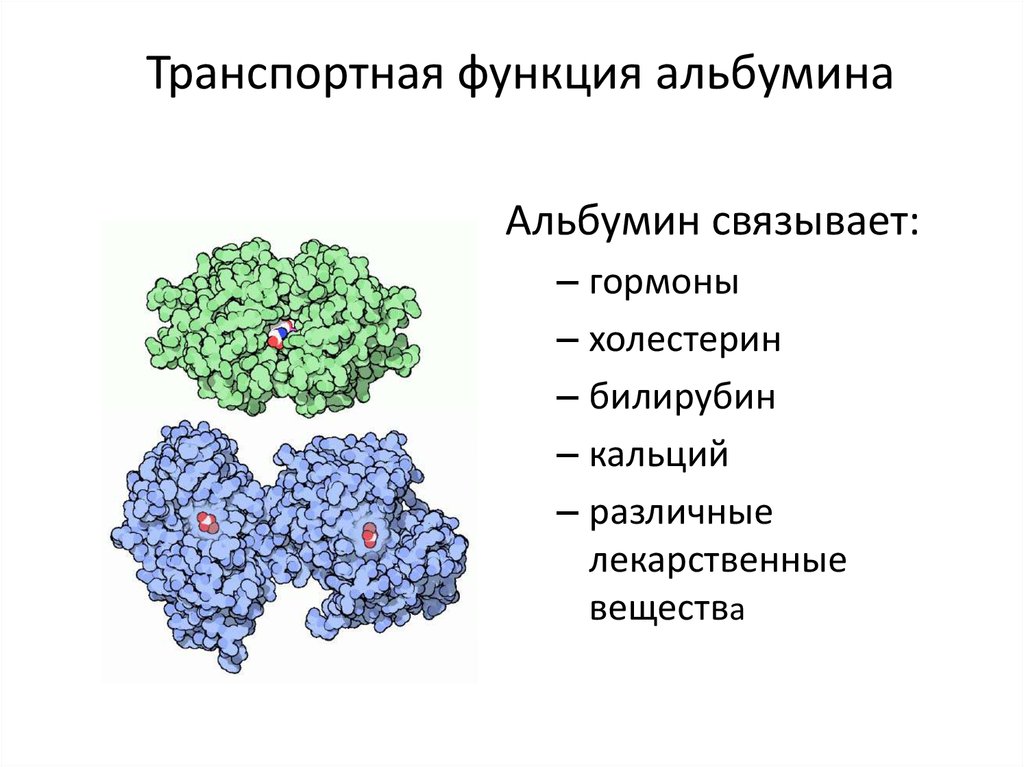 ).
).
Коллаген является наиболее распространенным белком у млекопитающих, присутствующим в соединительных тканях (коже, костях, сухожилиях, хрящах, роговице и т. д.), который обеспечивает жесткость, защиту, гибкость и смазывание. Этот белок совершенно нерастворим в воде и подвержен влиянию изменения температуры. Богат глицином и аланином, но также содержит серин и тирозин. Содержит три длинные полипептидные цепи, каждая из которых состоит примерно из тысячи аминокислот. Эти цепочки закручиваются в правильную тройную спираль, отвечающую за эластичность кожи и сухожилий. При сильном нагревании превращаются в гелеобразующие вещества, гелеобразующие растворяются в воде и дают вязкий раствор, который можно использовать как клей и как загуститель. пищевая промышленность. Если коллаген частично гидролизуется в мягких условиях (кислота, нагревание и т. д.), три нити коллагена разделяются на глобулярные, случайные клубки, образуя желатин, который имеет более низкую антигенность, но все же сохраняет часть своей последовательности, что способствует адгезии и пролиферации клеток (Wang et al. , 2009 г.).
, 2009 г.).
Многие процессы могут привести к денатурации белка, что означает изменение вторичной, третичной или четвертичной структуры. Растворимость может быть результатом различных уровней структуры. Например, соединительные белки не растворяются в воде. Хотя белки овальбумина растворимы в воде и более чувствительны к температуре или нагреванию (в отличие от коллагена, в них отсутствует последовательность глицина), это означает, что они могут легко терять свою вторичную и третичную структуру, процесс, называемый денатурацией (Huntington et al, 2001). Когда денатурированные молекулы объединяются в белковую сеть, этот процесс называется коагуляцией или гелем. Эта сформированная белковая сеть улавливает воду в пище между своими ячейками для образования геля или коагуляции, придавая пище ее консистенцию (яичное мясо). Она используется для поглощения воды (сгущения) и для стабилизации эмульсии и пены. Когда яйцо готовится, вязкость снижается. , яичный белок меняется с полупрозрачного на белый; это изменение цвета свидетельствует об изменении структуры белков альбумина. Взаимодействия этих заместителей, как полярных, так и неполярных, часто заставляют белок сворачиваться в сферические конформации, что и дало название этому классу. В отличие от структурной функции, которую выполняют волокнистые белки, глобулярные белки химически реактивны, выступая в качестве ферментов (катализаторов), транспортных агентов и регуляторных мессенджеров. Хотя глобулярные белки обычно чувствительны к денатурации (структурное разворачивание), некоторые из них могут быть удивительно стабильными. Нагревание белков может расщеплять водородные связи, ионные или гидрофобные связи. Белковые структуры чувствительны к температуре и рН, в частности, агрегация белков разворачивает содержимое альфа-спирали, денатурируется или разрушается при нагревании при высокой температуре. Некоторые белки являются жесткими и нерастворимыми в воде, они либо связаны ковалентно, либо расположены под действием других сил, которые нелегко разрушить; примеры конъюгированных белков включают коллаген (Gossett et al,19).
Взаимодействия этих заместителей, как полярных, так и неполярных, часто заставляют белок сворачиваться в сферические конформации, что и дало название этому классу. В отличие от структурной функции, которую выполняют волокнистые белки, глобулярные белки химически реактивны, выступая в качестве ферментов (катализаторов), транспортных агентов и регуляторных мессенджеров. Хотя глобулярные белки обычно чувствительны к денатурации (структурное разворачивание), некоторые из них могут быть удивительно стабильными. Нагревание белков может расщеплять водородные связи, ионные или гидрофобные связи. Белковые структуры чувствительны к температуре и рН, в частности, агрегация белков разворачивает содержимое альфа-спирали, денатурируется или разрушается при нагревании при высокой температуре. Некоторые белки являются жесткими и нерастворимыми в воде, они либо связаны ковалентно, либо расположены под действием других сил, которые нелегко разрушить; примеры конъюгированных белков включают коллаген (Gossett et al,19). 84, Хантингтон и др., 2001).
84, Хантингтон и др., 2001).
Заключение
Пищевые белки, такие как коллаген, казеин и яичный альбумин, обеспечивают высокое или низкое питательное качество для человека. Качество пищи зависит от структуры и функциональных свойств белка. Некоторыми функциональными свойствами белков являются растворимость, гидратация, вязкость, текстурирование, образование теста, эмульгирующие и пенообразующие свойства. Растворимость — это способность белков растворяться в воде, уменьшающаяся при термической обработке, эта потеря растворимости имеет серьезные последствия для эмульгирующих и пенообразующих свойств белка.
,
Поделись этим:
Фейсбук
Логотип Facebook
Твиттер
Логотип Твиттера
Реддит
Логотип Reddit
LinkedIn
Логотип LinkedIn
WhatsApp
Логотип WhatsApp
Процитировать эту работу
Чтобы экспортировать ссылку на эту статью, выберите стиль ссылки ниже:
- АПА
- ГНД
- МЛА-7
- Гарвард
- Ванкувер
- Википедия
- ОСКОЛА
UKEssays. (ноябрь 2018 г.). Структура и функция овальбумина. Получено с https://www.ukessays.com/essays/biology/structure-and-function-of-ovalbumin-biology-essay.php?vref=1
(ноябрь 2018 г.). Структура и функция овальбумина. Получено с https://www.ukessays.com/essays/biology/structure-and-function-of-ovalbumin-biology-essay.php?vref=1
Ссылка скопирована в буфер обмена.
«Структура и функция овальбумина». ukessays.com. 11 2018. UKEssays. 04 2023
Ссылка скопирована в буфер обмена.
«Структура и функция овальбумина». UKEssays. ukessays.com, ноябрь 2018 г. Интернет. 4 апреля 2023 г.
Ссылка скопирована в буфер обмена.
UKEssays. Ноябрь 2018 г. Структура и функция овальбумина. [В сети]. Доступно по адресу: https://www.ukessays.com/essays/biology/structure-and-function-of-ovalbumin-biology-essay.php?vref=1 [Проверено 4 апреля 2023 г.].
Ссылка скопирована в буфер обмена.
UKEssays. Структура и функция овальбумина [Интернет]. Ноябрь 2018 г.

