Белки и их строение и функции в организме: строение, свойства, функции — урок. Биология, 9 класс.
Строение белков
К содержанию
Среди органических веществ белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 — 80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой (—COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность. через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные белки
Другие заметки по биологии
Полезная информация?
Функции белков в организме – биологические, каталитиеские, транспортные
4.6
Средняя оценка: 4.6
Всего получено оценок: 2029.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2029.
Белки являются строительным материалом организма и играют важную роль в обмене веществ. Функции белков разнообразны и имеют огромное значение для поддержания процесса жизнедеятельности.
Материал подготовлен совместно с учителем высшей категории Макшаковой Натальей Алексеевной.
Опыт работы учителем биологии — 23 лет.
Строение
Белки – биополимеры, состоящие из отдельных звеньев – мономеров, которые называются аминокислотами.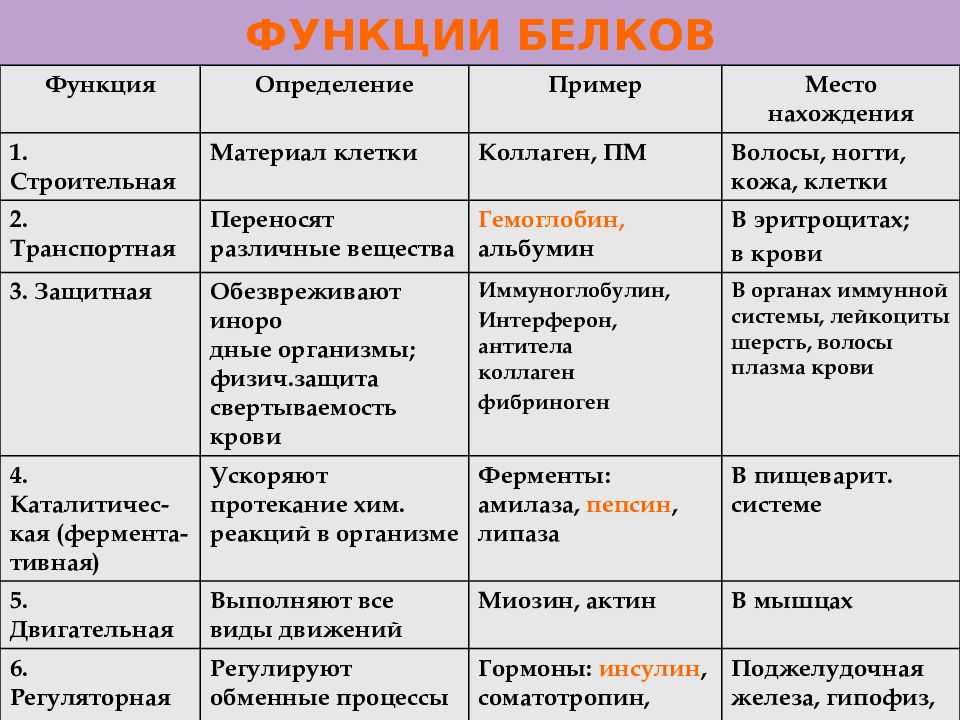 Аминокислоты состоят из карбоксильной (-СООН), аминной (-Nh3) группы и радикала. Аминокислоты в белке связываются между собой с помощью ковалентной пептидной связи, образуя полипептидную цепь. Пептидная связь образуется между карбоксильной и аминогруппой соседних аминокислот.
Аминокислоты состоят из карбоксильной (-СООН), аминной (-Nh3) группы и радикала. Аминокислоты в белке связываются между собой с помощью ковалентной пептидной связи, образуя полипептидную цепь. Пептидная связь образуется между карбоксильной и аминогруппой соседних аминокислот.
Обязательные химические элементы аминокислот:
- углерод;
- водород;
- азот;
- кислород.
Рис. 1. Строение белка.
Радикал может включать серу и другие элементы.
В соответствии с возможностью синтезироваться внутри организма выделяют два вида аминокислот:
- заменимые – синтезируются в организме;
- незаменимые – не синтезируются в организме и должны поступать из внешней среды.
Известно около 200 аминокислот. Однако в построении белков участвуют только 20.
Синтез
Биосинтез белков происходит в цитоплазме клетки на рибосомах. Это сложный процесс, состоящий из трех стадий:
- транскрипция – образование на участке ДНК информационной (матричной) РНК с информацией о последовательности аминокислот в белковой молекуле;
- трансляция – синтез на основе матричной РНК полипептидной цепи из аминокислот;
- модификация белка.

Синтез полипептидной цепи происходит на рибосоме с помощью матричной и транспортной РНК. Матричная РНК содержит информацию о последовательности аминокислот в белковой молекуле. Транспортные РНК доставляют на рибосому аминокислоты и осуществляют сверку их с информацией на матричной РНК. Этот процесс называется трансляцией. Модификация белка включает «работу над ошибками».
Части синтезированного белка заменяются, удаляются или удлиняются.
Рис. 2. Синтез белка.
Функции
Биологические функции белков представлены в таблице.
Функция | Описание | Примеры |
Транспортная | Переносят вещества (малые молекулы) через клеточную мембрану, а также участвуют в их транспорте кровью и другими жидкостями по организму. | Гемоглобин переносит кислород и углекислый газ, транскортин – транспортные белки, встроенные в мембраны клеток, участвуют в поступлении в клетку глюкозы, аминокислот. |
Двигательная | Обеспечивают сокращение мышечных клеток многоклеточных животных, участвуют в движении жгутиков и ресничек | Актин, миозин |
Структурная (строительная) | Участвуют в образовании цитоскелета, органоидов клетки, межклеточного вещества. Обеспечивают прочность тканей и клеточных структур. | Коллаген и эластин в хрящевой ткани, кератин волос и ногтей |
Сигнальная | Передают информацию между клетками, тканями, органами | Цитокины |
Ферментативная или каталитическая | Большинство ферментов в живых организмах имеют белковое происхождение. Они являются катализаторами, ускоряя биохимические реакции | Пепсин, каталаза, рибонуклеаза |
Регуляторная или гормональная | Гормоны белкового происхождения контролируют и регулируют процессы метаболизма | Инсулин, тиротропин |
Генно-регуляторная | Регулируют функции нуклеиновых кислот при переносе генетической информации | Гистоны регулируют репликацию и транскрипцию ДНК |
Энергетическая | Используется как дополнительный источник энергии. | В качестве источника энергии белки используются организмом после углеводов и липидов. |
Защитная | Специфичные белки – антитела – предохраняют организм, уничтожая чужеродные частицы. Особые белки участвуют в свертывании крови, останавливая кровотечения | Иммуноглобулины, фибриноген, тромбин |
Запасающая | Запасаются для питания клеток. Удерживают необходимые организму вещества | Ферритин удерживает железо, казеин, глютен, альбумин запасаются в организме |
Рецепторная | Удерживают различные регуляторы (гормоны, медиаторы) на поверхности или внутри клетки | Глюкагоновый рецептор, протеинкиназа |
Белки могут оказывать отравляющее и обезвреживающее действие. Например, палочка ботулизма выделяет токсин белкового происхождения, а белок альбумин связывает тяжёлые металлы.
Ферменты
Стоит сказать кратко о каталитической функции белков. Ферменты или энзимы выделяют в особую группу белков. Они осуществляют катализ – ускорение протекания химической реакции.
В соответствии со строением ферменты могут быть:
- простыми – содержат только аминокислотные остатки;
- сложными – помимо белкового остатка включают небелковые структуры, которые называются кофактором (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнаёт» определённый субстрат и связывается именно с ним как “ключ с замком”. Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель «рука-перчатка»). Модель показывает, что фермент «подстраивается» под субстрат. Благодаря изменению структуры снижается энергия активации реакции.
Рис. 3. Модель «рука-перчатка».
Активность ферментов зависит от нескольких факторов:
- температуры;
- концентрации фермента и субстрата;
- кислотности.
Различают 6 классов ферментов, каждый из которых взаимодействует с определёнными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Выяснили, какие функции выполняют белки в клетке, как они устроены и как синтезируются. Белки представляют собой полимерные цепочки, состоящие из аминокислот. Всего известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: переносят вещества, ускоряют биохимические реакции, регулируют процессы, происходящие в организме.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2029.
А какая ваша оценка?
Что такое белки и какова их функция в организме?
Последнее обновление: 16 декабря 2019 г.
Содержание
Белки состоят из множества строительных блоков, известных как аминокислоты. Наше тело нуждается в диетическом белке, чтобы поставлять аминокислоты для роста и поддержания наших клеток и тканей. Наша диетическая потребность в белке меняется на протяжении всей жизни. Европейское агентство по безопасности пищевых продуктов (EFSA) рекомендует взрослым потреблять не менее 0,83 г белка на кг массы тела в день (например, 58 г в день для взрослого человека весом 70 кг). Растительные и животные белки различаются по своему качеству и усвояемости, но это обычно не беспокоит большинство людей, если их общий белок соответствует их потребностям. Мы должны стремиться потреблять белок из различных источников, которые приносят пользу как нашему здоровью, так и планете.
Мы должны стремиться потреблять белок из различных источников, которые приносят пользу как нашему здоровью, так и планете.
Из чего состоят белки?
Белки состоят из множества различных аминокислот, связанных вместе. Существует двадцать различных аминокислотных строительных блоков, обычно встречающихся в растениях и животных. Типичный белок состоит из 300 или более аминокислот, и конкретное количество и последовательность аминокислот уникальны для каждого белка. Подобно алфавиту, аминокислотные «буквы» могут быть расположены миллионами различных способов для создания «слов» и целого белкового «языка». В зависимости от количества и последовательности аминокислот полученный белок будет складываться в определенную форму. Эта форма очень важна, поскольку она определяет функцию белка (например, мышечную или ферментативную). У каждого вида, включая человека, есть свои характерные белки.
Аминокислоты классифицируются как незаменимые и заменимые. Как следует из названия, незаменимые аминокислоты не могут вырабатываться организмом и поэтому должны поступать из нашего рациона.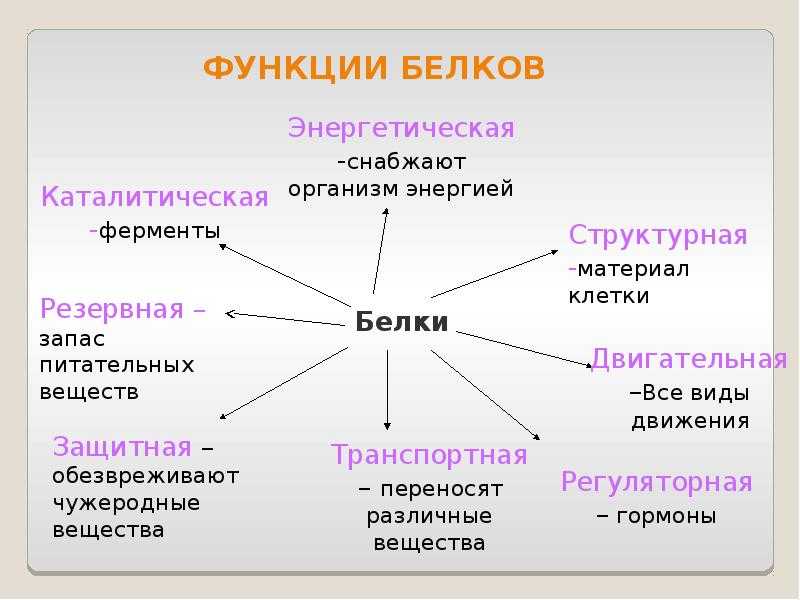 Принимая во внимание, что заменимые аминокислоты могут вырабатываться организмом и, следовательно, не обязательно должны поступать с пищей.
Принимая во внимание, что заменимые аминокислоты могут вырабатываться организмом и, следовательно, не обязательно должны поступать с пищей.
Таблица 1. Заменимые и незаменимые аминокислоты.
Незаменимые аминокислоты | Заменимые аминокислоты |
Гистидин Изолейцин Лейцин Лизин Метионин Трин Фенилаланин 90 03 Триптофан Валин | Аланин Аргинин* Аспарагин Аспартат Цистеин * Глутамат Глутамин* Глицин* Пролин* Серин Таурин* Тирозин* |
*это условно незаменимые аминокислоты, что означает, что они незаменимы только при определенных условиях (например, для новорожденных). 1
1
Что делают белки для организма?
Наше тело состоит из тысяч различных белков, каждый из которых выполняет определенную функцию. Они составляют структурные компоненты наших клеток и тканей, а также многие ферменты, гормоны и активные белки, секретируемые иммунными клетками (рис. 1).
Эти белки тела постоянно восстанавливаются и заменяются на протяжении всей нашей жизни. Этот процесс (известный как «синтез белка») требует непрерывного поступления аминокислот. Хотя некоторые аминокислоты могут быть переработаны в результате распада старых белков организма, этот процесс несовершенен. Это означает, что мы должны есть диетический белок, чтобы не отставать от потребностей нашего организма в аминокислотах.
Поскольку белок необходим для роста клеток и тканей, адекватное потребление белка особенно важно в периоды быстрого роста или повышенного спроса, например, в детстве, подростковом возрасте, беременности и кормлении грудью. 1
Рис. 1. Функции белков в организме.
1. Функции белков в организме.
Какие продукты богаты белком?
Белок содержится как в продуктах растительного, так и животного происхождения. На рисунке 2 показано содержание белка в типичной порции обычных продуктов животного и растительного происхождения. Для получения дополнительной информации о том, как определить размер здоровой порции, см. раздел «Измерение размера порции руками».
Рисунок 2. Продукты с высоким содержанием белка. 2
Есть ли разница между белками животного и растительного происхождения?
Как видно из рисунка 2, как животные, так и растительные продукты могут быть богатыми источниками белка. Но имеют ли они такое же качество?
Качество белка можно определить разными способами; однако все определения относятся к распределению и соотношению незаменимых и заменимых аминокислот, которые они содержат. В целом белки животного происхождения имеют более высокое качество, поскольку они содержат более высокие пропорции незаменимых аминокислот по сравнению с белками растительного происхождения.
Существует распространенное заблуждение, что в растительных белках полностью отсутствуют некоторые незаменимые аминокислоты. Фактически, большинство растительных белков содержат все 20 аминокислот, но, как правило, имеют ограниченное количество определенных незаменимых аминокислот, известных как их лимитирующие аминокислоты. Это означает, что если небольшое количество растительной пищи потребляется в качестве единственного источника белка, вряд ли она обеспечит достаточное количество незаменимых аминокислот для удовлетворения наших потребностей. Для людей, которые потребляют мало продуктов животного происхождения или вообще не употребляют их, таких как веганы или вегетарианцы, важно, чтобы они потребляли белок из источников с комплементарными ограничивающими аминокислотами. Например, потребление риса (с ограниченным содержанием лизина и тиамина, но с высоким содержанием метионина) и бобов (с ограниченным содержанием метионина, но с высоким содержанием лизина и тиамина) обеспечит дополнительные аминокислоты, которые могут помочь удовлетворить потребности в незаменимых аминокислотах.
Белки животного и растительного происхождения также различаются по своей биодоступности и усвояемости. Показатель усвояемости незаменимых аминокислот (DIAAS) является рекомендуемым методом определения усвояемости пищевого белка и выражается значениями ниже, а иногда даже выше 100. хороший белок дополнения к тем, у которых есть более низкие качества. Белки животного происхождения, как правило, имеют более высокие баллы DIAAS по сравнению с белками растительного происхождения (таблица 2). Поскольку большинство людей потребляют белок из различных источников, качество и усвояемость белка обычно не вызывают беспокойства.
Таблица 2. DIAAS и качество различных типов белков 100 г пищи. 3, 4
Тип белка | DIAAS 9003 9 | |
Пшеница | 40 | Низкий |
Миндаль | 40 | Низкий |
Рис | 59 | Низкий |
9 9 93 Горох 5 64 | Низкий | |
Нут | 83 | средний |
Куриная грудка | 108 | Высокая |
Высокий | ||
Молоко цельное | 114 | 3 Высокий |
Сколько белка мы должны съедать каждый день?
EFSA разработало референтные нормы (DRV) для белка. DRV для белка на разных этапах жизни обобщены в таблице 3. Для среднего взрослого человека рекомендуется потреблять не менее 0,83 г белка на каждый килограмм массы тела в день. 1 Другими словами, взрослый человек весом 70 кг должен ежедневно потреблять не менее 58 г белка. Это эквивалентно белку, содержащемуся примерно в 200 г куриной грудки или 240 г смешанных орехов.
DRV для белка на разных этапах жизни обобщены в таблице 3. Для среднего взрослого человека рекомендуется потреблять не менее 0,83 г белка на каждый килограмм массы тела в день. 1 Другими словами, взрослый человек весом 70 кг должен ежедневно потреблять не менее 58 г белка. Это эквивалентно белку, содержащемуся примерно в 200 г куриной грудки или 240 г смешанных орехов.
В периоды роста, такие как детство, беременность и кормление грудью, потребность в белке относительно высока. Кроме того, в пожилом возрасте у нас начинает увеличиваться соотношение белков и энергии. Это означает, что нам требуется такое же количество белка, но меньше энергии (или калорий) из-за снижения скорости метаболизма и более сидячего образа жизни. 1
Таблица 3. Референтные значения рациона для разных этапов жизни. 1 МТ: масса тела.
| Справочное значение | г/день 70 кг взрослый | |
Детский возраст (12 месяцев – 17 лет) | 1,14 – 0,83 г/кг BW | — | |
Взрослые (18-65 лет) | 0,83 г/кг МТ | 58 г | |
Пожилые люди (> 65 лет) | B 9 г/ | 70 г | |
Беременность | 0,83 г/кг МТ | 58 г | |
| 9002 3 дня за 3 дня 29 | 59 г | |
| + 9 г в день | 67 г | 3 | 3 | рд триместр | + 28 г в день | 86г |
Грудное вскармливание (0-6 месяцев) | + 19 г в день | 77 г | |
+13 г в день | 71 г |
Сколько белка мы едим каждый день?
В целом европейцы потребляют достаточно белка, и в большинстве развитых стран его дефицит встречается редко (рис. 3). Поскольку рацион европейцев уже превышает требуемый уровень, EFSA не рекомендует увеличивать текущее потребление белка. 1
3). Поскольку рацион европейцев уже превышает требуемый уровень, EFSA не рекомендует увеличивать текущее потребление белка. 1
Рисунок 3. Потребление белка в странах Европы.
Каковы преимущества белка для здоровья?
Употребление достаточного количества белка для удовлетворения потребностей нашего организма важно для многих функций организма. Однако есть данные, свидетельствующие о том, что в определенных ситуациях увеличение потребления белка сверх необходимого уровня может принести дополнительную пользу для здоровья.
Белки и контроль веса
Было доказано, что употребление продуктов, богатых белком, увеличивает наше чувство сытости (также известное как сытость) в большей степени, чем продукты с высоким содержанием жиров или углеводов. Краткосрочные исследования убедительно доказывают, что диеты с высоким содержанием белка (например, 1,2–1,6 г/кг в день; 84–112 г в день для взрослого человека весом 70 кг) могут помочь снизить общее потребление калорий и ускорить потерю веса. 5 Однако доказательства долгосрочного поддержания веса менее очевидны. 5 Как и все диеты, диета с высоким содержанием белка эффективна только в том случае, если ее придерживаться, что может быть трудно для некоторых людей, а низкая приверженность может частично объяснить ограниченную пользу, наблюдаемую при длительном поддержании веса. 5
5 Однако доказательства долгосрочного поддержания веса менее очевидны. 5 Как и все диеты, диета с высоким содержанием белка эффективна только в том случае, если ее придерживаться, что может быть трудно для некоторых людей, а низкая приверженность может частично объяснить ограниченную пользу, наблюдаемую при длительном поддержании веса. 5
Белок и саркопения
Саркопения — это заболевание, характеризующееся прогрессирующей потерей мышечной массы и физической функции, которое обычно характерно для пожилых людей. Саркопения связана с повышенной слабостью, риском падений, снижением функциональных возможностей и даже ранней смертью. 6 Поскольку белок необходим для восстановления и поддержания мышечной массы, неудивительно, что низкое потребление белка связано с повышенным риском развития саркопении. 6 Точно так же увеличение потребления белка, а также увеличение физической активности могут помочь сохранить мышечную массу и силу по мере старения, снижая риск саркопении и скелетных заболеваний.
Белок и спортивные результаты
Белки уже давно ассоциируются со спортивными результатами. Белок играет ключевую роль в восстановлении и укреплении мышечной ткани после тренировки. Хотя белок имеет решающее значение для наращивания мышечной массы, для получения максимальной пользы его следует рассматривать в контексте всей диеты, которая включает в себя необходимое количество углеводов, жиров, витаминов и минералов. Оптимальное потребление белка будет зависеть от типа (например, тренировки на выносливость или сопротивление), продолжительности и интенсивности упражнений, причем чем больше, тем лучше. Потребление белка 1,4–2,0 г на кг массы тела в день (например, 98-140 г в день для взрослого человека весом 70 кг) считается достаточным для удовлетворения потребностей большинства тренирующихся людей. 7 Спортсмены должны стремиться к достижению потребления белка за счет сбалансированной диеты, при этом белковые добавки используются для людей, которым необходимо поддерживать высокий уровень белка, но ограничивать общее потребление калорий.
Что произойдет, если вы съедите слишком много белка?
Недостаточно доказательств для установления порогового значения потребления белка, и EFSA заявило, что потребление белка в два раза выше DRV (1,7 г/кг в день, или 119г в день для взрослого человека весом 70 кг) по-прежнему считается безопасным при нормальных условиях. 1 Для людей с заболеванием почек избыточный белок может быть проблемой, и этим людям следует проконсультироваться с зарегистрированным диетологом или врачом общей практики, прежде чем повышать уровень белка.
Увеличение веса
Существует распространенное заблуждение, что вы не можете набрать вес, потребляя белок. Это неправда, точно так же, как углеводы и жиры, при употреблении во время профицита калорий избыток белка может превращаться в жировые отложения, что приводит к увеличению веса. Когда дело доходит до поддержания веса, самое главное – это оставаться в энергетическом балансе.
Красное и переработанное мясо и риск рака
Белок необходим для хорошего здоровья, но некоторые продукты с высоким содержанием белка могут быть полезнее для нашего здоровья, чем другие. В частности, потребление большого количества красного и переработанного мяса было связано с повышенным риском развития некоторых видов рака. 8 Красное мясо является хорошим источником белка, а также многих других необходимых питательных веществ, таких как железо, витамин B 12 и цинк, и его необязательно полностью избегать, чтобы снизить риск. Всемирный фонд исследования рака рекомендует потреблять не более трех порций (около 350-500 г приготовленного веса) красного мяса в неделю и очень мало обработанного мяса. 8
В частности, потребление большого количества красного и переработанного мяса было связано с повышенным риском развития некоторых видов рака. 8 Красное мясо является хорошим источником белка, а также многих других необходимых питательных веществ, таких как железо, витамин B 12 и цинк, и его необязательно полностью избегать, чтобы снизить риск. Всемирный фонд исследования рака рекомендует потреблять не более трех порций (около 350-500 г приготовленного веса) красного мяса в неделю и очень мало обработанного мяса. 8
Белковая устойчивость
Выбор продуктов питания, который мы делаем, влияет не только на наше здоровье, но и на окружающую среду. В целом белки животного происхождения, такие как говядина, молочные продукты и баранина, оказывают более сильное воздействие на окружающую среду (т. е. потребляют больше ресурсов и производят больше парниковых газов) по сравнению с источниками растительного происхождения, такими как соя, горох и чечевица (рис. 4). 9 Хотя полностью избегать продуктов животного происхождения не обязательно и не рекомендуется, изменение рациона питания с включением в него большего количества растительных источников белка может принести пользу нашему здоровью и планете. 10 Рациональное питание — это больше, чем просто выбор экологически чистых продуктов, богатых белком. Дополнительные советы о том, как вести более экологичный образ жизни, см. в советах по здоровому и экологичному питанию и советах по сокращению пищевых отходов.
4). 9 Хотя полностью избегать продуктов животного происхождения не обязательно и не рекомендуется, изменение рациона питания с включением в него большего количества растительных источников белка может принести пользу нашему здоровью и планете. 10 Рациональное питание — это больше, чем просто выбор экологически чистых продуктов, богатых белком. Дополнительные советы о том, как вести более экологичный образ жизни, см. в советах по здоровому и экологичному питанию и советах по сокращению пищевых отходов.
Рисунок 4 . Содержание белка и выбросы парниковых газов (ПГ) в различных продуктах питания. 9
Заключение
Белок необходим для жизни; он поставляет незаменимые аминокислоты, необходимые для роста и поддержания наших клеток и тканей. Наша потребность в белке зависит от нашего этапа жизни, и большинство европейцев потребляют достаточно белка, чтобы удовлетворить свои потребности. Поскольку большинство людей придерживаются разнообразной диеты, качество и усвояемость белков, которые они едят, не должны вызывать беспокойства, если общее количество белка соответствует их ежедневным потребностям. Поскольку мы едим продукты, а не питательные вещества, мы должны выбирать продукты, богатые белком, которые не только содержат незаменимые аминокислоты, но и поддерживают здоровое и устойчивое питание.
Поскольку мы едим продукты, а не питательные вещества, мы должны выбирать продукты, богатые белком, которые не только содержат незаменимые аминокислоты, но и поддерживают здоровое и устойчивое питание.
Ссылки
- EFSA (2012). Европейское агентство по безопасности пищевых продуктов, Научное заключение о рекомендуемых значениях белка в рационе питания. Журнал EFSA 2012; 10(2):2557
- Британская база данных о составе пищевых продуктов.
- Consultation, FE, 2011. Оценка качества пищевого белка в питании человека. ФАО продовольственная нутр. Пап, 92, стр.1-66.
- Phillips, S.M., 2017. Текущие концепции и нерешенные вопросы о потребностях в пищевом белке и пищевых добавках для взрослых. Границы в питании, 4, с.13.
- Лейди, Х.Дж., Клифтон, П.М., Аструп, А., Вичерли, Т.П., Вестертерп-Плантенга, М.С., Лускомб-Марш, Н.Д., Вудс, С.К. и Маттес, Р.Д., 2015. Роль белка в снижении и поддержании веса .
 Американский журнал клинического питания, 101(6), стр. 132
Американский журнал клинического питания, 101(6), стр. 132 - Круз-Джентофт А.Дж., Сайер А.А. (2019). Саркопения. Ланцет. 393 (10191): 2636-2646.
- Ягер Р., Керксик С.М., Кэмпбелл Б.И., Крибб П.Дж., Уэллс С.Д., Сквиат Т.М., Пурпура М., Зигенфусс Т.Н., Феррандо А.А., Арент С.М. и Смит-Райан, А.Е., 2017. Позиция Международного общества спортивного питания: белок и упражнения. Журнал
- Всемирный фонд исследования рака/Американский институт исследования рака. Экспертный отчет проекта «Непрерывное обновление» 2018. Мясо, рыба и молочные продукты и риск развития рака.
- Пур Дж., Немечек Т. (2018) Снижение воздействия пищевых продуктов на окружающую среду за счет производителей и потребителей. Наука Том. 360, выпуск 6392, стр. 987-992
- ФАО и ВОЗ. 2019. Устойчивое здоровое питание – Руководящие принципы. Rome
Структура и функции белков
Введение
Задумывались ли вы когда-нибудь о том, почему спортсмены или гимнасты часто придерживаются белковой диеты? Это потому, что эти люди тратят больше энергии по сравнению с людьми, которые не тренируются. А диета, богатая белками, подпитывает организм для наращивания мышечной массы, способствует быстрому восстановлению, повышает иммунитет, пополняет запасы гликогена и сжигает жир, что важно во время напряженных тренировок. [1]
А диета, богатая белками, подпитывает организм для наращивания мышечной массы, способствует быстрому восстановлению, повышает иммунитет, пополняет запасы гликогена и сжигает жир, что важно во время напряженных тренировок. [1]
Но нужны ли они только тем, кто занимается спортом? Нет, белок играет множество ролей во всех живых организмах. Это один из основных макроэлементов, синтезируемых организмами, необходимых для здоровой жизни.
В этой статье рассказывается, что такое белки, их типы и чем они отличаются друг от друга. Он также охватывает функции белков в живых организмах и методы изучения этих молекул в лабораторных условиях.
Что такое белки?
Белки являются одной из универсальных макромолекул в живых организмах, которые выполняют важные функции в различных биологических процессах.
Они присутствуют во всем теле организмов — в мышцах, костях, коже, волосах и практически во всех других частях тела или тканях. [2] Они состоят из 20 аминокислот, расположенных в различных структурных формах, образуя около 10 000 белков (или даже больше). [2]
[2]
Некоторые ключевые свойства белков, отвечающие за их функции: [3]
Являются ли белки линейными полимерами, построенными из мономерных звеньев, называемых аминокислотами?
Белки построены линейно из 20 аминокислот, что является повторяющимся процессом в клетке. Но линейная/первичная последовательность белка не отвечает за их функциональную роль. [3]
Последовательности спонтанно сворачиваются в различные конфигурации, образуя трехмерные структуры, которые определяются аминокислотами, присутствующими в последовательности. И эти складчатые структуры облегчают функции этих белков. [3]
Содержат ли белки широкий спектр функциональных групп?
Наиболее преобладающими функциональными группами, присутствующими в белках, являются спирты, тиолы, простые тиоэфиры, карбоновые кислоты, карбоксамиды и различные основные группы. [3]
Эти функциональные группы, объединенные в различные случайные паттерны в аминокислотной последовательности, объясняют широкий спектр функций белка. Простыми словами, свойства функциональных групп белков определяют их ферментативные и другие метаболические функции в организме. [3]
Простыми словами, свойства функциональных групп белков определяют их ферментативные и другие метаболические функции в организме. [3]
Могут ли белки взаимодействовать друг с другом и другими биологическими макромолекулами, образуя сложные ансамбли?
Белки взаимодействуют с другими белками или биомолекулами для выполнения задач, для которых они сами по себе не приспособлены. Примерами таких задач являются репликация ДНК, внутриклеточная передача сигналов и другие сложные важные биологические процессы. [3]
Некоторые белки являются жесткими, а некоторые демонстрируют ограниченную гибкость.
Жесткие белки (имеют плотную компактную структуру, которая ограничивает любое движение или движение) участвуют в структурном формировании клеток, таких как цитоскелет, который образует внутренние каркасы внутри клеток. [3]
В то время как гибкие белки (имеющие слабосвязанные структуры, которые могут легко перестраиваться или перемещаться при необходимости) действуют как шарниры, пружины и рычаги для выполнения основных функций и образования комплексов с другими белками и макромолекулами. [3]
[3]
Синтез белка
1. Биологический синтез
Процесс синтеза белка называется трансляцией. В этом процессе коды мРНК транслируются в соответствующие аминокислоты, участвующие в формировании белка. Каждая аминокислота имеет свою уникальную нуклеотидную последовательность генов. Генетический код одной аминокислоты состоит из трех наборов нуклеотидов, называемых кодонами. [4]
Процесс начинается с транскрипции ДНК в пре-мРНК с использованием РНК-полимеразы. Затем пре-мРНК модифицируют посредством посттранскрипции с образованием зрелой мРНК. [4] Зрелая мРНК используется рибосомами в качестве матрицы для синтеза белка.
Рибосомы связываются с мРНК и используют один кодон (состоящий из трех нуклеотидов), соответствующий антикодону, присутствующему на тРНК (трансферная рибонуклеиновая кислота — это адаптерная молекула, которая помогает в расшифровке мРНК) для синтеза одной аминокислоты. [4] Четыре нуклеотида, A (аденин), G (гуанин), C (цитозин) и T (тимин), образуют разные комбинации нуклеотидов, образующие разные аминокислоты.
Рисунок: Иллюстрация синтеза белка.
2. Химический синтез
Химический синтез белков включает в себя синтез пептидов, в котором используются такие стратегии, как химическое лигирование, лигирование Штаудингера или другие ортогональные химические реакции для связывания синтетических пептидов. [4] Здесь пептиды (цепочка из 30-50 аминокислот) образуются и соединяются друг с другом амидными или пептидными связями с образованием специфических белков.
Но это неэффективный метод, когда речь идет о производстве полипептидной цепи из более чем 300 аминокислот. Важно отметить, что химический синтез белка происходит от С-конца к N-концу, тогда как в биологических процессах синтез происходит в обратном направлении, то есть от N-конца к С-концу. [4]
Структуры белков
Белки построены путем соединения двух или более аминокислотных остатков вместе в различных ориентациях или конфигурациях. Аминокислоты в белках соединяются вместе пептидными связями, образующимися в результате реакции конденсации между двумя аминокислотами, при этом высвобождаются молекулы воды.
Описание структуры белка может показаться похожим на описание пептидов, но между белками и пептидами существует тонкая грань, поскольку они различаются по размеру, структуре и функциям, как объясняется ниже:
- Пептиды состоят из 2–50 аминокислот и могут быть дополнительно классифицированы на олигопептиды и полипептиды. [5] Полипептид представляет собой цепь из 20 и более аминокислот, соединенных между собой пептидными связями, а олигопептиды состоят из 20-30 аминокислотных остатков. Однако белки состоят из длинной цепи из 50 или более аминокислот, связанных пептидными связями.
- Пептиды в основном имеют линейную структуру, тогда как белки имеют четыре структурных уровня: первичный (линейный), вторичный, третичный и четвертичный. [5]
- Пептиды участвуют в регуляции активности других молекул, в то время как белки выполняют более широкий спектр функций, включая структурную детерминацию, ферментативные реакции и гормональные функции.
 [5]
[5]
Четыре уровня структуры белка
Различные уровни структуры белка возможны в результате различных химических взаимодействий в его структуре. Например, складывание линейной последовательности аминокислот в трехмерные структуры обусловлено несколькими нековалентными взаимодействиями, такими как водородные связи, ионные взаимодействия, силы Ван-дер-Ваальса и гидрофобные взаимодействия.
Ниже приводится краткое описание четырех уровней структуры белка. [6]
1. Первичная структура
Первичная структура представляет собой расположение аминокислот в линейную полипептидную цепь. Здесь аминокислоты соединены только пептидными связями и дисульфидными связями. Последовательность аминокислот в полипептидной цепи отвечает за функции белков, что определяется путем расшифровки генетических кодов или генов, соответствующих белкам. [6]
Рисунок: Представление первичной структуры белка.[8]
2.
 Вторичная структура
Вторичная структура
Вторичная структура – это регулярное повторяющееся расположение соседних аминокислот в полипептидной цепи. [7] Это происходит путем образования водородных связей между молекулами и представляет собой начальную стадию складывания полипептидов в трехмерную структурную форму, то есть до третичной и четвертичной структур.
Наиболее распространенными вторичными структурами являются альфа-спираль и бета-лист.
- Альфа-спираль: В этой структурной форме карбонильная группа (C=O) одной аминокислоты связана водородной связью с аминоводородом (NH) четвертой аминокислоты в последовательности. Это вытягивает линейную цепь в форму спиральной ленты, где каждый спиральный виток содержит 3,6 аминокислоты. [7]
- Бета-лист или нить: Здесь два или более сегмента полипептидной цепи выстроены рядом друг с другом. Нити соединены водородными связями в параллельной или антипараллельной форме.
 [7]
[7]
Рисунок: Структурные формы листов с альфа-спиралями и бета-гофрами.[8]
3. Третичная структура
Здесь полипептидная цепь дополнительно сворачивается в трехмерное пространство, включающее один или несколько доменов. Альфа-спираль и бета-листы свернуты в компактную глобулярную структуру, которая управляется неспецифическими гидрофобными взаимодействиями.
Взаимодействия происходят между полярными, неполярными, кислотными и основными группами R в полипептидной цепи. [7] Когда белки теряют третичную структурную форму, они не могут выполнять ни одну из своих функций.
В водной среде гидрофобные или неполярные группы перемещаются внутрь белков, в то время как гидрофильные R-группы лежат на поверхности или вне структуры. [7]
Рисунок: Представление третичной структуры белка.[8]
4. Четвертичная структура
В формировании четвертичной структуры участвует более одной полипептидной цепи. Полипептидные цепи могут быть идентичными в нескольких копиях или различаться последовательностями аминокислот. Именно слабые взаимодействия, такие как водородные связи и дисперсионные силы Лондона, удерживают несколько полипептидов связанными вместе, образуя четвертичную структуру. [6]
Полипептидные цепи могут быть идентичными в нескольких копиях или различаться последовательностями аминокислот. Именно слабые взаимодействия, такие как водородные связи и дисперсионные силы Лондона, удерживают несколько полипептидов связанными вместе, образуя четвертичную структуру. [6]
Хорошо известным примером четвертичной структуры является гемоглобин, который переносит кислород в крови и состоит из четырех пептидных цепей (двух альфа- и двух бета-цепей), образующих тетрамер. [6]
Рисунок: Иллюстрация четырех уровней структуры белка.[7]
Физико-химические свойства белка
- Цвет и вкус: Белки бесцветны и не имеют вкуса. Они однородны и кристалличны.
- Молекулярные массы белков: Можно рассчитать, если известна молекулярная масса аминокислот в линейной цепи. Таким образом, общее количество аминокислот, умноженное на 110 (за вычетом количества молекул воды, выделяющихся во время реакции конденсации), дает точную молекулярную массу белков.
 Примечание: средняя молекулярная масса аминокислот составляет 110 дальтон. [9]
Примечание: средняя молекулярная масса аминокислот составляет 110 дальтон. [9] - Коагуляция: Это тепловая денатурация белков, таких как альбумины и глобулины, с образованием нерастворимых коагулятов или агрегатов, известных как коагулянт. [9]
- Растворимость: Увеличение кислотности или щелочности раствора увеличивает растворимость белка. То есть растворимость белков зависит от рН раствора, и при изоэлектрическом рН они наименее растворимы. [9]
- Оптическая активность: Оптическая активность белков обусловлена асимметрией полипептидных цепей и а-атомов углерода в аминокислотных остатках. [10] Белки поворачивают плоскость для поляризованного света влево (левовращающие).
- Денатурация: Белок считается денатурированным, когда тепло, кислоты, щелочи, спирт, ацетон, мочевина, бета-меркаптоэтанол вызывают частичное или полное разворачивание нативной конформации полипептидных цепей.
 [9]
[9] - Изоэлектрический pH (pI): pH, при котором структура белка содержит равное количество положительных и отрицательных зарядов на их функциональных группах, называется изоэлектрическим pH. Это свойство применяется в лабораториях для выделения белков из разных образцов. Когда белки подвергаются воздействию электрического поля при изоэлектрическом pH, они не перемещаются ни к аноду, ни к катоду и становятся менее растворимыми — это вызывает осаждение белков. [9]
- Электрохимия белков: Электрохимия белков определяется как окислительно-восстановительный потенциал белков из-за наличия свободных положительных и отрицательных зарядов на функциональных группах аминокислот. Этот электрохимический характер в белках в основном определяется заряженными аммониевыми группами (―Nh4+) лизина и аргинина и отрицательно заряженными карбоксильными группами (―COO−) аспарагиновой кислоты и глутаминовой кислоты.
 Заряды на этих боковых группах аминокислот белков заставляют их двигаться к соответствующим (катодным или анодным) электродам в присутствии электрического поля и участвовать в любой химической реакции. [11]
Заряды на этих боковых группах аминокислот белков заставляют их двигаться к соответствующим (катодным или анодным) электродам в присутствии электрического поля и участвовать в любой химической реакции. [11]
- Реакция конденсации: Реакция конденсации происходит между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Это приводит к образованию пептидных связей и высвобождению молекул воды.
Классификация белков
A. По растворимости
- Волокнистые белки: Они нерастворимы в воде и в основном участвуют в поддерживающих и защитных функциях организмов. Они жесткие, прочные и линейной формы. [9] Здесь длинные параллельные полипептидные цепи перекрестно связаны друг с другом, образуя белок. Коллаген, кератин, шелк и фибрин являются распространенными примерами волокнистых белков. [9]
- Глобулярные белки: Они растворимы в воде и играют функциональную роль в метаболизме, например, образуют ферменты, гормоны и антитела.
 Здесь полипептидные цепи плотно свернуты в сферу. Большинство белков в клетках относятся к этой категории. Примеры включают ДНК-полимеразу, РНК-полимеразу и гемоглобин. [9]
Здесь полипептидные цепи плотно свернуты в сферу. Большинство белков в клетках относятся к этой категории. Примеры включают ДНК-полимеразу, РНК-полимеразу и гемоглобин. [9]
B. На основе структурной сложности
- Простые белки: Они имеют простую структурную организацию и состоят только из аминокислотных остатков. Они также известны как гомопротеины. Они могут быть глобулярными или волокнистыми белками. Примеры включают кератин, эластин, альбумин, коллаген и гистоны. [9]
- Конъюгированные белки: Это сложные белки, и здесь белки слабо связаны с одной или несколькими небелковыми частями. Небелковые группы называются простетическими группами и могут быть углеводами, липидами, ионами металлов, нуклеиновой кислотой, фосфорной кислотой и ФАД. [9] Эти белки обычно имеют глобулярную форму и растворимы в воде. Примеры включают нуклеопротеины, металлопротеины и липопротеины. [9]
- Производные белки: Это низкомолекулярные производные белков, полученные в результате частичного гидролиза простых или конъюгированных белков кислотой, ферментом или щелочью.
 Примерами являются коагулированные белки, протеины, пептоны и пептиды. [9]
Примерами являются коагулированные белки, протеины, пептоны и пептиды. [9]
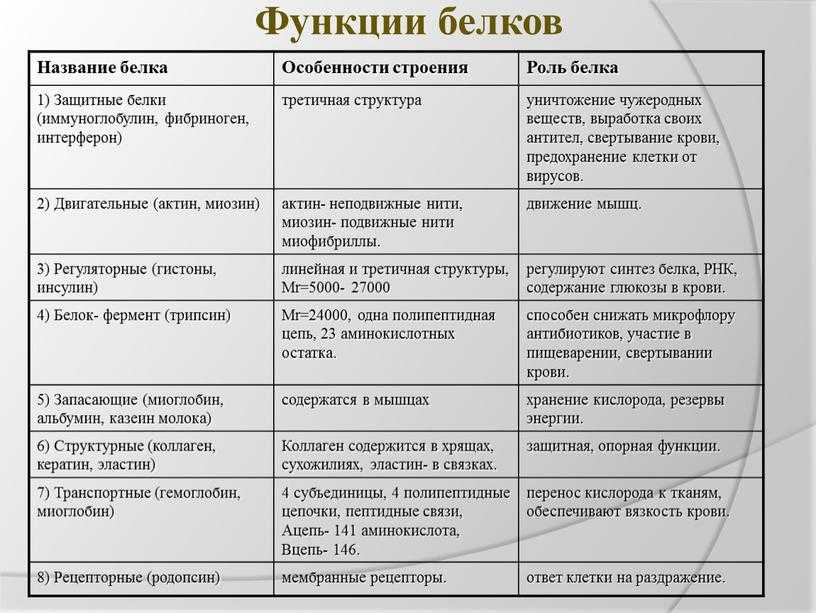
Биологические функции белка
Белки выполняют несколько жизненно важных метаболических функций в организмах. На основании их функций они классифицируются на: [12]
- Структурные белки: Большинство структурных белков являются волокнистыми белками и нерастворимы в воде. Они образуют компоненты костей, сухожилий, хрящей, кожи, соединительной ткани, волос и рогов. Примеры включают коллаген, кератин и эластин. [12]
- Ферменты: Они являются биологическими катализаторами и работают за счет снижения энергии активации реагентов. Во время этого процесса они ускоряют метаболические реакции клеток. Большинство ферментов представляют собой глобулярные конъюгированные белки. Примеры включают нитрогеназу, ДНК-полимеразу и липазу. [12]
- Гормоны: Белковые гормоны в клетках включают глюкагон, инсулин и адренокортикотропный гормон.
 [12]
[12] - Дыхательные пигменты: Это окрашенные белки, которые конъюгированы и содержат пигменты (хром) в качестве простетической группы. Примерами являются гемоглобин и миоглобин. [12]
- Сократительные белки: Эти белки участвуют в сокращении мышц за счет энергии молекул АТФ. Примерами являются актин и миозин. [12]
- Запасные белки: Эти белки запасают металл или аминокислоты в клетках и содержатся в семенах, яйцах, молоке и бобовых. Примерами являются казеин, глютен и ферритин. [12]
- Транспортные белки: Эти белки отвечают за транспортировку молекул или материалов к месту назначения. Они образуют каналы в плазматической мембране, а также участвуют в образовании крови и лимфы у животных. Примеры включают сывороточный альбумин. [12]
- Защитные белки: Это белки, участвующие в защите организма от чужеродных микробов или материалов.
 Примеры включают иммуноглобулин (антитела) и фибриноген. [12]
Примеры включают иммуноглобулин (антитела) и фибриноген. [12] - Токсины: Змеиные яды представляют собой токсичные белки.
Методы изучения белков
Различные характеристики белков изучаются с использованием различных методов, включая: in vivo, in vitro, и в силико . [4]
In vivo методы используются для изучения функциональной роли белков внутри клеток; методы in vitro предпочтительны, когда речь идет о понимании механизма работы белков в определенной среде; в то время как in silico — это вычислительный метод изучения белков, например, понимание образования белковых комплексов и определения структуры. [4]
Ниже приведены методы, основанные на исследованиях, для которых они используются: [4]
- Очистка белков: Процесс начинается с лизиса клеток; здесь клеточная мембрана разрушается для высвобождения всех клеточных компонентов, которые затем очищаются с помощью ультрацентрифугирования.
 Он фракционирует клеточные компоненты на разные фракции, содержащие растворимые белки. Белки в лизатах осаждают высаливанием и выделяют с использованием различных методов хроматографии, основанных на молекулярной массе, чистом заряде и аффинности связывания. Затем белок очищают с помощью гель-электрофореза, спектроскопии или электрофокусировки, в зависимости от требований эксперимента. [4]
Он фракционирует клеточные компоненты на разные фракции, содержащие растворимые белки. Белки в лизатах осаждают высаливанием и выделяют с использованием различных методов хроматографии, основанных на молекулярной массе, чистом заряде и аффинности связывания. Затем белок очищают с помощью гель-электрофореза, спектроскопии или электрофокусировки, в зависимости от требований эксперимента. [4] - Наличие белка в образцах: Для изучения наличия белков в данном образце используются два теста: биуретовый тест и нингидриновый тест. В биуретовом тесте 2 мл образца добавляют к 2 мл 10% NaOH и одной капле 10% раствора CuSO4. Если цвет раствора меняется на фиолетовый, это указывает на наличие пептидной связи. [13] В нингидриновом тесте образование фиолетовой окраски после добавления 1 мл раствора нингидрина к 1 мл белкового раствора и осторожного нагревания указывает на присутствие в растворе α-аминокислот. [13]
- Предсказание и определение структуры: Моделирование гомологии — это вычислительный инструмент, используемый для предсказания структуры белка.
 Это полезно для белковой инженерии, например, при разработке новых складок для лекарств. [4] Рентгеновская кристаллография, ЯМР-спектроскопия, интерферометрия с двойной поляризацией и круговой дихроизм — другие популярные методы, используемые для определения структуры белка. [4]
Это полезно для белковой инженерии, например, при разработке новых складок для лекарств. [4] Рентгеновская кристаллография, ЯМР-спектроскопия, интерферометрия с двойной поляризацией и круговой дихроизм — другие популярные методы, используемые для определения структуры белка. [4] - Протеомика: Все белки, присутствующие в клетке, называются протеомами. А изучение выделения, разделения, идентификации, характеристики и очистки этих белков известно как протеомика. Наиболее распространенными методами, используемыми для этой цели, являются 2D-электрофорез, масс-спектрометрия, белковые микрочипы и двухгибридный скрининг. [4]
Заключение
Белки являются одной из важнейших биомолекул, необходимых для поддержания жизни. Они состоят из аминокислот, расположенных на четырех структурных уровнях: первичном, вторичном, третичном и четвертичном.
Они отличаются от пептидов как на структурном, так и на функциональном уровнях. Функции белков варьируются от транспортировки молекул, формирования структуры до хранения и ферментативной роли, тогда как пептиды влияют только на активность других молекул.
Функции белков варьируются от транспортировки молекул, формирования структуры до хранения и ферментативной роли, тогда как пептиды влияют только на активность других молекул.
Спектр функций белков в организмах привлек внимание ученых к сложности их действий, поэтому ученым интересно понять структуру и механизм работы молекулы. Некоторыми распространенными инструментами, используемыми для изучения белков, являются масс-спектрометрия, хроматография, круговой дихроизм и спектрометрия.
Работа с белками требует высокого уровня предосторожности и опыта. А учитывая его важность для организмов, ученые пытаются разработать, синтезировать и очистить молекулу на индивидуальном уровне для применения в медицинских областях. Область протеомики также открывает двери для молодых ученых, чтобы совершить прорыв и внести свой вклад в повышение качества жизни человека.
Каталожные номера:
- Лучшие продукты, богатые белком, которые можно есть до и после тренировки для восстановления мышц.
 Получено с https://www.ndtv.com/health/best-protein-rich-foods-to-eat-before-and-after-a-workout-for-muscle-recovery-19.84238.
Получено с https://www.ndtv.com/health/best-protein-rich-foods-to-eat-before-and-after-a-workout-for-muscle-recovery-19.84238. - Белок. Получено с https://www.hsph.harvard.edu/nutritionsource/what-should-you-eat/protein/
- Берг Дж.М., Тимочко Дж.Л., Страйер Л. Биохимия. 5-е издание. Нью-Йорк: WH Freeman; 2002. Глава 3, Структура и функция белка. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK21177/.
- Белки. Получено с https://en.wikipedia.org/wiki/Protein.
- Пептиды и белки — в чем разница. Получено с https://www.guardian.in/blog/peptides-vs-proteins-whats-the-difference/.
- Структура белка. Получено с https://en.wikipedia.org/wiki/Protein_structure.
- Белковая структура. Получено с https://courses.lumenlearning.com/boundless-chemistry/chapter/protein-structure/
- Порядки структуры белка. Получено с https://www.khanacademy.org/science/biology/macromolecules/proteins-and-amino-acids/a/orders-of-protein-structure
- Белки: функции, структура, свойства и классификация.
 Получено с https://www.biologydiscussion.com/proteins/proteins-functions-structure-properties-and-classification/169.12
Получено с https://www.biologydiscussion.com/proteins/proteins-functions-structure-properties-and-classification/169.12 - Jirgensons B. (1973) Оптическая активность аминокислот, пептидов и белков. В кн.: Оптическая активность белков и других макромолекул. Молекулярная биология, биохимия и биофизика, т. 5. Springer, Берлин, Гейдельберг. https://doi.org/10.1007/978-3-642-87713-1_4
- Классификация белков. Получено с https://www.britannica.com/science/protein/Conformation-of-proteins-in-interfaces
- Классификация белков на основе структуры и функций. Получено с https://www.easybiologyclass.com/classification-of-proteins-based-on-structure-and-function/
- Арьял Сагар (2021). Белки — свойства, структура, классификация и функции. Получено с https://microbenotes.com/proteins-properties-structure-classification-and-functions/
Анджали Сингх
Анджали Сингх — писатель-фрилансер. Следуя своей страсти к науке и исследованиям, она получила степень магистра биологии растений и биотехнологии в Университете Хайдарабада, Индия.


 При распаде 1 г высвобождается 17,6 кДж
При распаде 1 г высвобождается 17,6 кДж