Аминокислоты поставляются кровью в: Аминокислоты. Свойства и применение аминокислот
Питательные и структурные элементы, необходимые для нормального роста волос.
Питательные и структурные компоненты необходимые для роста волос.
Аминокислоты.
Из 20 аминокислот, существующих в природе, в кератине представлены 18, значительную часть которых составляют серосодержащие аминокислоты (цистеин и метионин). В состав белков человека входят 2 аминокислоты, содержащие серу, — метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой. Цистеин и метионин необходимы для синтеза кератина – основного белка волосяного стержня.
Метионин
Метионин — незаменимая аминокислота, то есть не синтезируется в организме человека. Поэтому метионин должен постоянно поступать в организм вместе с пищей. Метионин – «стартовая» аминокислота при синтезе всех без исключения белков на рибосомах – является основным фактором, обеспечивающим нормальный запуск процессов белкового синтеза.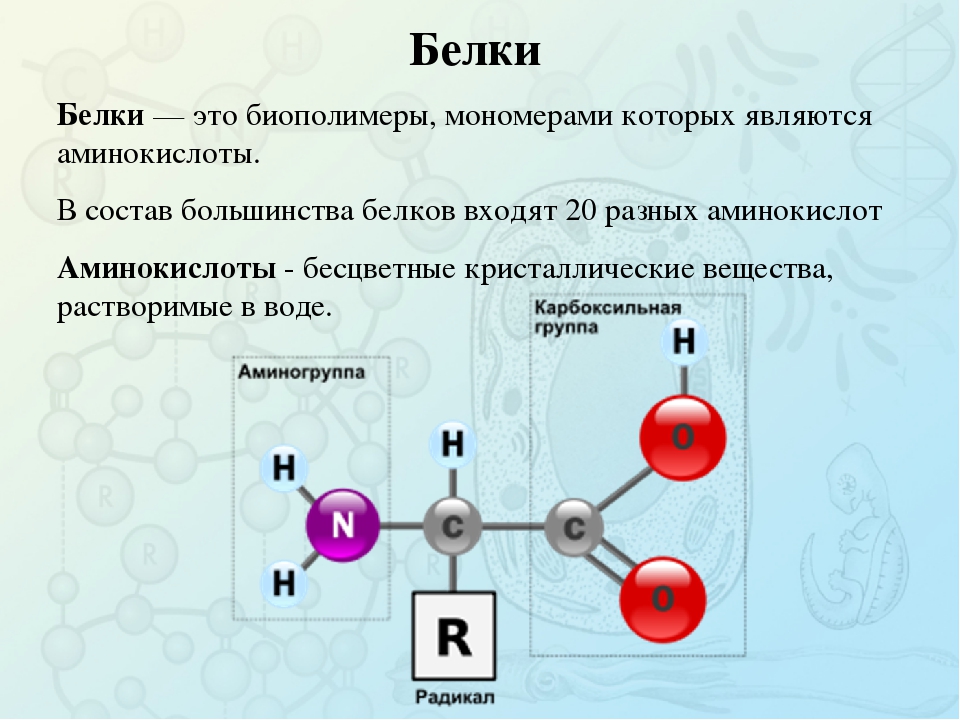 L – метионин основной донор биодоступной серы, поставляет SH-группы, необходимые для синтеза кератина – основного белка волосяного стержня, глутатиона, карнитина, фосфолипидов и других важнейших веществ. Метионин является источником серы при биосинтезе цистеина, который также участвует в синтезе кератина.
L – метионин основной донор биодоступной серы, поставляет SH-группы, необходимые для синтеза кератина – основного белка волосяного стержня, глутатиона, карнитина, фосфолипидов и других важнейших веществ. Метионин является источником серы при биосинтезе цистеина, который также участвует в синтезе кератина.
Основные натуральные источники
Больше всего встречается в говяжьем и курином мясе, в говяжей печени и треске, достаточно много содержится в твороге, куриных яйцах; крупах (по убыванию) рисовой, пшенной, овсяной, гречневой, перловой, пшеничной, манной; в горохе, макаронах и уже меньше в молоке/кефире и хлебе.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс, Триковэл, Биорекс, Веда Пауэр, Иммуджен.
Цистеин
Входит в состав α-кератинов, основного белка ногтей, кожи и волос. Он способствует формированию коллагена, улучшает эластичность и текстуру кожи, ускоряет регенерацию кожи после операций, ожогов.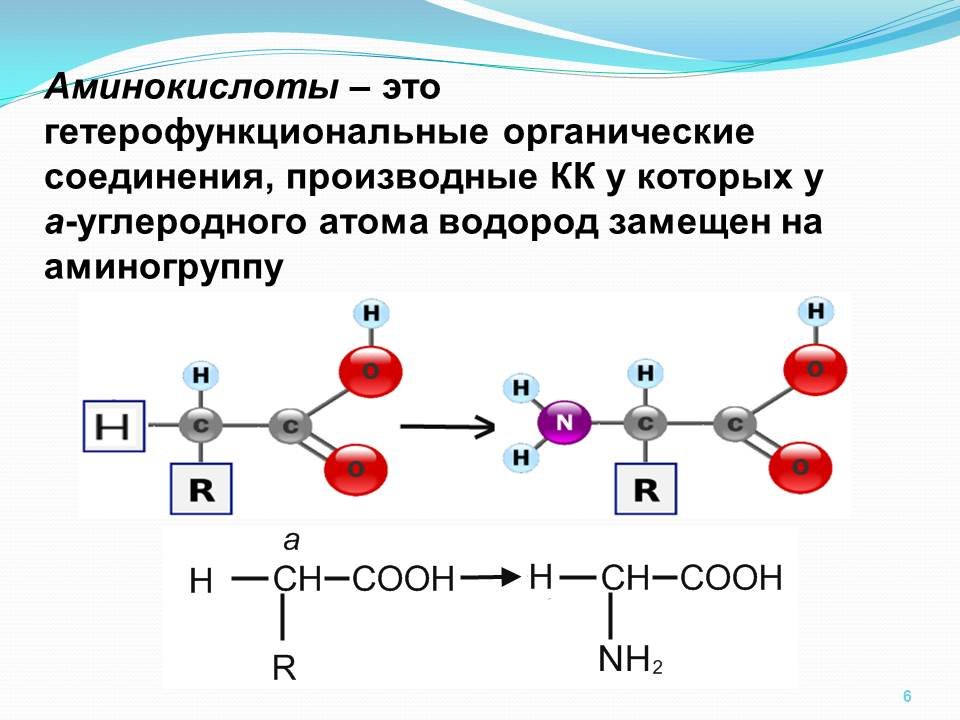 . Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов.
. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов.
Цистеин — заменимая аминокислота, которая может синтезироваться в организме из серина с участием метионина как источника серы, а также АТФ и витамина В6. Способствует обезвреживанию некоторых токсических веществ и защищает организм от повреждающего действия радиации. Один из самых мощных антиоксидантов, при этом его антиоксидантное действие усиливается при одновременном приеме витамина С и селена или в сочетании с витамином Е. Цистеин является предшественником глутатиона — вещества, оказывающего защитное действие на клетки.
Природные источники цистеина: Содержится в продуктах питания с высоким уровнем белка, в том числе: соя, мясо, птица, яйца, горох, овес, кукуруза, семечки, подсолнечника, мука пшеницы, грецкие орехи, бобы, фасоль, чечевица. Так же, некоторое количество цистеина содержится в красном перце, чесноке, луке, брюссельской капусте, брокколи.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс, Триковэл, Биорекс, Веда Пауэр
L-Аргинин
L-Аргинин – субстрат для ферментов, называемых NO-синтазами, работа которых приводит к образованию оксида азота (NO). NO является мощным сосудорасширяющим фактором, регулирующим поступление крови в органы и ткани тела, в том числе к волосяным луковицам. Таким образом, l-аргинин улучшает микроциркуляцию, а следовательно, доставку питательных и структурных компонентов, необходимых для роста волос.
NO является мощным сосудорасширяющим фактором, регулирующим поступление крови в органы и ткани тела, в том числе к волосяным луковицам. Таким образом, l-аргинин улучшает микроциркуляцию, а следовательно, доставку питательных и структурных компонентов, необходимых для роста волос.
Аргинин необходим для синтеза гормонов (например, гормона роста) и процессов азотистого обмена. От мощности работы цикла (орнитин – цитруллин – аргинин) зависит способность организма создавать мочевину и очищаться от белковых шлаков.
Аргинин способен увеличивать мышечную и уменьшать жировую массу тела, в конечном результате делая фигуру более стройной.
Аргинин обладает выраженным психотропным эффектом. Вызывая увеличение количества соматотропного гормона (СТГ) до верхних нормальных границ, аргинин способствует улучшению настроения, делает человека более активным, инициативным и выносливым, улучшает половую функцию.
Природные источники аргинина: Орехи, мясо, рыба, соя, пшеница, рис, овес.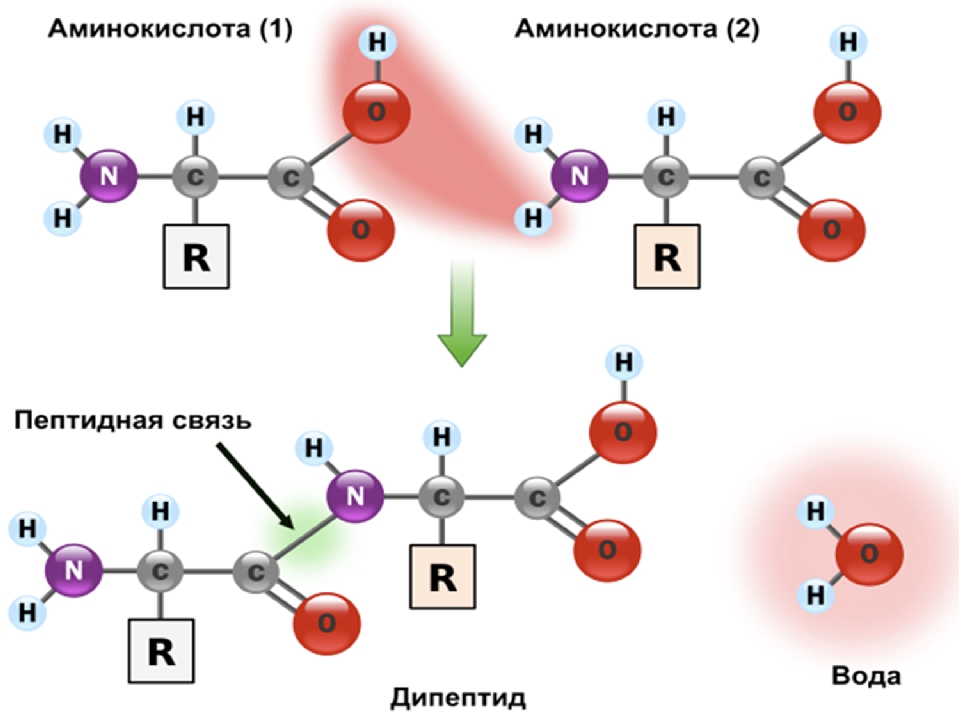
Входит в состав следующих препаратов:
Биорекс, Биорекс-Нони, Триковэл, НеоКрилоидин
Витамины.
Витамин C (Аскорбиновая кислота).
Витамин С — мощный антиоксидант. Он играет важную роль в регуляции окислительно-восстановительных процессов, участвует в синтезе коллагена и проколлагена, обмене фолиевой кислоты и железа, а также синтезе стероидных гормонов и катехоламинов. Аскорбиновая кислота также регулирует свертываемость крови, нормализует проницаемость капилляров, необходима для кроветворения, оказывает противовоспалительное и потивоаллергическое действие.Витамин С важен для роста и восстановления клеток, в том числе клеток волосяного фолликула и кровеносных сосудов.
В присутствии адекватного количества витамина С значительно увеличивается устойчивость витаминов В1, В2, A, E, пантотеновой и фолиевой кислот, необходимых для нормального функционирования волосяного фолликула и роста волос. Витамин С предохраняет холестерин липопротеидов низкой плотности от окисления и, соответственно, стенки сосудов от отложения окисленных форм холестерина.
Наш организм не может запасать витамин С, поэтому необходимо постоянно получать его дополнительно. Поскольку он водорастворим и подвержен действию температуры, приготовление пищи с термической обработкой его разрушает.
Основные природные источники: цитрусовые, овощи листовые зеленые, дыня, брокколи, брюссельская капуста, цветная и кочанная капуста, черная смородина, болгарский перец, земляника, помидоры, яблоки, абрикосы, персики, хурма, облепиха, шиповник, рябина, печеный картофель в «мундире». Травы, богатые витамином С: люцерна, коровяк, корень лопуха, песчанка, очанка, семя фенхеля, пажитник сенной, хмель, хвощ, ламинария, мята перечная, крапива, овес, кайенский перец, красный перец, петрушка, сосновые иглы, тысячелистник, подорожник, лист малины, красный клевер, плоды шиповника, шлемник, листья фиалки, щавель.
В продуктах животного происхождения — представлена незначительно (печень, надпочечники, почки).
Входит в состав следующих препаратов:
Биорекс, Триковэл
Основные антагонисты: ряд химических соединений, действию которых подвергается человек, такие, как загрязнители воздуха, промышленные токсины, тяжелые металлы, табачный дым, а также некоторые фармакологически активные соединения, в частности, антидепрессанты и диуретики могут привести к увеличению потребности в витамине С.
Тиами́н (витамин B1)
Для нормального роста волос необходимы витамины группы B, которые оказывают как самостоятельное действие на рост и состояние волос, а также являются своеобразным катализатором, ускоряющим действие других веществ. В1 — водорастворимый витамин. Тиамин играет важную роль в процессах метаболизма углеводов и жиров. Вещество необходимо для нормального протекания процессов роста и развития и помогает поддерживать надлежащую работу сердца, нервной и пищеварительной систем. Тиамин, являясь водорастворимым соединением, не запасается в организме и не обладает токсическими свойствами.
Как правило, развитие дефицита тиамина бывает связано с нарушениями в питании. Это может быть как следствием недостаточного поступления тиамина с пищей, так и происходить в результате избыточного употреблением продуктов, содержащих значительные количества антитиаминовых факторов. Так, свежие рыба и морепродукты содержат значительные количества тиаминазы, разрушающей витамин; чай и кофе ингибируют всасывание тиамина.
Основные природные источники. Основные количества тиамина человек получает с растительной пищей. Богаты тиамином такие растительные продукты, как пшеничный хлеб из муки грубого помола, соя, фасоль, горох, шпинат. Меньше содержание тиамина в картофеле, моркови, капусте. Из животных продуктов содержанием тиамина выделяются печень, почки, мозг, свинина, говядина. Также в дрожжах, Витамин B1 также синтезируется некоторыми видами бактерий, составляющих микрофлору толстого кишечника.
Входит в состав следующих препаратов:
Биорекс, Триковэл
Рибофлави́н (лактофлавин, витамин B2)
Один из наиболее важных водорастворимых витаминов, кофермент многих биохимических
процессов. Витамин B2 необходим для образования эритроцитов, антител, для регуляции роста и репродуктивных функций в организме. Он также необходим для здоровой кожи, ногтей, роста волос и для здоровья всего организма в целом.
Внешними проявлениями недостаточности рибофлавина у человека являются поражения слизистой оболочки губ, изъязвления в углах рта, отёк и покраснение языка, себорейный дерматит.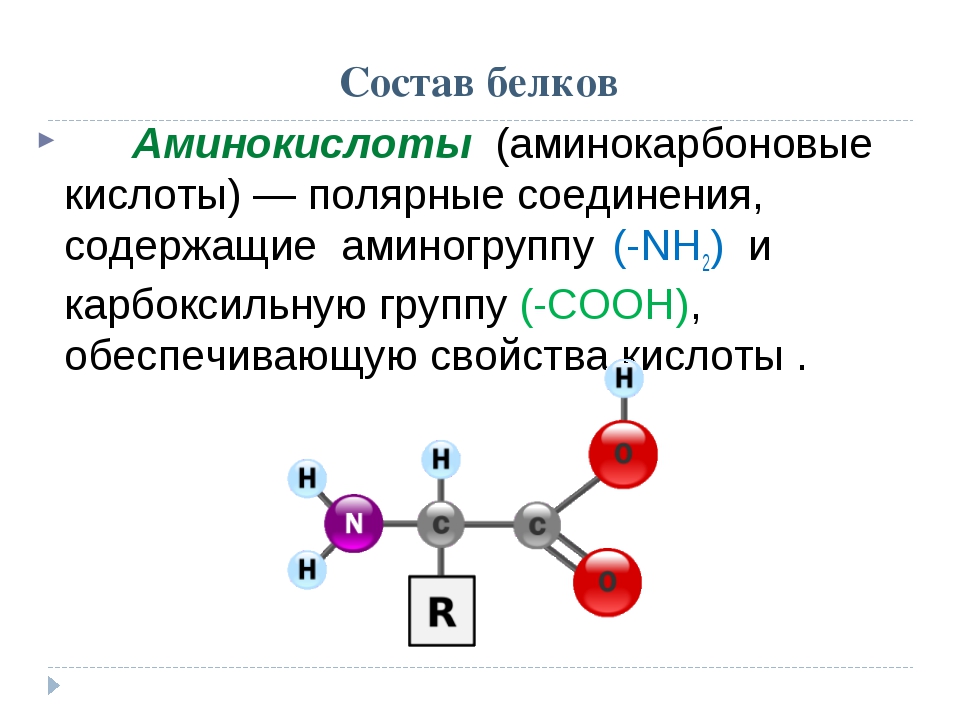 Часто развиваются также изменения со стороны органов зрения.
Часто развиваются также изменения со стороны органов зрения.
Основные причины недостатка рибофлавина у человека — недостаточное потребление продуктов содержащих этот витамин; неправильное хранение и приготовление продуктов содержащих данный витамин, вследствие чего содержание витамина резко уменьшается; хронические заболевания желудочно-кишечного тракта, приём медикаментов, являющихся антагонистами рибофлавина.
Основные природные источники. Рибофлавин содержится в печени, почках, дрожжах, миндале, твороге.
Человеческий организм не накапливает рибофлавин, и любой избыток выводится вместе с мочой.
Входит в состав следующих препаратов:
Биорекс, Триковэл
Витамин РР (Витамин В3, ниацинамид, никотинамид, никотиновая кислота)
Снабжает энергией растущие структуры, усиливает циркуляцию крови, способствуя лучшему питанию волос, улучшает снабжение волосяных фолликулов кислородом, входит в состав коэнзимов, участвующих в процессах клеточного обновления, стимулирует рост волос, выполняет функции увлажняющего агента. Он участвует в первом этапе окислительно-восстановительных процессов — образовании АТФ — источника энергии. В результате волосы получают больше питательных веществ и быстрее растут. Он отвечает за образование пигментов в волосах. При его недостатке нарушается рост волос, и они начинают рано седеть.
Он участвует в первом этапе окислительно-восстановительных процессов — образовании АТФ — источника энергии. В результате волосы получают больше питательных веществ и быстрее растут. Он отвечает за образование пигментов в волосах. При его недостатке нарушается рост волос, и они начинают рано седеть.
Основные природные источники.
Источниками ниацина являются продукты животного происхождения: мясо, печень, почки и сердце домашних животных, рыба, яйца, сыр, а также растительного — картофель, зеленый горошек, томаты, перец красный сладкий, капуста, крупы (особенно гречневая), бобовые, арахис, цельное зерно и пивные дрожжи. Никотинамид может синтезироваться из триптофана, поступающего с пищей, а также бактериями кишечника.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс
Пантотенат кальция (витамин В5):
Пантенол и пантотенат кальция регулируют обмен веществ в коже, оказывают противовоспалительное действие, способствуя устранению дефектов кожи и волос. Они улучшают кровообращение в коже, обеспечивают увлажняющий эффект. Усиливает доставку кислорода и укрепляет волосяную луковицу.
Они улучшают кровообращение в коже, обеспечивают увлажняющий эффект. Усиливает доставку кислорода и укрепляет волосяную луковицу.
Входит в состав следующих препаратов:
Триковэл
Витамин В6 (пиридоксина хлоргидрат, пиридоксин):
Термин витамин В6 или пиридоксин используется для обозначения целой группы родственных веществ, взаимозаменяемых в процессе метаболизма, а именно: пиридоксол (спирт) , пиридоксаль (альдегид) и пиридоксамин (амин).
Улучшает работу сосудов. Предотвращает появление зуда, сухости головы и, как следствие, препятствует образованию перхоти. При недостатке витамина В6 волосы могут стать тусклыми, начать выпадать, также может возникнуть себорея.
Основные природные источники
В пищевых продуктах витамин В6 обычно связан с белками. Пиридоксол обнаруживается главным образом в растениях, а пиридоксаль и пиридоксамин главным образом обнаруживаются в животных тканях. Превосходными источниками пиридоксина являются цыплята, коровья печень, свинина и телятина. Хорошими источниками пиридоксина также являются ветчина и рыба (тунец, форель, палтус, сельдь, лосось) , орехи (арахис, грецкий орех) , хлеб, крупа и цельные зерна злаковых. В целом овощи и фрукты достаточно бедны витамином В6, хотя некоторые из продуктов этого класса содержат пиридоксин в весьма значительном количестве, в частности фасоль, цветная капуста, бананы и изюм.
Хорошими источниками пиридоксина также являются ветчина и рыба (тунец, форель, палтус, сельдь, лосось) , орехи (арахис, грецкий орех) , хлеб, крупа и цельные зерна злаковых. В целом овощи и фрукты достаточно бедны витамином В6, хотя некоторые из продуктов этого класса содержат пиридоксин в весьма значительном количестве, в частности фасоль, цветная капуста, бананы и изюм.
Несмотря на то, что витамин В6 синтезируется кишечными бактериями,человек для удовлетворения потребностей своего организма нуждается во внешних источниках витамина В6, поступающего вместе с пищей.
Входит в состав следующих препаратов:
Триковэл
Фолиевая кислота
Обеспечивает деление клеток, в том числе клеток волосяной луковицы и рост тканей. Повышает биодоступность и утилизацию железа, присутствующего в организме, что также важно для роста волоса.
Основные природные источники:
Бобовые, салат, шпинат, капуста, зеленый лук, зеленый горошек, фасоль, соя, свекла, морковь, томаты, мука грубого помола и хлебобулочные изделия из этой муки, гречневая и овсяная крупы, пшено, дрожжи. Из продуктов животного происхождения богаты фолиевой кислотой печень, почки, творог, сыр, икра, яичный желток.
Из продуктов животного происхождения богаты фолиевой кислотой печень, почки, творог, сыр, икра, яичный желток.
Входит в состав следующих препаратов:
Триковэл
Витамин Е
Под названием витамин Е известны восемь встречающихся в природе соединений. Альфа-токоферол — наиболее распространенный и биологически наиболее активный из всех встречающихся в природе форм витамина Е.
Витамин Е – основной ингибитор перекисного окисления липидов. Это жирорастворимый антиоксидант. Он содержится в липидной части клеточной мембраны и защищает её от процессов липопероксидации, запускаемых свободными радикалами.
Все компоненты с антиоксидантной активностью защищают волосы от повреждающего действия свободных радикалов, сохраняют их здоровье и силу
Действие витамина Е усиливается селеном (синергичность).
Основные природные источники. Растительные масла (арахисовое, соевое, пальмовое, кукурузное, сафлоровое, подсолнечное и т. д. ) и зародыши пшеницы являются наиболее ценными источниками витамина Е. К числу других источников витамина Е относятся орехи, семена, цельные зерна и зеленые листовые овощи. Некоторые основные продукты питания типа молока и яиц содержат небольшое количество a-токоферола.
д. ) и зародыши пшеницы являются наиболее ценными источниками витамина Е. К числу других источников витамина Е относятся орехи, семена, цельные зерна и зеленые листовые овощи. Некоторые основные продукты питания типа молока и яиц содержат небольшое количество a-токоферола.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс, Триковэл, Иммуджен
Основные антагонисты
При одновременном приеме железо уменьшает поступление витамина Е в организм. Потребность в витамине Е связана с количеством полиненасыщенных жирных кислот, поступающих с пищей. Чем больше количество таких кислот, тем больше потребность в витамине Е.
Биотин (Витамин Н, витамин B7, кофермент R) — водорастворимый витамин группы В.
Биотин играет важную роль в углеводном обмене, взаимодействуя с гормоном поджелудочной железы инсулином. Биотин исключительно важен для поддержания стабильного уровня сахара в крови.
Он помогает усваивать белок и в обмене веществ является важным союзником других витаминов группы В, таких как фолиевая и пантотеновая кислоты и витамин В12. Кроме того, он участвует в метаболизме жирных кислот и в сжигании жира.
Биотин контролирует обмен жиров и преимущественно находится в клетках кожи и волос, поэтому, он влияет на содержание и состав жира в коже. Он делает кожу головы менее маслянистой, и может улучшать общую структуру и внешний вид волос. Там, где не хватает витамина, наступает себорея — нарушение функции сальных желез. Ее последствиями являются, в частности, выпадение волос и перхоть. Поскольку биотин содержит серу, он необходим для кожи, волос и ногтей. При дефиците биотина возникает и дефицит серы, кожа становится бледной, а волосы тусклыми. Более ломкими становятся и ногти. Биотин в сочетании с витаминами В-комплекса, незаменимыми жирными кислотами и такими минералами, как цинк используется при лечении себорейного дерматита.
Потребность в биотине возрастает при длительном лечении антибиотиками, которые подавляют кишечную микрофлору, продуцирующую биотин.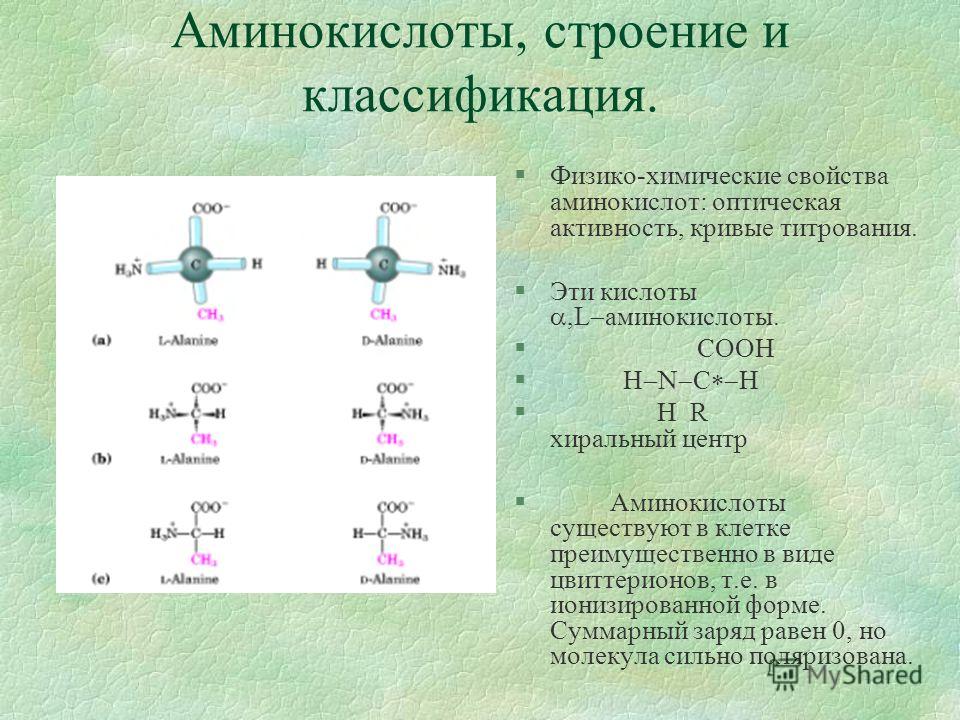 Для превращения биотина в активную форму необходим магний, и если у вас дефицит магния, также может наступить недостаточность биотина.
Для превращения биотина в активную форму необходим магний, и если у вас дефицит магния, также может наступить недостаточность биотина.
Основные природные источники.
Биотин содержится в очень многих продуктах питания. В продуктах животного происхождения его больше: в свиной и говяжьей печени и почках, сердце быка, желтках яиц. Есть он также в говядине, телятине, курином мясе и ветчине, коровьем молоке и сыре, сельди, камбале, консервированных сардинах.
Из растительных продуктов им богаты помидоры, соевые бобы, неочищенный рис и рисовые отруби, пшеничная мука, арахис, шампиньоны, зелёный горошек, морковь и цветная капуста, яблоки и апельсины, бананы и дыня, картофель, свежий лук, цельные зёрна ржи.
В тканях животных биотин связан с белками, а во фруктах и овощах он содержится в свободном состоянии. Все эти продукты могут являться для нас источником биотина, но тот биотин, который необходим нашим клеткам, синтезируется именно кишечной флорой, при условии правильного питания и хорошего здоровья, либо поступает в организм в составе некоторых препаратов.
Входит в состав следующих препаратов:
Триковэл
Микроэлементы.
Селен
Селен входит в активные центры многих ферментов. От участия селен-содержащих ферментов зависят прежде всего антиоксидантная и обеззараживающая функции организма. Этим объясняется, почему человеческий и животный организм не может выжить без минимально необходимой дозы селена.
В продуктах селен находится в виде селеносодержащих аминокислот – селенометионина и селеноцистеина. Достаточное поступление метионина – одно из основных условий для усвоения селена.
Основные природные источники.
- Селен содержится в морской и каменной солях, в почках (свиных, говяжьих и телячьих), в печени и сердце, в яйцах птицы, к тому же в желтке еще есть и витамин Е. Богаты селеном продукты морей — рыба, особенно сельдь. Бурые водоросли также заметно аккумулируют селен из морской воды. Селена нет в обработанных продуктах — консервах и концентратах, а во всех вареных, рафинированных продуктах его наполовину меньше, чем в свежих.

- Из продуктов растительного происхождения богаты селеном пшеничные отруби, проросшие зерна пшеницы, зерна кукурузы, помидоры, пивные дрожжи, грибы и чеснок, а также черный хлеб и другие продукты из муки грубого, помола. Высокие концентрации селена характерны для шампиньонов и дождевиков.
- Есть ряд лекарственных растений, богатых селеном. Это водоросли спирулины, береза повислая, эвкалипт лекарственный, солодка уральская, донник лекарственный, эфедра полевая и хвощ полевой.
Почему люди, употребляющие эти продукты в большом количестве, все равно испытывают дефицит селена? Обеспечить организм селеном, только полагаясь на определенную диету, невозможно. Содержание селена в растительной пище всегда зависит от почвы, на которой растение выросло. Растениям не нужен селен для нормального роста. Они беспрепятственно растут и на почвах, не содержащих селен и в этом случае, как следствие, и сами не содержат селен.
Немного лучше обстоит дело с продуктами животного происхождения. Так как селен также необходим животным для выживания, как и людям, корм для животных содержит всегда какое-то количество селена. В корма для животных также добавляется селен для улучшения качества мяса. Таким образом через потребление мяса осуществляется определенное снабжение селеном.
Так как селен также необходим животным для выживания, как и людям, корм для животных содержит всегда какое-то количество селена. В корма для животных также добавляется селен для улучшения качества мяса. Таким образом через потребление мяса осуществляется определенное снабжение селеном.
Подавляющая часть морских организмов обладает способностью накапливать селен, но не в биологически доступной форме. Он образует труднорастворимые комплексы с ртутью, которые не являются токсичными, однако, затрудняют усвоение селена.
Антагонисты селена. К факторам, снижающим биодоступность Se, относятся тяжёлые металлы (Cd, Hg), мышьяк, избыток и недостаток соединений серы, дефицит витаминов. Опасный «враг» селена — углеводы. А это значит, что пирожные, сладкие пироги, торты и печенье, все сладкие мучные продукты, все газированные напитки могут значительно затруднять использование организмом селена
Входит в состав следующих препаратов:
Иммуджен,
Медь
Медь используется в процессе синтеза белков, входит в активные центры многих ферментов, а также участвует в процессах роста и развития клеток и тканей. Она необходима для нормального процесса кроветворения и работы иммунной системы.
Медь участвует в синтезе коллагена, необходимого для образования белкового каркаса скелетных костей. Людям, имеющим хрупкие кости и склонным к переломам, часто бывает достаточно ввести в рацион питания добавки с медью – и переломы прекращаются, так как перестают вымываться минералы, укрепляется костная ткань, предотвращается развитие остеопороза.
Благодаря меди наши кровеносные сосуды принимают правильную форму, долго оставаясь прочными и эластичными. Медь способствует образованию эластина – соединительной ткани, образующей внутренний слой, выполняющий функцию каркаса сосудов.
Вместе с аскорбиновой кислотой медь поддерживает иммунную систему в активном состоянии, помогая ей защищать организм от инфекций; ферменты, отвечающие за защиту организма от свободных радикалов, тоже содержат в своём составе медь.
Особенно нужна медь для поддержания структуры фермента супероксиддисмутазы, обладающего мощным антиоксидантным действием. Этот фермент играет не последнюю роль в предупреждении преждевременного старения кожи и истончения волос – отвечает за целостность клеток, поэтому он часто входит в состав самых эффективных антивозрастных косметических средств.
Упругость и эластичность кожи поддерживается с помощью коллагена – в его составе тоже есть медь.
Медь стимулирует активность гормонов гипофиза и поддерживает в норме работу эндокринной системы. Так, белки и углеводы в присутствии меди усваиваются лучше, а активность инсулина повышается. Улучшая работу желез внутренней секреции, способствуя выработке необходимых ферментов и соков, медь нормализует процесс пищеварения и защищает пищеварительную систему от повреждений и воспалений. Без меди не может нормально формироваться мозг и нервная система – медь является основным компонентом миелиновых оболочек, без которых нервные волокна не могут проводить импульсы, а потом просто разрушаются.
Чтобы удовлетворять потребность в меди, человеку достаточно просто разнообразно питаться. Взрослому человеку достаточно 2 мг меди в день, а с пищей обычно попадает в 2-3 раза больше – если питание правильное. Усваивается, как правило, только третья часть всей попадающей в организм меди, так что ни дефицита, ни переизбытка наблюдаться не должно. Дефицит крайне редок, однако сегодня нехватка меди наблюдается чаще, чем в прежние времена. Дело в том, что раньше в почву не вносили в таких количествах азотистые удобрения, образующие аммиак, способный «забирать» медь из почвы. Вегетарианство и различные диеты тоже могут уменьшать количество меди в организме.
Недостаток меди приводит к задержке роста, развитию анемии, потере веса, накоплению холестерина, атрофии сердечной мышцы, остеопорозу, кожным заболеваниям, потере волос, утомляемости и частым инфекциям. Возникает также варикозное расширение вен, кожа рано покрывается морщинами, а волосы седеют.
Основные природные источники. Много меди в орехах, сыром яичном желтке, печени, бобовых, злаках, кисломолочных продуктах, овощах, фруктах и ягодах. Медь есть в свежем мясе животных, рыбе, морепродуктах, проросшей пшенице, сое, ржаном хлебе, спарже, картофеле и травах: укропе, лапчатке прямостоячей, марене красильной, сушенице, листьях чайного куста, лобелии вздутой. Питьевая вода тоже содержит медь – примерно 1 мг на литр.
Обычно той меди, которая попадает в организм человека с продуктами питания, бывает вполне достаточно, так что нехватка меди чаще всего обусловлена природными особенностями или нарушением обменных процессов.
Учёные считают, что людям с тёмными волосами требуется больше меди, чем светловолосым, так как медь необходима для поддержания окраски волос, т.к. без меди нарушается использование аминокислоты тирозина, которая является одним из основных факторов, отвечающих за цвет кожи и волос. Нехватка меди проявляется ранней сединой, поэтому темноволосым людям следует стараться включать в рацион больше продуктов, в которых её содержится много.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс, Триковэл, Биорекс
Антогонисты меди. При нехватке меди следует отказаться от употребления чёрного чая, не принимать большие дозы препаратов железа и аскорбиновой кислоты.
Цинк
Цинк играет важную роль в реализации гормональных функций в организме. Оказывает антиандрогенное действие, стимулирует рост волос.
Основные природные источники.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс, Триковэл, Биорекс
Источники энергии для роста волос.
Подкожная жировая клетчатка (гиподерма) представляет собой хранилище энергии и располагается под дермой.
Коэнзим Q10
Играет важную роль в процессе образования энергии, поддерживая деятельность митохондрий, что особенно важно для быстрорастущих структур, какими являются волосяные фолликулы.
Содержание АТФ в волосяной луковице.
Входит в состав следующих препаратов:
Иммуджен, Биорекс
Витамин РР (Витамин В3).
Снабжает энергией растущие структуры, усиливает циркуляцию крови, способствуя лучшему питанию волос, улучшает снабжение волосяных фолликулов кислородом, входит в состав коэнзимов, участвующих в процессах клеточного обновления, стимулирует рост волос, выполняет функции увлажняющего агента. Он участвует в первом этапе окислительно-восстановительных процессов — образовании АТФ — источника энергии. В результате волосы получают больше питательных веществ и быстрее растут. Он отвечает за образование пигментов в волосах. При его недостатке нарушается рост волос, и они начинают рано седеть.
Основные природные источники.
Источниками ниацина являются продукты животного происхождения: мясо, печень, почки и сердце домашних животных, рыба, яйца, сыр, а также растительного — картофель, зеленый горошек, томаты, перец красный сладкий, капуста, крупы (особенно гречневая), бобовые, арахис, цельное зерно и пивные дрожжи. Никотинамид может синтезироваться из триптофана, поступающего с пищей, а также бактериями кишечника.
Входит в состав следующих препаратов:
АльфаУно, АльфаУно Плюс
польза для организма, свойства и характеристики
Аспарагиновая кислота — одна из эндогенных аминокислот. Впервые была выделена в 1827 году из сока спаржи. Самостоятельно вырабатывается в организме или поступает с продуктами питания, а также пищевыми добавками. Входит в состав белков или содержится в свободном виде. Часто называют аспартат или аминоянтарная кислота. Сконцентрирована в клетках головного мозга и глазной сетчатке.
Отвечает за нормальную передачу нервных импульсов. Задействована в обмене азотистых веществ. Формировании мочевины и пиримидиновых оснований. До 35 лет организм в достаточном количестве вырабатывает и получает кислоты. С возрастом выработка и усвоение снижается. Требуется дополнительное поступление с биологическими добавками.
Кислота и ее соли являются одними из составляющих лекарственных средств. Борется с нарушениями работы многих органов. Применяют в качестве профилактики и предотвращения заболеваний. Спортсмены часто используют аспарагиновую кислоту для повышения тестостерона и анаболических гормонов. В здоровом организме синтезируется в достаточном количестве. Не сбалансированный рацион питания, чрезмерные физические нагрузки приводят к дефициту. Восполнить суточную норму можно с помощью высокобелковых продуктов и пищевых добавок на основе кислоты.
Натуральные источники
Аспарагиновая кислота содержится в животной и растительной пище. Правильное и сбалансированное питание нормализует выработку DAA в организме. Кислоту можно получить из молочной продукции, свежего, копченого мяса и рыбы.
1. Молочная продукция.
2. Курица, индейка, говядина.
3. Морепродукты.
4. Яйца.
5. Морская капуста.
6. Соя, бобовые.
7. Грецкие орехи, миндаль, арахис, фундук.
8. Спаржа.
9. Кукуруза.
10. Картофель.
11. Сухофрукты: курага, чернослив, сушеная вишня.
12. Крупы: гречка, рис, перловка, овес, пшеница.
13. Авокадо.
14. Пивные дрожжи.
Формы аспарагиновой кислоты
Выделяет две основные формы аспарагиновой кислоты – L и D. С идентичным молекулярным составом и разным функциями. Содержание L формы в организме больше чем D. У обеих есть центральное ядро и атомы прикрепленные сбоку.
1. Форма L задействована в синтезе белков. Выводит токсины и аммиак из организма. Важна для выработки энергии и синтеза глюкозы. Широко используют в производстве протеинов. Необходима спортсменам для пополнения запасов энергии в клетках. Регулировки количества сердечных сокращений, нормализации артериального давления.
2. Форма D сконцентрирована в головном мозге и половых органах. Задействована в биосинтезе карнозина, ансерина, пиримидиновых и пуриновых нуклеотидов. Окисляется в митохондриях мозга и преобразовывается в энергию. Обеспечивает нормальную работу функций нервной системы. Увеличивает выработку тестостерона и улучшает рост мышечной массы. Задействована в процессе сперматогенеза, влияет на производство и качество спермы. Стимулирует репродуктивную функцию женщин и мужчин, усиливает сексуальное влечение. Положительно влияет на женский организм во время менопаузы. Поддерживает потенциал и улучшает либидо.
Влияние аспарагиновой кислоты на организм
Аспарагиновая кислота необходима для нормальной работы иммунной системы, синтеза ДНК и РНК, аппарата наследственности, клеточного роста, процесса деления клеток. Выполняет в организме роль медиатора, отвечает за передачу сигнала от одного нейрона к другому. Преобразует углеводы в глюкозу и пополняет запасы гликогена. Задействована в процессе образования мочевины протекающего в печени, поставляет аммиак. Обладает иммуномодулирующим действием. Увеличивает физическую выносливость. Поддерживает нормальный баланс возбуждения и торможения в нервной системе. Стимулирует защитные функции организма. Улучшает проходимость крови, поставляет кислород в клетки миокарда. Поступление аспарагиновой кислоты в повышенной концентрации нужно при: постоянной усталость, депрессии, плохой памяти, нестабильном эмоциональном состоянии, низкой работоспособности. Регулярный прием необходим людям страдающим заболеваниями: сердечно-сосудистой системы, головного мозга, глаз. Подавляет негативное воздействие стрессов. Улучшает концентрацию внимания и мозговую активность. Обладает детоксирующим действием, выводит из организма токсины, химические соединения и аммиак.
Польза:
1. Участвует в синтезе аминокислот.
2. Поддерживает нормальную работу печени.
3. Стимулирует иммунную систему.
4. Улучшает работу мозга.
5. Борется со стрессами и депрессиями.
6. Нейтрализует соединения аммиака.
7. Выравнивает гормональный фон.
8. Выводит из организма остатки продуктов распада лекарственных средств.
9. Повышает выработку антител.
10. Увеличивает сопротивляемость организма к вирусам и инфекциям.
11. Задействована в транспортировке ионов магния и калия, для построения ДНК и РНК.
12. Защищает клетки от патогенного воздействия.
13. Обладает антибактерицидными свойствами.
14. Участвует в белковом обмене.
Роль аспарагиновой кислоты в организме спортсмена
Из-за чрезмерной физической нагрузки организм нуждается в поддержке и восстановлении. Аминокислоты и белковые молекулы необходимы для окислительно-восстановительных реакций. Спортсмены используют аспарагиновую кислоту для стимуляции собственного гормонального уровня. В виде пищевой добавки к основному рациону. Чтобы увеличить мышечную массу и повысить силовые показатели. Кислота взаимодействует с гипоталамусом в промежуточном мозге. Влияет на нейроэндокринную деятельность. Ускоряет синтез самототропина, тестостерона, прогестерона, гонадотрапина. Отвечающие за силу, вторичные морфологические признаки и объем мышц. Аспарагиновая кислота улучшает проницаемость кальция и магния в клетки. Минералы борются с симптомами перетренированности, например: слабостью и отеком мышц, нарушением режима сна, постоянной усталостью, частым сердцебиением, перепадами настроения, нарушением пищеварения. Прием пищевой добавки с аспарагиновой кислотой необходим для набора мышечной массы, борьбы с жировыми отложениями и улучшения самочувствия спортсмена.
Правила приема аспарагиновой кислоты
1. Принимать аспарагиновую кислоту нужно на протяжении 2-3 недель. После сделать небольшой перерыв 1-2 недели.
2. Суточная норма для взрослого человека составляет 3-6 грамм. Специалисты рекомендуют новичкам начинать прием с 1-2 грамм в сутки. Постепенно увеличивая норму.
3. Дозировку разделяйте на 3 раза. Принимайте утром, в обед и вечером.
4. Капсулы или порошок нужно пить после сна, перед приемом пищи и на ночь. Запивать стаканом воды или смешивать с гейнерами, белковыми добавки и другим спортпитом.
5. Перед приемом рекомендовано посоветоваться со специалистом.
Влияние аспарагиновой кислоты на уровень тестостерона
Тестостерон является половым гормоном, преобладающим в мужском организме. Воздействует на сексуальное влечение, силу и выносливость. Аспарагиновая кислота способствует увеличению тестостерона и лютеинизирующего гормона. Улучшает способность организма восстанавливать поврежденные мышечные ткани. Нормальный уровень тестостерона влияет на синтез протеина. Наращивает чистую мышечную массу. Борется с жировыми отложениями. Организм начинает расходовать жиры, преобразовывая в энергию. Подавляет выработку картизола, провоцирующего разрушение мышечных волокон, накопление жиров в области живота и боков. Необходимо поддерживать уровень тестостерона в норме. Чтобы избежать негативных последствий для организма.
Первыми признаками низкого тестостерона являются:
1. Слабые кости.
2. Частое выпадение волос.
3. Слабая эрекция или ее отсутствие.
4. Скопление жира в области груди, живота, боков и бедер.
5. Отсутствие сексуального влечения.
6. Вялость.
Показания и противопоказания к приему аспарагиновой кислоты
Показания:
1. Низкий уровень тестостерона.
2. Слабое либидо.
3. Расстройства центральной нервной системы.
4. В качестве профилактики сердечно-сосудистых заболеваний.
5. Гормональный дисбаланс.
6. Эректальная дисфункция.
7. Перенесенные травмы и операции.
8. Нарушения работы печени.
9. Когнитивные расстройства.
10. Возрастные изменения.
11. Дефицит калия и магния.
12. Хронические заболевания сердца.
Противопоказания:
1. Индивидуальная непереносимость компонентов.
2. Печеночная недостаточность.
3. Гиперклимия.
4. Черепно-мозговые травмы.
5. Нарушения кровообращения.
6. Отек легких.
7. Беременность.
8. Кормление грудью.
Спортивная медицина — BCAA | Обследование и лечение в Германии
Что такое BCAA?
Аббревиатура BCAA образовалась от английского словосочетания Branched Chain Amino Acids.
В переводе на русский сокращение BCAA означает – аминокислоты с разветвлёнными боковыми цепями. К ним относятся аминокислоты валин, лейцин и изолейцин. По своей химической структуре они напоминают цепочку и взаимодополняют друг друга. Для человеческого организма BCAA представляет собой важный источник энергии. Они способствуют
- наращиванию мышечной массы
- укреплению имунной системы
- повышению уровня энергии и работоспособности
- улучшению функций головного мозга
- предотвращению потери мышечной массы — также в пожилом возрасте
Аминокислоты являются основой протеинов (белков). В настоящее время известно более 20 протеиногенных аминокислот, большинство из которых организм человека синтезирует сам, однако далеко не все. Так называемые незаменимые аминокислоты поступают в организм только через питание. К таким аминокислотам относятся изолейцин, лейцин и валин. Они содержатся в богатых протеинами продуктах питания животного и растительного происхождения, например в зародышах пшеничного зерна, куриных яйцах, сырой красной рыбе, тунце, говяжьем филе, нуте, грецких орехах и нешлифованном рисе.
BCAA накапливается в мышцах и играет важную роль при метаболизме. Высокая концентрация аминокислот содержится в миокарде и мышцах скелета. При больших физических нагрузках, после операций, травм или ожогов организм теряет много протеинов. Аминокислоты с разветвлёнными цепями уменьшают потерю протеина и стимулируют его синтез и накопление в организме.
В чём особенность BCAA?
Когда мы потребляем белковую пищу, организм расщепляет белок на аминокислоты, которые затем попадают в кровь. Незаменимые аминокислоты очень важны для правильного функционирования мышц и клеток. Изолейцин, лейцин и валин не распадаются и не усваиваются как другие аминокислоты в печени, а попадают через кровь напрямую в мышцы. BCAA становятся сразу же доступными для мышечных клеток в качестве источника энергии.
Изолейцин поставляет энергию в клетки мышц. Недостаток изолейцина ведет к потере мышечной массы. Мышечная слабость, вялость, истощение и усталость являются типичными признаками его дефицита. Лейцин необходим для наращивания и сохранения мышечных тканей, а также способствует повышению выносливости. Помимо этого он поддерживает постоянный уровень сахара в крови и предотвращает потерю мышечной мыссы. Валин действует вместе с лейцином и изолейцином и имеет аналогичные свойства. Кроме этого он стимулирует секрецию инсулина. Недостаток валина может привести к остановке роста.
Где находят применение BCAA?
Аминокислоты с разветвлёнными цепями (BCAA) оказывают положительное воздействие на наш организм. Они ускоряют синтез протеинов, способствуют расщеплению жира, препятствуют потере мышечной массы – даже у людей в возрасте – и улучшают работу головного мозга.
BCAA применяются в интенсивной медицине и в качестве биологически активных пищевых добавок в силовых видах спорта и видах спорта на выносливость. Вопрос о применении BCAA в гериатрии – области медицины, занимающейся изучением заболеваний людей пожилого и старческого возраста – в настоящий момент активно дискутируется. При большой физической нагрузке, онкологических заболеваниях, болезнях печени, а также во время соблюдения диеты с низким содержанием углеводов организм теряет много аминокислот. Изолейцин, лейцин и валин в определённой степени компенсируют эту потерю. Помимо этого они помогают синтезу и накоплению протеинов в организме. BCAA используются:
- в спорте
- при нервном напряжении и стрессе
- в качестве вспомогательного лечения при циррозе печени
- для того чтобы отодвинуть момент наступления усталости
- для повышения работоспособности
- для сокращения времени регенерации
- для предотвращения потери мышечной массы
Применение BCAA в спорте и при силовых и аэробных нагрузках
При сильных физических нагрузках, например, беге на длинные дистанции, езде на велосипеде или силовых тренировках аминокислоты лейцин, изолейцин и валин играют важную роль. Они преобразуются в глюкозу и обеспечивают организм энергией. Спортсмены-профессионалы имеют повышенную потребность в лейцине, валине и изолейцине. Аминокислоты с разветвлёнными боковыми цепями (BCAA) обязательно должны присутсвовать в их в рационе питания. Суточная потребность в незаменимых кислотах у здорового взрослого человека составляет 10-15 грамм и зависит от роста, пола, веса и интенсивности физической активности.
BCAA, как правило, принимается в форме порошка или капсул. Профессиональные спортсмены, специализирующиеся на видах спорта, развивающих выносливость, спортсмены-гиревики, а также тяжелоатлеты благодаря приёму BCAA ускоряют процессы наращивания мышечной массы и пополнения энергетических запасов. BCAA замедляет процесс распад протеинов, в результате чего даже при большой физической нагрузке в распоряжении организма находится достаточно энергии. Физическая усталость оттягивается, ментальная усталость наступает позже. Спортсмены достигают более высоких результатов. Врач, специализирующиеся на спортивной медицине проконсультирует Вас по поводу достоинств и недостатков приёма BCAA и обсудит с Вами уже имеющиеся результаты научных исследований.
Аминокислоты с разветвлёнными боковыми цепями (BCAA) не следует принимать отдельно друг от друга. Если лейцин принимать изолированно от двух других незаменимых аминокислот, наращивание мышечной массы на какое-то время может быть приостановлено.
Применение BCAA в интенсивной медицине
BCAA играют немаловажную роль в медицинской сфере. Их свойства находят применение при поражении или разрушении мышечных тканей. Лейцин, изолейцин и валин способствуют более быстрому после оперативному заживлению, ускоряют процессы восстановления организма.
При различных заболеваниях печени BCAA вводится посредством инъекций или инфузий. Эта мера приводит к улучшению состояния здоровья пациентов с циррозом печени и останавливает процесс разрушения самого органа.
При острых и хроническох заболеваниях печени часто бывает нарушена функция детоксикации, что в свою очередь может негативно сказаться на функциях головного мозга. Поэтому BCAA часто применяют при печёночной энцефалопатии. Термин «энцефалопатия» берёт своё название из греческого и означает «вызванное печенью заболевание головного мозга».
Изолейцин, лейцин и валин также используются при определённых заболеваниях почек и некоторых заболеваниях нервной системы (боковой амиотрофический склероз, болезнь Хантингтона).
BCAA в гериатрии
Использование BCAA в гериатрии – разделе медицины, изучающем болезни людей пожилого и старческого возраста – может принести хорошие результаты. Потерю мышечной массы с возрастом можно остановить только за счет движения и целеноправленных тренировок. Для того, чтобы пациенты оставались как можно дольше подвижными, в настоящий момент активно обсуждается вопрос применения BCAA в гериатрии.
Есть ли побочные действия?
BCAA хорошо переносятся организмом. До настоящего момента нет каких-либо данных, указывающих на то, что дополнительный приём изолейцина, лейцина и валина может вызвать побочные эффекты. Несмотря на это приём BCAA следует обязательно обсудить с врачом, заниматься самоёлечением не рекомендуется.
Как правильно принимать аминокислоты
Аминокислоты — это строительный материал из которого состоят белки. Они играют важнейшую роль в нашем организме, из них образуются практически все элементы и ткани человеческого организма: сухожилия, волосы, кожа, связки. Однако, больше всего аминокислот используется для построения мышечной ткани, по-этому они являются важнейшей спортивной добавкой. Для нормального восстановления и роста мускулатуры в крови должна находиться необходимая концентрация аминокислот, по-этому важно правильно принимать их, во время, когда степень усвоения максимальная.
Аминокислоты условно делятся на три вида: заменимые, незаменимые и условнозаменимые. Заменимые могут поступать в организм как вместе с пищей, так и могут синтезироваться в самом организме. Незаменимые не вырабатываются в организме и по-этому должны поступать вместе с пищей. Условнозаменимые могут вырабатываться в организме при необходимости из незаменимых.
Рассмотрим подробнее функции каждой из аминокислот:
Незаменимые
- Валин – важнейший компонент роста тканей. Улучшает мышечную координацию, улучшает переносимость холода и жары.
- Лейцин – принимает участие в работе иммунной системы.
- Изолейцин – важнейший элемент мышечной ткани, может использоваться в качестве топлива.
- Фенилаланин – принимает участие в синтезе коллагена. Также участвует в синтезе норэпинерфина – вещества, которое передает сигналы от нервных клеток к головному мозгу.
- Лизин – способствует производству карнитина, тем-самым улучшая потребление кислорода.
- Метионин – участвует в процессах регенерации тканей почек и печени.
- Треонин — составляющий элемент коллагена, участвует в процессе очистки печени.
- Триптофан – принимает участие в выработке серотонина, управляет сном, аппетитом, болевым порогом, усталостью и т. д.
Полузаменимые
- Аргинин – принимает участие в детоксикации печени, необходим для роста мышц.
- Гистидин – влияет на синтез красных и белых кровяных телец, способствует мышечному росту.
- Тирозин – противостоит утомлению и стрессам, принимает участие в процессе синтеза гормонов щитовидной железы.
- Цистин – снимает воспаления и участвует в синтезе коллагена.
Заменимые
- Аланин – регулирует уровень сахара в крови, в стрессовых ситуациях может извлекаться организмом из мышц.
- Аспарагин – принимает участие в работе иммунной системы.
- Глютамин – используется организмом в качестве топлива, особенно при длительных нагрузках, укрепляет память и внимание.
- Глицин – принимает участие в производстве заменимых аминокислот, креатина. Дефицит глицина проявляется в упадке сил.
- Пролин – формирует соединительные ткани и может использоваться в качестве топлива при длительных нагрузках.
- Серин – необходим для функционирования нервной системы и выработки клеточной энергии.
- Цитруллин – участвует в разложении и выводе аммиака, как вторичного продукта белкового метаболизма.
- Таурин – регулирует работу нервной системы.
- Цистеин – принимает участие в росте волос и детоксикации организма.
- Орнитин – активирует процессы обмена веществ и способствует распаду жировой ткани.
Форма выпуска
Аминокислоты выпускаются в различной форме: в виде таблеток, порошка, капсул с порошком, капсул с раствором или просто в виде жидкости. Какую форму из них выбрать — большого значения не имеет, выбирайте исходя из удобства применения, цены и состава продукта.
По внутреннему содержанию наиболее распространены аминокислотные комплексы, которые содержат весь спектр заменимых и незаменимых аминокислот. Таких комплексов существует огромное множество и какой подойдет лучше для вашего организма можно определить методом проб и ошибок. Также стоит отметить BCAA, содержащие аминокислоты в свободной форме — изолейцин, лейцин и валин. BCAA лучше всего употреблять сразу после тренировки, когда потребность в них наиболее высока.
Также выпускаются и отдельные, например глютамин, которые используются для решения конкретных задач.
Как принимать?
Дневная норма — это сугубо индивидуальная величина, которая зависит от многих факторов, таких как количество белка принимаемого с пищей, количество потребляемого протеина(как добавка), интенсивность тренировочного процесса и т.д. Но, однозначно можно сказать, что наиболее распространено применение аминокислот в количестве — 10-30 грамм в день, разделенных на 3-4 приема. У каждого производителя свои дозировки и составы, по этому обращайте внимание на состав и рекомендации по приему, указанные производителем. С целью наилучших результатов и полного усвоения принимать их необходимо за 20-30 минут до еды, или в течении получаса после приема пищи. Кроме того, принимать аминокислоты следует перед тренировкой, через 10-15 минут после тренировки, а также непосредственно перед сном и утром после сна, перед завтраком.
Стоит отметить, что наиболее полезным будет применение BCAA сразу после физической нагрузки, во время, когда в организме открывается так-называемое «протеиновое окно». В этот период организм активно восстанавливается и наиболее интенсивно поставляет аминокислоты в травмированные после физической нагрузки мышцы.
Глутаминовая кислота | Химия онлайн
Глутаминовая кислота (глютаминовая кислота, глутамат) – заменимая аминокислота, в плазме крови вместе со своим амидом (глутамином) составляет около 1/3 всех свободных аминокислот.
Глутаминовая кислота входит в состав белков и ряда важных низкомолекулярных соединений. Она является составной частью фолиевой кислоты.
Название кислоты произошло от сырья, из которого она была впервые выделена – клейковина пшеницы.
Глутаминовая кислота — 2-аминопентандиовая или α-аминоглутаровая кислота.
Глутаминовая кислота (Глу, Glu, E) является одной из важнейших аминокислот растительных и животных белков, молекулярная формула — C5H9NO4.
Глутаминовая кислота впервые была выделена из эндосперма пшеницы в 1866 г. Ритгаузеном, а в 1890 г. синтезирована Вольфом.
Суточная потребность в глутаминовой кислоте выше, чем во всех других аминокислотах и составляет 16 грамм в сутки.
Физические свойства
Глутаминовая кислота представляет собой растворимые в воде кристаллы с температурой плавления 2020С. Это кристаллическая масса коричневого цвета со специфическим кислым вкусом и специфическим запахом.
Глутаминовая кислота растворяется в разбавленных кислотах, щелочах и горячей воде, трудно растворяется в холодной воде и концентрированной соляной кислоте, практически не растворима в этиловом спирте, эфире и ацетоне.
Биологическая роль
Глутаминовая кислота играет важную роль в обмене веществ.
В значительном количестве эта кислота и ее амид содержатся в белках.
Глутаминовая кислота стимулирует окислительно-восстановительные процессы в головном мозге. Глутамат и аспартат содержится в мозге в высоких концентрациях.
Глутаминовая кислота нормализует обмен веществ, изменяя функциональное состояние нервной и эндокринной систем.
Стимулирует передачу возбуждения в синапсах ЦНС, связывает и выводит аммиак.
Находясь в центре азотистого обмена, глутаминовая кислота тесно связана с углеводным, энергетическим, жировым, минеральным и другими видами обмена веществ живого организма.
Участвует в синтезе других аминокислот, АТФ, мочевины, способствует переносу и поддержанию необходимой концентрации K+ в мозге, повышает устойчивость организма к гипоксии, служит связующим звеном между обменом углеводов и нуклеиновых кислот, нормализует содержание показателей гликолиза в крови и тканях.
Глутаминовая кислота оказывает положительное влияние на дыхательную функцию крови, на транспорт кислорода и его использование в тканях.
Она регулирует липидный и холестериновый обмены.
Глутаминовая кислота играет важную роль не только в образовании вкусовых и ароматических свойств хлеба, но и оказывает влияние на деятельность основных представителей бродильной микрофлоры ржаных заквасок и теста – дрожжей и молочнокислых бактерий.
Обмен глутаминовой кислоты в организме
Свободная глутаминовая кислота содержится в различных органах и тканях в большом количестве по сравнению с другими аминокислотами.
Глутаминовая кислота участвует в пластическом обмене. Более 20% белкового азота представлено глутаминовой кислотой и ее амидом.
Она входит в состав фолиевой кислоты и глутатиона, участвует в обмене более 50% азота белковой молекулы.
При синтезе аспарагиновой кислоты, аланина, пролина, треонина, лизина и др. аминокислот используется не только азот глутамата, но и его углеродный скелет.
До 60% углерода глутаминовой кислоты может включаться в гликоген, 20-30% — в жирные кислоты.
Глутаминовая кислота и ее амид (глутамин) играют основную роль в обеспечении азотом метаболических превращений — синтеза заменимых аминокислот.
Участие глутаминовой кислоты в пластическом обмене тесно связано с ее детоксикационной функцией – она принимает на себя токсичный аммиак.
Участие глутаминовой кислоты в азотистом обмене может быть охарактеризовано как высокоактивная утилизация и обезвреживание аммиака.
Велика роль глутамата и глутамина в синтезе мочевины, так как оба ее азота могут быть поставлены этими соединениями.
Превращения глутаминовой кислоты регулируют состояние энергетического обмена митохондрий.
Влияние глутаминовой кислоты на обмен веществ
Глутаминовая кислота при введении ее в организм оказывает воздействие на процессы азотистого обмена. После инъекций глутамата натрия возрастает содержание аланина, глутамина, аспарагиновой кислоты в почках, мозгу, сердечной и скелетных мышцах.
Глутаминовая кислота обезвреживает аммиак, образующийся в организме в результате распада. Аммиак связывается с глутаминовой кислотой с образованием глутамина. Синтезированный в тканях глутамин поступает в кровь и переносится ее в печень, где используется для образования мочевины.
Обезвреживающее действие глутаминовой кислоты особенно выражено при повышенном содержании аммиака в крови тканях (при воздействии холода, перегреве, гипоксии, гипероксии, аммиачном отравлении).
Глутаминовая кислота способна связывать аммиак и стимулировать обмен веществ в печени, что дает возможность применять ее при печеночной недостаточности.
Глутаминовая кислота способна увеличивать синтез белка и РНК в печеночной ткани, стимулировать синтез белков и пептидов.
Глутаминовая кислота и ее амид играют существенную роль в синтезе белка:
— значительное содержание глутаминовой кислоты в белке;
— «сберегающий эффект» — предотвращение использования незаменимого азота для синтеза заменимых аминокислот;
— глутаминовая кислота легко превращается в заменимые аминокислоты, обеспечивает достаточный набор всех аминокислот, необходимых для биосинтеза белка.
Кроме анаболического действия глутаминовая кислота тесно связана с процессами метаболизма углеводов: до 60% углерода введеной глутаминовой кислоты обнаруживается в составе гликогена.
Глутаминовая кислота понижает уровень сахара в крови при гипергликемии.
Глутаминовая кислота препятствует накоплению в крови молочной и пировиноградной кислот, сохраняет на более высоком уровне содержание гликогена в печени и мышцах.
Под влиянием глутаминовой кислоты при гипоксии наблюдается нормализация содержания АТФ в клетках.
Углеродный скелет глутаминовой кислоты легко образует углеводы. Глутаминовая кислота не только сама включается в углеводные ресурсы тканей, но и значительно стимулирует окисление углеводов.
Наряду с метионином глутаминовая кислота способна предупреждать жировое перерождение печени, вызванное введением четыреххлористого углерода.
Глутаминовая кислота участвует в минеральном обмене, являясь регулятором обмена калия и связанного с ним метаболизма натрия
Из солей глутаминовой кислоты на распределение калия и натрия в крови и в тканях наибольшее влияние оказывает глутамат натрия. Он увеличивает содержание натрия в скелетных мышцах, сердце, почках, а также калия в сердце, печени и почках при одновременном снижении его уровня в плазме.
Глутаминовая кислота, легко и быстро проникая, через тканевые барьеры с большой скоростью подвергается окислению. Она оказывает воздействие на аминокислотный, белковый, углеводный, липидный обмены, на рапределение калия и натрия в организме.
Эффект воздействия глутаминовой кислоты более выражен при измененном состоянии организма, когда наблюдается дефицит самой кислоты или связанных с ней продуктов обмена веществ.
Влияние глутаминовой кислоты на энергетический обмен митохондрий
Введение глутамата стимулирует дыхание животных, улучшает дыхательную функцию крови, увеличивает напряжение кислорода в тканях.
В условиях кислородного голодания глутамат предотвращает уменьшение содержания гликогена и богатых энергией соединений в печени, мышцах, головном мозге и сердце животных и вызывает снижение уровня недоокисленных продуктов и молочной кислоты в крови и скелетных мышцах.
Влияние глутаминовой кислоты на функциональное состояние нейроэндокринной системы
Глутаминовая кислота может влиять на обмен веществ, функции органов и систем, не только включаясь в тканевые обменные процессы, но и через изменение функционального состояния нервной и эндокринной систем.
Участие нервной системы в механизме действия глутаминовой кислоты определяется особой ролью аминокислоты в обмене веществ головного мозга, так как именно в нервной ткани она наиболее широко вовлекается в разнообразные процессы.
В энергетическом обмене нервной системы глутаминовая кислота занимает центральное место, т.к. не только способна окисляться в мозге наравне с глюкозой, но также и введенная глюкоза в значительной мере превращается в глутаминовую кислоту и ее метаболиты.
Концентрация глутаминовой кислоты в мозге в 80 раз превышает ее концетрацию в крови. В функционально активных участках мозга по сравнению с другими концентрация глутаминовой кислоты в 3 раза больше.
Из всех отделов мозга наибольшее количество глутаминовой кислоты приходится на область двигательного анализатора. Так, уже через несколько минут после перорального или внутреннего введения глутаминовая кислота обнаруживается во всех отделах мозга и гипофизе.
Функцию центрального метаболита глутаминовая кислота выполняет не только в мозге, но и в переферических нервах.
Важное значение глутаминовой кислоты в деятельности нервной системы связано с ее способностью обезвреживать аммиак и образовывать глутамин.
Глутаминовая кислота способна увеличивать артериальное давление, повышать уровень сахара в крови, обеспечивать мобилизацию гликогена в печени и выводить больных из состояния гипогликемической комы.
При длительном приеме глутаминовая кислота стимулирует функции щитовидной железы, что проявляется на фоне дефицита йода и белка в питании.
Подобно нервной системе мышцы относятся к возбудимой ткани с большими нагрузками и резкими переходами от покоя к активности. Глутаминовая кислота увеличивает сократительную способность миокарда, матки. В связи с этим, глутаминовая кислота применяется как биостимулятор при слабости родовой деятельности.
Природные источники
Сыр пармезан, яйца, зеленый горошек, мясо (цыпленок, утка, говядина, свинина), рыба (форель, треска), томаты, свекла, морковь, лук, шпинат, кукуруза.
Области применения
Глутаминовая кислота и глутамин применяются в качестве кормовых и пищевых добавок, приправ, сырья для фармацевтической и парфюмерной промышленности.
В пищевой промышленности глутаминовая кислота и ее соли находят широкое применение в качестве вкусовой приправы, придающей продуктам и концентратам «мясной» запах и вкус, а также как источник легко усвояемого азота.
Мононатриевая соль глутаминовой кислоты – глутамат натрия – один из важнейших носителей вкусовых качеств, применяемых в пищевой промышленности.
В условиях стрессового энергетического дефицита показано дополнительное введение в организм глутаминовой кислоты, так как это нормализует азотистый обмен в организме и мобилизует все органы, ткани и организм в целом.
Применение глутаминовой кислоты как пищевой добавки
Еще с начала XX века на Востоке глутаминовая кислота используется как вкусовая добавка к пище и источника легко усвояемого азота. В Японии глутамат натрия – обязательная принадлежность стола.
Широкая популярность глутаминовой кислоты как пищевой добавки связана с ее способностью улучшать вкус продуктов. Глутамат натрия улучшает вкус мясной, рыбной или овощной пищи и восстанавливает ее натуральные вкусовые качества («глутаминовый эффект»).
Глутамат натрия усиливает вкус многих пищевых продуктов, а также способствует длительному сохранению вкусовых качеств консервированных продуктов. Это свойство позволяет его широко используют в консервной промышленности, особенно при консервировании овощей, рыбы, мясных продуктов.
Во многих зарубежных странах глутамат натрия добавляют практически во все продукты при консервировании, замораживании или просто при хранении. В Японии, СЩА и других странах глутамат натрия является такой же обязательной принадлежностью стола, как соль, перец, горчица и другие приправы.
Он повышает не только вкусовую ценность пищевых продуктов, но и стимулирует деятельность пищеварительных желез.
Глутамат натрия рекомендуется добавлять в продукты со слабовыраженным вкусом и ароматом: макароннеы изделия, соусы, мясные и рыбные блюда. Так, слабый мясной бульон после добавления в него 1,5-2.0 г глутамата натрия на порцию приобретает вкус крепкого бульона.
Глутамат натрия значительно улучшает также вкус отварной рыбы и рыбных бульонов.
Картофельное пюре становится ароматнее и вкуснее при добавлении в него глутамата натрия в количестве 3-4 г на 1 кг продукта.
При добавлении в офощные изделия глутамат натрия не придает им какого-либо нового вкуса, запаха или цвета, но зато резко усиливает собственный вкус и аромат продуктов, из которых приготавливают блюда, что отличает его от обычных приправ.
С фруктами, некоторыми молочными и зерновыми продуктами, а также очень жирными продуктами глутамат натрия не гармонирует.
В кислой среде действие глутамата натрия на вкус продуктов снижается, т.е. в кислые продукты или кулинарные изделия его необходимо прибавлять больше.
Применение глутаминовой кислоты как кормовой добавки сельскохозяйственных животных
Некоторые заменимые аминокислоты становятся незаменимыми, если они не поступают с пищей, а клетки не справляются с их быстрым синтезом.
Использование глутаминовой кислоты как кормовой добавки особенно эффективно на фоне малобелковой диеты и у растущих организмов, когда потребность в источниках азота возрастает. Под действием глутаминовой кислоты компенсируется дефицит азота.
По эффекту обогащения пищи белковым азотом к глутаминовой кислоте близок ее амид – глутамин.
Эффективность глутаминовой кислоты зависит от ее дозировки. Применение больших количеств глутаминовой кислоты оказывает токсическое действие на организм.
Применение глутаминовой кислоты в медицине
Глутамитновую кислоту широко используют в медицине.
Глутаминовая кислота способствует снижению содержания аммиака в крови и тканях при различных заболеваниях. Она стимулирует окислительные процессы при гипоксических состояниях, поэтому успешно применяют при сердечнососудистой и легочной недостаточности, недостаточности мозгового кровообращения и как профилактическое средство асфиксии плода при патологических родах.
Также глутаминовую кислоту используют при болезни Боткина, печеночной коме, циррозе печени.
В клинической практике применение этой кислоты вызывает улучшение состояния больных при инсулиновой гипокгликемии, судорогах, астенических состояниях.
В детской практике глутаминовую кислоту применяют при задержке психического развития, церебральных параличах, болезни Дауна, полиолимите.
Важной особенностью глутаминовой кислоты является ее защитное действие при различных отравлениях печени и почек, усиление фармакологического действия одних и ослабление токсичности других лекарственных средств.
Антитоксическое действие глутаминовой кислоты обнаружено при отравлении метиловым спиртом, сероуглеродом, окисью углерода, гидразином, четыреххлористым углеродом, нефтегазами, хлористым марганцем, фторидом натрия.
Глутаминовая кислота оказывает влияние на состояние нервных процессов, в связи с этим она широко применяется при лечении эпилепсии, психозов, при истощении, депрессии, олигофрении, черепно-мозговых травм новорожденных, нарушениях мозгового кровообращения, туберкулезном менингите, параличах, а также при заболеваниях мышц.
Глутамат повышает работоспособность и улучшает биохимические показатели при интенсивной мышечной работе и утомлении.
Глутаминовая кислота может быть использована при патологии щитовидной железы, в частности, при эндемическом зобе.
Глутаминовая кислота используется в сочетании с глицином для больных с прогрессирующей мышечной дистрофией, миопатией.
Глутаминовая кислота используется при лечении пневмоний у детей раннего возраста.
Глутаминовая кислота противопоказана при лихорадочных состояниях, повышенной возбудимости и бурно протекающих психотических реакциях.
Аминокислоты
Классификация аминокислот
Препарат для парентерального питания — раствор аминокислот список препаратов клинико-фармакологической группы в справочнике лекарственных средств Видаль
Клинико-фармакологическая группа
Препараты группы
Аминовен Инфант | Р-р д/инф. 6%: фл. 100 мл или 250 мл 10 шт. с держателями пластиковыми или без них рег. №: П N013844/01 Р-р д/инф. 10%: фл. 100 мл или 250 мл 10 шт. с держателями пластиковыми рег. №: П N013844/01 | |||
Аминосол-Нео | Р-р д/инф. 10%: фл. 500 мл в компл. с держателем рег. №: ЛС-001691 Р-р д/инф. 15%: фл. 500 мл в компл. с держателем рег. №: ЛС-001691 | |||
Хаймикс® | Раствор для инфузий рег. №: Р N002762/01 |
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
КЕТОСТЕРИЛ инструкция по применению, цена в аптеках Украины, аналоги, состав, показания | KETOSTERIL таблетки, покрытые пленочной оболочкой компании «Fresenius Kabi Deutschland GmbH»
фармакодинамика. Кетостерил — комбинированный препарат для лечения почечной недостаточности, содержащий кетоновые аналоги аминокислот. Улучшает азотистый обмен, способствует анаболизму протеинов, уменьшает выраженность уремической симптоматики, улучшает состояние пациентов с хроническим заболеванием почек.
После абсорбции кетоаналоги трансаминируются в соответствующие незаменимые L-аминокислоты путем поглощения азота из незаменимых аминокислот, тем самым уменьшая образование мочевины путем повторного использования аминогруппы, способствует утилизации азотосодержащих продуктов обмена.
Кетостерил в сочетании с низкобелковой диетой позволяет снизить потребление азота, одновременно предотвращая негативные последствия недостаточного употребления диетического белка и недостаточного питания и обеспечивает организм необходимыми L-аминокислотами при минимальном введении азота. Кетоновые аналоги незаменимых аминокислот, входящих в состав препарата, дают полноценное субстратное обеспечение белкового синтеза.
Кето-/аминокислоты не вызывают гиперфильтрацию остаточных нефронов. Кетостерил улучшает азотистый обмен, снижает концентрацию в крови ионов калия, магния и фосфора, что оказывает положительное влияние при почечной гиперфосфатемии и вторичном гиперпаратиреозе.
При систематическом применении кетостерила отмечено улучшение состояния пациентов с хронической почечной недостаточностью. В отдельных случаях применение кетостерила способствует самому позднему началу проведения диализа.
Фармакокинетика. Плазменная кинетика аминокислот и их интеграция в метаболические пути хорошо известны. У больных с уремией причиной изменения уровней аминокислот в плазме крови, которые часто отмечаются, не является поглощение аминокислот, которые поставляются, то есть процесс поглощения не нарушается. Изменение уровней аминокислот в плазме крови, связанных с нарушением кинетики после поглощения, могут быть выявлены на очень ранней стадии заболевания.
У здоровых лиц уровень кетокислот в плазме крови повышается в течение 10 мин после перорального приема. Достигается максимум 5-кратное повышение базовых уровней. Пиковые уровни отмечают в течение 20–60 мин, а после 90 мин уровни стабилизируются в диапазоне базовых уровней. Таким образом, желудочно-кишечная абсорбция является очень быстрой. Одновременное повышение уровня кетокислот и соответствующих аминокислот свидетельствует, что кетокислоты трансаминируются очень быстро. В связи с физиологическими путями утилизации кетокислот в организме вероятно, что экзогенные кетокислоты очень быстро интегрируются в метаболические циклы. Кетокислоты проходят те же катаболические пути, что и классические аминокислоты. Никаких специальных исследований выведения кетокислоты пока не проводили.
профилактика и лечение нарушений, вызванных изменением метаболизма при повреждении или дефиците белка при хронической почечной недостаточности. Назначают в сочетании с ограниченным употреблением белка с пищей: 40 г белка в сутки (для взрослых) и менее. Применять у пациентов, у которых скорость клубочковой фильтрации <25 мл/мин.
препарат применять внутрь. Если не назначено иначе, Кетостерил принимают из расчета 1 таблетка на 5 кг массы тела в сутки (0,1 г/кг массы тела в сутки), или 4–8 таблеток (доза рассчитана на пациента с массой тела 70 кг) 3 раза в сутки, во время еды.
Таблетки глотать не разжевывая. Кетостерил назначают одновременно с малобелковой диетой (ограничением белка в рационе) 40 г/сут и меньше.
Дети. Опыт применения у детей отсутствует, поэтому препарат не рекомендуется назначать этой категории пациентов.
повышенная чувствительность к компонентам препарата; гиперкальциемия; нарушения обмена аминокислот.
частота побочных эффектов оценивается следующим образом: очень часто (≥1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10 000 , <1/1000), очень редко (<1/10 000).
Метаболические нарушения: очень редко — гиперкальциемия.
При возникновении гиперкальциемии дозу витамина D следует снизить. Если гиперкальциемия сохраняется, необходимо уменьшить дозу препарата Кетостерил, как и другие источники кальция.
У лиц с повышенной чувствительностью возможно развитие аллергических реакций.
необходимо регулярно контролировать уровень кальция в плазме крови.
Кетостерил следует принимать во время еды для его лучшего всасывания и превращения в соответствующие аминокислоты. Следует обеспечить достаточную калорийность пищи около 30–40 ккал/кг/сут.
При наследственной фенилкетонурии следует учитывать, что препарат содержит фенилаланин.
По степени уменьшения уремических симптомов под влиянием прапарата Кетостерил дозу одновременно назначенного гидроксида алюминия следует соответственно снизить. Необходимо наблюдать за снижением уровня фосфатов в плазме крови.
Применение в период беременности и кормления грудью. Недостаточно опыта применения препарата Кетостерил в период беременности и кормления грудью. Исследования репродуктивной токсичности не указывают на прямое или косвенное негативное влияние на беременность, развитие плода, роды или послеродовой период. При беременности применять с осторожностью.
Способность влиять на скорость реакции при управлении транспортными средствами или другими механизмами. Не влияет.
одновременное назначение лекарственных средств, содержащих кальций, может привести к повышению уровня кальция в плазме крови.
Лекарственные средства, которые формируют с кальцием труднорастворимые соединения, например тетрациклин, хинолины, такие как ципрофлоксацин и норфлоксацин, а также лекарственные средства, содержащие железо, фтор или эстрамустин, не следует принимать одновременно с Кетостерилом во избежание нарушения всасывания активных веществ, поэтому между приемом Кетостерила и этих препаратов должно пройти не менее 2 ч.
Восприимчивость к кардиоактивным гликозидам и, соответственно, риск аритмии повышаются, если Кетостерил вызывает повышение уровня кальция в плазме крови. Во время лечения Кетостерилом выраженность симптомов уремии уменьшается. Поэтому необходимо также уменьшить возможное введение гидроксида алюминия. Необходимо контролировать снижение уровня фосфата в плазме крови.
о случаях передозировки не сообщалось.
в оригинальной упаковке для защиты от влаги при температуре не выше 25 °C.
Дата добавления: 08.07.2020 г.
Общие сведения об аминокислотах
Общие сведения об аминокислотах
Обзор
Аминокислоты — это химические единицы или «строительные блоки», из которых состоят белки. Они также являются конечными продуктами переваривания белков или гидролиза. Аминокислоты содержат около 16 процентов азота. Химически это то, что отличает их от двух других основных питательных веществ, сахаров и жирных кислот, которые не содержат азота.
Чтобы понять, насколько жизненно важны аминокислоты, вы должны понимать, насколько важны белки для жизни.Это белок, который обеспечивает структуру всего живого. Каждый живой организм, от самого крупного животного до мельчайшего микроба, состоит из белка. В различных формах белок участвует в жизненно важных химических процессах, поддерживающих жизнь.
Люди часто не осознают свою потребность в аминокислотах, потому что не осознают, насколько загружен человеческий организм.
• Каждую секунду костный мозг производит 2,5 миллиона эритроцитов.
• Каждые четыре дня происходит замена большей части слизистой оболочки желудочно-кишечного тракта и тромбоцитов.
• Большая часть белых клеток заменяется за десять дней.
• Человек имеет эквивалент новой кожи за двадцать четыре дня и костного коллагена через тридцать лет.
Для всех этих постоянных ремонтных работ требуются аминокислоты.
Есть ли у вас дефицит аминокислот или проблемы с перевариванием аминокислот?
Обратитесь в клинику ISM, чтобы получить консультацию по вопросам здоровья и разработать индивидуальную программу оздоровления.
Белки — необходимая часть каждой живой клетки тела. Наряду с водой, белок составляет большую часть веса нашего тела.
- В организме человека белковые вещества составляют мышцы, связки, сухожилия, органы, железы, ногти, волосы и многие жизненно важные жидкости организма и необходимы для роста костей.
- Ферменты и гормоны, которые катализируют и регулируют все процессы в организме, являются белками.
- Белки помогают регулировать водный баланс организма и поддерживать надлежащий внутренний pH. Они способствуют обмену питательных веществ между межклеточными жидкостями и тканями, кровью и лимфой.Дефицит белка может нарушить водный баланс организма, вызывая отек.
- Белки составляют структурную основу хромосом, через которую генетическая информация передается от родителей к потомству. Генетический «код», содержащийся в ДНК каждой клетки, на самом деле является информацией о том, как производить белки этой клетки.
После переваривания белка в желудке аминокислоты попадают в кровь. Попадая в кровь, аминокислоты переносятся как эритроцитами, так и жидкой частью крови, называемой плазмой.Таким образом, аминокислоты распределяются по всем тканям организма, где различные клетки тела берут то, что им нужно для восстановления и преобразования белковых структур, в которых они нуждаются.
В крови постоянно содержатся аминокислоты. Пост не очищает их, а диета с высоким содержанием белка не увеличивает их существенно. Организм постоянно нуждается в белках и аминокислотах, и он поддерживает довольно однородный баланс.
(a) Аминокислоты как белковый субстрат
Белки представляют собой цепочки аминокислот, связанных вместе так называемыми пептидными связями.Каждый отдельный тип белка состоит из определенной группы аминокислот в определенном химическом расположении. Именно особые аминокислоты и способ их последовательного соединения придают белкам, из которых состоят различные ткани, их уникальные функции и свойства. Каждый белок в организме адаптирован для определенных нужд; белки не взаимозаменяемы.
Белки, входящие в состав человеческого тела, не получают напрямую с пищей. Скорее, диетический белок расщепляется на составляющие его аминокислоты, которые затем организм использует для создания необходимых ему белков.Таким образом, незаменимыми питательными веществами являются аминокислоты, а не белок.
(b) Аминокислоты в метаболизме организма
Существуют и другие аминокислоты, которые важны для метаболических функций.
- Некоторые из них, такие как цитрулин, глутатион, орнитин и таурин, могут быть подобны (или побочными продуктами) аминокислотам, строящим белок.
- Некоторые действуют как нейротрансмиттеры или как предшественники нейротрансмиттеров, химических веществ, передающих информацию от одной нервной клетки к другой.Таким образом, мозгу необходимы определенные аминокислоты для получения и отправки сообщений.
- Аминокислоты также позволяют витаминам и минералам правильно выполнять свою работу. Даже если витамины и минералы усваиваются и усваиваются организмом, они не могут быть эффективными, если не присутствуют необходимые аминокислоты. Например, низкий уровень аминокислоты тирозина может привести к дефициту железа.
Как мы классифицируем аминокислоты?
Существует приблизительно двадцать восемь общеизвестных аминокислот, которые комбинируются различными способами, чтобы создать тысячи различных типов белков, присутствующих во всех живых существах.В организме человека печень производит около 80 процентов необходимых аминокислот. Остальные 20 процентов должны быть получены из рациона. Их называют незаменимыми аминокислотами. Незаменимые аминокислоты, которые должны поступать в организм с пищей:
- гистидин
- изолейцин
- лейцин
- лизин
- метионин
- фенилаланин
- треонин
- триптофан
- валин
Заменимые аминокислоты, которые могут быть произведены в организме из других аминокислот, полученных из пищевых источников, включают:
- аланин
- глутамин
- аспарагин
- глицин
- цитруллин
- орнитин
- цистеин
- пролин
- цистин
- серин
- гамма-аминомасляная кислота
- таурин
- глутаминовая кислота
- тирозин
Тот факт, что они названы «несущественными», не означает, что они не нужны, только то, что они не обязательно должны поступать с пищей, потому что организм может производить их по мере необходимости.А заменимые аминокислоты могут стать «незаменимыми» при определенных условиях. Например, заменимые аминокислоты цистеин и тирозин производятся из незаменимых аминокислот метионина и фенилаланина. Если метионин и фенилаланин недоступны в достаточных количествах, цистеин и тирозин становятся незаменимыми в рационе.
Процесс сборки аминокислот / белков
Процессы сборки аминокислот для производства белков и расщепления белков на отдельные аминокислоты для использования организмом являются непрерывными.Когда нам нужно больше ферментных белков, организм производит больше ферментных белков; когда нам нужно больше клеток, организм производит больше белков для клеток. Эти разные типы белков производятся по мере необходимости. Если в организме истощатся запасы какой-либо из незаменимых аминокислот, он не сможет производить белки, которым требуются эти аминокислоты. Недостаточное количество даже одной незаменимой аминокислоты может препятствовать синтезу и снижению уровня необходимых белков в организме. Кроме того, все незаменимые аминокислоты должны присутствовать в рационе одновременно, чтобы другие аминокислоты использовались.
Как могла возникнуть такая ситуация? Проще, чем вы думаете. Многие факторы могут способствовать дефициту незаменимых аминокислот, даже если вы придерживаетесь хорошо сбалансированной диеты, содержащей достаточно белка. Нарушение всасывания, инфекции, травмы, стресс, употребление наркотиков, возраст и дисбаланс других питательных веществ — все это может повлиять на доступность незаменимых аминокислот в организме. Недостаточное потребление витаминов и минералов, особенно витамина С, может нарушить абсорбцию аминокислот в нижней части тонкого кишечника.Витамин B6 также необходим для транспорта аминокислот в организме.
Если ваша диета не сбалансирована должным образом, то есть если она рано или поздно не обеспечивает достаточного количества незаменимых аминокислот, это станет очевидным как физическое расстройство. Однако это не означает, что диета, содержащая огромное количество белка, является ответом. На самом деле это вредно для здоровья. Избыток белка создает чрезмерную нагрузку на почки и печень, которым приходится перерабатывать продукты жизнедеятельности белкового обмена.Почти половина аминокислот в пищевом белке превращается печенью в глюкозу и используется для обеспечения клеток необходимой энергией. В результате этого процесса образуются отходы — аммиак. Аммиак токсичен для организма, поэтому организм защищает себя, заставляя печень превращать аммиак в гораздо менее токсичное соединение, мочевину, которая затем переносится с кровотоком, отфильтровывается почками и выводится из организма.
Amino Acid Blood Level — обзор
Amino Acids (AA)
Молекулярная масса белков колеблется в пределах 55–220 кДа, что намного выше порогового значения для стандартных мембран CRRT; в то время как AA составляет всего 110 Да (75–204 Да).Потеря АК во время ПЗПТ в основном изучалась в контексте общего парентерального питания (ПП). Соответствующие результаты обобщены в Таблице 37.2A, B.
ТАБЛИЦА 37.2A. Резюме исследований аминокислотного баланса в CRRT
| Исследование | Давенпорт 1989 [59] | Дэвис 1991 [53] | Франкенфилд 1993 [50] | Кихара 1997 [57] |
|---|---|---|---|---|
| Пациенты | (n = 8) | (n = 6) | (n = 19) | (n = 6) |
| NUTRITION | TPN | TPN | TPN | |
| Потребление белка / AA | 0.7 г / кг / день ∗ | 0,7–1,4 г // кг / день ∗ | 2,2 г / кг / день | 0,5 г / кг / день ∗ |
| CRRT | CVVH | CAVHDF | CAVHDF / CVVHDF | Медленное HD ‡ × 10 ч |
| Bld AA уровни | Большинство в пределах нормального диапазона, но Gln / Gla низкий | 12 из 19 уровней AA низкий, например Ser, Gln, Tau, Try, Iso | Все равны или выше, чем в контроле † , кроме Tau | Ser, Asg ниже нормы |
| Клиренс АК (мл / мин) | — | 3-метил-His (33.7) Gly (27,6) | — | Cys (36,5) Leu (25,4) |
| потери АК (г) | 3,8–7,4 г / день (максимальное: Ala, Pro, Gln / Gla) | — | 10–16 г / день по сравнению с 5 г / день в контроле † (Gln 2 г / день) | 6,2 г (за сеанс) (максимальное: Gln / Gla, Ala) |
| Общие потери нитро (г) AA Потери нитро | — (0,6 г – 1,1 г / день) | — — | — — | 8.4 г / день ( ≈ 1,0 г / день) |
| % потери потеряно | до 11% суточного потребления нитро | до 12,1% суточного потребления белка Наивысшее для Тира , Lys, Val | 6–9% суточного потребления АК по сравнению с 3% в контроле ┼ | 16% суточного потребления АК |
ЗПТ: заместительная почечная терапия; AA: аминокислота; Нитро: азот; ОПП: острое повреждение почек; ПП: полное парентеральное питание; -: не сообщили; CVVH: непрерывная вено-венозная гемофильтрация; CAVHDF: непрерывная артериовенозная гемодиафильтрация; CVVHDF: непрерывная вено-венозная гемодиафильтрация; HD: гемодиализ; ч: час; CVVHD: непрерывный вено-венозный гемодиализ; HF: гемофильтрация; ХПН: терминальная стадия почечной недостаточности; EN: энтеральное питание; ПН: парентеральное питание; Gln: глутамин; Gla: глутаминовая кислота; Ала: аланин; Плюсы: пролин; Сер: серин; Cys: цистеин; Leu: лейцин; Арг: аргинин; Тау: таурин; Попробуйте: тирозин; Изо: изолейцин;
≈: приблизительно; Его: гистидин; Гли: глицин; Lys: лизин; Вал: валин; Phe: фенилаланин; Asg: аспарагин.
ТАБЛИЦА 37.2B. Резюме исследований аминокислотного баланса в CRRT
| Исследование | Novak 1997 [54] | Maxvold 2000 [55] | Bellomo 2002 [51] | Scheinkestel 2003 [52] |
|---|---|---|---|---|
| Пациенты 6 Пациенты | (n = 6) | (n = 6) (peds) | (n = 7) | (n = 11) |
| NUTRITION | TPN | TPN | TPN | TPN |
| Потребление белка / AA | 1.2 г / кг / день | 1,5 г / кг / день | 2,5 г / кг / день | с увеличением до 2,5 г / кг / день |
| CRRT | CVVHDF | CVVH / CVVHD | CVVHDF | CVVHD |
| Bld AA уровни | Наиболее низкие, чем обычно, например. Gln, Val, Leu, Iso, Tyr | — | Все более высокие или нормальные, кроме Asg, His, Tau | Уровни АК значительно выше при приеме 2,5 г / кг / день |
| Клиренс АК (мл / мин) | Сообщил только Gln (18.6) | HF: Cys (75,4), Arg (46,1) # HD: Cys (53,1), Gln (31,0) # | Tyr (45,5) Asg (24,4) | — |
| Потери AA (г) | — | 12,5 г (HF), 11,6 г (HD) (в день / 1,73 м 2 ) (Наивысший Gln, Lys, Pro) | 12 г / день (Наивысшие Ala, Val, Lys) | — |
| Общие потери нитро (г) AA Потери нитро | ≈ 27.4 г / день (0,6 г / день) | ≈ 22 г / день / 1,73 м 2 (≈ 2,0 г / день / 1,73 м 2 ) | 24,3 г / день — | — — |
| % потери потребления | 4,5% ежедневного потребления AA | 11–12% ежедневного потребления AA | 5–21% ежедневного потребления AA Наивысшая потеря% для Tyr | 17% от общего потребления АК (87% потеря Tyr) |
ЗПТ: заместительная почечная терапия; AA: аминокислота; Нитро: азот; ОПП: острое повреждение почек; ПП: полное парентеральное питание; -: не сообщили; CVVH: непрерывная вено-венозная гемофильтрация; CAVHDF: непрерывная артериовенозная гемодиафильтрация; CVVHDF: непрерывная вено-венозная гемодиафильтрация; HD: гемодиализ; ч: час; CVVHD: непрерывный вено-венозный гемодиализ; HF: гемофильтрация; ХПН: терминальная стадия почечной недостаточности; EN: энтеральное питание; ≈: приблизительно; Gln: глутамин; Gla: глутаминовая кислота; Ала: аланин; Плюсы: пролин; Сер: серин; Cys: цистеин; Leu: лейцин; Арг: аргинин; Тау: таурин; Попробуйте: тирозин; Изо: изолейцин;
His: гистидин; Гли: глицин; Lys: лизин; Вал: валин; Phe: фенилаланин; Asg: аспарагин; педиатры: педиатрия.
Уровни в крови
Уровни AA в крови, как правило, выше или нормальны по сравнению с референсным диапазоном или контролем у пациентов на ПЗПТ с потреблением белка более 2 г / кг / день [50–52], в то время как уровни ниже нормальный диапазон при меньшем потреблении белка [53,54]; значение которого неизвестно.
SC AA
Большинство отдельных AA имеют высокий SC около 1,0, такие как цистеин, аргинин, аланин и глутамин; кроме глутаминовой кислоты (0,25–0,5) [53,55]. Глутаминовая кислота имеет низкий изоэлектрический pH и предполагает отрицательный поверхностный заряд при физиологическом pH [56].Предполагается, что АК с таким же низким изоэлектрическим pH могут отталкиваться отрицательным поверхностным зарядом на большинстве синтетических мембран и, таким образом, уменьшать их SC [55], но эта тенденция не наблюдается последовательно.
Клиренс АК
Клиренс АК колеблется от 20–45 мл / мин у пациентов на ПЗПТ [51,53,54,57] по сравнению с примерно 200 мл / мин у пациентов, находящихся на периодическом гемодиализе [58]. Клиренс АК увеличивается с увеличением скорости потока диализата [53] и может быть на 30-40% выше при ХВГВ по сравнению с ХВПГ, и эта разница более очевидна для отдельных АА с более высоким клиренсом [55].Тем не менее, нет никакой последовательной тенденции в дифференциальном зазоре какого-либо конкретного AA.
Потери АК
Потребление белка более 1,5 г / кг / день связано с потерей АК примерно на 12 г / день [50,51,55], а потеря AA кажется меньше при более низком потреблении белка [57,59] . Потери АК составляют от 5% до 20% суточного потребления АК [50–55,57,59]. Важно отметить, что фракционная потеря АК (по отношению к потреблению) вместо этого снижается с увеличением потребления белка [52]. Индивидуальные уровни AA в крови хорошо коррелируют с соответствующими потерями при CRRT [50,52,57,59], и есть слабые доказательства того, что общая потеря AA незначительно выше при CVVH, чем CVVHDF, и с более высокой интенсивностью лечения [53,60].Кроме того, существует избирательность в индивидуальных потерях АК, при этом глутамин и аланин теряются в более высоких абсолютных количествах [51,55,57,59], а тирозин имеет самую высокую частичную потерю на прием [51-53]. Все три не являются незаменимыми АК при нормальном физиологическом состоянии.
Баланс азота
Общая потеря азота при ЗПЗП составляет около 25 г / день [51,54,55], из которых 10% приходится на потерю азота АК [54,55,57], а остальное, вероятно, связано с белком. катаболизм; и это приводит к отрицательному азотному балансу.Баланс азота у этих пациентов может быть улучшен за счет увеличения потребления белка, при этом наивысшие уровни АК в крови и баланс азота достигаются при потреблении белка 2,5 г / кг / день [51,52].
Аминокислоты — Milkproduction.com
Сбалансированный рацион по отдельным аминокислотам повышает эффективность корма.
Производство белка коровой ограничено конкретной аминокислотой, которая является кратчайшей по отношению к потребности коровы в образовании аминокислотных цепей.
Целью кормления дойных коров должно быть максимальное увеличение микробной продукции аминокислот, а затем дополнение микробного запаса дополнительными аминокислотами, которые, как ожидается, не будут подвергаться ферментации в рубце.Потребность в аминокислотах может быть выражена с использованием факторного метода или метода идеального белка.
Если мы сможем более точно прогнозировать потребности коров в питательных веществах и питательные вещества, поступающие из рационов, мы сможем снизить затраты на корма и уменьшить потери питательных веществ, одновременно способствуя максимальному производству молока. Белок состоит из аминокислот. Мы знаем, что коровам для производства требуется определенное количество отдельных аминокислот. Сбалансированный рацион по отдельным аминокислотам, а не по сырому протеину, поможет нам точно настроить рацион и повысить эффективность корма.
Белок — это цепь из 50 или более отдельных аминокислот. Есть 20 различных аминокислот. Химически каждая аминокислота содержит углерод, азот, кислород и водород в разных количествах и в разных местах. Некоторые аминокислоты также содержат серу. При лабораторном анализе сырого протеина измеряется содержание азота в кормах. Предполагается, что белок содержит 16% азота. Процент сырого протеина рассчитывается путем умножения процентного содержания азота в корме на коэффициент 6.25 (100/16).
Корова поглощает и использует отдельные аминокислоты, а не белок. У нее нет потребности в «белке», а скорее разные потребности в каждой из 10 незаменимых аминокислот, включая фенилаланин, валин, треонин, триптофан, изолейцин, метионин, гистидин, аргинин, лейцин и лизин. Термин «незаменимая» аминокислота относится к тем аминокислотам, которые корова не может продуцировать путем изменения химической конфигурации другой аминокислоты. Каждая незаменимая аминокислота должна поступать в кишечник с пищей или микробами рубца.Корове также необходимы «заменимые» аминокислоты, но она может производить их в достаточном количестве для удовлетворения своих потребностей.
Корова берет отдельные аминокислоты и объединяет их в цепочки с определенными последовательностями, чтобы получить белок в виде молока, теленка или мышц. Производство белка коровой ограничено конкретной аминокислотой, которая находится в кратчайшем запасе по отношению к ее потребности в образовании аминокислотных цепей. Эта аминокислота называется «первой ограничивающей» аминокислотой в рационе. «Первая ограничивающая» аминокислота любой диеты будет зависеть от аминокислотного профиля ингредиентов рациона.Для дойных коров это обычно лизин или метионин. Аргинин тоже вызывает беспокойство. Три различных аминокислоты с разветвленной цепью также могут стать ограничивающими (валин, изолейцин и лейцин).
Получение белка у коровы — это все равно что собрать большую головоломку, состоящую из множества разных частей, каждая из которых соединяется в определенном порядке. Если у коровы есть два одинаковых кусочка пазла, но отсутствует другой, как бы она ни старалась, она не сможет завершить головоломку. Если добавлен дополнительный метионин, но лизин на самом деле является «первой лимитирующей» аминокислотой, ответной реакции не будет.
Поставка аминокислот:
Микробы рубца, не деградированные диетические аминокислоты (из UIP или аминокислот, защищенных рубцом) и эндогенные аминокислоты (из отколовшихся клеток и секретов пищеварительного тракта) — все они вносят свой вклад в пул аминокислот, вытекающих из рубца и доступных для абсорбция в тонком кишечнике. На самом деле микробные аминокислоты рубца составляют около 50-75% от общего количества аминокислот. Эндогенные вклады минимальны.
Целью кормления дойных коров всегда должно быть максимальное производство аминокислот микробами, а затем добавление дополнительных аминокислот, которые, как ожидается, не будут подвергаться ферментации в рубце.Эта стратегия представляет собой экономичный источник аминокислот, а из-за роста микробной популяции повышается усвояемость крахмала и клетчатки, чтобы обеспечить большее количество летучих жирных кислот для получения энергии.
1. Микробные аминокислоты:
Аминокислотный профиль микробного белка очень похож на аминокислотный профиль молока. Это делает микробный белок «высококачественным» белком, аналогичным животным белкам, которые мы используем в кормах. Предсказать количество микробных аминокислот, продуцируемых в рубце, сложно.Количество микробных аминокислот, продуцируемых в рубце, зависит от наличия углеводов в рубце, синхронизации наличия углеводов и белков, доступного жира в рубце, pH рубца, скорости обновления содержимого рубца и типов микробов рубца.
NRC (2001) прогнозирует производство микробного белка на основе прогнозируемого количества переваренного органического вещества в рубце. Они используют уравнение, которое связывает выход микробного белка, определенный в прошлых исследованиях с использованием канюлированных в кишечник коров, с скорректированным содержанием TDN (без учета жира) в рационе, скармливаемом коровам в каждом из этих исследований (CP микробов (граммы) = 130 * Скорректированный TDN потребление (кг)).Если в рационе содержится ограниченное количество разложенного в жвачке кормового белка (DIP или RDP), прогнозируемое микробное производство белка ограничено. Когда потребление RDP меньше, чем в 1,18 раза превышает прогнозируемый выход микробного CP с поправкой на TDN, тогда микробный CP рассчитывается как 0,85-кратное потребление RDP. Затем количество микробных аминокислот можно предсказать на основании предполагаемого аминокислотного профиля микробного белка.
По-прежнему существуют проблемы с уравнениями NRC (2001) для прогнозирования микробного потока аминокислот.Уравнение NRC игнорирует тот факт, что количество RDP, необходимое микробам, зависит от количества энергии, доступной для использования микробами. Скорректированный TDN является особенно плохим предсказателем продукции микробных аминокислот при более высоком потреблении энергии. При таких диетах различия в наличии углеводов и белков в рубце больше. Кроме того, рационы, рассчитанные на высокую продуктивность, обычно содержат больше жира в рубце. Из-за более высокого уровня ферментируемых углеводов в высокопроизводительных диетах они приводят к более низкому pH рубца.Избыточный жир и низкий pH отрицательно влияют на рост микробов. Скорость обновления рубца увеличивается по мере увеличения потребления сухого вещества. По мере увеличения скорости обновления рубца эффективность роста микробов в рубце также увеличивается. Уравнения NRC (2001) неадекватно учитывают скорость обновления рубца. Такие продукты, как культура дрожжей и другие продукты ферментации, также могут усиливать рост микробов, и их необходимо учитывать в уравнениях прогнозирования.
Чтобы улучшить прогнозирование микробного поступления аминокислот, были разработаны компьютеризированные модели для математического описания и компиляции научных данных.Модель чистых углеводов / аминокислот (и модель CPM) была разработана в Корнельском университете, Университете Пенсильвании и в Горнодобывающем институте. Некоторые диетологи используют его на фермах. Эта модель классифицирует микробы как варочные ферменты, содержащие клетчатку, так и не содержащие клетчатки. Предполагается, что эти микробы будут расти и производить микробный белок по-разному в зависимости от прогнозируемого количества доступных углеводов, аминокислот и pH рубца. Обеспечение углеводов и аминокислот в рубце прогнозируется на основе скорости переваривания и скорости прохождения корма.Поскольку модель учитывает больше факторов, влияющих на рост микробов, она потенциально может работать лучше, чем уравнения NRC, при прогнозировании поступления микробных аминокислот.
Аминокислотный состав (%) тканей тела, молока и микробного истинного белка
Ткань | Молоко | Микробы | |
| Лизин | 8.2 | 8,3 | 10,46 |
Метионин | 2,7 | 2,7 | 2,68 |
Аргинин | 6,8 | 3,7 | 6,96 |
Валин | 5,2 | 6,7 | 6.16 |
| Изолейцин | 5,5 | 6,0 | 5,88 |
| лейцин | 7,2 | 10,0 | 7,51 |
Источник: Mantysaari, P.E., C.J. Sniffen и J.D. O’Connor. 1989
По оценкам исследователей, около 70% микробного белка состоит из аминокислот (истинный белок (Korhoren et al., 2002).Аминокислотный состав истинного микробного протеина довольно постоянен и не сильно меняется в зависимости от диеты.
2. Неразложенные диетические аминокислоты рубца:
Неразделенный белок рубца (НПБ) вносит значительный, но непостоянный вклад в поступление аминокислот в тонкий кишечник. Аминокислотный профиль UIP может быть очень хорошим, например, в животных белках, таких как рыбная мука или кровяная мука. Однако некоторые рационы, которые кажутся достаточными по количеству НПВ, поступающего в тонкий кишечник, могут быть маргинальными по определенным аминокислотам.Например, известно, что в кукурузе мало лизина. Продуктивность высокопродуктивной коровы может быть ограничена лизином, если большая часть ее НПВ поступает из зерна кукурузных дистилляторов или кукурузной глютеновой муки. Смесь источников НПВ, которая включает немного кукурузы, сои и животного белка, должна более адекватно обеспечивать корову аминокислотами в пропорциях, необходимых для производства белков молока и мяса.
Аминокислота | Хороший источник |
| метионин | Рыбная мука, мука из кукурузной глютена, метионин для обхода рубца |
Лизин | Кровяная мука, рыбная мука, переработанная соя, лизин обходного пути рубца |
Аргинин | Перья, рыбная мука, переработанная соя |
Количество пищевых аминокислот, которые переваривают микробы, является функцией конкуренции между скоростью, с которой микробы могут переваривать белок, и скоростью, с которой белок выходит из рубца.Многие кормовые компании и распространенные компьютерные программы кормления используют для кормов заданные значения разлагаемости. Эти значения получены путем инкубации корма в рубце (in situ) или в буферном растворе и ферменте в течение того времени, в течение которого корм, как ожидается, будет находиться в рубце коровы (16 часов для концентратов и 30 часов для кормов). . Но истинный ПВП корма не всегда будет одинаковым, потому что скорость прохождения этого корма будет варьироваться в зависимости от количества корма, съеденного коровой. Чем выше потребление сухого вещества, тем быстрее корм проходит через рубец.UIP наиболее правильно рассчитывается как функция скорости деградации и скорости прохождения.
Для прогнозирования деградированного кормового белка (DIP или RDP) и нерасщепленного кормового белка (UIP или RUP) публикация NRC (2001) рекомендует разбивать кормовые белки на 3 фракции (A, B и C). Предполагается, что фракция А полностью разлагается в рубце. Фракция C не разлагается в рубце. Количество перевариваемой в рубце фракции B зависит от прогнозируемой скорости ее переваривания (полученной из данных in situ) и прогнозируемой скорости прохождения (рассчитанной на основе потребления сухого вещества, процентного содержания диетического концентрата, процентного содержания NDF в рационе и содержания влаги в корме). ).В публикации NRC (2001), основанной на данных прошлых исследований, усвояемость нерасщепленного кормового белка варьируется в зависимости от источника корма.
В модели чистых углеводов / аминокислот белки фракционируют на 4 фракции, доступные для рубца. Скорость разложения назначается каждой из четырех фракций, а скорость прохождения назначается каждому сырью. UIP рассчитывается как функция скорости разложения и скорости прохождения каждой фракции белка.
Микробная популяция рубца меняется в зависимости от рациона питания.Это может повлиять на расщепление белка в рубце и оценку обходных аминокислот. В исследовании, проведенном в Miner Institute (de Ondarza and Sniffen, 2000), корова с ранней лактацией (60 DIM) и корова с поздней лактацией (142 DIM) получали рационы, которые, как ожидается, производили различные микробные массы и среду рубца. Количество белка, удаленного из кормов микробами рубца за восемь часов, определяли методом in situ (дакроновый мешок). Были обнаружены различия в способности белков разлагаться в рубце между диетами.Например, при разложении жареных соевых бобов у коровы в позднем периоде лактации исчезло около 65% ХП. Но у коровы в раннем периоде лактации, потребляющей более высокое соотношение концентрата и корма, в среднем исчезло 75% ХП. Эти различия были статистически значимыми, но различия не были постоянными для разных проанализированных кормов.
Аминокислотный профиль непереваренного пищевого белка не будет таким же, как у общего потребляемого белка. Микробы предпочтительно используют некоторые аминокислоты и оставляют более высокий процент других аминокислот непереваренными.К сожалению, такое предпочтительное использование аминокислот трудно предсказать. В таблице ниже показано соотношение концентраций аминокислот в соевой муке и рыбной муке после и до инкубации рубца. Значение ниже 1,00 указывает на то, что аминокислота преимущественно разлагалась в рубце. Значение выше 1,00 указывает на то, что аминокислота не разложилась в рубце в такой степени, как другие аминокислоты в корме.
Соотношение концентраций аминокислот после и до инкубации рубца
Соевый шрот | Рыбная мука | |
Лизин | 0.90 | 1,11 |
Метионин | 0,92 | 0,70 |
Аргинин | 0,88 | 0,94 |
Изолейцин | 1,01 | 1,11 |
Лейцин | 1,02 | 1,15 |
Источник: Susmel et al., 1989
У доктора Питера Робинсона, специалиста по совместному развитию с Калифорнийским университетом, есть 3 статьи на своем веб-сайте, которые содержат аминокислотные данные о белке ускользания из рубца.
Аминокислоты, защищенные рубцом
Аминокислоты, защищенные рубцом, могут вызывать ответную реакцию производства молока только в том случае, если они перевариваются после переваривания жвачки, и только если они поставляют корове «ограничивающие аминокислоты». Конечно, чтобы предсказать потребность в определенных аминокислотах, необходимо использовать точную модель рубца для балансировки рациона.
Поглощение и эффективность использования аминокислот:
Аминокислоты должны всасываться из кишечника в кровоток. Не все аминокислоты всасываются с одинаковой эффективностью. Иногда они соревнуются за места поглощения. Исследователи также обнаружили, что пептиды (небольшие цепочки аминокислот) иногда абсорбируются быстрее, чем отдельные аминокислоты. Аминокислоты в кровотоке используются с разной эффективностью в зависимости от функции, для которой они используются.Например, 1 грамм лизина может попасть в тонкий кишечник коровы. Если бы 80% этого лизина было переварено и абсорбировано из кишечника, в кровотоке осталось бы 0,80 г лизина. Если бы лизин в крови использовался для производства теленка с эффективностью 85%, было бы доступно 0,68 г лизина (0,80 * 0,85) для удовлетворения потребности коровы в лизине.
Использование отдельных абсорбированных аминокислот для различных функций
| Техническое обслуживание | Рост | Репродукция | Молоко | |
Лизин | 0.85 | 0,85 | 0,85 | 0,88 |
Метионин | 0,85 | 0,85 | 0,85 | 0,98 |
Аргинин | 0,85 | 0,85 | 0,66 | 0,42 |
Валин | 0,66 | 0.85 | 0,66 | 0,72 |
Изолейцин | 0,66 | 0,85 | 0,66 | 0,62 |
Лейцин | 0,66 | 0,85 | 0,66 | 0,72 |
Источник: Evans and Patterson, 1985
Требования к аминокислотам:
Молочным коровам нужны аминокислоты для производства молока и мышечного белка, для производства белка в растущем плоде и для производства белков, необходимых им для поддержания себя (например, ферментов, необходимых для переваривания кормов).Каждый из этих белков состоит из разных аминокислот. По этой причине корове потребуется разное количество каждой из незаменимых аминокислот в зависимости от стадии лактации, роста и беременности.
Потребность в аминокислотах может быть выражена с использованием факторного метода или метода идеального белка. При факторном методе требования основаны на потребностях животного (например, количестве молока, которое должно быть произведено и его аминокислотном содержании), и различной эффективности, с которой аминокислоты абсорбируются и используются.К сожалению, эту эффективность сложно оценить. Молочная железа потребляет больше некоторых аминокислот, чем выделяет с молоком. С некоторыми заменимыми аминокислотами молочная железа потребляет меньше, чем содержится в производимом молоке. Таким образом, набор аминокислот, необходимых для производства молока, отличается от аминокислотного состава молока.
Поглощение аминокислот молочной железой по сравнению с выходом аминокислот с молоком (г / 100 г аминокислот)
Аминокислота | Общее потребление | Выход из молочной железы |
Аргинин | 8.53 | 3,40 |
Гистидин | 3,29 | 2,74 |
Изолейцин | 8,80 | 5,79 |
Лейцин | 13,04 | 9,18 |
| Лизин | 9.14 | 3,40 |
Метионин | 2,82 | 2,71 |
Фенилаланин | 4,51 | 4,75 |
Треонин | 4,76 | 3,72 |
Валин | 10,01 | 5.89 |
Эванс, 1999 г.
Клетки организма используют активные транспортные механизмы для захвата аминокислот. Существует 3 различных типа транспорта аминокислот: нейтральные аминокислоты (треонин, лейцин, валин, изолейцин, фенилаланин, метионин, цистин / цистеин и триптофан), основные аминокислоты (гистидин, аргинин и лизин) и кислые аминокислоты. кислоты. В пределах одного типа аминокислоты одна аминокислота может конкурировать и ингибировать транспорт другой аминокислоты.Из-за потенциального негативного воздействия аминокислот друг на друга факторный метод может переоценить ответную реакцию продукции при избытке одной аминокислоты. Например, в одном исследовании, в котором лизин был первой ограничивающей аминокислотой, а добавка метионина была дополнительной, выработка молочного белка фактически снизилась (Rulquin and Verite, 1993).
По этой причине для сбалансированного рациона по аминокислотам чаще используется метод идеального белка (подход соотношения). Идеальный белковый метод основан на результатах научных исследований в отношении аминокислот, выраженных в процентах от метаболизируемого белка или незаменимых кишечных аминокислот.Взаимосвязь аминокислот друг с другом определяет рацион, а не фактическое количество поглощенных аминокислот. Согласно исследованию Шваба из Университета Нью-Гэмпшира, 5% незаменимых кишечных аминокислот должны составлять метионин, а 15% — лизин. Согласно исследованиям Rulquin и Verite во Франции, 2,5% метаболизируемых аминокислот должны составлять метионин, а 7,3% — лизин. Публикация NRC (2001) обобщила большой набор данных и пришла к выводу, что 2.2% метаболизируемых аминокислот должно составлять метионин и 7,2% — лизин. Без добавления отдельных аминокислот этих целей трудно достичь. Согласно Sniffen et al., 2001, содержание молочного белка снижается, когда метионин составляет менее 2,1–2,2% метаболизируемых аминокислот, а лизин — менее 6,0–6,5% метаболизируемых аминокислот. Sniffen et al., 2001 проанализировали результаты 21 эксперимента, который проводился с защищенным в рубце лизином и метионином, а также с рядом концентратов и кормов.Для производства молока и выхода сырого белка из молока оптимальное количество метионина составляло 2,07% метаболизируемого белка, а оптимальное количество лизина составляло 7,04% метаболизируемого белка.
На основании своей работы по моделированию Sniffen et al., 2001 одобрили подход соотношения к аминокислотному балансу. Однако было признано, что потребность в метаболизируемом белке по-прежнему должна удовлетворяться, и что факторные запасы отдельных аминокислот по-прежнему должны превышать факторные потребности. В настоящее время компьютеризированные модели, использующие как факторный подход, так и подход идеального соотношения для балансировки аминокислот, должны быть наиболее эффективными.
Артикул:
Чалупа, В., Р. Бостон, С.Дж. Сниффен, Д.Г. Лиса. 1998. Разработка моделей питания молочных коров. В: Proceedings of the Advanced Dairy Workshop, Сиракузы, Нью-Йорк.
de Ondarza, M.B. и C.J. Sniffen. 2000. Диета влияет на скорость разложения белка в рубце. Корма. 8 мая 2000 г., с. 14.
Эванс, Э. и Р.Дж. Паттерсон. 1985. Использование динамического моделирования рассматривается как хороший способ сформулировать потребность в сыром протеине и аминокислотах для кормов крупного рогатого скота.Корма. 14 октября 1985 г., с. 24.
Мантисаари П.Э., К.Дж. Сниффен и Дж. Д. О’Коннор. 1989. Прикладная модель предоставляет средства для балансировки аминокислот для молочного скота. Корма. 15 мая 1989 г., с. 13.
Национальный исследовательский совет. 1989. Потребности в питательных веществах для молочного скота. 6-е изд. изд. обновление 1989. Нац. Акад. Sci., Вашингтон, округ Колумбия
Сниффен, К.Дж., Р.В. Беверли, К.С. Муни, М. Роу и А.Л. Скидмор. 1993. Потребности в питательных веществах по сравнению с поставкой молочной коровы: стратегии для учета изменчивости.J. Dairy Sci. 76: 3160.
Susmel, P., B. Stefanon, C.R. Mills и M. Candido. 1989. Изменение аминокислотного состава различных источников белка после инкубации рубца. Anim. Prod. 49: 375.
Эванс, Э. 1999. Критерии оценки использования аминокислот для синтеза молочного белка. Proc. Eastern Nutr. Конф., Стр. 113-123.
Эванс, Э. 2003. Практические аспекты сбалансированного рациона по аминокислотам. В: Proceedings of the Tri-State Dairy Nutrition Conference, Fort Wayne, Indiana, p.133.
Корхорен, М., С. Ахвеньярви, А. Ванхатало и П. Хухтанен. 2002. Добавление ячменя или рапсового шрота к дойным коровам, получавшим силос из травяного красного клевера. II. Аминокислотный профиль микробных фракций. J. Anim. Sci. 80: 2188.
Национальный исследовательский совет. 2001. Потребности в питательных веществах для молочного скота. 7-е изд. изд. Natl. Акад. Sci., Вашингтон, округ Колумбия
Рулкин, Х. и Р. Верите. 1993. Аминокислотное питание молочных коров: влияние продукции и потребности животных. Страница 55 в Последние достижения в области питания животных.ПК. Гарнсуорси и Д. Коул, ред. Издательство Ноттингемского университета.
Рулкин, Х., П.М. Писулевски, Р. Верите и Дж. Гинар. 1993. Производство и состав молока в зависимости от поструминального поступления лизина и метионина: подход, основанный на реакции на питательные вещества. Живой. Prod. Sci. 37:69.
Rulquin, H., R. Verite, J. Guinard, and P.M. Писулевский. 1995. Потребность дойных коров в аминокислотах. Страница 143 в Исследования и разработки в зоотехнике: движение к новому веку. М. Иван, изд., ISBN 0-662-23589-4, Центр исследований продуктов питания и животных, Оттава, Канада.
Sniffen, C.J., W.H. Чалупа, Т. Уэда, Х. Сузуки, И. Шинзато, Т. Фуджиеда, В. Жюльен, Л. Роде, П. Робинсон, Дж. Харрисон, А. Фриден и Дж. Ночек. 2001. Аминокислотное питание лактирующей коровы. В: Материалы Корнельской конференции по питанию для производителей кормов 2001 г., Рочестер, штат Нью-Йорк, с. 188.
Ссылки по теме:
Использование защищенных аминокислот
аминокислот для здоровья животных
Незаменимые аминокислоты: это аминокислоты, которые могут синтезироваться в организме животного, обычно из других аминокислот или других соединений.К ним относятся аланин, аспарагиновая кислота, цистеин, цистин, глутаминовая кислота, глицин, гидроксипролин, пролин, серин и тирозин.
Хотя «заменимые» аминокислоты могут синтезироваться организмом животного и не нуждаются в добавлении в рацион, они по-прежнему играют важную роль в организме. Термин «несущественные» не имеет отношения к их биологическому значению. Исторически они считались неважными 2 с точки зрения питания, но недавние научные исследования доказали, что эта точка зрения ложна.Несмотря на свое название, заменимые аминокислоты важны для производства белков, которые способствуют метаболизму и пищеварению, регулируют экспрессию генов, сигнальные клетки, вызывают антиоксидантные реакции, регулируют фертильность, поддерживают нейротрансмиссию и обеспечивают иммунные ответы.
Независимо от того, является ли аминокислота незаменимой или несущественной, животным необходимо достаточное количество всех аминокислот для удовлетворения своих метаболических потребностей, независимо от того, нужно ли им производить молоко, наращивать мышцы и ткани или воспроизводить потомство.В зависимости от того, что нужно каждому животному, оно может производить разные белки в разных количествах, что может потребовать разного количества конкретных аминокислот. Таким образом, потребность животного в потреблении аминокислот может меняться в зависимости от его стадии жизни. Например, беременная корова имеет другие потребности в аминокислотах по сравнению с дойной коровой, потому что количество белка, которое им требуется, немного отличается.
Потенциал животного в производстве белка ограничен количеством аминокислот в его организме.Поскольку для определенных белков требуются определенные аминокислоты, если организм не может синтезировать достаточное количество одной аминокислоты или она не поступает в достаточном количестве с пищей, он не сможет производить определенные типы белков, необходимых для определенных процессов. Самая короткая аминокислота называется «первой лимитирующей» аминокислотой в рационе. Потребность в определенных аминокислотах будет варьироваться в зависимости от вида, пола, диеты и стадии жизни животного. Например, лизин и метионин являются типичными первыми ограничивающими аминокислотами у дойных коров.
Идентификация этой первой ограничивающей аминокислоты чрезвычайно важна для производственных целей, поскольку животные не могут достичь производственных уровней синтеза белка без достаточных количеств первой ограничивающей аминокислоты; Независимо от того, сколько лизина вы кормите молочной коровой, если метионин является первой лимитирующей аминокислотой, животное может не синтезировать достаточно белков для производства желаемого количества молока. По этой причине обеспечение достаточного количества всех незаменимых аминокислот в рационах производственных животных имеет первостепенное значение.
Проблемы, связанные с недостатком аминокислот в рационах сельскохозяйственных животных
Если животное не получает в рационе достаточного количества определенных незаменимых аминокислот, оно не может производить достаточно белков для поддержания определенных метаболических функций. С производственной точки зрения отсутствие достаточного количества аминокислот в рационе животного приведет к снижению общей производительности, что может значительно снизить прибыльность. Вот лишь несколько проблем, связанных с нехваткой аминокислот для скота:
1.Изменения на впуске
Одним из первых и наиболее важных признаков дисбаланса аминокислот в корме стада является снижение потребления корма. Хотя большинство животных сначала будут есть больше пищи, чтобы попытаться восполнить дефицит, через несколько дней животные значительно уменьшат потребление пищи. Это снижение потребления происходит потому, что дисбаланс аминокислот в пище приводит к снижению чувства голода у многих видов. Это может привести к дальнейшему дефициту питательных веществ и, как следствие, к снижению работоспособности и проблемам со здоровьем.
2. Малая масса
Как у молодых, так и у взрослых животных дефицит аминокислот способствует низкой массе тела и общему снижению мышечного развития. Для молодых животных это может иметь долгосрочные последствия, в том числе снижение скорости роста, увеличение времени для достижения зрелости и уменьшение размера в период созревания. Этот низкий вес тела не может быть исправлен с помощью принудительного кормления 3 . Исследования показали, что даже когда животные вынуждены потреблять достаточное количество калорий, если в рационе отсутствуют аминокислоты, животное все равно будет испытывать морфологические проблемы и часто будет продолжать терять вес.
Кровяной мозговой барьер и церебральный метаболизм (Раздел 4, Глава 11) Нейронаука в Интернете: Электронный учебник для нейронаук | Кафедра нейробиологии и анатомии
11.1 Гематоэнцефалический барьер поддерживает постоянство внутренней среды мозга
Гематоэнцефалический барьер (ГЭБ) защищает нервную ткань от изменений в составе крови и токсинов. В других частях тела внеклеточные концентрации гормонов, аминокислот и калия часто колеблются, особенно после еды, упражнений или стресса.Поскольку многие из этих молекул регулируют возбудимость нейронов, подобное изменение в составе интерстициальной жидкости в ЦНС может привести к неконтролируемой активности мозга. Эндотелиальные клетки, образующие гематоэнцефалический барьер, имеют узкую специализацию, что позволяет точно контролировать вещества, которые входят в мозг или покидают его.
Открытие гематоэнцефалического барьера. Открытие ГЭБ датируется более чем 100 лет назад, когда в 1880-х годах Пауль Эрлих заметил, что внутривенное введение некоторых красителей (например,грамм. трипановый синий) окрашивал все органы, кроме головного и спинного мозга. Он пришел к выводу, что красители обладают более низким сродством к связыванию с нервной системой по сравнению с другими тканями. В 1913 году Эдвин Голдман, сотрудник Эрлиха, продемонстрировал, что те же самые красители при прямом введении в спинномозговую жидкость (CSF) легко окрашивали нервную ткань, но не другие ткани. Термин «гематоэнцефалический барьер» был придуман Левандовски в 1898 году после того, как он и его коллеги провели эксперименты, чтобы продемонстрировать, что нейротоксические агенты влияют на функцию мозга только при прямом введении в мозг, но не при введении в сосудистую систему.Потребовалось еще 70 лет, прежде чем Риз и его коллеги с помощью электронно-микроскопических исследований локализовали барьер для эндотелиальных клеток капилляров в головном мозге.
Рисунок 11.1a | Рисунок 11.1b |
Эндотелиальные клетки в капиллярах головного мозга являются местом расположения ГЭБ.ГЭБ у взрослых состоит из сложной клеточной системы узкоспециализированной базальной мембраны, большого количества перицитов, встроенных в базальную мембрану, и концевых ножек астроцитов. В то время как эндотелиальные клетки образуют собственно барьер, взаимодействие с соседними клетками, по-видимому, необходимо для развития барьера. Эндотелиальные клетки головного мозга отличаются от эндотелиальных клеток других органов двумя важными способами. Во-первых, между эндотелиальными клетками головного мозга существуют постоянные плотные контакты.Эти плотные соединения предотвращают параклеточное движение молекул. Во-вторых, нет никаких обнаруживаемых трансэндотелиальных путей, таких как внутриклеточные везикулы. Эти свойства эндотелиальных клеток головного мозга создают барьер между кровью и мозгом. Некоторые из ключевых процессов изображены на рисунке 11.1.
Рисунок 11.2 |
- Непрерывные плотные контакты, которые соединяют эндотелиальные клетки в капиллярах мозга, ограничивают диффузию молекул через ГЭБ.
- Базальная (базальная) мембрана обеспечивает структурную поддержку капилляров, и было высказано предположение, что специфические белки, присутствующие в базальной мембране, участвуют в развитии ГЭБ.
- Астроцитарные отростки стопы выделяют специфические факторы и необходимы для развития ГЭБ.Отростки астроцитарной стопы содержат водные каналы (аквапорин-4), которые обеспечивают поглощение воды и способствуют отеку мозга.
- Транспортные носители глюкозы и незаменимых аминокислот способствуют перемещению этих растворенных веществ в мозг. Поскольку клетки мозга не могут синтезировать эти незаменимые аминокислоты, они попадают в кровь.
- Вторичные транспортные системы, по-видимому, вызывают отток небольших молекул и заменимых аминокислот из мозга в кровь.
- Переносчики ионов натрия на просветной мембране и Na, K-АТФаза на антипросветной мембране отвечают за перемещение натрия из крови в мозг. Большое количество митохондрий, присутствующих в эндотелиальных клетках головного мозга, обеспечивает энергию для функции этой Na, K-АТФазы.
- «Ферментативный гематоэнцефалический барьер»: метаболические процессы в эндотелиальных клетках капилляров головного мозга важны для функции крови и мозга и контролируют проникновение нейротрансмиттеров в мозг.
11.2 Молекулярные компоненты плотных контактов
Рис. 11.3 |
Плотные контакты между эндотелиальными клетками отвечают за барьерную функцию. Окклюдин был первым интегральным мембранным белком, локализованным исключительно в плотных контактах. Однако у мышей, несущих нулевую мутацию в гене окклюдина, развиваются морфологически нормальные плотные контакты, что указывает на то, что окклюзия не является существенной для правильного образования плотных контактов.В отличие от окклюзии, клаудины необходимы для образования плотных контактов. Интегральные мембранные белки плотных контактов связаны с цитоскелетом через зоны окклюзии-1 (ZO-1), ZO-2 и ZO-3. Кроме того, стыки, не связанные с окклюдином, перемешиваются с плотными стыками. В слипчивых соединениях обнаруживаются специфические для эндотелия интегральные мембранные белки VE-кадгерины. Кроме того, семейство белков, называемых молекулами соединительной адгезии (JAM), и недавно обнаруженные молекулы адгезии, избирательной к эндотелиальным клеткам (ESAM), локализуются в плотных контактах BBB.Их точная функция в целостности ГЭБ еще предстоит определить.
Все области мозга не имеют гематоэнцефалического барьера. Структуры, расположенные в стратегических позициях по средней линии желудочковой системы и не имеющие ГЭБ, в совокупности называются окружными желудочковыми органами (CVO). В этих небарьерных областях плотные контакты между эндотелиальными клетками прерываются, что позволяет молекулам проникать. Многие из этих областей участвуют в гормональном контроле.
Области головного мозга без гематоэнцефалического барьера:
- Гипофиз
- Среднее возвышение
- Площадь пострема
- Преоптический карман
- Парафиз
- Шишковидная железа
- Эндотелий сосудистого сплетения
Рисунок 11.4 |
Вещества с высокой растворимостью липидов могут перемещаться через ГЭБ путем простой диффузии. Распространение — основной механизм проникновения большинства психоактивных веществ. Рисунок 11.2 показывает, что скорость поступления соединений, которые диффундируют в мозг, зависит от их растворимости в липидах. Растворимость липидов оценивается по коэффициенту распределения масло / вода.
На рис. 11.5a показано, как рассчитывается коэффициент разделения нефть / вода.На рис. 11.5b показана взаимосвязь между коэффициентом распределения масло / вода и проникновением в мозг выбранных молекул.
Рисунок 11.5a | Рисунок 11.5b | Рис. 11.6 |
Вода. Вода легко попадает в мозг. Вследствие высокой проницаемости вода свободно перемещается в мозг и из него при изменении осмолярности плазмы. Это явление клинически полезно, поскольку внутривенное введение плохо проницаемых соединений, таких как маннит, осмотически обезвоживает мозг и снижает внутричерепное давление.Этот метод иногда используется у пациентов с травмами головы для снижения внутричерепного давления.
Газы. Такие газы, как CO2, O2 и летучие анестетики быстро проникают в мозг. Как следствие, скорость, с которой их концентрация в головном мозге приходит в равновесие с плазмой, ограничивается в первую очередь скоростью церебрального кровотока.
11.3 Транспорт глюкозы и аминокислот
Рисунок 11.7 |
Опосредованный переносчиком транспорт позволяет молекулам с низкой растворимостью в липидах преодолевать гематоэнцефалический барьер. Глюкоза из крови попадает в мозг с помощью транспортного белка. Глюкоза — это основной энергетический субстрат мозга. Белок транспорта глюкозы (GLUT-1) высоко обогащен эндотелиальными клетками капилляров головного мозга. Эти переносчики переносят молекулы глюкозы через гематоэнцефалический барьер. Хотя это бывает редко, пациенты с дефицитом Glut-1 (вызванным генетическими мутациями) могут иметь серьезные трудности в обучении.Низкий уровень глюкозы в спинномозговой, но не в крови, указывает на заболевание.
Незаменимые аминокислоты не могут быть синтезированы мозгом и, следовательно, должны поступать в результате распада белка и диеты. Фенилаланин, лейцин, тирозин, изолейцин, валин, триптофан, метионин и гистидин, которые являются незаменимыми аминокислотами, а также предшественник дофамина, L-DOPA, попадают в мозг так же быстро, как и глюкоза. Эти аминокислоты транспортируются в мозг с помощью белков, предпочитающих лейцин, или транспортных белков L-типа.Эти соединения конкурируют друг с другом за попадание в мозг. Следовательно, повышение уровня одного из них в плазме подавляет поглощение других. Эта конкуренция может быть важной при некоторых метаболических заболеваниях, таких как фенилкетонурия (ФКУ), когда высокие уровни фенилаланина в плазме снижают поглощение мозгом других незаменимых аминокислот.
Небольшие нейтральные аминокислоты, такие как аланин, глицин, пролин и ГАМК (гамма-аминомасляная кислота), значительно ограничены в их поступлении в мозг.Эти аминокислоты являются заменимыми аминокислотами и транспортируются с помощью транспортного белка, предпочитающего аланин, или транспортного белка А-типа. Транспортный белок A-типа отсутствует на просветной поверхности гематоэнцефалического барьера. Напротив, эти небольшие нейтральные аминокислоты, по-видимому, транспортируются из мозга через гематоэнцефалический барьер.
11.4 Защита мозга от передаваемых с кровью нейротоксинов и лекарственных препаратов
P-гликопротеинов — это насосы, управляемые АТФ, которые придают множественную лекарственную устойчивость раковым клеткам путем выкачивания лекарств из клеток.Эти белки экспрессируются в эндотелиальных клетках головного мозга, которые могут ограничивать проницаемость ГЭБ гидрофобных соединений, таких как циклоспорин А и винбластин, перекачивая их из эндотелиальных клеток обратно в кровь.
Метаболические процессы в эндотелиальных клетках капилляров головного мозга важны для работы крови и головного мозга. Большинство нейротрансмиттеров, присутствующих в крови, не попадают в мозг из-за их низкой растворимости в липидах и отсутствия специфических транспортных носителей в просветной мембране эндотелиальных клеток капилляров (см.рис.11.1). Напротив, L-ДОФА, предшественник дофамина, имеет сродство к переносчику L-типа. Следовательно, он легче попадает в мозг из крови, чем можно было бы предсказать, исходя из его липидной растворимости. По этой причине пациентов с болезнью Паркинсона лечат L-ДОФА, а не дофамином. Однако проникновение L-DOPA в мозг ограничено присутствием ферментов L-DOPA декарбоксилазы и моноаминоксидазы в эндотелиальных клетках капилляров. Этот «ферментативный гематоэнцефалический барьер» ограничивает прохождение L-ДОФА в мозг и объясняет необходимость применения больших доз L-ДОФА при лечении болезни Паркинсона.В настоящее время терапия усилена одновременным лечением ингибитором L-DOPA декарбоксилазы.
Рисунок 11.8b |
Эндотелиальная моноаминоксидаза также может играть роль в инактивации нейротрансмиттеров, высвобождаемых нейрональной активностью.Моноамины демонстрируют очень низкое поглощение при поступлении со стороны просвета. Системы захвата моноаминов присутствуют на антипросветной поверхности эндотелиальных клеток капилляров головного мозга. Эндотелиальный капилляр головного мозга также содержит множество других ферментов, метаболизирующих нейротрансмиттеры, таких как холинэстеразы, трансаминазы ГАМК, аминопептидазы и эндопептидазы. Кроме того, в капиллярах мозга обнаружено несколько ферментов, метаболизирующих лекарства и токсины. Таким образом, «ферментативный гематоэнцефалический барьер» защищает мозг не только от циркулирующих нейромедиаторов, но и от многих токсинов.
Скомпрометированный ГЭБ и болезнь. Дисфункция ГЭБ может привести к повреждению нейронов и нарушению функции мозга. Такие заболевания, как энцефалит, рассеянный склероз (РС), инсульт или опухоли, вызывают ухудшение ГЭБ с разрушительным влиянием на функцию нейронов. В этих условиях снижается выработка белка плотного соединения клаудина. Опухоли головного мозга вызывают полное разрушение ГЭБ, что приводит к перитуморальному отеку. Кроме того, опухолевые клетки секретируют специфические факторы [например,фактор роста эндотелия сосудов (VEGF), который вызывает образование новых кровеносных сосудов (или ангиогенез)], которые имеют тенденцию к протечке.
Рисунок 11.9 |
Обход ГЭБ с помощью лекарств. Ряд лекарств, имеющих потенциальную терапевтическую ценность, нелегко проникает в мозг, поскольку они обладают низкой растворимостью в липидах и не переносятся специфическими носителями, присутствующими в ГЭБ.Чтобы преодолеть это ограничение, были разработаны схемы, улучшающие поступление лекарств в мозг. 1) Один из способов обойти ГЭБ — доставить лекарство непосредственно в спинномозговую жидкость. Этот подход можно использовать для лечения пациентов с менингитом или раковыми клетками в спинномозговой жидкости. 2) Некоторые вазоактивные соединения, такие как брадикинин и гистамин, которые не изменяют ГЭБ у нормальных людей, могут увеличивать проницаемость ГЭБ при патологических состояниях. Эти соединения можно использовать для доставки химиотерапевтических агентов в мозг.3) Могут быть синтезированы препараты с высокой проницаемостью по ГЭБ для улучшения проникновения в мозг. Большинство нейроактивных препаратов эффективны, потому что растворяются в липидах и легко проникают в мозг. Например, героин и морфин очень похожи по структуре. Однако героин, который имеет две ацетильные группы, более растворим в липидах. Эта более высокая липидорастворимость героина объясняет его более быстрое начало действия. Попадая в мозг, ацетильная группа героина ферментативно удаляется с образованием морфина, который лишь медленно покидает мозг.Понимание процесса переноса имеет решающее значение для разработки следующего поколения лекарств, полезных для лечения заболеваний головного мозга.
11,5 Церебральный метаболизм и кровоток
Церебральный метаболизм
Мозг метаболически является одним из самых активных органов тела. Мозг не накапливает лишнюю энергию и получает почти все свои потребности в энергии за счет аэробного окисления глюкозы. Следовательно, ему требуется постоянная подача глюкозы и кислорода для удовлетворения его энергетических потребностей.Большая часть энергии, потребляемой мозгом, используется для активного транспорта ионов, чтобы поддерживать и восстанавливать мембранные потенциалы, разряженные в процессе возбуждения и проводимости. Когда приток крови к мозгу прекращается и происходит отсутствие кислорода и крови, потеря сознания происходит через 5-10 секунд. Если кровоток не возобновляется в течение нескольких минут, происходит необратимое повреждение головного мозга. Хорошо известно, что во время кризов, таких как остановка сердца, повреждение головного мозга возникает раньше всего и имеет решающее значение для определения степени выздоровления.Отсутствие глюкозы столь же разрушительно, но время, приводящее к необратимым повреждениям от гипогликемии, больше, потому что можно использовать другие субстраты.
Различные области мозга имеют разные потребности в энергии, которые связаны с активностью нейронов в этих областях. Измерение количества глюкозы, используемой в минуту в различных областях мозга крысы и обезьяны в нормальном сознании, демонстрирует, что использование глюкозы широко варьируется по всему мозгу.Причем среднее значение в сером веществе примерно в пять раз больше, чем в белом.
Количество кровотока напрямую связано с активностью мозга. У отдельной группы животных определяли приток крови к областям мозга. Результаты показывают, что больше крови поступает в область мозга с высокой метаболической активностью.
Рисунок 11.10 Связь между мозговым кровотоком и метаболизмом глюкозы. |
Рисунок 11.10 показывает отличную корреляцию между количеством потребляемой глюкозы и местным церебральным кровотоком.
Регулирование притока крови к области головного мозга достигается за счет расширения сосудов головного мозга. Расширение кровеносных сосудов контролируется местными факторами, такими как оксид азота (NO), PaCO2, PaO2 и pH. Высокий уровень NO, высокий PaCO2, низкий PaCO2 и низкий pH, которые образуются в результате мозговой деятельности, имеют тенденцию расширять кровеносные сосуды и увеличивать кровоток.Скорость производства этих химических веществ зависит от активности и скорости энергетического обмена. Следовательно, приток крови к области мозга связан с нейрональной активностью в этой области.
Утилизация глюкозы и визуализация головного мозга. Метаболизм глюкозы — главный источник энергии для мозга. Глюкоза из крови поступает в мозг с помощью транспортного белка Glut-1. Попав внутрь клетки мозга, он вступает в гликолитический путь, где превращается в пируват, а затем метаболизируется в цикле Кребса с образованием АТФ.Часть молекул АТФ используется для генерации высокоэнергетических молекул фосфокреатина. В определенных условиях аэробный метаболизм глюкозы способен обеспечивать мозг достаточной энергией от АТФ и фосфокреатина для поддержания нормальной функции. Когда возникает мозговая недостаточность, сначала происходит потеря фосфокреатина, за которой следует истощение АТФ, что обычно сигнализирует о серьезном повреждении мозга.
Депривация глюкозы может привести к нарушению функции мозга. Гипогликемия, которая может возникнуть из-за чрезмерного количества инсулина, связана с изменениями психического состояния.Эти изменения можно быстро обратить вспять введением глюкозы. В определенных обстоятельствах, например, во время голодания, мозг может использовать «кетоновые тела» вместо глюкозы в качестве субстратов. Кетоновые тела, ацетоацетат и D-бета-гидроксибутират образуются в результате катаболизма жирных кислот в печени. Кетоновые тела метаболизируются с образованием ацил-КоА, который входит в цикл трикарбоновых кислот (ТСА) с достаточной скоростью, чтобы удовлетворить метаболические потребности мозга.
Измерение местного использования глюкозы.Местный энергетический обмен сочетается с местной функциональной активностью. Использование авторадиографического аналога глюкозы, 2-дезоксиглюкозы (2-DG), применялось для измерения метаболизма глюкозы у экспериментальных животных.
Рис. 11.11a | Рисунок 11.11b |
Рисунок 11.4 иллюстрирует фундаментальный принцип метода радиоактивной дезоксиглюкозы для измерения локальной утилизации глюкозы в головном мозге. Утилизация глюкозы начинается с фосфорилирования глюкозы гексокиназой. Образующийся глюкозо-6-фосфат не задерживается в тканях. Вместо этого он метаболизируется до продуктов, таких как CO2 и h3O, которые покидают ткань.2-дезоксиглюкоза является аналогом глюкозы и транспортируется через гематоэнцефалический барьер системой переносчиков глюкозы. Внутри клеток мозга 2-дезоксиглюкоза фосфорилируется гексокиназой до дезоксиглюкозо-6-фосфата (DG-6-P) и не может далее разлагаться на CO2 и h3O. Вместо этого он улавливается и количественно накапливается в ткани в течение разумного периода времени. Пометив дезоксиглюкозу (например, [18F] фтор-2-дезокси-D-глюкоза), можно измерить скорость образования меченого дезоксиглюкозо-6-фосфата.Количество 18FDG-6-фосфата можно непосредственно определить с помощью позитронно-эмиссионной томографии (ПЭТ). Метод 2-дезоксиглюкозы был модифицирован для использования человеком с ПЭТ, с короткоживущими изотопами, испускающими позитроны, помеченными как 2-дезоксиглюкоза.
11.6 Функциональная активация энергетического метаболизма
Рисунок 11.12 |
Из-за связи метаболизма с функцией функциональная активация с помощью определенных стимулирующих задач приводит к региональному увеличению метаболизма глюкозы в соответствующих церебральных структурах.Движение пальцев и рук увеличивает метаболизм в соответствующих областях мозга. У добровольцев-правшей спонтанная речь увеличивала метаболическую активность в области Брока. Представление зрительных образов увеличивает утилизацию глюкозы в первичной зрительной коре.
Функциональная МРТ. Вариант МРТ, называемый функциональной МРТ (фМРТ), основан на увеличении кровотока в определенных областях мозга, который сопровождает активность нейронов. Увеличение кровотока приводит к локальному снижению дезоксигемоглобина из-за меньшей экстракции кислорода.Дезоксигемоглобин парамагнитен и служит источником сигнала в фМРТ. В отличие от ПЭТ, фМРТ использует сигнал, присущий мозгу, и стала предпочтительной технологией для исследования функций мозга.
Рисунок 11.13 |
11.7 Заболевания головного мозга и метаболизм
Судорожные расстройства — это функциональные нарушения мозговой деятельности, приводящие к выраженным изменениям метаболизма мозга и мозгового кровотока.Метаболические изменения, обнаруженные с помощью ПЭТ, часто могут дополнять электрофизиологические записи для определения эпилептогенных очагов. Эта информация помогает нейрохирургам удалить эпилептогенный очаг хирургическим путем.
Метаболические измерения с помощью ПЭТ можно использовать для определения размера инфаркта после ишемического инсульта. Опухоли головного мозга имеют высокие метаболические потребности и сильно васкуляризованы. ПЭТ или фМРТ можно использовать для определения местонахождения опухоли и оценки эффективности лечения.
Взаимопревращений аминокислот в фетально-плацентарной единице: модель на животных и исследования на людях in vivo
Meschia G, Battaglia FC, Hay WW, Sparks JW 1980 Использование субстратов плацентой овцы in vivo. Fed Proc 39 : 245–249
CAS
PubMed
PubMed Central
Google Scholar
Holzman IR, Lemons JA, Meschia G, Battaglia FC 1979 Поглощение аминокислот маткой и баланс глутамин-глутамата через плаценту беременной овцы. J Dev Physiol 1 : 137–149
CAS
Google Scholar
Lemons JA, Adcock EW III, Jones MD Jr, Naughton MA, Meschia G, Battaglia FC 1976 Поглощение аминокислот пуповиной у нестрессированного плода ягненка. J Clin Invest 58 : 1428–1434
CAS
Статья
Google Scholar
Holzman IR, Lemons JA, Meschia G, Battaglia FC 1977 Производство аммиака беременной маткой. Proc Soc Exp Biol Med 156 : 27–30
CAS
Статья
Google Scholar
Jaroszewicz L, Jozwik M, Jaroszewicz K 1971 Активность аминотрансфераз в плаценте человека на ранних сроках беременности. Biochem Med 5 : 436–439
CAS
Статья
Google Scholar
Goodwin GW, Gibboney W, Paxton R, Harris RA, Lemons JA 1987 Активность аминотрансферазы аминокислот с разветвленной цепью и комплекса дегидрогеназы 2-оксокислот с разветвленной цепью в тканях материнской и плодовой овец. Biochem J 242 : 305–308
CAS
Статья
Google Scholar
Chung M, Teng C, Timmerman M, Meschia G, Battaglia FC 1998 Производство и использование аминокислот плацентой овцы in vivo . Am J Physiol 274 : E13 – E22
CAS
Статья
Google Scholar
Marconi AM, Battaglia FC, Meschia G, Sparks JW 1989 Сравнение аминокислотных артериовенозных различий в печени и плаценте ягненка. Am J Physiol 257 : E909 – E910
CAS
Google Scholar
Cetin I, Fennessey PV, Sparks JW, Meschia G, Battaglia FC 1992 Потоки серина плода через печень, задние конечности и плаценту плода на поздних сроках беременности. Am J Physiol 263 : E786 – E793
CAS
Google Scholar
Geddie G, Moores R, Meschia G, Fennessey PV, Wilkening RB, Battaglia FC 1996 Сравнение транспорта лейцина, серина и глицина через плаценту овцы. Плацента 17 : 619–627
CAS
Статья
Google Scholar
Moores RR Jr, Rietberg CC, Battaglia FC, Fennessey PV, Meschia G 1993 Метаболизм и транспорт материнского серина плацентой овцы: производство глицина и отсутствие транспорта серина в плод. Pediatr Res 33 : 590–594
CAS
Статья
Google Scholar
Moores RR Jr, Carter BS, Meschia G, Fennessey PV, Battaglia FC 1994 Потоки серина из плаценты и плода в середине беременности у ягненка. Am J Physiol 267 : E150 – E155
CAS
Google Scholar
Loy GL, Quick AN, Hay WW, Meschia G, Battaglia FC, Fennessey PV 1990 Фетоплацентарное дезаминирование и декарбоксилирование лейцина. Am J Physiol 259 : E492 – E497
CAS
PubMed
Google Scholar
Тиммерман М., Чанг М., Вилкенинг Р. Б., Феннесси П. В., Батталья Ф. К., Мешия Г. 1998 Взаимосвязь поглощения аланина плодами и метаболизма аланина в плаценте с концентрацией аланина в плазме крови матери. Am J Physiol 275 : E942 – E950
CAS
PubMed
Google Scholar
Мейер П.Р., Петерсон Р.Г., Бондс Д.Р., Мешия Дж., Батталья ФК 1981 Скорость синтеза и обновления белка в течение жизни плода. Am J Physiol 240 : E320 – E324
Google Scholar
Anderson AH, Fennessey PV, Meschia G, Wilkening RW, Battaglia FC 1997 Плацентарный транспорт треонина и его использование у нормального плода и плода с задержкой роста. Am J Physiol 272 : E892 – E900
CAS
PubMed
Google Scholar
Cetin I, Fennessey PV, Quick AN Jr, Marconi AM, Meschia G, Battaglia FC, Sparks JW 1991 Оборот и окисление глицина и синтез серина в печени из глицина у плодов ягнят. Am J Physiol 260 : E371 – E378
CAS
Статья
Google Scholar
Guyton TS, de Wilt H, Fennessey PV, Meschia G, Wilkening RB, Battaglia FC 1993 Поглощение аланина из пуповины, скорость удаления и скорость декарбоксилирования в плоде ягненка. Am J Physiol 265 : E497 – E503
CAS
Статья
Google Scholar
Moores RR Jr, Vaughn PR, Battaglia FC, Fennessey PV, Wilkening RB, Meschia G 1994 Метаболизм глутамата в плоде и плаценте овец на поздних сроках беременности. Am J Physiol 267 : R89 – R96
CAS
Google Scholar
Hay WW Jr, Sparks JW, Quissel BJ, Battaglia FC, Meschia G 1981 Одновременные измерения пупочного поглощения, коэффициента утилизации плода и скорости оборота глюкозы плода. Am J Physiol 240 : E662 – E668
CAS
PubMed
Google Scholar
Вон Дж. Р., Лобо С., Батталья ФК, Феннесси П. В., Уилкенинг Р. Б., Мешия Г. 1995 Глутамин-глутаматный обмен между плацентой и печенью плода. Am J Physiol 368 : E705 – E711
Google Scholar
Barbera A, Wilkening RW, Battaglia FC, Meschia G 1997 Метаболические изменения в кровообращении в печени и пуповине плода во время родов, вызванных глюкокортикоидами. Pediatr Res 41 : 242–248
CAS
Статья
Google Scholar
Singh S, Sparks JW, Meschia G, Battaglia FC, Makowski EL 1984 Сравнение показателей метаболизма задних конечностей плода и матери у овец. Am J Obstet Gynecol 149 : 441–449
CAS
Статья
Google Scholar
Wilkening RB, Boyle DW, Teng C, Meschia G, Battaglia FC 1994 Поглощение аминокислот задними конечностями плода овцы при нормальном и эугликемическом гиперинсулинемических состояниях. Am J Physiol 266 : E72 – E78
CAS
PubMed
Google Scholar
Liechty EA, JA Lemons 1984 Изменения в метаболизме аминокислот в задних конечностях плода овцы во время голодания матери. Am J Physiol 246 : E430 – E435.
CAS
PubMed
Google Scholar
Lemons JA, Schreiner RL 1983 Метаболизм аминокислот в плоде овцы. Am J Physiol 244 : E459 – E466
CAS
PubMed
Google Scholar
Cetin I, Marconi AM, Bozzetti P, Piceni Sereni L, Corbetta C, Pardi G, Battaglia FC 1998 Концентрации пуповинных аминокислот у младенцев, подходящих для гестационного возраста и маленьких детей: биохимические различия, присутствующие в утробе матери. Am J Obstet Gynecol 158 : 120–126
Артикул
Google Scholar
Cetin I, Corbetta C, Piceni Sereni L, Marconi AM, Bozzetti P, Pardi G, Battaglia FC 1990 Концентрации пуповинных аминокислот у нормальных и задержанных в росте плодов, образцы in utero с помощью кордоцентеза. Am J Obstet Gynecol 162 : 253–261.
CAS
Статья
Google Scholar
Цетин I, Ronzoni S, Marconi AM, Perugino G, Corbetta C, Battaglia FC, Pardi G 1996 Материнские концентрации и различия в концентрациях аминокислот в плазме у плода и матери при нормальной (AGA) беременности и беременностях с задержкой внутриутробного развития. Am J Obstet Gynecol 174 : 1575–1583
CAS
Статья
Google Scholar
Marconi AM, Cetin I, Buscaglia M, Pardi G 1992 Взятие образцов пуповины во время средней беременности: что мы узнали ?. Плацента 13 : 115–122
CAS
Статья
Google Scholar
Цетин I, Маркони А.М., Баггиани А.М., Бускаглия М., Парди Г., Феннесси П.В., Батталья Ф.К. 1995 г. Плацентарный перенос глицина и лейцина in vivo при беременности человека. Pediatr Res 37 : 571–575
CAS
Статья
Google Scholar
Chien PFW, Smith K, Watt PW, Scrimgeour CM, Taylor DJ, Rennie MJ 1993 Изучение белкового обмена у плода человека в срок с использованием стабильных изотопных индикаторов аминокислот. Am J Physiol 265 : E31 – E35
CAS
PubMed
Google Scholar
Marconi AM, Paolini CL, Stramare L, Cetin I, Fennessey PV, Pardi G, Battaglia FC 1999 Устойчивое обогащение лейцином матери и плода при нормальной беременности и беременностях с задержкой роста плода. Pediatr Res 46 : 114–119
CAS
Статья
Google Scholar
Paolini CL, Marconi AM, Cetin I, Ronzoni S, Pike A, Fennessey PV, Pardi G, Battaglia FC 2000 Плацентарный перенос лейцина, глицина, фенилаланина и пролина in vivo при нормальной и внутриутробной беременности . J Soc Gynecol Investigation 7 : 51A (Aabstr)
Google Scholar
Росс Дж. К., Феннесси П. В., Уилкенинг Р. Б., Батталья ФК, Меския Г. 1996 Плацентарный перенос и использование лейцина плодами в модели задержки роста плода. Am J Physiol 270 : E491 – E503
CAS
Google Scholar
Парди Г., Цетин I, Маркони А.М., Ланфранки А., Бозцетти П., Феррацци Е., Бускаглия М., Батталья ФК 1993 Диагностическая ценность анализа крови у плодов с задержкой роста. N Engl J Med 328 : 692–696
CAS
Статья
Google Scholar
Jansson T 2000 Переносчики аминокислот в плаценте человека. Pediatr Res (в печати)
Связь между повреждающим поведением свиней, санитарными условиями и поступлением белков и аминокислот в рационе
Abstract
Тенденция к снижению уровней сырого протеина ( CP ) в рационах свиней с целью повышения эффективности использования протеина может увеличить возникновение вредных форм поведения, таких как кусание ушей и хвоста, особенно у свиней, содержащихся в неоптимальных условиях здоровья. Мы исследовали, в факторном дизайне 2 × 2 × 2, 576 целых свиней-самцов с хвостовой купировкой в 64 загонах, подвергнутых воздействию низких ( LSC, ) vs.высокие санитарные условия ( HSC ) и кормление нормальным CP ( NP ) по сравнению с диетой с низким CP ( LP , 80% NP) ad libitum с базальным аминокислотным профилем ( AA ) или профиль АА дополнен дополнительными треонином, триптофаном и метионином. Свиньи с HSC были вакцинированы в первые девять недель жизни и получили антибиотики по прибытии на экспериментальную ферму через десять недель, после чего их содержали в продезинфицированной части фермы с соблюдением строгих правил гигиены. Свиньи LSC содержались на той же ферме в недезинфицированных загонах, в которые раз в две недели вводили навоз с другой свинофермы.В возрасте 15, 18 и 24 недель оценивали распространенность повреждений хвоста и ушей, а также ран хвоста и ушей. В возрасте 20 и 23 недель частота укусов и агрессии оценивалась по 10 × 10 минут на загон в неделю. Распространенность повреждения ушей во время фазы откорма (47 против 32% свиней, P <0,0001) и частота прикусывания ушей (1,3 против 1,2 раза в час, P = 0,03) были увеличены в LSC по сравнению с со свиньями HSC. Этот эффект на прикусывание ушей зависел от диеты, однако профиль с добавками AA уменьшал прикусывание ушей только у свиней LSC на 18% (профиль SC × AA, P <0.01). Распространенность ран хвоста была ниже у свиней в LSC (13 ± 0,02), чем у свиней в HSC (0,22 ± 0,03) в фазе выращивания ( P <0,007). Независимо от профиля AA или санитарного статуса, свиньи LP демонстрировали больше укусов (+ 20%, P <0,05), кусания хвоста (+ 25%, P <0,10), обнюхивания (+ 152%, P ). <0,01), другие оральные манипуляции, направленные на товарищей по перу (+ 13%, P <0,05) и агрессию (+ 30%, P <0,01), чем у свиней NP, без влияния на повреждение уха или хвоста.В заключение следует отметить, что как низкие санитарные условия, так и снижение количества диетического белка увеличивают вероятность пагубного поведения у свиней и, следовательно, могут отрицательно сказаться на благополучии свиней. Следует обратить внимание на влияние состава пищевых питательных веществ на поведение и благополучие свиней, особенно когда свиньи содержатся в неоптимальных (санитарных) условиях.
Образец цитирования: Meer Yvd, Gerrits WJJ, Jansman AJM, Kemp B, Bolhuis JE (2017) Связь между повреждающим поведением свиней, санитарными условиями и поступлением белков и аминокислот в рацион.PLoS ONE 12 (5):
e0174688.
https://doi.org/10.1371/journal.pone.0174688
Редактор: Антонио Гонсалес-Булнес, INIA, Испания
Поступила: 9 ноября 2016 г .; Принят в печать: 13 марта 2017 г .; Опубликован: 8 мая 2017 г.
Авторские права: © 2017 Meer et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все данные о повреждениях хвоста и ушей доступны по адресу DOI: 10.4121 / uuid: 5fd53a9f-bd33-4bcb-a20a-f454a026a712. Данные о поведенческих наблюдениях доступны по адресу DOI: 10.4121 / uuid: 0a408400-0144-4c4f-83fc-231d559596de.
Финансирование: Это исследование финансировалось голландским консорциумом Feed4Foodure. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
В свиноводстве сокращение количества диетического белка способствует достижению цели повышения эффективности животноводства в сфере производства питательных веществ. Снижение уровня белка в рационе кажется возможным без ущерба для показателей роста свиней, если в рацион добавляются незаменимые аминокислоты (AA) [1, 2]. Было высказано предположение, однако, что кормление диетами с низким содержанием белка в рационе может увеличить вероятность повреждающего поведения, такого как кусание ушей и хвоста [3, 4].Если определенные питательные вещества ограничивают рост или функционирование иммунной системы, свиньи могут усилить свое поведение в поисках пищи и изменить свои предпочтения в корме, чтобы удовлетворить свои потребности в питании [4]. Действительно, свиньи, получавшие диету с низким содержанием белка, хотя и получали ad libitum, демонстрировали большую активность в поисках пищи, чем свиньи, получавшие диету с адекватным уровнем белка [4]. Свиньи, в свою очередь, могут перенаправить свое естественное поведение в поисках пищи и поисков на товарищей по загону, особенно когда подходящих субстратов для укоренения нет или они очень редко доступны.Прикосновение носа, жевание, укоренение и сосание, направленные на хвосты, уши и другие части тела сородичей, могут привести к сильному укусу и, как следствие, к ранениям [5, 6]. После того, как образовались раны, укусы могут усилиться, особенно у свиней, которых кормили диетами с низким содержанием белка, которых кровь еще больше привлекает [7].
Диетический дисбаланс АА также был связан с агрессивным кусанием. Несколько исследований показывают, что свиньи реагируют на нехватку определенных незаменимых АК, включая метионин ( Met ), треонин ( Thr ) и триптофан ( Trp ), соответствующим образом корректируя свое поведение при выборе корма [8–11].Из-за относительной нехватки АА может усилиться поведение при поиске пищи и перенаправленный кус, и кровь может стать более привлекательной. В соответствии с последним, Макинтайр и Эдвардс [12] обнаружили, что предпочтение жевать пропитанную кровью веревку по сравнению с пропитанной водой веревкой увеличивается, когда свиней кормили диетой с низким содержанием Trp. Повышенное предпочтение крови у свиней, получающих рацион с низким содержанием Trp, может, соответственно, влиять на опасный укус. В подтверждение этого, поросята-отъемыши получали рацион с добавлением свободного Trp в избытке по сравнению с потребностью немного меньше на хвостах и ушах их сородичей по загону [13].
Дефицит белков в пище или дисбаланс АК могут влиять на поведение за счет воздействия на нейротрансмиттеры мозга, поскольку многие из них синтезируются из определенных АК. Влияние пищевой концентрации Trp, например, на агрессивное поведение и стресс, о чем сообщалось у многих видов [14–18], было связано с его ролью в качестве предшественника серотонина (5-гидрокситриптамин; 5-HT ). Недавние исследования предоставили доказательства связи между вредным укусом и 5-HT.Свиньи имели пониженное накопление 5-HT тромбоцитами и более высокую скорость поглощения 5-HT тромбоцитами в те фазы жизни, в течение которых они были классифицированы как кусающие за хвост [19]. Кроме того, Valros et al. [20] сообщили, что метаболизм Trp и центрального 5-HT у кусающих за хвост отличался от метаболизма жертв и тех, кто не кусал.
Помимо влияния диеты на вредное поведение при укусе, плохое состояние здоровья было определено как один из факторов риска этой многофакторной проблемы [21, 22].Например, респираторные заболевания и кусание хвоста, по-видимому, связаны на уровне животных [23] и на уровне фермы [24]. Точная природа взаимосвязи между здоровьем и укусами до конца не изучена. С одной стороны, плохое состояние здоровья или плохие санитарные условия могут привести к увеличению потребности в определенных питательных веществах, особенно в тех, которые участвуют в активации иммунной системы, таких как Trp, и, таким образом, способствовать укусу. С другой стороны, укус также может вызвать проблемы со здоровьем, поскольку он часто приводит к воспалительным реакциям [25], что подтверждают Heinonen et al.[26], которые обнаружили более высокие концентрации в острой фазе в крови у укушенных за хвост свиней по сравнению с контрольными свиньями без укуса хвоста. Наконец, плохое здоровье и опасный укус также могут частично отражать неоптимальное управление, кормление или климатические условия, которые, как известно, усугубляют как проблемы со здоровьем, так и поведенческие проблемы [24, 27, 28], не обязательно являясь причинно-следственными связями. Таким образом, причину и следствие трудно распутать в описываемых до сих пор связях, связанных с укусом здоровья, и, насколько нам известно, не проводилось никаких исследований по теме, в которой состоянием здоровья манипулировали экспериментально, а не только оценивали.
Следовательно, снижение концентрации белка в рационе на свинофермах с плохим состоянием здоровья может усугубить поведенческие проблемы. Поэтому мы изучили комбинированное влияние различных санитарных условий, уровня пищевого белка и профиля АК на перенаправленное поведение при укусе и повреждение хвоста и уха свиней. Параметры продуктивности и здоровья свиней в настоящем исследовании были опубликованы в другом месте [29].
Животные. материалы и методы
Эксперимент был одобрен Комитетом по уходу и использованию животных Университета Вагенингена.
Опытный образец
Был применен факторный план 2 × 2 × 2 с санитарными условиями (высокий: HSC или низкий: LSC), диетическим уровнем сырого протеина (низкий: LP или нормальный: NP) и диетическим профилем AA (базовый: AA- B или дополненный: AA-S ) в качестве экспериментальных факторов на уровне загона.
Животные и лечение
Всего на коммерческой ферме было отобрано 576 поросят Topigs 20 × Tempo (Topigs, Helvoirt, Нидерланды) с куполообразным хвостом.Половина вовлеченных поросят подвергалась обработке LSC, а другая половина — обработке HSC. Поросята для LSC и HSC были отобраны из одних и тех же помещений для опороса и распределялись по пометам; все поросята свиноматки были отобраны либо для LSC, либо для HSC. После отъема (средний возраст 24 дня) свиней LSC и HSC помещали в группы в разные помещения для предотвращения перекрестной вакцинации. Поросята с HSC, а не поросята с LSC, были вакцинированы против Mycoplasma hyopneumoniae , цирковируса свиней типа 2, репродуктивного и респираторного синдрома свиней, Lawsonia intracellularis , Actinobacillus pleuropneumoniae и вируса гриппа A в первые девять недель возраста как указано в Van der Meer et al.[29].
Свиньи HSC и LSC были транспортированы отдельно на другую коммерческую ферму, где проводился эксперимент (Vlierbos V.O.F., Neerloon, Нидерланды) с половиной свиней в возрасте 10 недель и другой половиной в возрасте 11 недель. (две партии по 288 штук; LSC: 144, HSC: 144).
По прибытии свиней распределяли по загонам в зависимости от массы тела ( BW, ), чтобы минимизировать вариации BW между загонами (средняя BW ± стандартная ошибка среднего; LSC партия 1:17.3 ± 0,06 кг, партия LSC 2: 18,1 ± 0,07 кг, партия HSC 1: 15,9 ± 0,07 кг, партия HSC 2: 17,4 ± 0,07 кг). Всего было использовано 64 бетонных загона, каждый загон имел частично решетчатый пол и содержал девять свиней (0,8 м 2 места на свинью). Все ручки были распределены по восьми комнатам; четыре помещения мы выбрали для свиней LSC и четыре помещения для свиней HSC. Каждую экспериментальную диету для каждой комнаты распределяли по двум стойлам, что давало одно повторение лечебной комбинации на комнату. Распределение экспериментального рациона по комнатам производилось случайным образом.Для каждой комбинации лечения было восемь повторов (ручки). В каждой комнате были отдельные ямы для навоза и отдельная система механической вентиляции с отрицательным давлением. Температура в комнатах была установлена на уровне 24 ° C в начале эксперимента и снижалась до 20 ° C во время эксперимента. Помещения LSC не подвергались уборке после содержания предыдущей партии промышленных свиней откорма, которые покинули предприятие за два дня до этого, и к этим помещениям не применялся специальный протокол гигиены. Через пять недель после прибытия свежий навоз другой коммерческой свинофермы вносили в загоны LSC каждые две недели до конца эксперимента для повышения антигенного давления.Свиньи LSC не получали никаких профилактических препаратов. Напротив, свиньи с HSC получали дозу антибиотиков (Fenflor; AUV Veterinary Services BV, Cuijk, Нидерланды; 1 мл / свинью, внутримышечно в 1-й и 3-й день эксперимента) после прибытия в возрасте 10 недель и были помещены в четыре помещения. продезинфицированные помещения в отдельной части свинофермы с соблюдением строгих правил гигиены (см. [29]).
За животными наблюдали в течение всего периода откорма, разделенного на три фазы: фаза закваски (0–34 дня), стадия выращивания (35–49 дней) и фаза откорма (с 50 дня до целевой средней массы загона 110 кг).
Рационы, кормление и анализы
загонов были отнесены к диете с низким уровнем сырого протеина (CP) (LP) или нормальным уровнем CP (NP), каждая из которых имела либо базальный профиль AA, либо дополнительный профиль AA, что привело к четырем различным диетам: ЛП-АА-Б, ЛП-АА-С, НП-АА-Б, НП-АА-С.
Отношение кажущегося перевариваемого в подвздошной кишке (AID) Lys / MJ NE в рационах снижалось на каждой последующей фазе эксперимента, чтобы следовать трехфазной системе кормления. Для рациона NP соотношение Lys / MJ NE было установлено на уровне 95% от требуемых значений для хряков, как опубликовано NRC [30], чтобы предотвратить ограничение калорийности рациона для показателей роста.Соответствующие рационы содержали 0,90 г AID Lys / MJ NE для фазы закваски, 0,81 г AID Lys / MJ NE для фазы выращивания и 0,75 г AID Lys / MJ NE для фазы завершения. Диеты LP были созданы путем снижения уровня включения всех белковосодержащих ингредиентов на 20% в обмен на кукурузный крахмал и целлюлозу, в результате чего были получены рационы с 0,72 г AID Lys / MJ NE для начальной фазы, 0,65 г AID Lys / MJ NE. для фазы выращивания и 0,60 г AID Lys / NE для фазы завершения.
Базальный AA-профиль (AA-B) был разработан для покрытия потребностей в AA для отложения белка в организме [30–32] и для покрытия потерь AA, связанных с базальными эндогенными белками в пищеварительном тракте подвздошной кишки [30, 33], потерями AA в коже. волосы [30] и потери АК, связанные с обновлением клеток и тканей в организме [34], как указано в [29]).Дополненный профиль AA (AA-S) был получен из профиля AA-B путем увеличения соотношения Met, Thr и Trp относительно Lys на основе AID на 20%. Считается, что эти АК становятся все более важными в качестве строительных блоков для синтеза специфических белков, таких как белки острой фазы, синтезируемых в случае активации иммунной системы [35–38], и воздействия на иммунные процессы [39]. Состав рационов показан в таблицах 1–3, а профили AA показаны в данных в файле S1. Расчетное значение NE в таблицах 1–3 было основано на таблице кормов для домашнего скота Центрального бюро Веэвоедер [40].Все диеты были изокалорийными на основе NE и предоставлялись в виде гранул во время эксперимента. На загон имелось одно пространство для кормления и одна ниппельная поилка, а корм и вода предлагались ad libitum .
Рационы были проанализированы на состав АК путем кислотного гидролиза при 110 ° C в течение 23 часов и ионообменной хроматографии с постколоночной дериватизацией нингидрином [41] и Trp путем щелочного гидролиза при 110 ° C в течение 20 часов ионообменной хроматографии с флуоресценцией. обнаружение [42].
Наблюдения за поведением
Свиньи наблюдались в возрасте 20 (фаза выращивания) и 23 (фаза откорма) недельного возраста с использованием выборки поведения.Частоты поведения, описанные в таблице 4, регистрировались во время живых наблюдений с 8.00–12.20 ч и 14.00–16.50 ч в течение двух последовательных дней. В случае непрерывного укуса в течение> 30 секунд, через 30 секунд засчитывалось новое происшествие. За животными в каждом загоне наблюдали 10 × 10 мин, что дало 100 минут наблюдений на загон в неделю наблюдения. Распределение 10-минутных блоков наблюдения в течение дня и в течение двух дней наблюдения было сбалансировано для экспериментальных обработок. Наблюдатели не обращали внимания на диетическое лечение и разделились по загонам, сбалансированным для лечения.Все четыре наблюдателя были обучены одним и тем же человеком перед поведенческими наблюдениями.
Очки повреждений и ранений
Повреждение хвоста регистрировалось в возрасте 15, 18 и 24 недель как индикатор укуса хвоста с использованием следующих баллов, как описано в Ursinus et al. [43]: 1. Нет повреждений хвоста, 2. Следы укусов; тонкие царапины. Отдельные следы укусов имеют размер булавочной головки, 3. Маленькая рана; отчетливо видимое поражение со свежей или засохшей кровью на (верхней части) хвоста, но хвост сохраняет свою длину, 4.Средняя рана; ясно видимое поражение со свежей или засохшей кровью на хвосте и хвост частично укорочен, 5. Тяжелая рана; поражение свежей или засохшей кровью, полностью удаляют хвост. Повреждение уха регистрировалось вместе с оценкой повреждения хвоста. Были зафиксированы только повреждения тыльной стороны ушей. Оценка проводилась следующим образом: 1. Нет повреждений уха, 2. Верхние или нижние повреждения; тонкие царапины, 3. Поражения сверху и снизу; тонкие царапины, 4. Серьезное повреждение, часть уха отсутствует. Эти оценки были определены, как описано Ursinus et al.[43]. Случаи некроза уха получили 5 баллов. Неизвестно, является ли некроз уха результатом укуса уха. Недавние эпидемиологические исследования указывают на возможный путь заражения некрозом ушей через укусы, однако распространение некроза ушей в стадах свиней трудно объяснить только условно-патогенными бактериальными инфекциями [44, 45]. Записывали баллы повреждения обоих ушей, и средний балл обоих ушей использовали для дальнейшего анализа, в результате чего получалось одно значение на свинью за неделю записи для дальнейшего анализа.Свиньи получали двоичную оценку как за повреждение хвоста, так и за повреждение уха: (0) отсутствие повреждений (оценка 1) против (1) повреждение (оценка> 1) за фазу. Точно так же свиньи получали бинарную оценку (0) отсутствие раны (оценка <3 для хвостов и оценка <4 для ушей) по сравнению с (1) рана (оценка> 2 для хвостов и> 3 для ушей) на фазу. . Эти оценки были усреднены по ручкам и фазам и использовались для дальнейшего анализа. В случае оценки повреждения хвоста или ушей> 4, свиней индивидуально лечили спреем с йодом и другим спреем для ран для предотвращения бактериальных инфекций (MS jodium bruin и MS protect verband spray, MS Schippers B.В., Бладел, Нидерланды). Свиньи из эксперимента не удалялись.
Статистический анализ
Статистический анализ выполнялся с использованием SAS (SAS 9.3, Institute Inc.). Перед анализом частоты поведения были усреднены по загонам и фазам (выращивающий и откормочный). Остатки переменных отклика проверялись на нормальность и, при необходимости, преобразовывались в квадратный корень. Все переменные частоты поведения были проанализированы в смешанной модели, которая включала санитарное состояние, диетический уровень CP, пищевой профиль AA, партию, фазу, санитарное состояние × диетический уровень CP и санитарные условия × диетический профиль AA в качестве фиксированных эффектов.Другие взаимодействия были удалены из модели, когда они не были значимыми. Эффект вложенности комнаты в санитарные условия использовался как случайный эффект для корректировки различий между комнатами.
Чтобы проанализировать баллы повреждений, распространенность повреждений была проанализирована путем выражения повреждения как переменной 0–1 (0 = отсутствие повреждений, 1 = повреждение) на свинью за фазу. Усредненные по ручке распространенности были проанализированы по фазам с помощью смешанной модели, которая включала санитарное состояние, диетический уровень CP, диетический профиль AA, партию, санитарные условия × пищевой уровень CP и санитарные условия × диетический профиль AA в качестве фиксированных эффектов.Другие взаимодействия были удалены из модели, когда они не были значимыми. Эффект вложенности комнаты в санитарные условия использовался как случайный эффект для корректировки различий между комнатами. Распространенность ран анализировали путем выражения ран как 0–1 переменной (0 = нет ран, 1 = рана) на свинью на фазу и выражали как распространенность на загон на фазу. Средняя распространенность ран, усредненная по ручке, была проанализирована по фазам с той же моделью, что и усредненная по ручке распространенность повреждений. Все значения представлены как необработанные средние значения ± стандартная ошибка среднего.
Результаты
Наблюдения за поведением
Оральные манипуляции с товарищами по группе происходили чаще (4,1 ± 0,4 раза на свинью в час), чем жевание объекта обогащения (1,0 ± 0,2) и агрессия (2,4 ± 0,3). Оральные манипуляции были менее направлены на хвосты (0,3 ± 0,1), чем на уши (1,5 ± 0,2) или другие части тела, кроме хвоста или ушей (2,3 ± 0,3). Частота обнюхивания была довольно низкой (0,1 ± 0,1), так же, как и при установке (0,4 ± 0,1).
Частота полных оральных манипуляций с товарищами по пентхаусу (жевание или покусывание хвоста, уха или других частей тела) была выше для LSC, чем для HSC свиней (4.5 против 3,8 раз на свинью в час, P ≤ 0,05, таблица 5). На прикусывание ушей влияло взаимодействие между санитарными условиями и диетическим лечением АК ( P ≤ 0,05, рис. 1). Укусы ушей чаще регистрировались у свиней LSC, получавших рацион AA-B, по сравнению с свиньями LSC, получавших рационы AA-S (1,9 против 1,5 раза в час), тогда как частота укусов у свиней HSC была аналогичной для свиней, получавших рацион AA- Диета B и диета AA-S (1,2 против 1,3 раза в час). Для поведения кусания хвоста также была обнаружена взаимосвязь между санитарными условиями и уровнем содержания АК в рационе ( P ≤ 0.05). Кусание хвоста чаще регистрировалось у свиней с HSC, получавших рацион с AA-B, по сравнению со свиньями с HSC, получавших рацион с AA-S (0,4 ± 0,1 против 0,3 ± 0,1 раз в час), тогда как уровень AA в рационе не влиял на частоту кусания хвоста в LSC свиней (0,4 ± 0,1 против 0,4 ± 0,1 раза в час). Санитарные условия, диетический профиль АК или их взаимодействие не влияли на жевание объекта обогащения или на агрессивное поведение.
Рис. 1. Частота укусов у свиней, содержащихся в различных санитарных условиях и получавших диету с низким или нормальным уровнем белка в рационе и базальным или дополнительным аминокислотным профилем.
Прикусывание ушей было зарегистрировано при взятии проб живых животных ad libitum в течение 100 минут на загон в целом. Столбики представляют собой необработанные средние значения на группу лечения ± стандартная ошибка среднего. LSC = низкие санитарные условия, HSC = высокие санитарные условия, LP = низкий уровень сырого протеина в рационе (белые столбики). NP = нормальный диетический уровень сырого протеина (серые столбцы), AA-B = основной диетический аминокислотный профиль (полосатые столбцы), AA-S = пищевой аминокислотный профиль с добавками, содержащий на 20% больше Met, Thr и Trp по сравнению с базальным профилем (пунктирные столбцы), SC = санитарные условия, AA = аминокислотный профиль.
https://doi.org/10.1371/journal.pone.0174688.g001
Таблица 5. Частоты поведения, собранные путем выборки поведения во время фазы выращивания и откорма у свиней, содержащихся в низких или высоких санитарных условиях и обеспеченных рационами, содержащими низкий или нормальный уровень белка и базальный или дополнительный аминокислотный профиль.
https://doi.org/10.1371/journal.pone.0174688.t005
Помимо санитарных условий и профиля АК в рационе, на поведение свиней повлиял также уровень белка в рационе.Свиньи, получавшие LP, показали более высокую частоту полных оральных манипуляций с товарищами по группе (4,4 ± 0,4 против 3,8 ± 0,4 раза в час), укусов ушей (1,6 ± 0,2 против 1,3 ± 0,32 раза в час), манипуляций другими частями тела ( 2,5 ± 0,3 против 2,2 ± 0,3 раза в час), обогащение укусов объекта (1,2 ± 0,2 против 0,8 ± 0,2 раз в час), тотальная агрессия (2,7 ± 0,3 против 2,1 ± 0,3 раза в час), драки (1,3 ± 0,2 против 0,9 ± 0,2 раза в час), обнюхивание (0,2 ± 0,1 против 0,1 ± 0,0 раз в час) (все P ≤ 0.05, Таблица 5, Рис. 2), и тенденция к более высокой частоте кусания хвоста, чем у свиней, получавших NP (0,4 ± 0,1 против 0,3 ± 0,1 раз в час; 0,05 ≤ P ≤ 0,10).
Свиньи, получавшие диету AA-B, имели более высокую частоту нарастания, чем свиньи, получавшие диету AA-S (0,4 ± 0,1 против 0,3 ± 0,1 раза в час, P ≤ 0,05). Установление было зарегистрировано больше для LP, чем свиней, получавших NP, в LSC (0,5 ± 0,1 против 0,4 ± 0,1 раз в час), но меньше для LP, чем для свиней, получавших NP в HSC (0,3 ± 0,1 против 0,4 ± 0.1 раз в час) (санитарные условия × взаимодействие уровня белка в пище, P ≤ 0,05).
Оценка повреждений хвоста и ушей
При рассмотрении распространенности повреждения хвоста как бинарной оценки (повреждение хвоста по сравнению с отсутствием повреждения хвоста), почти у всех свиней были поражения хвоста с оценкой выше 1, т.е. эксперимент. Кроме того, у 39% свиней была рана хвоста (оценка> 2), по крайней мере, в одной из фаз. На эти пропорции не повлияли санитарные условия или диета.
При усреднении бинарных баллов повреждения хвоста на загон и фазу, доля свиней с повреждением хвоста в загонах LSC (0,80 ± 0,03) была выше, чем в загонах HSC (0,65 ± 0,03) в начальной фазе ( P ≤ 0,05; Таблица 6). В фазе выращивания доля свиней с повреждением хвоста в LSC (0,81 ± 0,04) была ниже, чем в HSC (0,92 ± 0,02; P ≤ 0,05, таблица 6). Взаимодействие для повреждения хвоста на завершающей фазе было обнаружено для SC × CP, P ≤ 0,05; Свиньи кормят NP в HSC (0.82 ± 0,04) имели более низкие баллы повреждений, чем свиньи, получавшие LP, в HSC (0,92 ± 0,02), тогда как этот показатель не отличался для свиней в LSC (0,91 ± 0,02 против 0,92 ± 0,02).
Таблица 6. Доля свиней (на основе средних значений загона) с повреждениями хвоста (оценка> 1) и повреждениями ушей (оценка> 1), наблюдаемых для каждой экспериментальной группы: свиньи с низким и высоким санитарным состоянием, оба с рационом, содержащим либо низкий, либо нормальный белок. уровни и базовые или дополненные аминокислотные профили.
https: // doi.org / 10.1371 / journal.pone.0174688.t006
В целом 78% свиней с LSC и 58% свиней с HSC имели по крайней мере на одной фазе оценку повреждения уха выше 1 ( P ≤ 0,05). При усреднении бинарных баллов повреждения уха на загон и фазу, доля животных с повреждением уха была выше в загонах, получавших рацион питания AA-B (0,37 ± 0,04), по сравнению с животными, получавшими рационы AA-S (0,25 ± 0,03) на этапе выращивания P ≤ 0,05). Доля свиней с повреждением уха на этапе выращивания была выше для LSC (0.33 ± 0,04), чем у свиней HSC (0,28 ± 0,04). Для финишной фазы доля повреждений ушей была выше для LSC (0,92 ± 0,02), чем для HSC свиней (0,87 ± 0,02; P ≤ 0,05). Распределение свиней LSC и HSC по оценкам повреждений хвоста и уха представлено в таблицах B и C в файле S1, соответственно.
Если рассматривать распространенность ран хвоста как бинарную оценку (рана хвоста против раны без раны), в LSC меньшая доля свиней имела раны хвоста (0,13 ± 0,02), чем в HSC (0.22 ± 0,03) в фазе выращивания ( P ≤ 0,05; Таблица 7). Диета LP имела тенденцию приводить к более низкой доле свиней с ранами на хвосте (0,32 ± 0,04) по сравнению с диетой NP (0,38 ± 0,04) в фазе выращивания (0,05 ≤ P ≤ 0,10). Доля свиней с раной на хвосте, как правило, была ниже для рациона AA-B (0,20 ± 0,03), чем для рациона AA-S (0,14 ± 0,02) на стадии выращивания (0,05 ≤ P ≤ 0,10). В фазе откорма было обнаружено взаимодействие для SC × CP для доли свиней с ранами на хвосте, в LSC была обнаружена более низкая доля свиней с ранами, когда скармливали диету LP (0.17 ± 0,03) вместо диеты NP (0,24 ± 0,03), тогда как в HSC большая часть свиней имела раны хвоста при кормлении диетой LP (0,22 ± 0,04) вместо диеты NP (0,15 ± 0,04) в фазе выращивания. ( P ≤ 0,05).
Таблица 7. Доля свиней (на основе средних значений загона) с ранами на хвосте (оценка> 2) и ранами уха (оценка> 3), наблюдаемых для каждой группы лечения: свиньи с низким и высоким санитарным состоянием, обе с рационами, содержащими либо низкий, либо нормальный белок. уровни и базовые или дополненные аминокислотные профили.
https://doi.org/10.1371/journal.pone.0174688.t007
При усреднении бинарных баллов для ран уха (баллы> 3 для ран уха против баллов <4 для) по ручке и фазе, многие ручки имели оценку 0 (без ран). Поэтому статистических тестов оценки ран уха не проводилось. Необработанные средние представлены в таблице 7.
Обсуждение
В этом исследовании мы оценили влияние санитарных условий, концентрации белка в рационе и профиля АК в рационе на поведение свиней, содержащихся в практических условиях.Насколько нам известно, это первое исследование повреждающего поведения свиней, которые экспериментально подвергаются различным санитарным условиям и получают различные диетические процедуры в условиях коммерческой фермы. Мы демонстрируем доказательства причинно-следственной связи между санитарными условиями и вредным поведением, указывая на то, что кусающееся поведение, особенно укусы ушей у свиней, связано со статусом здоровья в зависимости от диеты. Кроме того, низкий уровень белка в пище явно увеличивал частоту как повреждающего поведения, так и агрессии.Пищевая добавка Thr, Met и Trp в некоторой степени изменила эти поведенческие реакции у свиней с плохими санитарными условиями или свиней, получавших с низким содержанием белка.
В нашем исследовании укусы ушей и манипуляции с другими частями тела, кроме ушей и хвоста, оценивались чаще, чем укусы хвоста. Учитывая частое возникновение ран хвоста, в экспериментальном хозяйстве применяли купирование хвоста. Это все еще распространенная практика в Нидерландах и многих других странах. Известно, что укусы чаще случаются на фермах с купированными хвостами, вероятно, потому, что купированные хвосты не являются самой привлекательной частью тела для укусов [46].Также в исследованиях на свиньях с неповрежденными [47] и полузакрытыми хвостами [42] укусы ушей и манипуляции с другими частями тела наблюдались чаще, чем укусы хвоста. Оральные манипуляции с товарищами по перу происходили гораздо чаще, чем кусание предоставленного объекта обогащения, вероятно, потому, что части тела сородичей лучше удовлетворяют потребности свиней в подходящих материалах для жевания и укоренения [48] и больше, чем имеющиеся объекты обогащения. .
Хвостовая стыковка, т. Е.ампутация хвоста или его части у молодых свиней до сих пор проводится в нескольких странах ЕС для предотвращения повреждения хвоста в более старшем возрасте [49]. Однако первопричины кусания хвоста не устраняются этой практикой, и раны на хвосте остаются проблемой [20]. Наши результаты, при которых почти у всех свиней наблюдаются как минимум следы укусов, и у 39% свиней на одном из этапов производства имеется небольшая или большая рана на хвосте, подтверждают, что купирование хвоста не является гарантией отсутствия укуса хвоста. Это соответствует другим исследованиям. Например, в исследовании с ирландскими убойными свиньями 99% изученных свиней имели купированный хвост, а 72.5% этих свиней имели повреждения хвоста при убое [50]. В исследовании по наблюдению за свиньями с полускупленными хвостами [42] частота укусов у свиней (1,7 ± 0,1 в час) была выше, чем у свиней за хвост (0,6 ± 0,1 в час), как и в нашем исследовании. В целом, процент свиней с поражением хвоста был выше, чем процент свиней с поражением уха, что позволяет предположить, что, несмотря на его относительно более низкую частоту, кусание хвоста было более серьезным, чем повреждение уха в нашем исследовании.
Вредное поведение и взаимодействие с санитарными условиями и диетой
Свиньи в LSC показали больше укусов (+ 39%) по сравнению со свиньями HSC.Добавки к пище с дополнительными Met, Thr и Trp снижали частоту укусов (-16%) только у свиней LSC. Доля свиней с повреждением уха была выше в LSC, чем в HSC во время фазы выращивания (тенденция) и фазы откорма. Точно так же доля свиней с повреждением хвоста была выше в LSC во время фазы закваски, хотя была обнаружена противоположная доля свиней с повреждением хвоста или ранениями в фазе выращивания. Свиньи с LSC имели более высокие концентрации гаптоглобина в крови и более высокие показатели плеврита в легких на убой, чем свиньи с HSC [29], что подтверждает разницу в состоянии здоровья.Воздействие LSC как на повреждающее поведение, так и на повреждения и раны, которые они вызывают, предполагает причинную связь между плохим здоровьем и возникновением поведенческих проблем.
Повышенная склонность свиней с плохим состоянием здоровья начать кусать своих сородичей может быть связана с повышенной активацией иммунной системы. В соответствии с этим, у кур-несушек стимуляция иммунной реактивности за счет интратрахеального воздействия человеческого сывороточного альбумина, усиление повреждающего расклевывания пера [51], перенаправленное кормление, показывающее сильное сходство с кусанием хвоста у свиней [52].Иммунная стимуляция может привести к изменению потребностей животного в питательных веществах, особенно в АК. Недавние исследования действительно показали, что потребности в Trp [35, 36, 38], Met + цистеин, [37] и Thr [53, 54] повышаются в случае стимуляции иммунной системы. Повышенная активность иммунной системы у растущих животных может перенаправить питательные вещества с роста на другие процессы, требующие АА. Действительно, свиньи LSC в нашем исследовании показали меньшую прибавку массы тела, чем свиньи HSC [29]. Примечательно, что в отличие от большинства исследований с использованием модельных агентов, таких как LPS [37, 55, 56], полный адъювант Фрейнда ( CFA) [38, 57], для стимуляции иммунной системы, различия в санитарном статусе в этом эксперименте происходили строго без свиньи с признаками клинического заболевания.Таким образом, свиньям с неоптимальным здоровьем может потребоваться больше АА для поддержки иммунной системы при сохранении роста. Действительно, особенно у свиней, содержащихся в плохих санитарных условиях, рационы с добавками Met, Thr и Trp приводили к более высокому соотношению привеса к корму и большему приросту живой массы [29]. Если определенные АК ограничивают оптимальное функционирование организма, свиньи могут активизировать свое жевательное и укорененное поведение, чтобы удовлетворить свои потребности в питании, и, в коммерческих условиях, направить часть своего орального поведения на товарищей по загону.Это подтверждается более низкой частотой укусов ушей, зарегистрированной для AA-S, по сравнению с свиньями, получавшими AA-B, в LSC. Частота укусов хвоста, а также оценка повреждений ушей и хвоста у свиней LSC не всегда снижалась дополнительным рационом AA. Первое предполагает, что связь между состоянием здоровья, наличием АК в метаболизме и повреждающим поведением сложна и, возможно, зависит от множества механизмов.
Дисбаланс в АА может также влиять на поведение, изменяя метаболизм нейромедиаторов в головном мозге.Некоторые нейротрансмиттеры головного мозга синтезируются из АК [58, 59]. Треонин является предшественником глицина мозга [60], Met может использоваться в качестве донора метильных групп, используемых для синтеза многих субстратов, таких как холин [61, 62], который является предшественником ацетилхолина [63], и Trp является предшественником. серотонина (5-гидрокситриптамин; 5-HT) [62], нейромедиатора, который, как известно, влияет на поведение и эмоциональное состояние. В нескольких исследованиях на животных и людях [14–18], включая исследования на свиньях [28, 64], было показано, что агрессивное поведение и стресс связаны с поступлением триптофана и / или 5-HT в мозг.Ursinus et al. [19] недавно обнаружили, что свиньи, которые кусают хвосты, имеют пониженный уровень 5-HT в крови, и в соответствии с этим у цыплят, клевавших перья, также обнаружены измененные периферический [65] и центральный метаболизм 5-HT [66, 67]. Это могло быть связано либо с прямым воздействием 5-HT на повреждающее поведение, продемонстрированным экспериментально только для кур [68], либо отражением пониженной доступности АК для синтеза нейромедиаторов, вызванной или не вызванной ухудшением состояния здоровья.
Поскольку Trp конкурирует с другими крупными нейтральными АК ( LNAA ) за прохождение через гематоэнцефалический барьер, соотношение Trp: LNAA в крови является основным определяющим фактором концентрации 5-HT в головном мозге [69].
Несмотря на то, что были различия в соотношении Trp: LNAA между диетами AA-B и AA-S, не было обнаружено явного влияния диетического профиля AA на агрессию и на некоторые из повреждающих форм поведения. Напротив, добавление АК в рацион АК-S приводило к более низким зарегистрированным частотам нарастания, чем у свиней, получавших рацион АК-В. Не совсем ясно, через какие механизмы поступление АК в рационе влияет на поведение роста.
Помимо слабого здоровья свиней, которые с большей вероятностью начнут кусаться, на что также влияет поступление аминокислот с пищей, соотношение укусов здоровья [24, 70, 71] может быть усилено плохой способностью больных свиней избегать укусов. [21].Наконец, можно предположить, что активация иммунитета у раненых свиней (например, [25, 26], в свою очередь, увеличивает вероятность того, что эти свиньи тоже начнут кусаться, что, следовательно, приводит к эскалации кусания хвоста или уха во всей группе.
Уменьшение количества белка в пище: риск вредного поведения?
Практически все зарегистрированные вредные и агрессивные формы поведения чаще оценивались у свиней, получавших диету LP, считающихся с диетическим дефицитом незаменимых аминокислот, чем у свиней, получавших диету NP, что демонстрирует четкое и прямое влияние уровня белка в рационе на повреждающее поведение.Кроме того, более высокая доля свиней с повреждением хвоста и ранами на хвосте была обнаружена в HSC в фазе откорма, когда свиней кормили диетой LP. В исследовании McIntyre и Edwards [12] свиньи имели более высокое предпочтение модели влажного, пропитанного кровью хвоста при кормлении диетой с низким содержанием белка (98 г CP / кг) по сравнению с их предпочтением при кормлении контрольной диетой (189 г CP / кг). кг). Эти результаты показывают, что диета с дефицитом незаменимых аминокислот увеличивает предпочтение крови. Однако они использовали разные источники белка в обоих диетах [12].Поэтому в их исследовании нельзя исключить влияние источника белка, а не только уровня CP. Однако в нашем исследовании одни и те же источники белка с разным уровнем включения использовались в соответствующих диетах. Поскольку среднесуточное потребление корма существенно не отличалось между диетами LP и NP, мы пришли к выводу, что разница в поглощении AA приводит к большему количеству пероральных манипуляций с одноклубниками и большей агрессии.
LP-рационы могли привести к нехватке или дисбалансу AA, что привело к беспокойным свиньям в поисках недостающих питательных веществ.Возможно, некоторые нейротрансмиттеры головного мозга не могут быть синтезированы из АК, полученной из пищевого белка, как было заявлено Харпером и Петерсом [72], просто потому, что было доступно недостаточное количество предшественников. Дисбаланс питания, вероятно, из-за общей нехватки АК в этом случае, может увеличить активность кормления и перенаправленное, разрушительное поведение.
Помимо воздействия на повреждающее поведение, общая нехватка пищевых добавок АК также может быть ответственной за усиление агрессивного поведения у свиней, получавших рационы LP.Диеты LP, независимо от профиля AA, были диетами с более низкой концентрацией Trp по сравнению с диетами NP. Низкая концентрация Trp в головном мозге из-за низкой концентрации Trp в пище может влиять на метаболизм серотонина в мозге, приводя к более агрессивному поведению, как было обнаружено Martinez-Trejo et al. [13], или могут влиять на агрессивное поведение с помощью других гормонов, таких как кортизол или норадреналин, по данным Koopmans et al. [64]. Также влияние концентрации АК на концентрацию инсулина в крови могло сыграть роль, поскольку известно, что инсулин крови также играет роль в захвате Trp в головном мозге [70].
В качестве альтернативы Fraser et al. [7] предположили, что влияние недостаточного уровня незаменимых аминокислот в рационе на поведение при кусании косвенно вызвано более низкой скоростью роста этих животных, а не составом рациона как таковым. В подтверждение этого Мак Интайр и Эдвардс [12] обнаружили тенденцию к корреляции между увеличением массы тела и предпочтением модели «кровяной хвост» по сравнению с моделью «водяного хвоста». Также Ларсен [73] обнаружил, что кусающие хвост свиньи часто были медленнее растущими животными. Напротив, Ursinus et al.[42] сообщили о более высоком фенотипическом и генотипическом росте у фанатиков, кусающих хвост. Эти авторы предположили, что быстрорастущие свиньи и свиньи с низкой скоростью роста из-за проблем со здоровьем могут иметь высокую метаболическую потребность в синтезе белка для мышечной ткани или общих иммунных процессах, что может объяснить их повышенную склонность к укусу. Также сообщалось, что большая разница в размерах животных в одном загоне отрицательно влияет на поведение при кусании [21]. При вычислении стандартной ошибки для веса тела на загон в нашем исследовании стандартная ошибка была выше для LSC, чем для животных HSC, что означает, что вариация веса на загон была выше у животных LSC.При вычислении этой стандартной ошибки для веса тела с измеренным поведением не было обнаружено четкой корреляции.
Даже если скорость роста связана с укусами, необходимы дополнительные исследования для определения причин и следствий, а также для изучения воздействия потенциально общего основного фактора, такого как, например, фактическое состояние или плохое состояние здоровья в анамнезе. Таким образом, низкобелковая диета с дефицитом незаменимых АК должна рассматриваться как фактор риска укусов и агрессии у свиней, которым можно лишь частично противодействовать добавлением определенных незаменимых АК, таких как Met, Thr и Trp.
В заключение, это исследование показывает причинно-следственную связь между санитарными условиями, диетическим уровнем CP и вредным поведением. Как LSC, так и снижение уровня ХП в рационе увеличивают вероятность повреждающего поведения у свиней и, следовательно, могут отрицательно сказаться на благополучии свиней. Этим эффектам можно лишь частично противодействовать добавлением определенных незаменимых АК, которые, как известно, все чаще требуются в случае активации иммунной системы.
Прикусывание хвоста и уха, несомненно, является многофакторной проблемой, и борьба с ней требует многопрофильных усилий.Это исследование демонстрирует, что необходимо соблюдать осторожность при снижении концентрации белка в рационе для повышения эффективности использования белка у свиней, даже при сохранении соотношения наиболее важных незаменимых аминокислот к энергии. Это создает риск более агрессивного поведения, особенно когда свиньи содержатся в плохих санитарных условиях.
Вспомогательная информация
Файл S1.
Таблица A. Составленные диетические профили аминокислот относительно лизина на очевидном уровне усвояемости подвздошной кишки, скармливаемые в сочетании с различными уровнями пищевого белка свиньям, содержащимся в различных санитарных условиях. 1 AA-B = основной диетический аминокислотный профиль; Профиль AA-S = профиль добавленных аминокислот с 20% дополнительными Met, Thr и Trp, чем базальный профиль. Таблица B. Процент свиней в различных категориях повреждений хвоста по результатам наблюдений, проведенных на всех этапах для низких и высоких санитарных условий. Оценка 1: Нет повреждений хвоста; 2: Следы укусов; 3: небольшая рана; 4: Средняя рана, часть хвоста отсутствует; и 5: Тяжелая рана, хвоста не осталось. LSC: свиньи с низким санитарным состоянием, HSC: свиньи с высоким санитарным состоянием. Таблица C. Процент свиней с различными категориями повреждений уха по результатам наблюдений, проведенных на всех этапах для низких и высоких санитарных условий. Оценка 1: Нет повреждений уха, 2: Верхние или нижние поражения, 3: Верхние и нижние поражения, 4: Серьезные повреждения, часть уха отсутствует и 5: некроз уха. LSC: свиньи с низким санитарным состоянием, HSC: свиньи с высоким санитарным состоянием.
https://doi.org/10.1371/journal.pone.0174688.s001
(DOCX)
Благодарности
Авторы выражают благодарность.Ф. ван ден Берг, А. К. Бартельс, М. Оомс, Г. Де Фрис-Рейлинг и всем участвовавшим студентам за их помощь во время этого эксперимента. Авторы также благодарят H. van Diepen и J. Kuipers за их советы и поддержку при составлении экспериментальных диет.
Вклад авторов
- Концептуализация: JB YM.
- Обработка данных: YM.
- Формальный анализ: YM.
- Получение финансирования: WG AJ.
- Расследование: Ю.М.
- Методология: YM WG JB.
- Администрация проекта: AJ WG.
- Ресурсы: Ю.М.
- Авторский надзор: WG JB AJ BK.
- Подтверждение: WG JB YM.
- Визуализация: WG JB YM.
- Написание — первоначальный эскиз: YM JB.
- Написание — просмотр и редактирование: YM JB WG AJ BK.
Ссылки
- 1.
Gloaguen M, Le Floc’h N, Corrent E, Primot Y, van Milgen J. Использование свободных аминокислот позволяет составлять рационы с очень низким содержанием сырого протеина для поросят. J Anim Sci. 2014. 92 (2): 637–644. pmid: 24398840 - 2.
Керр Б.Дж., Пасха РА. Влияние рациона с пониженным содержанием белка и аминокислот на азотный и энергетический баланс свиней-производителей. J Anim Sci. 1995. 73 (10): 3000–3008. pmid: 8617671 - 3.
Иерихон К., Черч Т.Каннибализм у свиней. Кан Вет Дж. 1972; 13 (7): 156. pmid: 5041147 - 4.
Дженсен МБ, Кириазакис I, Лоуренс А.Б. Активность и направленное поведение свиней предлагали корма с различным содержанием сырого протеина. Appl Anim Behav Sci. 1993. 37 (3): 211–21. - 5.
Битти В.Е., В.Е. МАС, Уокер Н., Уэтерап Р. Обогащение окружающей среды интенсивного свиноводства с использованием компоста из отработанных грибов. Anim Sci. 2001; 71: 35–42. - 6.
Zonderland JJ, Wolthuis-Fillerup M, Van Reenen CG, Bracke MBM, Kemp B, Den Hartog LA, et al.Профилактика и лечение кусания хвоста у поросят-отъемышей. Appl Anim Behav Sci. 2008. 110 (3): 269–281. - 7.
Фрейзер Д., Бернон Д.Е., Болл РО. Повышенное влечение свиней к крови при недостаточном содержании белков в рационе. Может J Anim Sci. 1991. 71 (3): 611–619. - 8.
Roth FX, Meindl C, Ettle T. Доказательства того, что поросенок выбрал метионин в рационе. J Anim Sci. 2006. 84 (2): 379–386. pmid: 16424266 - 9.
Эттл Т., Рот FX. Конкретный выбор рациона поросят на триптофан 1.J Anim Sci. 2004. 82 (4): 1115–1121. pmid: 15080334 - 10.
Эттл Т., Рот FX. Диетические предпочтения в отношении кормов с разной концентрацией треонина у поросят. Physiol Behav. 2005. 85 (3): 289–295. pmid: 15941574 - 11.
Эттл Т., Рот FX. Селекция рациона на лизин поросятами при разном режиме кормления. Livest Sci. 2009. 122 (2): 259–263. - 12.
Макинтайр Дж, Эдвардс С.А. Исследование влияния различного потребления белка и энергии на поведение модели при жевании хвоста у растущих свиней.Appl Anim Behav Sci. 2002. 77 (2): 93–104. - 13.
Мартинес-Трехо Дж., Ортега-Серрилья М., Родарте-Коваррубиас Л., Эррера-Аро Дж., Фигероа-Веласко Дж., Галиндо-Мальдонадо Ф. и др. Агрессивность и продуктивность поросят с добавкой триптофана. J Anim Vet Adv. 2009; 8: 608–11. - 14.
Чемберлен Б., Эрвин Ф. Р., Пил Р. О., Янг С. Н.. Влияние повышения или понижения уровня триптофана на агрессию у мартышек. Pharmacol Biochem Be. 1987. 28 (4): 503–510. - 15.
Гиббонс Дж.Л., Барр Г.А., Бриджер У.Х., Либовиц С.Ф. Манипуляции с диетическим триптофаном: влияние на убийство мышей и серотонин мозга у крыс. Brain Res. 1979. 169 (1): 139–153. pmid: 572256 - 16.
Лепаж О, Тоттмар О, Винберг С. Повышенное потребление L-триптофана с пищей противодействует вызванному стрессом повышению уровня кортизола в плазме у радужной форели (Oncorhynchus mykiss). J Exp Biol. 2002. 205 (23): 3679–3687. - 17.
Саломон Р.М., Мазуре К.М., Дельгадо П.Л., Мендиа П., Чарни Д.С.Функция серотонина при агрессии: эффект острого истощения триптофана в плазме у агрессивных пациентов. Biol Psychiat. 1994. 35 (8): 570–572. pmid: 8038301 - 18.
Винберг С., Эверли Ø, Лепаж О. Подавление агрессии радужной форели (Oncorhynchus mykiss) диетическим l-триптофаном. J Exp Biol. 2001. 204 (22): 3867–3876. - 19.
Урсинус В.В., Ван Ринен К.Г., Реймерт И., Болхуис Дж. Э. Кусание хвоста свиньям: серотонин в крови и страх как части пазла? PloS один.2014; 9 (9): e107040. pmid: 25188502 - 20.
Валрос А., Хейнонен М. Спасите свиньи хвосты. Управление здоровьем свиней. 2015; 1 (1): 1–7. - 21.
Тейлор Н.Р., главный DCJ, Мендл М., Эдвардс С.А. Кусание за хвост: новая перспектива. Вет Дж. 2010; 186 (2): 137–47. pmid: 19804997 - 22.
Шредер-Петерсен DL, Симонсен HB. Кусание за хвост у свиней. J. 2001; 162 (3): 196–210. - 23.
Критас С.М., Моррисон РБ. Связь между укусом хвоста у свиней и болезнями и осуждением при убое.Vet Rec. 2007. 160: 149–152. pmid: 17277296 - 24.
Мойнар С., Мендл М., Николь С.Дж., Грин ЛЭ. Исследование факторов риска на ферме у свиней при укусе хвоста. Appl Anim Behav Sci. 2003. 81 (4): 333–355. - 25.
Мюнстерхельм К., Симола О., Килинг Л., Валрос А., Хейнонен М. Параметры здоровья у кусающих хвост и укушенных свиней в исследовании случай – контроль. Животное. 2013; 7 (05): 814–821. - 26.
Хейнонен М., Орро Т., Кокконен Т., Мюнстерхельм К., Пелтониеми О., Валрос А.Кусание хвоста вызывает сильную острофазовую реакцию и воспаление хвоста у свиней на откорме. Вет Дж. 2010; 184 (3): 303–307. pmid: 19398209 - 27.
Zonderland JJ, Bracke MBM, den Hartog LA, Kemp B, Spoolder HAM. Влияние пола на развитие повреждений хвоста в однополых или смешанных группах поросят-отъемышей. Livest Sci. 2010. 129 (1): 151–158. - 28.
Эдвардс С. Кусание хвоста свиньям: понимание неразрешимой проблемы. Вет Дж. 2006; 171 (2): 198–199. pmid: 156 - 29.ван дер Меер Y, Ламмерс А., Янсман А.Д.М., Рейнен MMJA, Хендрикс WH, Герритс В.Дж. Продуктивность свиней, содержащихся в различных санитарных условиях, зависит от потребления белка и добавок аминокислот. Журнал зоотехники. 2016. Fortcoming
- 30.
NRC. Потребности свиней в питательных веществах. 11-е изд. Вашингтон, округ Колумбия: Национальная академия. Пресс, 2012. - 31.
Bikker P, Verstegen MWA, Bosch MA. На аминокислотный состав растущих свиней влияет потребление белка и энергии.J. Nutr. 1994; 124: 1961–1969. pmid: 7931705 - 32.
Le Bellego L, Noblet J. Эффективность и использование диетической энергии и аминокислот у поросят, получавших рацион с низким содержанием белка. LivestProd Sci. 2002. 76 (1–2): 45–58. - 33.
Jansman AJM, Smink W, van Leeuwen P, Rademacher M. Оценка количества и аминокислотного состава базального эндогенного сырого протеина в подвздошной кишке свиней на основе литературных данных. Anim Feed Sci Tech. 2002. 98 (1–2): 49–60. - 34.Moughan PJ. Обмен белков у растущей свиньи. В: Кириазакис. Количественная биология свиньи. CABI Publishing; 1998. С. 299–331.
- 35.
Melchior D, Sève B, Le Floc’h N. Хроническое воспаление легких влияет на концентрацию аминокислот в плазме у свиней. J Anim Sci. 2004. 82 (4): 1091–1099. pmid: 15080331 - 36.
Le Floc’h N, Melchior D, Sève B. Диетический триптофан помогает сохранить гомеостаз триптофана у свиней, страдающих воспалением легких.J Anim Sci. 2008. 86 (12): 3473–3479. pmid: 18676721 - 37.
Rakhshandeh A, Htoo JK, de Lange CFM. Стимуляция иммунной системы растущих свиней не влияет на очевидную перевариваемость аминокислот в подвздошной кишке, но снижает соотношение между удерживанием азота и серы в организме. Livest Sci. 2010. 134 (1–3): 21–23. - 38.
Le Floc’h N, Gondret F, Matte JJ, Quesnel H. К рекомендациям по аминокислотам для конкретных физиологических и патофизиологических состояний у свиней. P Nutr Soc.2012. 71 (03): 425–432. - 39.
Ву Г. Аминокислоты: обмен веществ, функции и питание. Аминокислоты. 2009; 37: 1–17. pmid: 19301095 - 40.
Центральное бюро Veevoeder (CVB). Химический состав и пищевая ценность кормовых ингредиентов. Нидерланды, Лелистад: CVB; 2011. - 41.
Международная организация по стандартизации (ISO). 2005a. ISO 5983–1: 2005. Корма для животных — Определение содержания азота и расчет содержания сырого протеина — Часть 1: Метод Кьельдаля.ISO, Женева, Швейцария. - 42.
Международная организация по стандартизации (ISO). 2005b. ISO 13904: 2005. Корма для животных. Определение содержания триптофана. ISO, Женева, Швейцария. - 43.
Ursinus WW, Wijnen HJ, Bartels AC, Dijvesteijn N, van Reenen CG, Bolhuis JE. Пагубное поведение при клевке у интенсивно выращиваемых свинок: влияние джутовых мешков и взаимосвязь с производственными характеристиками. J Anim Sci. 2014. 92 (11): 5193–5202. pmid: 25253806 - 44.Karlsson F, Svartström O, Belák K, Fellström C, Pringle M. Встречаемость Treponema spp. при язвах свиной кожи и десен. Vet Microbiol. 2013. 165 (3): 402–409.
- 45.
Прингл М., Бакханс А., Отман Ф., Шёлунд М., Феллстрём С. Изоляция спирохет рода Treponema от свиней с некрозом ушей. Vet Microbiol. 2009. 139 (3): 279–283. - 46.
Goossens X, Sobry L, Odberg F, Tuyttens F, Maes D, De Smet S и др. Протокол оценки популяции на ферме для сравнения благополучия свиней на разных фермах.Anim Welfare. 2008; 17 (1). - 47.
Камерлинк I, Урсинус В.В., Биджма П., Кемп Б., Болхуис Дж. Косвенные генетические эффекты, влияющие на скорость роста домашних свиней, изменяют агрессивное и манипулятивное поведение при укусе. Behav Genet. 2015; 45 (1): 117–126. pmid: 25227986 - 48.
Ван де Верд HA, Docking CM, Day JEL, Avery PJ, Edwards SA. Системный подход к обогащению окружающей среды для свиней. Appl Anim Behav Sci. 2003. 84 (2): 101–118. - 49.
Сазерленд MA, Tucker CB.Вкратце: обзор купирования хвоста у сельскохозяйственных животных. Appl Anim Behav Sci. 2011; 135 (3): 179–191. - 50.
Харли С., Бойл Л.А., О’Коннелл Н.Э., Мор С.Дж., Тейшейра Д.Л., Хэнлон А. Доказательство ценности свинины? Распространенность и финансовые последствия нарушений благополучия ирландских убойных свиней. Anim Welfare. 2014. 23 (3): 275–285. - 51.
Parmentier HK, Rodenburg TB, De Vries Reilingh G, Beerda B, Kemp B. Предрасполагает ли усиление специфических иммунных реакций курам-несушкам к расклеванию перьев? Poultry Sci.2009. 88 (3): 536–542. - 52.
Роденбург ТБ, Кун П. Влияние размера группы на вредное поведение, агрессию, страх и стресс у сельскохозяйственных животных. Appl Anim Behav Sci. 2007. 103 (3–4): 205–214. - 53.
Рен М., Лю XT, Ван X, Чжан Г.Дж., Цяо С.Ю., Цзэн XF. Повышенные уровни стандартизированного перевариваемого в подвздошной кишке треонина ослабляют повреждение кишечника и иммунные ответы у поросят-отъемышей, зараженных Escherichia coli K88 +. Anim Feed Sci Tech. 2014; 195: 67–75. - 54.Ли П., Инь И-Л, Ли Д., Ву Ким С., Ву Г. Аминокислоты и иммунная функция. Brit J Nutr. 2007. 98 (02): 237–252.
- 55.
Ким Дж. К., Муллан Б. П., Фрей Б., Пейн Х. Г., Плюске-младший. Отложения белков во всем организме и аминокислотные профили в плазме у растущих и / или откормленных свиней, получавших возрастающие уровни серосодержащих аминокислот с липополисахаридной провокацией Escherichia coli и без нее. J. Anim. Sci. 2012; 90: 362–365. pmid: 23365380 - 56.
де Риддер К., Левеск К.Л., Хтоо Дж.К., де Ланге CFM.Стимуляция иммунной системы снижает эффективность использования триптофана для отложения белка в организме растущих свиней. J. Anim. Sci. 2012; 90: 3485–3491. pmid: 22851250 - 57.
Кампман-ван де Хук Э., Саккас П., Герритс В. Дж. Дж., Ван ден Борн Дж. Дж. Дж., Янсман А. Дж. М.. Вызванное воспаление легких и поступление белка в рацион влияют на удержание азота и метаболизм аминокислот у растущих свиней. Br. J. Nutr. 2015; 113: 414–425. pmid: 25604632 - 58.
Андерсон Г.Х. Контроль потребления белка и энергии: роль аминокислот в плазме и нейромедиаторов головного мозга.Может J Physiol Pharm. 1979; 57 (10): 1043–1057. - 59.
Мэсси К.А., Блэйксли СН, Питкоу Х.С. Обзор физиологических и метаболических эффектов незаменимых аминокислот. Аминокислоты. 1998. 14 (4): 271–300. pmid: 9871473 - 60.
Castagné V, Moënnoz D, Finot PA, Maire JC. Эффекты гипертреонинемии, вызванной диетой. I) уровни аминокислот в центральной нервной системе и периферических тканях. Life Sci. 1993; 53 (24): 1803–1810 PMID: 8246679 - 61.
Берк К.А., Нистром Р.Ф., Джонсон Британская Колумбия.Роль метионина как донора метила для синтеза холина у цыплят. J Biol Chem. 1951; 188 (2): 723–728.61. pmid: 14824160 - 62.
Rodwell VW. Превращение аминокислот в специализированные продукты. В: Murray RK, Granner DK, Mayes PA, Rodwell VW, редакторы. Harper’s Illustrated Biochemistry, 26-е издание, США: компании Mc Graw-Hill; 2003. С. 264–269. - 63.
Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO и др. Ацетилхолин. Neuroscience 2 nd edition.Сандерленд: Sinauer Associates; 2001. - 64.
Купманс С.Дж., Руис М., Деккер Р., ван Дипен Х., Корте М., Мроз З. Избыток триптофана в рационе снижает концентрацию кортизола и норадреналина в плазме и ускоряет восстановление после социального стресса у свиней. Physiol Behav. 2005. 85 (4): 469–478. pmid: 15996691 - 65.
Bolhuis JE, Ellen ED, Van Reenen CG, De Groot J, Napel JT, Koopmanschap RE и др. Влияние генетического группового отбора против смертности на поведение и периферический серотонин у домашних кур-несушек с обрезанными и неповрежденными клювами.Physiol Behav. 2009. 97 (3–4): 470–475. pmid: 19341749 - 66.
Kops MS, de Haas EN, Rodenburg TB, Ellen ED, Korte-Bouws GAH, Olivier B и др. Влияние фенотипа клевания пера (сильное клевание пера, жертвы и не клювы) на серотонинергическую и дофаминергическую активность в четырех областях мозга кур-несушек (Gallus gallus domesticus). Physiol Behav. 2013; 120: 77–82. pmid: 232
- 67.
Kops MS, Kjaer JB, Güntürkün O, Westphal KGC, Korte-Bouws GAH, Olivier B и др.Высвобождение серотонина в хвостовом нидопаллии взрослых кур-несушек, генетически отобранных для высокого и низкого расклевывания пера: исследование микродиализа in vivo. Behav Brain Res. 2014; 268: 81–87. pmid: 24720936 - 68.
ван Хирден Ю.М., де Бур С.Ф., Колхас Ю.М., Корте С.М. Контроль клевания пера серотонином. Behav Neurosci. 2004; 118 (3): 575. pmid: 15174935 - 69.
Wurtman RJ, Fernstrom JD. Контроль синтеза моноаминов в мозге с помощью диеты и аминокислот в плазме.Am J Clin Nutr. 1975. 28 (6): 638–647. pmid: 1093382 - 70.
Критас СК, Моррисон РБ. Связь между укусом хвоста у свиней и болезнями и осуждением при убое. Vet Rec. 2007. 160 (5): 149–152. pmid: 17277296 - 71.
Marques BMFPP, Bernardi ML, Coelho CF, Almeida M, Morales OE, Mores TJ и др. Влияние кусания хвоста на прибавку в весе, поражения и потери при убое свиней на откорме. Бюстгальтеры Pesq Vet. 2012; 32: 967–974. - 72.
Харпер AE, Питерс JC.Потребление белка, концентрация аминокислот и серотонина в мозге и самостоятельный выбор белка. J Nutr. 1989. 119 (5): 677–689. pmid: 2656935 - 73.
Ларсен С.

