Функция казеин: Казеин: ответы на популярные вопросы.
Казеин: ответы на популярные вопросы.
26. 09. 2018
Казеиновый протеин выделяется на фоне остальных видов товаров с высоким содержанием белка в магазине спортивного питания. О сыворотке знает практически каждый, а о казеине – лишь опытные спортсмены. Сегодня мы ответим на самые популярные вопросы об этой «темной лошадке».
Чем полезен казеин?
Казеин представляет собой сложный белок, получаемый из молока коровы с помощью процесса створаживания. Белок молока состоит на 80% из казеина, а оставшаяся часть – это сывороточный протеин. При этом в молоке он находится не в свободной форме, а в виде соединения с кальцием (казеинит кальция).
Казеин играет важную роль в обеспечении непрерывного и равномерного синтеза белка в течение длительного периода времени. Эту функцию он выполняет благодаря богатому составу аминокислот. А особое свойство сворачиваться в шарики замедляет процесс переваривания пищи, активируя медленное высвобождение аминокислот и их эффективное использование в качестве строительного материала для мышечных волокон. Поэтому протеин не подвергается разрушению, а аминокислоты используются по прямому назначению, а не в качестве источника энергии.
Поэтому протеин не подвергается разрушению, а аминокислоты используются по прямому назначению, а не в качестве источника энергии.
Казеиновый протеин придает спортсмену чувство сытости, не искушая его нарушать диету. Организм получает достаточную дозу белковых соединений и избавляется от чувства голода.
Подведем небольшой итог. В чем же польза казеина:
— обильный состав аминокислот;
— непрерывное питание мышц;
— предотвращение распада белка;
— эффективное применение аминокислот;
— придание сытости.
Поэтому казеин занял важную нишу в индустрии спортивного питания.
Чем казеиновый протеин отличается от сывороточного?
Отличительной особенностью казеинового белка от сывороточного является его медленное усвоение. То есть его аминокислоты поступают медленно, тем самым сохраняя оптимальный азотный баланс продолжительное время. А это важный фактор при наборе мышечной массы.
Еще одно отличие – это замедление максимального анаболического эффекта путем менее быстрого расщепления протеина. Этот процесс возможен из-за меньшего содержания лейцина по сравнению с сывороткой: 8 против 11. Эта аминокислота с разветвленной боковой цепью стимулирует выработку белковых соединений для построения мышечных тканей и уменьшает разрушение белка, что благоприятно сказывается на объеме мышц. Поэтому сыворотка проявляет анаболические свойства в большей степени, чем казеин. У него другая функция – поддержание равномерного снабжения мышц аминокислотами.
Этот процесс возможен из-за меньшего содержания лейцина по сравнению с сывороткой: 8 против 11. Эта аминокислота с разветвленной боковой цепью стимулирует выработку белковых соединений для построения мышечных тканей и уменьшает разрушение белка, что благоприятно сказывается на объеме мышц. Поэтому сыворотка проявляет анаболические свойства в большей степени, чем казеин. У него другая функция – поддержание равномерного снабжения мышц аминокислотами.
Таким образом, быстроусвояемые белки необходимы до и после тренировки, когда мышцы больше всего испытывают в них дефицит. С этим отлично справится сывороточный протеин. Казеиновый же будет идеальным вариантом для приема перед сном или между длительными промежутками времени без пищи, когда мышечные ткани нуждаются в питании и восстановлении.
Итог: сыворотка больше подходит для набора мышц, а казеин – для уменьшения эффекта катаболизма и восстановления после тяжелого дня.
Как улучшить эффект от приема казеина?
Так как казеин – это медленноусвояемый протеин, то для лучшего результата необходимо дополнять его быстрыми белками или аминокислотами. Например, тем же сывороточным протеином или комплексом ВСАА. Так организм будет обеспечен и быстрым, и постоянным питанием мышц аминокислотами.
Например, тем же сывороточным протеином или комплексом ВСАА. Так организм будет обеспечен и быстрым, и постоянным питанием мышц аминокислотами.
Как принимать казеин?
Казеин подойдет любому спортсмену, который стремится получить достаточную дозу белка из своего рациона. Но, в первую очередь, он будет просто идеальным вариантом для людей, у которых аллергия на сывороточный или яичный протеин.
Аллергическая реакция на казеин – достаточно редкое явление. Она выражается в расстройстве работы желудочно-кишечного тракта. Но в любом случае не следует употреблять сверхбольшие порции казеинового протеина, так как это может привести к дискомфорту, например, метеоризму. Поэтому необходимо следовать рекомендованной дозировке даже тем, для кого он не является аллергеном.
Пить казеин нужно в ночной период или между длительными перерывами без пищи. Медленный белок не позволит мышцам остаться без питания в течение долгого времени. Это свойство защитит мышечные ткани от катаболизма, что подтверждается многочисленными исследованиями. Наиболее предпочтителен прием казеинового протеина перед сном.
Наиболее предпочтителен прием казеинового протеина перед сном.
Размер ежедневной порции казеина зависит от множества факторов:
— масса;
— возраст;
— пол;
— количество белка, получаемого из обычной пищи;
— наличие в рационе другого спортивного питания;
— тренировочная программа;
— режим сна и отдыха.
Если спортсмен комбинирует казеин с другими видами протеина, но порция будет меньше, в противном случае – больше. Если он нужен только для восстановления, то порцию можно уменьшить, но если требуется увеличить анаболический эффект, то и порция должна быть соответствующая. Например, для атлета весом 90кг оптимальная порция – 45г при условии работы на массу.
Казеин обеспечивает непрерывное высвобождение аминокислот в течение длительного периода времени, снабжая мышечные ткани белками для роста и восстановления. Его прием перед отходом ко сну убережет мышцы от разрушения и улучшит анаболический эффект.
Если спортсмен не употребляет пищу четыре часа и более, то казеиновый протеин снова придет на помощь. Тогда его целесообразно принимать и днем, чтобы постоянно насыщать мышцы аминокислотами.
Тогда его целесообразно принимать и днем, чтобы постоянно насыщать мышцы аминокислотами.
Для лучшего результата нужно совмещать казеин с быстроусвояемыми белками и не забывать о полноценном и разнообразном питании.
Казеин – верный помощник атлета, который поддержит, когда нет возможности принять пищу долгое время. Он снабдит организм медленными белками и обеспечит непрерывную подпитку мышц. Он сделает Вас еще на шаг ближе к заветной цели.
Казеин
Казеин
Казеи́н (лат. caseus — сыр) — сложный белок, образующийся из предшественника казеина — казеиногена при створаживании молока под действием протеолитических ферментов. Является основным белком молока, содержание в коровьем молоке в период лактации 2,8-3,5% по массе (сывороточных белков 0,5%), в женском — в два раза меньше. Присутствует в молоке в несвободном виде — в казеинате кальция. Составляет основную массу творога и сыра. Применяется в производстве красок, клеев, пластмасс, искусственных пищевых продуктов. По структуре относится к фосфопротеинам. Относится к запасным белкам, представляет собой смесь нескольких фосфопротеидов.В коровьем молоке казеин составляет (от всех белков молока) около 80%. Содержание αs1- казеина, αs2-казеина, β-казеина и κ-казеина от всего казеина составляет соответственно 54,2, 30,1 и 13,3%. Во фракцию казеина входит также g-казеин (2,5% от всего казеина) — продукт частичного протеолиза b-казеин, катализируемого протеиназой молока. Основные компоненты казеина имеют генетические варианты, отличающиеся аминокислотными остатками. Состав казеина молока, по Комайлю и Миллону: С — 55,24%, Н — 8,26, N — 16,70, a по Читтендену и Пейнтеру: С — 53,30, H — 7,07, N — 15,91, S — 0,82, P — 0,87. Изучена первичная структура всех казеинов и их физико-химические свойства. Эти белки имеют молярную массу около 20 тыс., изоэлектрическую точку (рI) 4,7. Содержат повышенное количество пролина (полипептидная цепь имеет b-структуру), устойчивы к действию денатурантов.Остатки фосфорной кислоты (обычно в виде Са-соли) образуют сложноэфирную связь главным образом с гидроксигруппой остатков серина.
По структуре относится к фосфопротеинам. Относится к запасным белкам, представляет собой смесь нескольких фосфопротеидов.В коровьем молоке казеин составляет (от всех белков молока) около 80%. Содержание αs1- казеина, αs2-казеина, β-казеина и κ-казеина от всего казеина составляет соответственно 54,2, 30,1 и 13,3%. Во фракцию казеина входит также g-казеин (2,5% от всего казеина) — продукт частичного протеолиза b-казеин, катализируемого протеиназой молока. Основные компоненты казеина имеют генетические варианты, отличающиеся аминокислотными остатками. Состав казеина молока, по Комайлю и Миллону: С — 55,24%, Н — 8,26, N — 16,70, a по Читтендену и Пейнтеру: С — 53,30, H — 7,07, N — 15,91, S — 0,82, P — 0,87. Изучена первичная структура всех казеинов и их физико-химические свойства. Эти белки имеют молярную массу около 20 тыс., изоэлектрическую точку (рI) 4,7. Содержат повышенное количество пролина (полипептидная цепь имеет b-структуру), устойчивы к действию денатурантов.Остатки фосфорной кислоты (обычно в виде Са-соли) образуют сложноэфирную связь главным образом с гидроксигруппой остатков серина. Высушенный казеин — белый порошок без вкуса и запаха, практически не растворимый в воде и органических растворителях, растворяется в водных растворах солей и разбавленных щелочей, из которых выпадает в осадок при подкислении. казеин обладает способностью к створаживанию. Способность к створаживанию имеет большое значение для эффективной ассимиляции новорожденными молока, так казеин обеспечивает его задержку в желудке. Казеин легко доступен для пищеварительной протеиназы уже в нативном состоянии, в то время как все глобулярные белки приобретают это свойство при денатурации.
Высушенный казеин — белый порошок без вкуса и запаха, практически не растворимый в воде и органических растворителях, растворяется в водных растворах солей и разбавленных щелочей, из которых выпадает в осадок при подкислении. казеин обладает способностью к створаживанию. Способность к створаживанию имеет большое значение для эффективной ассимиляции новорожденными молока, так казеин обеспечивает его задержку в желудке. Казеин легко доступен для пищеварительной протеиназы уже в нативном состоянии, в то время как все глобулярные белки приобретают это свойство при денатурации.
Казеин содержит все необходимые организму аминокислоты (в т. ч. незаменимые).
Мицеллярный казеин или казеинат кальция? В чем разница? Какой казеин выбрать?
Казеин
Мы знаем, что молоко является хорошим источником белка. Те из нас, кто не поленился загуглить о том, что же такое «протеин», выяснили также, что есть два основных вида молочного белка – сыворотка и казеин. Дальше больше. Сывороточный протеин и казеин делятся на подвиды, а именно сывороточный изолят, сывороточный концентрат, казеинат кальция и мицеллярный казеин. Каждый из них обладает своими функциями и важен для пищеварения и мышечного восстановления.
Сывороточный протеин и казеин делятся на подвиды, а именно сывороточный изолят, сывороточный концентрат, казеинат кальция и мицеллярный казеин. Каждый из них обладает своими функциями и важен для пищеварения и мышечного восстановления.
Сейчас мы познакомимся с казеином и его видами.
Что такое казеин?
Казеин – это молочный белок, составляющий 80 процентов от всего белка, имеющегося в молоке. В нем содержатся все незаменимые аминокислоты, необходимые для мышечного роста. Известно также, что казеин называют «ночным белком» из-за того, что расщепляется он медленно и, как следствие, в медленном темпе обеспечивает организм аминокислотами, поддерживая мышечное восстановление во время сна. Медленное и постоянное высвобождение аминокислот предупреждает разрушение мышц. В результате, в то время пока вы спите, ваше тело продолжает работать. Вывод: казеин – это идеальный белок для приема перед сном.
Казеин также хорошо подходит для поддержания положительного азотного баланса в дневное время в промежутках между приемами пищи. Опять-таки, здесь приходится выбирать между разными видами казеина – казеинатом кальция и мицеллярным казеином.
Опять-таки, здесь приходится выбирать между разными видами казеина – казеинатом кальция и мицеллярным казеином.
В чем разница между ними и в чем преимущества каждого из них?
Миццеллярный казеин
В молоке казеин существует в виде мицелл. Это натуральная форма казеина. Она не растворяется, а, попадая в желудок, формирует там комочки. Структура данных комочков такова, что они долго задерживаются в желудке, и для их переваривания требуется много времени. Соответственно также долго высвобождаются аминокислоты. Продолжаться это может от 6 до 8 часов. Подобное свойство идеально для тех, кто регулярно тренируется, кто хочет наладить медленный приток аминокислот для оптимального мышечного восстановления.
Мицеллярный казеин содержит примерно 90 процентов неденатурированного белка и богат BCAA и глютамином. Получают его в процессе отделения казеина от сыворотки, жиров и лактозы в молоке.
Казеинат кальция
Казеинат кальция – это форма казеина, соединенная с кальцием для повышения его растворимости. Подобное вмешательство кальция приводит к тому, что казеинату кальция для переваривания требуется меньше времени, а в желудке он не образует так называемые мицеллы, или комочки. По времени это занимает от 2 до 3 часов для полного переваривания и обеспечения мышц аминокислотами во время восстановительного периода. Подобное довольно быстрое время усвоения делает казеинат кальция не главным источником белка для тех, кто регулярно занимается.
Подобное вмешательство кальция приводит к тому, что казеинату кальция для переваривания требуется меньше времени, а в желудке он не образует так называемые мицеллы, или комочки. По времени это занимает от 2 до 3 часов для полного переваривания и обеспечения мышц аминокислотами во время восстановительного периода. Подобное довольно быстрое время усвоения делает казеинат кальция не главным источником белка для тех, кто регулярно занимается.
Казеинат кальция содержит 90 процентов белка. В нем много глютамина и минералов.
Мицеллярный казеин vs казеинат кальция
Мицеллярный казеин – это идеальный источник белка для поддержания мышечного роста. Казеинат кальция широко используется при производстве еды в промышленности в продуктах быстрого приготовления.
Многие определяют мицеллярный казеин как наилучшую форму казеина, но исследования не показывают различий между ним и казеинатом кальция с точки зрения аминокислотного профиля. Период высвобождения аминокислот – это то, чем они отличаются. Ведь скорость расщепления у них различна.
Ведь скорость расщепления у них различна.
Мицеллярный казеин как медленно высвобождающаяся форма является идеальным источником белка для регулярно тренирующихся, которые нуждаются в оптимальном восстановлении в течение долго периода, в частности ночью.
Rule 1
Купить
Optimum Nutrition
Купить
Maxler
Купить
QNT
Купить
Optimum Nutrition
Купить
Ultimate Nutrition
Купить
Syntrax
Купить
Maxler
Купить
FIT KIT
Купить
BombBar
Купить
Chikalab
Купить
Maxler
Купить
Казеин (F78), аллерген-специфические IgG — цена анализа в Армавире в ИНВИТРО
Исследуемый материал
Сыворотка крови
Метод определения
Хемилюминесцентный иммуноанализ.
Определение иммуноглобулинов класса IgG к одному из основных белков молока – казеину.
См. также тест №650 — Казеин, IgE.
также тест №650 — Казеин, IgE.
Казеи́н (лат. caseus — сыр) — сложный белок, образующийся из предшественника казеина — казеиногена при створаживании молока под действием протеолитических ферментов. Это основной белок молока, его содержание в коровьем молоке в период лактации составляет 2,8 — 3,5%, около 80% всех белков коровьего молока (содержание казеина в женском молоке в два раза меньше).
Казеин содержит все необходимые человеку аминокислоты, является главной составной частью творога и сыра. Сенсибилизация к коровьему молоку встречается у 75% детей с пищевой аллергией (см. также тесты №№ 608, 6648 – Коровье молоко IgE, IgG; №№ 649, 6601 — Бета-лактоглобулин IgE, IgG).
Клиническими признаками подобной аллергии могут быть кожные проявления (зудящая сыпь, экзема, дерматит), гастроэнтеральные симптомы (боли в животе, рвота, диарея, метеоризм и запор), иногда — респираторные явления (кашель, приступы удушья, ринит). Аллергию к белкам молока следует отличать от непереносимости молока, которая связана с недостаточностью фермента (см. тест на лактазную недостаточность №236 – Содержание углеводов в кале).
тест на лактазную недостаточность №236 – Содержание углеводов в кале).
Подавляющее большинство случаев пищевой аллергии является IgE-обусловленными аллергическими реакциями. Базовые лабораторные диагностические аллерготесты основаны на выявлении присутствия в крови специфических IgE антител (см. определение специфических IgE).
IgG антитела часто встречаются при пищевой аллергии, выявляемые IgG необязательно реактивны к тем же белкам, что и IgE, роль их до конца не ясна. Потенциально они могут участвовать в реакциях пищевой гиперчувствительности: показано, что дегрануляцию тучных клеток и базофилов могут индуцировать не только комплекс IgE и антигена, но и другие стимулы, например — анафилотоксины СЗа и С5а, которые продуцируются в ходе альтернативного (участвуют IgG4) или классического (участвуют IgG1, IgG2, IgG3) пути активации комплемента.
Но известно также, что IgG-антитела к аллергену могут выполнять и функцию блокирующих антител, которые уменьшают выраженность аллергических реакций, протекающих с участием специфических IgE. IgG антитела к пищевым аллергенам можно обнаружить у здоровых людей как свидетельство повышенного потребления тех или иных продуктов без наличия к ним аллергии.
IgG антитела к пищевым аллергенам можно обнаружить у здоровых людей как свидетельство повышенного потребления тех или иных продуктов без наличия к ним аллергии.
Диагностическое значение факта выявления в крови пациента повышенного количества IgG к пищевым аллергенам спорно. Исследование IgG к пищевым аллергенам обычно проводят в дополнение к исследованию IgE, с целью выбора оптимального изменения диеты с исключением или ротацией отдельных компонентов пищи, что может заметно улучшить состояние пациента.
Назначение и интерпретацию результатов теста должен производить специалист, представляющий ограничения данного исследования и рассматривающий его в комплексе с клинико-анамнестическими данными и результатами остальных тестов.
Казеин, IgE (Food — Casein, IgE, F78)
Исследуемый материал
Сыворотка крови
Метод определения
Хемилюминесцентный иммуноанализ
Определение специфических IgE к аллергенам белка молока — казеина.
Казеи́н (лат. caseus — сыр) — сложный белок, образующийся из предшественника казеина — казеиногена при створаживании молока под действием протеолитических ферментов. Это основной белок молока, его содержание в коровьем молоке в период лактации составляет 2,8 — 3,5%, около 80% всех белков коровьего молока (содержание казеина в женском молоке в два раза меньше). Казеин содержит все необходимые человеку аминокислоты, является главной составной частью творога и сыра.
Сенсибилизация к коровьему молоку встречается у 75% детей с пищевой аллергией (см. также тесты №№ 608, 6648 – Коровье молоко IgE, IgG; №№ 649, 6601 — Бета-лактоглобулин IgE, IgG).
Клиническими признаками подобной аллергии могут быть кожные проявления (зудящая сыпь, экзема, дерматит), гастроэнтеральные симптомы (боли в животе, рвота, диарея, метеоризм и запор), иногда — респираторные явления (кашель, приступы удушья, ринит).
Аллергию к белкам молока следует отличать от непереносимости молока, которая связана с недостаточностью фермента (см. тест на лактазную недостаточность №236 – Содержание углеводов в кале).
тест на лактазную недостаточность №236 – Содержание углеводов в кале).
Казеин, нативный аллергокомпонент молока (f78, nBos d 8), IgE, ImmunoCAP (f78, nBos d 8 Casein, Milk, IgE)
Интерпретация результатов
Интерпретация результатов исследования содержит информацию
для лечащего врача и не является диагнозом.
Информацию из этого раздела нельзя использовать для
самодиагностики и самолечения.
Точный диагноз ставит врач, используя как результаты данного
обследования, так и нужную информацию из других источников:
анамнеза,
результатов других обследований и т. д.
д.
Единицы измерения: kU/l.
Пределы обнаружения: 0,1-100 kU/l.
Референсные значения: < 0,35 kU/l.
Интерпретация результатов
Повышение уровня
- Результат выше указанного порога подтверждает наличие аллергической сенсибилизации к казеину, более высокие значения указывают на уровень сенсибилизации. Диагноз аллергии устанавливают на основании клинических симптомов, с учетом анамнеза пациента и результатов обследования.
- Ложноположительный результат вследствие очень высокого уровня общего IgE.
Понижение уровня
Отсутствие сенсибилизации к казеину молока.
Литература
- Аллергология и иммунология.
 Национальное руководство (ред. Хаитова Р.М., Ильиной Н.И.). — М.: Изд. «ГЭОТАР-Медиа». 2013:640.
Национальное руководство (ред. Хаитова Р.М., Ильиной Н.И.). — М.: Изд. «ГЭОТАР-Медиа». 2013:640. - Намазова-Баранова Л.С. с соавт. Особенности диагностики аллергии у детей. Вестник РАМН. 2017;72(1):33-41.
- Sly P.D. et al. Early identification of atopy in the prediction of persistent asthma in children. Lancet. 2008;372:1100-1106.
- Материалы фирмы-производителя реагентов. http://www.phadia.com/en/Products/Allergy-testing-products/ImmunoCAP-Allergen-Information
Казеин Fitness Formula Casein Premium — Shoppy
Описание
Казеин является одним из основных белков молока, наряду с сывороточными белками.
В молоке казеин составляет 80% от общего содержания молочного белка (сывороточный белок составляет 20%). В отличие от «быстрых» сывороточных протеинов, казеин, попадая в желудок человека, образует сгусток, который переваривается более длительное время (около 6-8 часов) и долгосрочно обеспечивает организм необходимыми аминокислотами.
В отличие от «быстрых» сывороточных протеинов, казеин, попадая в желудок человека, образует сгусток, который переваривается более длительное время (около 6-8 часов) и долгосрочно обеспечивает организм необходимыми аминокислотами.
Что такое Мицеллярный казеин?
Мицеллярный казеин — это форма казеина, которая производится из молока щадящими способами микро и ультрафильтрации без применения нагревания и кислот. Таким образом, лучше сохраняется натуральная структура белка, что ведет к лучшему усвоению.
Когда и зачем нужно употреблять казеин?
В сравнении с другими видами протеином казеин обладает основным уникальным свойством – он медленноусвояемый. Скорость усвоения этого протеина человеческим организмом – 6-8 часов, в течение которых его аминокислоты, медленно высвобождаясь, попадают в кровь и снабжают мышцы и другие ткани организма строительным материалом. Именно поэтому его принято употреблять либо перед сном на ночь, либо перед длительным перерывом в приемах пищи. Медленная усвояемость способствует запасающей функции казеина. И это важно не столько для роста мышц, а скорее для предотвращения их разрушения во время сна и длительных перерывах между едой.
Медленная усвояемость способствует запасающей функции казеина. И это важно не столько для роста мышц, а скорее для предотвращения их разрушения во время сна и длительных перерывах между едой.
Казеин хорош при сжигании жиров. При смешивании с жидкостью мицеллярный казеин 80% образует густую консистенцию, которая при приеме в желудок создает комфортное (не тяжелое) ощущение сытости, устраняя голод. Он не содержит углеводов и беден жирами. Препятствует разрушению мышц в процессе жиросжигания.
Нет смысла принимать казеин сразу после тренировки, так как в это время организм нуждается в быстром белке — сывороточном.
Быстрорастворимый (Instant) Мицеллярный казеин.
Благодаря микроинкапсуляции гранул белка с использованием соевого лецитина на стадии фильтрации, казеину придается свойства быстрорастворимости. Быстрорастворимый мицеллярный казеин удобно использовать — он не создает пыли, легко размешивается в жидкости ложкой (воде, молоке, соке…) даже ложкой без образования комков и прилипания к стенкам шейкера, а также не образует избыточную пену.
Информацию об условиях отпуска (реализации) уточняйте у продавца.
Информация о технических характеристиках, комплекте поставки, стране изготовления, внешнем виде и цвете товара носит справочный характер и основывается на последних доступных к моменту публикации сведениях
Стоимость доставки из других регионов приблизительная. Точную стоимость уточняйте у продавца.
Сообщить о неточности в описании
Каковы функции протеинового казеина? | Здоровое питание
Автор: Джина Риджио Обновлено 27 декабря 2018 г.
Казеин — это сложный белок, который составляет 80 процентов белка в молоке. Фактически, это комбинация белков и других молекул, которые вместе образуют так называемую мицеллу казеина. Мицеллы казеина делают возможными многие функции казеина, такие как облегчение пищеварения, а также рост и развитие молодняка. Это также необходимо для сыроварения и других технологий производства продуктов питания.Его молекулярная структура позволяет легко отделять его от молока — свойство, которое находит широкое применение в пищевой промышленности.
Это также необходимо для сыроварения и других технологий производства продуктов питания.Его молекулярная структура позволяет легко отделять его от молока — свойство, которое находит широкое применение в пищевой промышленности.
Казеин Химия
Фосфопротеин казеин состоит из четырех различных субъединиц — αs1-казеина, αs2-казеина, b-казеина и k-казеина, которые вместе образуют комплекс с фосфором, кальцием, водой и ферментами для сделать сферу, называемую мицеллой. Назначение мицеллы — сделать большие нерастворимые молекулы растворимыми в воде. Водолюбивые или гидрофильные компоненты находятся снаружи сферы, а нерастворимые компоненты — внутри.
Рост и развитие
Каждая субъединица казеина обладает различной последовательностью аминокислот, что обусловливает ее разнообразный аминокислотный состав. Из-за его богатого аминокислотного профиля ученые предположили, что его роль заключается в обеспечении источника аминокислот для роста и развития младенцев, детей и молодых животных. Это особенно хороший источник лизина, аминокислоты, которой часто мало в диетах на основе зерновых. Однако еще одна важная цель казеина может заключаться в предотвращении кальцификации молочной железы, как отмечается в статье, опубликованной в апрельском номере журнала «Chemistry Central Journal» за 2013 год.»
Это особенно хороший источник лизина, аминокислоты, которой часто мало в диетах на основе зерновых. Однако еще одна важная цель казеина может заключаться в предотвращении кальцификации молочной железы, как отмечается в статье, опубликованной в апрельском номере журнала «Chemistry Central Journal» за 2013 год.»
Здоровье и пищеварение
Казеин популярен среди спортсменов и бодибилдеров благодаря своей репутации наращивания мышечной массы. Фактически, в исследовании, опубликованном в 2004 г., было показано, что добавки казеина повышают уровень аминокислот в сыворотке и наращивают мышечную массу после силовых тренировок. журнал «Медицина и наука в спорте и физических упражнениях». При употреблении мицелла казеина разрушается кислотой в желудке, которая образует сгусток и способствует медленному распаду белка и, следовательно, постоянному поступлению аминокислот сверх несколько часов, позволяя организму более эффективно удерживать и использовать эти аминокислоты.
Food Technology
Сыроделы также используют способность казеина к свертыванию. Ферменты разрушают мицеллу и вызывают свертывание казеина — и сгусток отделяется, образуя творог. Затем творог перерабатывается в сыр. Кроме того, свойства казеина позволяют удалять жир из молока. Молоко можно центрифугировать или вращать с чрезвычайно высокой скоростью, при этом молоко разделяется на слой сливок, водянистый слой, называемый супернатантом, и твердый слой, называемый осадком.Супернатант известен как обезжиренное молоко. Мицеллы казеина являются центральным элементом многих функций казеина.
Роль казеина в поддержке работы поверхностно связанного кинезина | Journal of Biological Engineering
Чтобы оценить роль казеина в поддержке активности поверхностно-адсорбированного кинезина, мы сначала исследовали функцию кинезина в различных условиях казеина, а затем количественно оценили связывание как казеиновых, так и кинезиновых моторов с поверхностями, используя флуоресцентные анализы. Хотя моторы, адсорбированные на поверхности, трудно визуализировать под микроскопом, относительно просто визуализировать и количественно оценить взаимодействие микротрубочек с этими моторами. Ранее было показано, что, поскольку отдельных моторов кинезина достаточно, чтобы связывать микротрубочки и транспортировать их по поверхности, ниже максимальной моторной плотности, скорость, с которой микротрубочки приземляются и перемещаются по поверхности, пропорциональна плотности активных кинезинов на поверхности [11 , 24]. Следовательно, поверхностную плотность функциональных моторов можно оценить, позволив микротрубочкам приземлиться в течение определенного времени, а затем подсчитав количество микротрубочек на поверхности.Мы систематически удаляли казеин из блокирующего раствора, моторного раствора или раствора микротрубочек и подсчитывали среднее количество микротрубочек, распространяющихся по поверхности стекла, функционализированной кинезином, через 15 минут. Использовали казеин цельного коровьего молока, содержащий все четыре субъединицы казеина, и исследовали как высокие (8 мкг / мл), так и низкие (0,8 мкг / мл) концентрации белка кинезина.
Хотя моторы, адсорбированные на поверхности, трудно визуализировать под микроскопом, относительно просто визуализировать и количественно оценить взаимодействие микротрубочек с этими моторами. Ранее было показано, что, поскольку отдельных моторов кинезина достаточно, чтобы связывать микротрубочки и транспортировать их по поверхности, ниже максимальной моторной плотности, скорость, с которой микротрубочки приземляются и перемещаются по поверхности, пропорциональна плотности активных кинезинов на поверхности [11 , 24]. Следовательно, поверхностную плотность функциональных моторов можно оценить, позволив микротрубочкам приземлиться в течение определенного времени, а затем подсчитав количество микротрубочек на поверхности.Мы систематически удаляли казеин из блокирующего раствора, моторного раствора или раствора микротрубочек и подсчитывали среднее количество микротрубочек, распространяющихся по поверхности стекла, функционализированной кинезином, через 15 минут. Использовали казеин цельного коровьего молока, содержащий все четыре субъединицы казеина, и исследовали как высокие (8 мкг / мл), так и низкие (0,8 мкг / мл) концентрации белка кинезина. Ранее было показано, что при низких концентрациях кинезина очень мало двигателей или совсем не адсорбируются на поверхности, если поверхности не были предварительно обработаны блокирующим белком, но при высоких концентрациях двигателей некоторая часть двигателей предположительно связывается и денатурируется на поверхности. и заменяют роль блокирующих белков [11].Однако до настоящего времени роль казеина в моторных и микротрубочковых растворах систематически не исследовалась.
Ранее было показано, что при низких концентрациях кинезина очень мало двигателей или совсем не адсорбируются на поверхности, если поверхности не были предварительно обработаны блокирующим белком, но при высоких концентрациях двигателей некоторая часть двигателей предположительно связывается и денатурируется на поверхности. и заменяют роль блокирующих белков [11].Однако до настоящего времени роль казеина в моторных и микротрубочковых растворах систематически не исследовалась.
Таблица 1 показывает измеренное количество микротрубочек, распространяющихся в области видеоэкрана 65 мкм × 48 мкм при различных условиях нагрузки казеином с использованием высоких или низких концентраций кинезина. Количество микротрубочек подсчитывали из пяти снимков экрана и рассчитывали их среднее значение и стандартное отклонение. Из этих данных можно сделать три четких наблюдения. Во-первых, если нет стадии блокирования казеина и казеин не включен в моторный раствор, микротрубочки не наблюдаются.Этот результат, который согласуется с предыдущей работой [11], указывает на то, что в отсутствие обработки казеином для блокировки поверхности моторы кинезина денатурируют на поверхности стекла или связываются так, что их моторные домены не могут взаимодействовать с микротрубочками. Во-вторых, начальная стадия блокирования казеина не оказывает значительного влияния на подвижность микротрубочек, когда казеин включается в последующий раствор для адсорбции кинезина. Включение стадии блокирования казеина увеличило количество наблюдаемых микротрубочек с 60 ± 4.От 4 (среднее ± стандартное отклонение, N = 5) до 80 ± 9,6 (улучшение на 33%) для высоких концентраций кинезина и от 4,4 ± 1,5 до 9,2 ± 2,4 (улучшение на 109%) для низких концентраций кинезина. Предположительно, поскольку концентрация казеина (200 мкг / мл) значительно выше, чем моторная концентрация (8 или 0,8 мкг / мл), казеин быстро связывается с поверхностью и способен выполнять свою блокирующую роль, если он входит в состав моторное решение. В-третьих, включение казеина в раствор микротрубочек всегда увеличивает наблюдаемое количество микротрубочек со средним улучшением в 3 раза по всем условиям и максимальным наблюдаемым улучшением в 5 раз.В 4 раза в случае, когда казеин включен как на стадии блокирования, так и на стадии адсорбции кинезина, и использовалась высокая концентрация кинезина.
Во-вторых, начальная стадия блокирования казеина не оказывает значительного влияния на подвижность микротрубочек, когда казеин включается в последующий раствор для адсорбции кинезина. Включение стадии блокирования казеина увеличило количество наблюдаемых микротрубочек с 60 ± 4.От 4 (среднее ± стандартное отклонение, N = 5) до 80 ± 9,6 (улучшение на 33%) для высоких концентраций кинезина и от 4,4 ± 1,5 до 9,2 ± 2,4 (улучшение на 109%) для низких концентраций кинезина. Предположительно, поскольку концентрация казеина (200 мкг / мл) значительно выше, чем моторная концентрация (8 или 0,8 мкг / мл), казеин быстро связывается с поверхностью и способен выполнять свою блокирующую роль, если он входит в состав моторное решение. В-третьих, включение казеина в раствор микротрубочек всегда увеличивает наблюдаемое количество микротрубочек со средним улучшением в 3 раза по всем условиям и максимальным наблюдаемым улучшением в 5 раз.В 4 раза в случае, когда казеин включен как на стадии блокирования, так и на стадии адсорбции кинезина, и использовалась высокая концентрация кинезина.
Таблица 1 Измеренное среднее количество микротрубочек, наблюдаемых при различных условиях концентрации казеина и кинезина.
Наблюдаемое изменение количества микротрубочек, присутствующих на поверхности в различных экспериментальных условиях, должно быть результатом воздействия казеина либо на доступность адсорбированного на поверхности кинезина для участия в связывании микротрубочек, либо на плотность адсорбированного кинезина.Из таблицы 1 можно сделать вывод, что адсорбированный на поверхности кинезин сохраняет свою функциональность, за исключением случая низкой концентрации кинезина и когда казеин не был включен ни в один инкубационный раствор. Утрата функциональности кинезина может происходить либо из-за денатурации кинезина, либо из-за связывания головного домена кинезина с поверхностью, что может привести к отсутствию наблюдаемого связывания микротрубочек. Следовательно, включение казеина не влияет на способность кинезина нормально работать на доступной микротрубочке, если контакт с микротрубочкой был возможен. Эта гипотеза основана на наблюдении увеличенной наблюдаемой плотности микротрубочек при добавлении казеина к окончательному раствору микротрубочек. Более того, поскольку в раствор микротрубочек с казеином не был добавлен дополнительный кинезин, плотность кинезина на поверхности не могла быть увеличена, но, скорее, большее количество существующего кинезина на поверхности было доступно для участия в связывании микротрубочек, когда казеин был включен. в растворе микротрубочек. Также очевидно, что после адсорбции кинезина в отсутствие казеина они не могут быть восстановлены путем последующего включения казеина в раствор микротрубочек.Это может быть результатом того, что кинезин имеет более сильное сродство к поверхности, чем казеин, или что в случае денатурирования кинезина на поверхности стекла денатурированный кинезин не может восстановить свою функциональность, если впоследствии вводится казеин, и он способен замещать кинезин.
Эта гипотеза основана на наблюдении увеличенной наблюдаемой плотности микротрубочек при добавлении казеина к окончательному раствору микротрубочек. Более того, поскольку в раствор микротрубочек с казеином не был добавлен дополнительный кинезин, плотность кинезина на поверхности не могла быть увеличена, но, скорее, большее количество существующего кинезина на поверхности было доступно для участия в связывании микротрубочек, когда казеин был включен. в растворе микротрубочек. Также очевидно, что после адсорбции кинезина в отсутствие казеина они не могут быть восстановлены путем последующего включения казеина в раствор микротрубочек.Это может быть результатом того, что кинезин имеет более сильное сродство к поверхности, чем казеин, или что в случае денатурирования кинезина на поверхности стекла денатурированный кинезин не может восстановить свою функциональность, если впоследствии вводится казеин, и он способен замещать кинезин.
На основании этих наблюдений мы предполагаем, что казеин образует двойной слой на поверхности стеклянной подложки аналогично тому, как сообщалось ранее [22]. В нашей модели кинезин собирается на первом сильно адсорбированном слое казеина, который закрепляет кинезин на поверхности.Хотя механизм этого взаимодействия необходимо идентифицировать, возможно, что кинезиновый хвост имеет сродство к некоторой области казеинового белка или что кинезиновый хвост имеет сродство к поверхности стекла, но казеиновый белок препятствует связыванию кинезиновой головки. к стеклянной поверхности. В любом случае ясно, что кинезин имеет более сильное сродство к первому слою казеина, чем второй слой казеина к первому слою казеина или кинезина. Второй, более слабо связанный слой казеина служит для позиционирования головной области кинезина, способствуя взаимодействию с микротрубочкой.Наблюдаемое увеличение связывания микротрубочек, когда казеин был включен в раствор микротрубочек, предполагает, что кинезин фиксируется с некоторым сродством к своему положению, поскольку обмен раствора не удаляет кинезин с поверхности в значительной степени (см. Ниже). Однако, когда казеин был включен в раствор микротрубочек, количество наблюдаемых микротрубочек увеличивается во всех случаях, что позволяет предположить, что усиление взаимодействия адсорбированных моторов с микротрубочками происходит в присутствии дополнительного казеина, который пополняет второй слабо связанный слой казеина, который разрушен.
В нашей модели кинезин собирается на первом сильно адсорбированном слое казеина, который закрепляет кинезин на поверхности.Хотя механизм этого взаимодействия необходимо идентифицировать, возможно, что кинезиновый хвост имеет сродство к некоторой области казеинового белка или что кинезиновый хвост имеет сродство к поверхности стекла, но казеиновый белок препятствует связыванию кинезиновой головки. к стеклянной поверхности. В любом случае ясно, что кинезин имеет более сильное сродство к первому слою казеина, чем второй слой казеина к первому слою казеина или кинезина. Второй, более слабо связанный слой казеина служит для позиционирования головной области кинезина, способствуя взаимодействию с микротрубочкой.Наблюдаемое увеличение связывания микротрубочек, когда казеин был включен в раствор микротрубочек, предполагает, что кинезин фиксируется с некоторым сродством к своему положению, поскольку обмен раствора не удаляет кинезин с поверхности в значительной степени (см. Ниже). Однако, когда казеин был включен в раствор микротрубочек, количество наблюдаемых микротрубочек увеличивается во всех случаях, что позволяет предположить, что усиление взаимодействия адсорбированных моторов с микротрубочками происходит в присутствии дополнительного казеина, который пополняет второй слабо связанный слой казеина, который разрушен. во время последнего обмена раствором микротрубочек.Эта модель совместной сборки показана на рисунке 2.
во время последнего обмена раствором микротрубочек.Эта модель совместной сборки показана на рисунке 2.
Рисунок 2
Схематическое изображение процесса сборки казеина и кинезина . Кинезин связывается с поверхностью за счет взаимодействия с первым адсорбированным слоем казеина. Второй более слабо связанный слой казеина взаимодействует с головным доменом кинезина, способствуя взаимодействию с микротрубочками.
В модели, показанной на рисунке 2, предполагается, что казеин имеет один отдельный гидрофильный домен и один отдельный гидрофобный домен, как и в случае β-казеина [22].Однако казеин, использованный в экспериментах, приведенных в таблице 1, включал казеин из коровьего молока, который состоит из α s1 (12–15%), α s2 (3–4%), β (9–11%). %) и κ (2–4%) казеинов. Структура этих казеинов была определена [21] и не идентична. Одно из наиболее заметных различий заключается в структуре двух α казеинов, которые имеют два различных гидрофобных домена.
Чтобы определить, влияют ли отдельные субъединицы казеина на взаимодействие кинезин-микротрубочка по-разному, мы провели анализы подвижности с использованием очищенных форм α (содержащих субъединицы α s1 и α s2 ) , β и κ казеинов, и сравнили эти результаты соответствуют контролю, использующему казеин цельного коровьего молока.Среднее количество микротрубочек, наблюдаемых при каждом условии, показано на рисунке 3 (а). На рисунке 3 (b) включены снимки экрана анализа подвижности микротрубочек для высокой концентрации кинезина. Результаты анализов, содержащих очищенную форму α казеина, совпадают с результатами контрольных анализов с использованием цельного казеина. Этот результат согласуется с тем фактом, что коровье молоко содержит 15–19% α казеина, тогда как β казеины и κ казеины присутствуют в меньших количествах — 9–11% и 2–4%, соответственно. Интересно, что β-казеин оказался наиболее эффективным в поддержке подвижности микротрубочек, что привело к 1.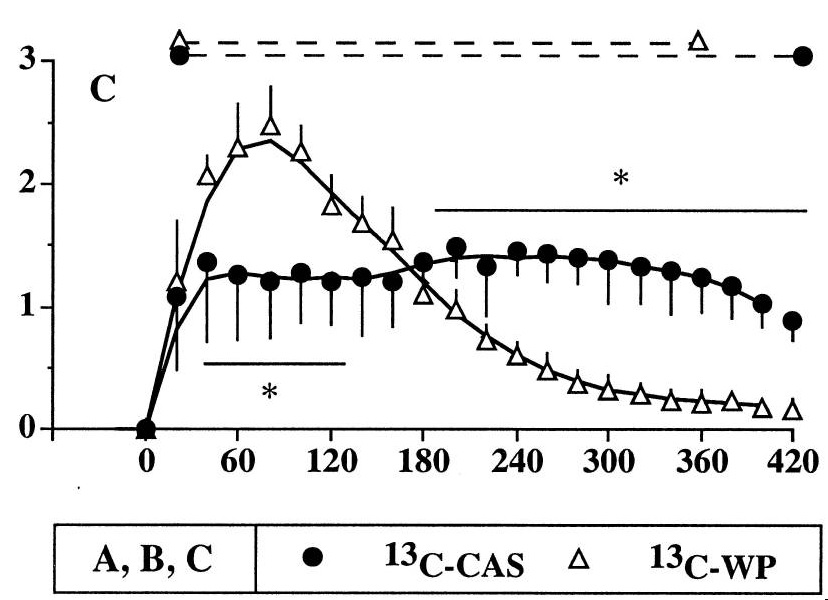 6-кратное увеличение по сравнению с цельным казеином или α-казеином при низкой моторной плотности. Это может означать, что уменьшение среднего числа микротрубочек, наблюдаемое для цельного и α казеина по сравнению с β казеином, на самом деле может быть результатом взаимодействия различных казеинов с образованием гетерогенных двухслойных структур, в которых любой из двух слоев казеина содержит два или более адсорбированных субъединицы казеина (см. ниже). Наконец, κ-казеины, по-видимому, наименее эффективны в поддержке взаимодействия кинезин-микротрубочки. В каппа-казеине микротрубочек было всего на 20% и 29% меньше, чем в целом казеине при высокой и низкой моторной плотности соответственно.Обнаружение того, что κ-казеин приводит к низкой активности даже при высоких моторных концентрациях, предполагает, что кинезин по-другому взаимодействует с κ-казеином, чем с α- или β-казеином.
6-кратное увеличение по сравнению с цельным казеином или α-казеином при низкой моторной плотности. Это может означать, что уменьшение среднего числа микротрубочек, наблюдаемое для цельного и α казеина по сравнению с β казеином, на самом деле может быть результатом взаимодействия различных казеинов с образованием гетерогенных двухслойных структур, в которых любой из двух слоев казеина содержит два или более адсорбированных субъединицы казеина (см. ниже). Наконец, κ-казеины, по-видимому, наименее эффективны в поддержке взаимодействия кинезин-микротрубочки. В каппа-казеине микротрубочек было всего на 20% и 29% меньше, чем в целом казеине при высокой и низкой моторной плотности соответственно.Обнаружение того, что κ-казеин приводит к низкой активности даже при высоких моторных концентрациях, предполагает, что кинезин по-другому взаимодействует с κ-казеином, чем с α- или β-казеином.
Рисунок 3
Сравнение эффективности различных субъединиц казеина на функцию кинезина . (a) Среднее количество микротрубочек наблюдали в стандартном анализе подвижности при низких (0,8 мкг / мл) и высоких (8 мкг / мл) моторных концентрациях, когда казеин был включен на этапах блокирования поверхности, адсорбции кинезина и подвижности микротрубочек.Для разных субъединиц казеина (α, β и κ) все растворы содержали только эту конкретную субъединицу. (b) Снимки экрана, показывающие плотность микротрубочек на поверхности стекла для различного казеина и высокого кинезина. Микротрубочки размером менее 1 мкм не учитывались. Масштабная линейка 10 мкм.
(a) Среднее количество микротрубочек наблюдали в стандартном анализе подвижности при низких (0,8 мкг / мл) и высоких (8 мкг / мл) моторных концентрациях, когда казеин был включен на этапах блокирования поверхности, адсорбции кинезина и подвижности микротрубочек.Для разных субъединиц казеина (α, β и κ) все растворы содержали только эту конкретную субъединицу. (b) Снимки экрана, показывающие плотность микротрубочек на поверхности стекла для различного казеина и высокого кинезина. Микротрубочки размером менее 1 мкм не учитывались. Масштабная линейка 10 мкм.
Различия, наблюдаемые в функции различных субъединиц казеина, предположительно происходят из-за различной структуры различных субъединиц казеина. Поскольку α-казеины имеют два гидрофобных домена, упаковка и порядок его двойного слоя должны количественно отличаться от структуры двухслойного β-казеина, который содержит один отдельный гидрофобный домен в дополнение к его гидрофильному домену.Более того, каппа-казеин содержит только один гидрофильный и гидрофобный домен, такой как β-казеин, но среднее количество микротрубочек, наблюдаемое в анализах, содержащих каппа-казеин, было почти на порядок меньше, чем наблюдаемое в анализах, содержащих β-казеин (рис. 3). Однако полагают, что κ-казеин играет роль в сборке мицелл казеина [19–21], которая отличается от роли субъединиц α и β. Интересно, что практически во всех исследованиях подвижности микротрубочек не наблюдалось связывания микротрубочек длиной менее 2–3 мкм в случае κ-казеина.
3). Однако полагают, что κ-казеин играет роль в сборке мицелл казеина [19–21], которая отличается от роли субъединиц α и β. Интересно, что практически во всех исследованиях подвижности микротрубочек не наблюдалось связывания микротрубочек длиной менее 2–3 мкм в случае κ-казеина.
Чтобы определить, все ли субъединицы казеина собираются в двухслойный самостоятельно аналогично тому, как предполагается, что весь казеин собирается, связывание флуоресцентных субъединиц казеина с поверхностью стекла было измерено с помощью флуоресцентной микроскопии. Стеклянные покровные стекла покрывали цельным, меченным родамином, α, β и κ казеином, промывали в растворе против тушения, содержащем BRB80, 20 мМ D-глюкозы, 20 мкг / мл глюкозооксидазы, 8 мкг / мл каталазы и 0,5% β-мерцептоэтанола для уменьшения обесцвечивание родамином и визуализировано с помощью эпифлуоресцентной микроскопии.Второй набор покровных стекол сначала покрывали немеченым казеином, затем подвергали воздействию флуоресцентно меченого казеина и, наконец, промывали раствор для защиты от выцветания. Интенсивность флуоресценции родамина на поверхности количественно определялась для каждого случая, и интенсивность корректировалась с учетом фоновый сигнал при отсутствии какой-либо флуоресцентной метки. Данные для двух условий представлены на рисунке 4. Учитывалась степень маркировки родамином казеина и его субъединиц. УФ-спектрофотометрический анализ был выполнен на казеинах, меченных родамином, и интенсивность флуоресценции была соответственно нормализована.Когда помеченный родамином цельный казеин или субъединицы казеина подвергали воздействию чистой стеклянной поверхности, на поверхности адсорбировался прочно связанный слой казеина, который не смывался при замене раствора белка на раствор антифадера. Однако, когда в проточную ячейку сначала вводили немеченый казеин, а затем меченый казеин, измеренная интенсивность снижалась во всех случаях. В случае цельного казеина и β-казеина это снижение было значительным, составив 48% и 34% соответственно.Эти данные предполагают, что двухслойная структура образуется для всего казеина и β-казеина, и что второй слой связан более слабо.
Интенсивность флуоресценции родамина на поверхности количественно определялась для каждого случая, и интенсивность корректировалась с учетом фоновый сигнал при отсутствии какой-либо флуоресцентной метки. Данные для двух условий представлены на рисунке 4. Учитывалась степень маркировки родамином казеина и его субъединиц. УФ-спектрофотометрический анализ был выполнен на казеинах, меченных родамином, и интенсивность флуоресценции была соответственно нормализована.Когда помеченный родамином цельный казеин или субъединицы казеина подвергали воздействию чистой стеклянной поверхности, на поверхности адсорбировался прочно связанный слой казеина, который не смывался при замене раствора белка на раствор антифадера. Однако, когда в проточную ячейку сначала вводили немеченый казеин, а затем меченый казеин, измеренная интенсивность снижалась во всех случаях. В случае цельного казеина и β-казеина это снижение было значительным, составив 48% и 34% соответственно.Эти данные предполагают, что двухслойная структура образуется для всего казеина и β-казеина, и что второй слой связан более слабо. Очень небольшая разница в измеренных интенсивностях для казеина κ снова указывает на различие в том, как этот казеин взаимодействует с поверхностью стекла и кинезином, и не дает никаких доказательств образования двухслойного. Для α-казеина было меньше общего связывания, и предварительная обработка немеченым казеином имела минимальный эффект. Данные по связыванию микротрубочек с рис. 3 предполагают, что весь казеин и α казеин аналогичным образом взаимодействуют с адсорбированным на поверхности кинезином, но данные связывания на рис. 4 предполагают обратное и вместо этого предполагают сходство между цельным казеином и β казеином.Возможно, что разница заключается в специфических взаимодействиях между различными казеинами α s1 и α s2 , которые здесь не рассматриваются отдельно. В качестве альтернативы, возможно, что в случае всего казеина отдельные казеины образуют гетерогенный двухслойный слой, который объединяет различные субъединицы казеина. Например, первый адсорбированный слой может представлять собой α-казеин, гидрофобная область которого взаимодействует с гидрофобной областью β-казеина и т.
Очень небольшая разница в измеренных интенсивностях для казеина κ снова указывает на различие в том, как этот казеин взаимодействует с поверхностью стекла и кинезином, и не дает никаких доказательств образования двухслойного. Для α-казеина было меньше общего связывания, и предварительная обработка немеченым казеином имела минимальный эффект. Данные по связыванию микротрубочек с рис. 3 предполагают, что весь казеин и α казеин аналогичным образом взаимодействуют с адсорбированным на поверхности кинезином, но данные связывания на рис. 4 предполагают обратное и вместо этого предполагают сходство между цельным казеином и β казеином.Возможно, что разница заключается в специфических взаимодействиях между различными казеинами α s1 и α s2 , которые здесь не рассматриваются отдельно. В качестве альтернативы, возможно, что в случае всего казеина отдельные казеины образуют гетерогенный двухслойный слой, который объединяет различные субъединицы казеина. Например, первый адсорбированный слой может представлять собой α-казеин, гидрофобная область которого взаимодействует с гидрофобной областью β-казеина и т. Д. Важно отметить, что максимальное наблюдаемое количество микротрубочек на рис. 3 наблюдалось для чистого β-казеина, и как на рис. 4, так и на рис. предыдущая работа предполагает, что β-казеин образует двойной слой на поверхности [22], предполагая, что двойной слой казеина является важным компонентом в обеспечении эффективного взаимодействия кинезин-микротрубочки.
Д. Важно отметить, что максимальное наблюдаемое количество микротрубочек на рис. 3 наблюдалось для чистого β-казеина, и как на рис. 4, так и на рис. предыдущая работа предполагает, что β-казеин образует двойной слой на поверхности [22], предполагая, что двойной слой казеина является важным компонентом в обеспечении эффективного взаимодействия кинезин-микротрубочки.
Рисунок 4
Определение того, образуют ли различные казеины двухслойные, где первый слой прочно связан со стеклом . В первом наборе казеин, меченный родамином, инкубировали в проточной кювете, промывали раствором антифадера и измеряли интенсивность флуоресценции с использованием микроскопии полного внутреннего отражения (TIRF). Во втором наборе немеченый казеин инкубировали перед инъекцией меченого казеина. Проточную кювету промывали раствором антифадера и измеряли флуоресценцию с использованием TIRF.
Хотя измерение связывания микротрубочек является хорошим показателем плотности активных кинезиновых моторов на поверхности, оно не может различать изменения в концентрации моторов, адсорбированных на поверхности, и относительной активности адсорбированных моторов. Чтобы изучить относительную плотность кинезина, который адсорбируется на поверхности в присутствии различных субъединиц казеина, и определить влияние обмена раствора на поверхностную плотность адсорбированного кинезина, связывание флуоресцентных моторов кинезина с поверхностью измеряли с помощью флуоресцентной микроскопии. .В этом эксперименте предметное стекло сначала блокировали немеченым казеином, а затем раствор, содержащий меченый родамином кинезин и немеченый казеин, вводили в проточную ячейку и инкубировали в течение 30 минут. Плотность двигателей, связанных с поверхностью, оценивали путем измерения интенсивности флуоресценции на поверхности с помощью флуоресцентной микроскопии полного внутреннего отражения (TIRF), как описано в методах. Поскольку этот метод измеряет флуоресценцию только в пределах ~ 100 нм от поверхности, вклад любых несвязанных двигателей в растворе сводится к минимуму.Наконец, этот моторный раствор был заменен раствором, содержащим казеин без дополнительного кинезина.
Чтобы изучить относительную плотность кинезина, который адсорбируется на поверхности в присутствии различных субъединиц казеина, и определить влияние обмена раствора на поверхностную плотность адсорбированного кинезина, связывание флуоресцентных моторов кинезина с поверхностью измеряли с помощью флуоресцентной микроскопии. .В этом эксперименте предметное стекло сначала блокировали немеченым казеином, а затем раствор, содержащий меченый родамином кинезин и немеченый казеин, вводили в проточную ячейку и инкубировали в течение 30 минут. Плотность двигателей, связанных с поверхностью, оценивали путем измерения интенсивности флуоресценции на поверхности с помощью флуоресцентной микроскопии полного внутреннего отражения (TIRF), как описано в методах. Поскольку этот метод измеряет флуоресценцию только в пределах ~ 100 нм от поверхности, вклад любых несвязанных двигателей в растворе сводится к минимуму.Наконец, этот моторный раствор был заменен раствором, содержащим казеин без дополнительного кинезина. Этот раствор инкубировали в течение 30 минут и снова количественно определяли флуоресценцию поверхности с использованием TIRF. На рис. 5 показаны измеренные значения интенсивности флуоресценции после вычитания фона до и после стадии промывки. Первый результат заключается в том, что до вымывания плотность двигателей была одинаковой для цельного, α- и β-казеина, в то время как меньшее количество двигателей было связано в присутствии κ-казеина. Второй результат заключается в том, что вымывание снижает поверхностную плотность кинезина на 15%, 24%, 27% и 39% для цельных, α, β и κ казеинов, соответственно.Тот факт, что плотность кинезина только частично снижается на этапе обмена раствора, указывает на то, что кинезин либо связан с поверхностью, либо с первым слоем казеина, адсорбированным на поверхности. Одним из примечательных результатов является то, что как до, так и после вымывания интенсивность флуоресценции была самой низкой для κ-казеина, что позволяет предположить, что κ-казеин наименее эффективен для связывания кинезина с поверхностью.
Этот раствор инкубировали в течение 30 минут и снова количественно определяли флуоресценцию поверхности с использованием TIRF. На рис. 5 показаны измеренные значения интенсивности флуоресценции после вычитания фона до и после стадии промывки. Первый результат заключается в том, что до вымывания плотность двигателей была одинаковой для цельного, α- и β-казеина, в то время как меньшее количество двигателей было связано в присутствии κ-казеина. Второй результат заключается в том, что вымывание снижает поверхностную плотность кинезина на 15%, 24%, 27% и 39% для цельных, α, β и κ казеинов, соответственно.Тот факт, что плотность кинезина только частично снижается на этапе обмена раствора, указывает на то, что кинезин либо связан с поверхностью, либо с первым слоем казеина, адсорбированным на поверхности. Одним из примечательных результатов является то, что как до, так и после вымывания интенсивность флуоресценции была самой низкой для κ-казеина, что позволяет предположить, что κ-казеин наименее эффективен для связывания кинезина с поверхностью. Этот результат согласуется с небольшим количеством микротрубочек, наблюдаемых для κ-казеина на рисунке 3, но снижение плотности адсорбированных моторов на ~ 55% не полностью объясняет почти на порядок уменьшение количества микротрубочек, связанных в κ-казеине или что κ казеин не может поддерживать функциональность кинезина.В совокупности эти данные могут указывать на то, что κ-казеин снижает взаимодействие между кинезином и микротрубочкой по сравнению с другими субъединицами казеина. Это может быть результатом неспособности каппа-казеина образовывать двухслойный слой, как показано на рисунке 4. Для выяснения различий во взаимодействиях между отдельными казеинами и кинезином необходимы дополнительные исследования.
Этот результат согласуется с небольшим количеством микротрубочек, наблюдаемых для κ-казеина на рисунке 3, но снижение плотности адсорбированных моторов на ~ 55% не полностью объясняет почти на порядок уменьшение количества микротрубочек, связанных в κ-казеине или что κ казеин не может поддерживать функциональность кинезина.В совокупности эти данные могут указывать на то, что κ-казеин снижает взаимодействие между кинезином и микротрубочкой по сравнению с другими субъединицами казеина. Это может быть результатом неспособности каппа-казеина образовывать двухслойный слой, как показано на рисунке 4. Для выяснения различий во взаимодействиях между отдельными казеинами и кинезином необходимы дополнительные исследования.
Рисунок 5
Интенсивность флуоресценции (условные единицы) меченного родамином кинезина, измеренная с помощью микроскопии полного внутреннего отражения .Проточную кювету инкубировали в течение 10 минут с растворами цельного казеина или различных субъединиц казеина. Затем в проточную кювету вводили кинезин, меченный родамином, и измеряли флуоресценцию с использованием микроскопии полного внутреннего отражения (TIRF). Наконец, в проточные кюветы вводили раствор антифадера, и флуоресценцию снова измеряли с помощью TIRF.
Затем в проточную кювету вводили кинезин, меченный родамином, и измеряли флуоресценцию с использованием микроскопии полного внутреннего отражения (TIRF). Наконец, в проточные кюветы вводили раствор антифадера, и флуоресценцию снова измеряли с помощью TIRF.
Связанные со здоровьем аспекты белков молока
Abstract
Молоко является важным компонентом сбалансированной диеты и содержит множество ценных компонентов.Известная польза молока для здоровья связана с его белками не только из-за их питательной ценности, но и из-за их биологических свойств. Научные данные свидетельствуют о том, что антиканцерогенная активность, антигипертензивные свойства, модуляция иммунной системы и другие метаболические особенности молока связаны с его белками (интактными белками или их производными). В этой статье рассматриваются основные аспекты молочных белков, связанные со здоровьем, такие как антиканцерогенное, иммуномодулирующее, противомикробное, антикариогенное, гипотензивное и гипохолестеринемическое действие. В совокупности полученные данные указывают на эффективность белков молока в снижении факторов риска рака, сердечно-сосудистых заболеваний и общем улучшении состояния здоровья.
В совокупности полученные данные указывают на эффективность белков молока в снижении факторов риска рака, сердечно-сосудистых заболеваний и общем улучшении состояния здоровья.
Ключевые слова: Сыворотка, казеин, пептид, здоровье, питание
Введение
Коровье молоко — это жидкий корм (87% воды), который содержит в среднем 13% сухих веществ и около 9% обезжиренных веществ. . Молоко — это богатый питательными веществами продукт, обладающий важной питательной ценностью за счет кальция, витамина D (особенно в обогащенной форме), белка, витамина B 12 , витамина A, рибофлавина, калия и фосфора.Достаточное содержание аминокислоты триптофана, предшественника ниацина, подчеркивает, что молоко является важным источником эквивалентов ниацина. Кроме того, он содержит различные биологически активные соединения с лечебным (нутрицевтическим) действием (1-4). Эпидемиологические исследования показали связь потребления молока и продуктов из него с пониженным риском метаболических нарушений, сердечно-сосудистых заболеваний, гипертонии, рака и некоторых других заболеваний (5-9).
Общее содержание белка в коровьем молоке составляет примерно 3.5% по весу (36 г / л), обеспечивая почти 38% от общего обезжиренного твердого вещества молока и около 21% энергии цельного молока (4, 10). Молоко известно как основной источник высококачественных белков, обладающих широким спектром питательных, функциональных и физиологических свойств (11-12). Молоко также является уникальным источником пептидов с биологической активностью. Пептиды, полученные из фракций казеина и сывороточных белков, включая опиоидные пептиды, антигипертензивные пептиды, фосфопептиды казеина (CPP), гликомакропептиды (GMP) и лакторфины, обладают различными физиологическими функциями, такими как опиоидоподобные свойства, иммуностимулирующая активность, антигипертензивная активность, антибактериальное и противовирусное действие, а также усиление абсорбции кальция (13-18).Новаторство этой статьи представляет собой всесторонний обзор пищевых и терапевтических эффектов молочных белков и биоактивности пептидов, в котором собраны все значимые исследования за последние 30 лет и представлены обновленные текущие знания в одном месте.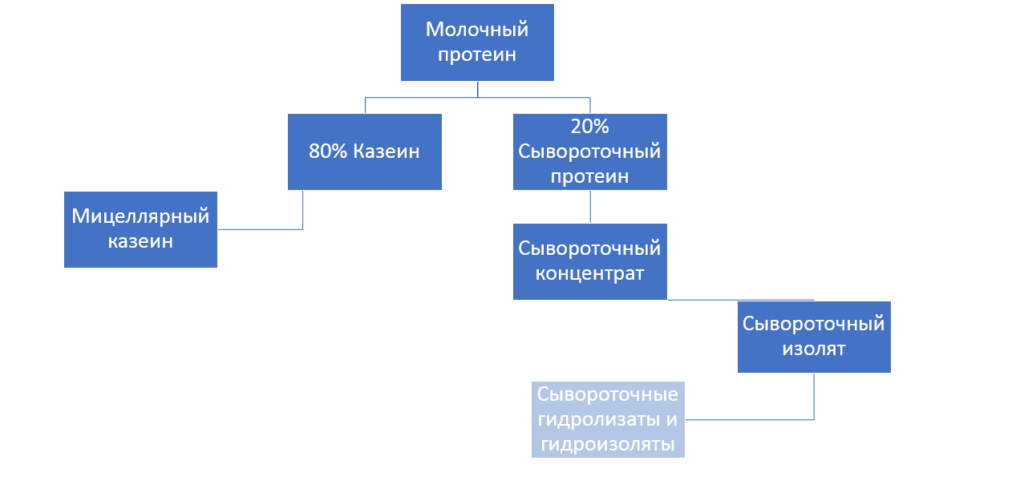
Белки молока
Казеин и сывороточный белок являются основными белками молока. Казеин составляет около 80% (29,5 г / л) от общего белка коровьего молока, а сывороточный белок составляет около 20% (6.3 г / л) (19-21). Казеин в основном конъюгирован с фосфатом и в основном состоит из комплексов фосфат кальция с мицеллами (20). Это гетерогенное семейство из 4 основных компонентов, включая альфа- (α s1 — и α s2 -казеин), бета-, гамма- и каппа-казеин (2, 22, 23).
Сывороточный протеин представляет собой набор глобулярных белков с высоким уровнем структуры α-спирали, а кислотно-основные и гидрофобно-гидрофильные аминокислоты распределены в достаточно сбалансированной форме (24). Альфа-лактальбумин (α-LA) и бета-лактоглобулин (β-LG) являются преобладающими сывороточными белками и составляют около 70–80% от общего количества сывороточных белков.Среди других типов сывороточных белков следует упомянуть иммуноглобулины (Igs), сывороточный альбумин, лактоферрин (LF), лактопероксидазу (LP) и протеазо-пептоны (19, 24-26). Сывороточные белки имеют существенные уровни вторичной, третичной и четвертичной структур. Они термолабильны, стабилизируя свою структуру пртотеина за счет межмолекулярных дисульфидных связей (25).
Сывороточные белки имеют существенные уровни вторичной, третичной и четвертичной структур. Они термолабильны, стабилизируя свою структуру пртотеина за счет межмолекулярных дисульфидных связей (25).
Пищевая ценность
Белок коровьего молока считается высококачественным или полноценным белком, поскольку он содержит все 9 незаменимых аминокислот в пропорциях, соответствующих потребностям в аминокислотах (3-4).Из-за высокого качества белка коровьего молока он считается стандартным эталонным белком для оценки питательной ценности других пищевых белков (4). Кроме того, содержание аминокислот с разветвленной цепью (изолейцин, лейцин и валин) в белках молока выше, чем во многих других источниках пищи. Эти аминокислоты, особенно лейцин, помогают минимизировать мышечное истощение в условиях повышенного распада белка и могут стимулировать синтез мышечного белка. Кроме того, сывороточный белок имеет высокое содержание серосодержащих аминокислот (цистеина и метионина), которые являются предшественниками глутатиона, трипептида с антиоксидантными, антиканцерогенными и иммуностимулирующими свойствами (4, 28).
Лечебные преимущества
Казеины и сывороточные протеины различаются по своим физиологическим и биологическим свойствам. В последние годы во многих исследованиях изучались терапевтические аспекты белков молока. Эти аспекты молочных белков описаны ниже в. указывает на выборочные публикации о пользе молочных белков для здоровья.
Таблица 1
Избранные публикации о пользе молочных белков для здоровья
| Вид протеина | Биологическая функция | Примечание | Артикул | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Сывороточные протеины Концентрат сывороточного протеина | Антиканцерогенная активность | Ингибирование возникновения и роста химически индуцированных опухолей | 43, 44, 45 | |||||||
| Иммуномодуляционные ответы | 51 | |||||||||
| Влияние на популяции Т-клеток, увеличение концентрации Т-хелперов и соотношения Т-хелперные клетки / Т-супрессоры | 53 | |||||||||
| β-Лактоглобулин | Антикарологическая активность | Стимуляция синтеза глутатиона | 48 | |||||||
| Противовирусная активность | Ингибирование ВИЧ-1 активности протеаз и интегразы | 67 | ||||||||
| 9015 Лактальбумин | Противораковое средство активность | Антипролиферативное действие на клеточные линии аденокарциномы толстой кишки | 50 | |||||||
| Антибактериальная и противовирусная активность | Уменьшение количества клеток в фекалиях младенцев E.coli | 66 | ||||||||
| Ингибирование активности протеазы и интегразы ВИЧ-1 | 67 | |||||||||
| Лактоферрин | Антиканцерогенная, противовоспалительная 153 активность | Антиканцерогенная, противовоспалительная активность | ||||||||
| Иммуномодулатин | улучшение ответов гиперчувствительности замедленного типа на ряд антигенов | 55 | ||||||||
| антиметастатическая активность и увеличение количества CD8 +, NK +, CD4 +, NK-клеток мыши | 59 | |||||||||
| Антибактериальная активность и противовирусная активность | Ингибирующее действие против H. pylori | 60, 61 | ||||||||
| Антибактериальная активность против грамотрицательных микроорганизмов | 62 | 67, 68 | ||||||||
| Антикариогенная активность | Ингибирование взаимодействия между S.mutans и агглютинин слюны | 70 | ||||||||
| Ингибирование S. mutans присоединения к S-HA | 71 | |||||||||
| Иммуноглобулин Профилактика | антибактериальная активность | |||||||||
| Защита от перорального заражения энтеротоксигенными E.coli | 65 | |||||||||
| Антикариогенная активность | Незначительная ингибирующая активность против S.mutans приверженность к S-HA | 71 | ||||||||
| Казеин Целый казеин | Антиканцерогенная активность | Защищает от рака толстой кишки | 85 | |||||||
| Антимутагенное действие в тонком кишечнике | 87, 88 | |||||||||
| Антикариогенная активность | Снижение скорости растворения гидроксиапатита 151 | 95, 96, 97 | ||||||||
| к-казеин | Противокариозная активность | Снижение активности фермента, способствующего образованию бляшек | 90 | |||||||
| 91, 92 | ||||||||||
| β-казеин | Гипохолестеринемические эффекты | Снижение уровня холестерина в крови | 98 | |||||||
| 109, 110, 111 | ||||||||||
| Ингибирование ангиогенеза опухоли, опосредованное факторами роста у мышей | 112 | |||||||||
| Иммуназа (IgM, IgG и IgA) продукция | 118 | |||||||||
| Снижение ответа IL-6 в моноцитарной клеточной линии | 119 | |||||||||
| Повышение активности фагоцитов человека | 120 | |||||||||
| Антибактериальный агент иальная активность | Подавление роста различных грамположительных и грамотрицательных бактерий | 122, 123 | ||||||||
| Антигипертензивная активность | зависимая вазоконстрикция | 134 | ||||||||
| Лакторфин | Антигипертензивная активность | Снижение артериального давления у крыс с гипертонической болезнью | 129 | |||||||
| Казеин-фосфопептиды, снижающие активность фосфопептидов кальция | , антигипертензивная активность | эпизод | 158, 160, 161 | |||||||
| Ингибирование S.sobrinus и S. sanguis приверженность S-HA | 163 | |||||||||
| Каппацин | Антибактериальная активность | Ингибирование S. mutans, Porphyromonas gingivalis и | Антибактериальная активность | Антибактериальная активность в отношении стафилококков, сарцины, B. subtilis, Diplococcus pneumoniae и Streptococcus pyogenes | 149 | |||||
| Инбактериальная активность против бактерий | ||||||||||
| Гликомакропептид | Противовирусная активность | Ингибирование вируса гриппа человека и вируса Эпштейна-Барра | 155, 156 | |||||||
| Иммуномодулирующее действие на кишечник | 145 | |||||||||
| Усиление пролиферации и фагоцитарной активности макрофагоподобных клеток человека | 146 | |||||||||
| Пептиды казоморфина 151 | Снижение пролиферационной активности простакреобразования линии раковых клеток | 136 | ||||||||
| Стимуляция апоптоза в клетках лейкемии человека (HL-60) | 137 |
Лечебные преимущества сывороточного протеина
Противораковое действие
Несколько исследований показывают, что молочные белки, особенно сывороточные белки, могут защищать человеческий организм от некоторых видов рака (толстой кишки, молочной железы и предстательной железы), вероятно, благодаря их способности повышать клеточный уровень глутатиона, а также способствовать гормональному и клеточному иммунному развитию. ответы (9, 29-34).Было указано, что сывороточные белки, такие как LA, LG, LF, LP и Igs, обладают антиканцерогенной активностью (35).
LF, железосвязывающий гликопротеин из семейства трансферринов, обладает антипролиферативными, противовоспалительными и антиоксидантными свойствами (9, 36-40). Основываясь на исследованиях in vivo, пероральное введение LF грызунам значительно снижало химически индуцированный канцерогенез в различных органах, таких как грудь, пищевод, язык, легкие, печень, толстая кишка, мочевой пузырь, и затруднял ангиогенез (37, 41, 42).Однако механизмы действия LF еще предстоит понять, кроме того, есть некоторые доказательства, подтверждающие его способность взаимодействовать с некоторыми рецепторами и модулировать генетическую экспрессию нескольких молекул, которые жизненно важны для клеточного цикла и механизмов апоптоза (9).
Большинство результатов, свидетельствующих о противоопухолевых свойствах сывороточных белков, было получено в ходе исследований in vitro с использованием клеточных линий карциномы или исследований in vivo с использованием моделей на животных. В исследованиях in vitro, изучающих химически индуцированное образование опухолей, сообщается об ингибирующем эффекте добавления сывороточного протеина на частоту и рост опухолей, который индуцируется 1,2-диметилгидразином (DMH) и азоксиметаном (AOM), и может снизить риск развития колоректальный рак (43-45).Hakkak и др. . (46) обнаружили, что частота опухолей молочной железы, вызванная диметилбенз- [α] -антраценом, химическим веществом, используемым для образования аденокарциномы молочной железы, была примерно на 50% ниже у самок крыс, получавших 14% (мас. / Мас.) Сывороточного протеина, по сравнению с крысы, получавшие казеин, и примерно на 30% меньше, чем крысы, получавшие сою, через 4 месяца. В другом исследовании McIntosh et al. (47), крысы на диете из сывороточного белка (20 г белка / 100 г массы тела) показали улучшенную защиту от индуцированных диметилгидразином кишечных опухолей по сравнению с животными, получавшими равное количество соевого белка или красного мяса.
β-LG, как богатый источник цистеина, стимулирует синтез глутатиона, антиканцерогенного трипептида, продуцируемого печенью для защиты от опухолей кишечника (48). Кроме того, сообщалось об ингибировании роста клеток рака молочной железы человека MCF-7 альбумином бычьей сыворотки (БСА) in vitro (49). Кроме того, бычий α-LA в концентрации от 5 до 35 мкг / мл проявлял антипролиферативную и апоптотическую активность в отношении некоторых типов линий клеток рака толстой кишки человека, таких как Caco2 и Ht-29 (50).
Иммуномодулирующие эффекты
Различные исследования in vitro, и in vivo, доказали, что белки молочной сыворотки способны положительно влиять на иммунные реакции.Мыши, получавшие концентрат сывороточного протеина (в течение 12 недель), показали значительно более высокий ответ антител слизистой оболочки на яичный альбумин и токсин холеры по сравнению с мышами, получавшими обычную диету (51).
Было установлено, что употребление белков бычьей сыворотки (в течение 5-8 недель) улучшает реакции гиперчувствительности замедленного типа на подушечках стопы и in vitro конканавалин А-индуцированную пролиферацию клеток селезенки у мышей (52). Также сообщалось о влиянии концентрата сывороточного протеина на популяции Т-клеток.Мыши, получавшие 25 г концентрата неденатурированного сывороточного протеина (в течение 4 недель), демонстрировали большее количество клеток L3T4 + (вспомогательные клетки) и более высокое соотношение клеток L3T4 + / Lyt-2 + (помощник / супрессор) по сравнению с мышами, получавшими изокалорийную казеиновую диету ( 53). Значительное увеличение общего количества лейкоцитов, количества лимфоцитов CD4 + и CD8 + и продукции интерферона-гамма (IFN-γ), стимулированного конканавалином А, клетками селезенки также наблюдалось у мышей, получавших фракцию альфа-сыворотки, по сравнению с мышами, получавшими казеин и изолят соевого белка (54).
В одном исследовании было объявлено о дозозависимом улучшении реакции гиперчувствительности замедленного типа на ряд антигенов, включая овальбумин, эритроциты барана и бациллу Кальметта-Герена у мышей после перорального или парентерального введения бычьего LF (55 ).
Исследование in vitro показало, что модифицированный концентрат сывороточного протеина (mWPC) подавлял пролиферативные ответы Т- и В-лимфоцитов на митогены в зависимости от дозы , , а также подавлял индуцированную аллоантигеном пролиферацию лимфоцитов во время смешанной лейкоцитарной реакции. .Кроме того, секреция цитокинов, IFN-γ и интерлейкина-4 (IL-4), а также процент активированных CD25 + Т-клеточных бластов после стимуляции митогеном подавлялись с помощью mWPC (56). Было замечено, что пероральное введение бычьего LF способствовало антиметастатической активности и сильно увеличивало количество CD4 +, CD8 + и естественных киллеров (NK) в лимфоидных тканях, тонком кишечнике и периферической крови мышей с опухолями. Более того, он усиливал цитотоксическую активность этих клеток против клеток лимфомы Yac-1 и карциномы толстой кишки 26.Кроме того, он значительно увеличивает выработку IL-18, IFN-γ и каспазы-1 в тонком кишечнике (37, 57).
Было продемонстрировано, что у онкологических больных назначение сывороточного протеина (30 г в день в течение 6 месяцев) нормализует количество лейкоцитов в крови (58). Также сообщалось, что добавление сывороточного протеина увеличивает уровень глутатиона в плазме и активность естественных киллеров (NK) у пациентов с хроническим гепатитом B (59).
Противомикробное и противовирусное действие
Интактная сыворотка содержит ряд уникальных компонентов с широким антимикробным действием.Несколько исследований продемонстрировали ингибирующую активность сывороточных белков против Helicobacter pylori ( H . pylori ) у инфицированных субъектов. В исследовании с участием пятидесяти девяти здоровых субъектов Okuda et al . (60) показали, что пероральный прием таблеток LF (200 мг) дважды в день в течение 12 недель снижает способность H. pylori образовывать колонии , . но полного искоренения добиться не удалось. В большом многоцентровом исследовании уровень эрадикации H.pylori у инфицированных пациентов, получавших LF (200 мг) дважды в день в течение 7 дней, составила 73% (61).
LF оказывает прямое бактерицидное действие против грамотрицательных организмов благодаря своей способности связываться с липидной частью А липополисахаридов бактерий и увеличивать проницаемость мембран (62). Было обнаружено, что LF (1 мг / мл) значительно защищал культивируемые эпителиальные клетки (выделенные от пациентов, страдающих фарингитом) против in vitro инвазии стрептококком группы A ( GAS) и интенсивно предотвращал инвазивность GAS, предварительно обработанного эритромицином или ампициллином. (63).Эффективность концентрата Ig коровьего молока против Shigella flexneri и защита от шигеллеза среди здоровых взрослых людей была описана Tacket et al . (64). Кроме того, иммуноглобулины, полученные из коровьего молока, могут защищать от перорального заражения энтеротоксигенным Escherichia coli (E. coil) у здоровых взрослых добровольцев (65). Брюкет соавт. Сообщил о значительном снижении роста и количества клеток детского фекального микроорганизма, E. coil 2348/69, у младенцев, которых кормили смесью с добавлением α-LA.(66).
Более того, некоторые исследования показали противовирусную активность сывороточных белков. В некоторых исследованиях изучалась ингибирующая активность сывороточных белков против вируса иммунодефицита человека (ВИЧ). LF, α-LA и β-LG показали ингибирующую активность против ВИЧ-1. LF проявлял сильную ингибирующую активность против активности обратной транскриптазы ВИЧ-1, но слабую ингибирующую активность против протеазы и интегразы ВИЧ-1, в то время как α-LA и β-LG проявляли ингибирующую активность против протеазы и интегразы ВИЧ-1, но не ингибировали ВИЧ-1. обратная транскриптаза.LF был более эффективным на ранней стадии ВИЧ-инфекции (67–68).
Антикариогенное действие
Существует множество научных данных, подтверждающих защитное действие сывороточных белков против кариеса зубов. Было указано, что сыворотка может оказывать местное антикариозное воздействие благодаря своей буферной способности (69). Mitoma и др. . (70) продемонстрировали, что бычий ЛФ может прочно связываться с агглютинином слюны и, следовательно, ингибировать взаимодействие между белковым антигеном Streptococcus mutans ( S.mutans ) и агглютинин слюны. В другом исследовании было продемонстрировано ингибирование присоединения S. mutans к покрытому слюной гидроксиапатиту (S-HA) компонентами молока. Бычий LF показал самую сильную ингибирующую активность. Другие компоненты, такие как LP и IgG, проявляли умеренную ингибирующую активность (71). Кроме того, LP и лизоцим синергетически обеспечивали антикариозный эффект за счет ограничения метаболизма глюкозы S. mutans и, следовательно, снижали продукцию кислоты в среде зубного налета (25, 71).
Влияние сывороточных белков на чувство сытости, прием пищи и потерю веса
Влияние молока и молочных продуктов на регулирование приема пищи и насыщения объясняется несколькими компонентами. Среди компонентов молока белки обладают наибольшим потенциалом для подачи сигналов о сытости, а белки молока более насыщают, чем другие источники белка (72-74). Белки сыворотки способствуют краткосрочному и долгосрочному регулированию приема пищи, вызывая сигналы сытости (75-76).Одно исследование показало, что потребление 45 г сывороточного протеина в виде подслащенных напитков подавляло потребление пищи в большей степени, чем яичный альбумин и соевый протеин в пицце через 60 минут (77). В другом исследовании напитки, содержащие 400 ккал и 48 г сыворотки, стимулировали субъективное насыщение и снижали потребление пищи во время шведского стола на 90 минут позже, чем напитки, содержащие такое же количество казеина (78). Завтрак с высоким содержанием белка (58,1% энергии из белка и 14,1% энергии из углеводов), состоящий из молочных продуктов, обогащенных изолятом сывороточного белка, повысил уровень глюкагоноподобного пептида-1 более чем на 3 часа больше, чем завтрак с высоким содержанием углеводов (19.3% энергии из белков и 47,3% энергии из углеводов), состоящих из простого йогурта (79).
В клиническом испытании со здоровыми участниками с избыточным весом и ожирением Baer et al . (80) обнаружили, что после 23 недель потребления дополнительного сывороточного белка, соевого белка и изоэнергетического количества углеводов, массы тела и жировых отложений среди группа сывороточного протеина была ниже, чем группа, потребляющая углеводы. Окружность талии также была меньше у субъектов, получавших сывороточный протеин, чем в других группах.Более того, уровень грелина натощак был ниже у субъектов, получавших сывороточный белок, по сравнению с соевым белком или углеводом.
Было показано, что кормление инсулинорезистентных крыс с ожирением сывороточным протеином снижает потребление калорий, уменьшает жировые отложения и, следовательно, приводит к значительному улучшению чувствительности к инсулину по сравнению с диетой из красного мяса (81-82). Кроме того, у крыс, получавших неограниченное количество белков в рационе в течение 25 дней, фракции молочного белка (цельный молочный белок, сывороточный белок или фракция, обогащенная β-LG) снижали потребление калорий, массу тела и жировые отложения.β-LG оказалась наиболее эффективной фракцией (83).
Лечебные преимущества казеиновых белков
Противораковое действие
Имеются данные, свидетельствующие о том, что казеин может защищать организм от некоторых видов рака. Казеин ингибирует фекальную бета-глюкуронидазу, фермент, продуцируемый кишечными бактериями, и деконъюгирует проканцерогенные глюкурониды с канцерогенами (21). Казеин также может защищать от рака толстой кишки благодаря своему влиянию на иммунную систему, в частности, за счет стимуляции фагоцитарной активности и увеличения лимфоцитов (29).Другие исследователи предполагают, что антиканцерогенные свойства казеина связаны с его молекулярной структурой (84).
Более низкая заболеваемость ДМГ-индуцированным колоректальным раком была обнаружена у крыс, получавших казеиновую диету, по сравнению с крысами, получавшими другие источники белка, такие как соя и красное мясо. Внутриклеточная концентрация глутатиона в печени также была выше у крыс, получавших казеин (47). Уменьшение заболеваемости опухолями толстой кишки также наблюдалось у крыс, получавших смесь казеина и протеина пшеницы, по сравнению с крысами, получавшими эквивалентное количество протеина пшеницы и нута (85).В ходе исследования крысы, получавшие 10 еженедельных инъекций AOM по 7,4 мг / кг массы тела, получали синтетические изоэнергетические диеты с различным содержанием белка, включая 25% казеина (диета с нормальным содержанием белка), 10% казеина (диета с низким содержанием белка). , или 5% казеина (диета с очень низким содержанием белка). Применение диеты, содержащей 25% казеина, приводило к меньшей заболеваемости опухолями толстой кишки у крыс, чем изоэнергетическая диета, содержащая 10 и 5% казеина, через 30 недель (86).
Исследования in vitro и in vivo продемонстрировали влияние казеината и соевого белка на мутагенный потенциал N-метил-N’-нитро-N-нитрозогуанидина (MNNG).Из этих двух пищевых белков только казеин проявлял антимутагенную активность против MNNG в тонком кишечнике мышей, получавших этот мутаген (87). Кроме того, антимутагенный потенциал казеина оценивался в отношении различных мутагенов, включая некоторые мутагены пищевого происхождения. Казеин проявил наибольшую антимутагенную активность в отношении бензо [а] пирена, N-метилнитрозомочевины и нитрозированного 4-хлориндола и наименьшую антимутагенную активность в отношении азида натрия и N-нитрохинолин-1-оксида (88).
Антикариогенное действие
Некоторые исследования показывают, что казеин может способствовать положительному воздействию молока на здоровье полости рта (89).Каппа-казеин (k-казеин) может защищать от кариеса зубов за счет снижения активности глюкозилтрансферазы, фермента, стимулирующего образование зубного налета, продуцируемого S. mutans , и способности этого фермента прилипать к поверхности зубов или S-HA (90 ). -Казеин также снижает адгезию S. mutans к поверхности S-HA зубов (91-92).
Исследование на крысах, инфицированных смешанными бактериальными суспензиями Streptococcus sobrinus OMZ 176 и Actinomyces viscosus Ny1 , показало, что потребление сухого молочного мицеллярного казеина может уменьшить образование расширенных зубных трещин и повреждений гладкой поверхности, а также ингибировать колонизацию Streptococcus sobrinus (S.sobrinus) (93). В другом исследовании весь казеин был объединен с раствором лимонной кислоты, чтобы оценить влияние безалкогольных напитков на скорость растворения гидроксиапатита. Добавление 0,02% (мас. / Об.) Казеина к растворам лимонной кислоты значительно снизило скорость растворения гидроксиапатита примерно на 50–60% (94).
Гипохолестеринемические эффекты
Некоторые исследователи изучали влияние казеина на уровень холестерина в крови. В перекрестном исследовании 11 нормальных участников получали диеты, обеспечивающие 20% калорий из казеина или соевого белка.Среднее потребление холестерина составляло 500 мг / сут. Первоначальное снижение уровня холестерина в плазме и холестерина липопротеинов низкой плотности (ХС-ЛПНП) наблюдалось в обеих диетах (95). В другом перекрестном исследовании нормолипидемические здоровые мужчины, не страдающие ожирением, потребляли 2 диеты с жидкими смесями, содержащими казеин или соевый белок. Через 30 дней на каждой диете концентрация липопротеина (а) снижалась примерно на 50% при сравнении казеиновой диеты с соевой белковой диетой. Концентрации общего холестерина, ХС-ЛПНП и холестерина липопротеинов высокой плотности (ХС-ЛПВП) также были снижены при использовании обеих диет (96).У пациентов с гиперхолестеринемией, которые потребляли 2 дозы казеина (30 или 50 г) в виде напитка, концентрация общего холестерина была снижена в течение 16 недель (97). Одно исследование с участием австралийцев с высоким риском развития сердечных заболеваний показало, что ежедневный прием 25 г бета-казеина ( β-казеин) A1 или A2 может значительно снизить концентрацию холестерина в крови (98).
Терапевтические преимущества биоактивных пептидов, полученных из белков молока
Молоко содержит различные биоактивные компоненты, в том числе биоактивные пептиды с физиологической функциональностью.Пептиды, полученные из молока, включают множество веществ, которые являются мощными модуляторами различных регуляторных процессов в организме и проявляют многофункциональную биоактивность. Биологически активные пептиды, скрытые в неповрежденных белках молока, высвобождаются и активируются при желудочно-кишечном переваривании молока, ферментации молока с помощью заквасочных культур протеолиза или гидролиза протеолитическими ферментами. Было продемонстрировано, что биоактивные пептиды, полученные из казеина и белков сыворотки, включая опиоидные пептиды, антигипертензивные пептиды, СРР, лакторфины и альбутенсин, играют физиологические роли, такие как опиоидоподобные свойства, иммуностимуляция, ингибирование ангиотензин-I-превращающего фермента (АПФ), анти- гипертензивное свойство и антимикробное действие (13, 14, 99-105).
Терапевтические преимущества биоактивных пептидов, полученных из сыворотки
Гидролиз сывороточных белков приводит к образованию биоактивных пептидов. Экспериментальные данные показали, что биоактивные пептиды могут быть очищены от α-LA, β-LG, бычьего LF и BSA. Некоторым из этих пептидов даны особые названия, такие как α- и β-лакторфин, β-лактотензин, серофин, альбутенсин A, лактоферрицин (Lfcin) и лактоферрампин. Большинство этих пептидов не охарактеризовано в той же степени, что и пептиды, производные от казеина.В последнее время пептиды, полученные из сыворотки, привлекли особое внимание из-за их профилактических и терапевтических свойств (14, 106, 107). Ниже обсуждаются различные терапевтические преимущества биоактивных пептидов, полученных из сыворотки.
Противораковое действие
Пептиды, происходящие из N-концевой области LF, были исследованы с целью идентификации последовательностей с потенциальной противоопухолевой активностью. Рой и др. . (108) выделили 4 пептида из пепсиновых гидролизатов лактоферрина с антипролиферативными и апоптотическими свойствами.Последовательность, соответствующая остаткам 17–38 бычьего LF, показала наивысшую апоптотическую активность в клетках лейкемии человека (HL-60). Eliassen et al. (109) сообщили, что бычий Lfcin, f (17-41), проявлял цитотоксическую активность в отношении линий клеток Meth Afibrosarcoma, меланомы и карциномы толстой кишки и значительно уменьшал размер солидных Meth A опухолей. Кроме того, Lfcin проявлял противоопухолевую активность против клеток рака молочной железы MDA-MB-435, индуцируя апоптоз (110) и цитотоксическую активность in vitro и in vivo против клеток нейробластомы путем дестабилизации цитоплазматической и митохондриальной мембран (111). .
Lfcin B может также ингибировать ангиогенез, опосредованный сосудистым эндотелиальным фактором роста и фактором роста фибробластов на моделях мышей, а также опосредовать антипролиферативную и антимиграционную активность против индуцированных проангиогенным фактором эндотелиальных клеток пупочной вены человека (112).
Исследования in vitro предполагают, что лечение Lfcin B индуцировало апоптотическую гибель в нескольких различных клеточных линиях лейкемии и карциномы человека путем стимуляции митохондриального пути апоптоза за счет продукции активных форм кислорода и активации каспазы-9 и каспазы-3 (113) .Кроме того, было замечено, что бычий Lfcin может запускать митохондриально-зависимый апоптоз в клетках Jurkat T-лейкемии за счет повреждения клеточной мембраны посредством связывания с клеточной мембраной, увеличения проницаемости клеточной мембраны и последующего разрушения митохондриальной мембраны (114 ).
Иммуномодулирующие эффекты
Сыворотка включает несколько мощных иммуномодулирующих пептидов, которые скрыты в интактной структуре сывороточных белков (115). Влияние пептидов, высвобождаемых при триптическом расщеплении бычьего β-LG на различные иммунные функции у мышей, было изучено Pecquet et al .(116). Толерантность к β-LG была повышена у мышей, получавших гидролизаты β-LG или фракции гидролизата. Также наблюдалось снижение уровней IgE в сыворотке и кишечнике. Кроме того, были подавлены β-LG-специфическая гиперчувствительность замедленного типа и пролиферативные ответы клеток селезенки.
Prioult et al . (117) объявили, что гидролизат β-LG с пептидазами Lactobacillus paracasei генерировал ряд небольших иммуномодулирующих пептидов. Эти пептидные последовательности снижали пролиферацию лимфоцитов и усиливали выработку иммунодепрессанта интерлейкина-10.
Несколько исследований выявили иммуномодулирующие свойства Lfcin. Гидролиз бычьего LF пепсином дает иммуностимулирующие и иммуноингибирующие пептиды. Гидролизат значительно усиливал пролиферацию и образование Ig (IgM, IgG и IgA) в мышиных спленоцитах, а также пролиферацию и продукцию IgA в клетках Пейера-патча in-virto (118). Было обнаружено, что бычий LF и Lfcin B снижают ответ IL-6 в человеческих моноцитарных клетках THP-1 после стимуляции липополисахаридом (119).Кроме того, Lfcin B увеличивал фагоцитарную активность нейтрофилов человека за счет прямого связывания с нейтрофилами и опсониноподобной активности (120).
Противомикробное действие
Было установлено, что
пептидов, производных от LF, обладают антимикробными свойствами. Антибактериальные свойства ферментных гидролизатов бычьего ЛФ были исследованы Tomita et al (121). Гидролизаты, полученные расщеплением LF свиным пепсином, тресковым пепсином или кислой протеазой из Penicillium duponti , проявляли интенсивную антибактериальную активность против Escherichia coli 0111.
Было показано, что Lfcin B ингибировал или инактивировал различные группы грамположительных и грамотрицательных бактерий, включая E. coli , Salmonella enteritidis , Yersinia enterocolitica, Klebsiella pneumoniae , Proteus vulgarasis , aeruginosa , Campylobacter jejuni , Staphylococcus aureus , Staphylococcus haemolyticus , Streptococcus thermophilus , S. mutans , Clostridium perfringenium, B.subtilis) и Bifidobacterium infantis (122-124).
Протеолитическое расщепление α-LA генерировало 3 антибактериальных пептидных фрагмента, включая LDT1 f (1–5), LDT2 f (17–31SS109– 114) и LDC f (61–68S-S75–80). Эти последовательности были эффективны против грамположительных бактерий, в то время как они проявляли слабую активность против грамотрицательных бактерий (124). Кроме того, 4 пептидных фрагмента, включая f (15-20), f (25-40), f (78-83) , и f (92–100), были выделены триптическим расщеплением β-LG крупного рогатого скота.Выделенные фрагменты показали бактерицидную активность в отношении грамположительных бактерий (126).
Антигипертензивное действие
Было установлено, что инкубация in vitro белков молока с протеазой желудочно-кишечного тракта, включая пепсин, трипсин и химотрипсин, может дать большое количество фрагментов с активностью ингибирования АПФ. Пептиды, ингибирующие АПФ, производятся во время желудочно-кишечного транспорта. Бактериальные и растительные протеиназы также можно применять для получения таких пептидов (127-128).
Нурминен и др. . (129) исследовали антигипертензивную активность альфа-лакторфина, тетрапептида (Tyr-Gly-Leu-Phe), происходящего из молочного α-LA, у находящихся в сознании спонтанно гипертензивных крыс (SHR) и у нормотензивных крыс Wistar Kyoto. α-Лакторфин дозозависимо снижал артериальное давление у крыс SHR и Wistar Kyoto. Ферментативное расщепление сывороточного протеина протеиназой К высвободило 6 мощных пептидов, ингибирующих АПФ. Эти пептиды обладали антигипертензивной активностью в отношении SHR. Из этих 6 пептидов фрагмент Ile-Pro-Ala, первоначально полученный из β-LG, проявлял наибольшее ингибирующее действие на АПФ (130).
Маллалли и др. . (131) исследовали ингибирующую активность АПФ при триптическом расщеплении бычьего β-LG. Фракция β-LG (142–148) дала индекс ингибирования АПФ 84,3%. В другом исследовании некоторые пептиды, ингибирующие АПФ, были выделены путем гидролиза белков бычьей сыворотки с помощью комбинации ферментов, включая пепсин, трипсин и химотрипсин, или только с трипсином. Полученные пептиды представляли собой фрагменты α-LA (50-52), (99-108), (104-108) и фрагменты β-LG (22-25), (32-40), (81-83), ( 94-100), (106-111), (142-146).Активность АПФ подавлялась на 50% гидролизатами сыворотки в диапазоне концентраций 345-1733 мкг / мл (132).
Кроме того, ферментативное расщепление LF высвободило некоторые антигипертензивные пептиды с молекулярной массой ниже 3 кДа. Эти фракции показали ингибирующую активность в отношении ACE и эндотелин-превращающего фермента (ECE) in vitro (133).
Ruiz-Giménez et al. (134) сообщили, что набор из 8 пептидов, генерируемых LfcinB (20-25), может ингибировать активность ACE in vitro .Из этих пептидов 7 проявили ex vivo ингибирующую активность против ACE-зависимой вазоконстрикции. Только пероральное введение LfcinB (20-25) и одного из его фрагментов, F1, снижает артериальное давление у SHR.
Более того, в контролируемом исследовании с участием добровольцев с предгипертензивной или предгипертензивной стадией 1 артериальное давление было значительно ниже в группе лечения, которая потребляла 20 г / день гидролизованного изолята сывороточного белка, богатого биоактивными пептидами, чем в контрольной группе, которая потребляла такое же количество негидролизованного изолята сывороточного протеина (135).
Терапевтические преимущества биоактивных пептидов, полученных из казеина
Казеин, содержащийся как в молоке, так и в молочных продуктах, является основным источником биоактивных пептидов. Пептиды, производные от казеина, проявляют разные биоактивные роли (14). Ниже обсуждаются терапевтические преимущества биоактивных пептидов, полученных из казеина.
Противораковое действие
Согласно различным цитохимическим исследованиям, есть некоторые доказательства возможной антиканцерогенной активности пептидов, производных от казеина. Исследования in vitro показали, что пептиды на основе казеина, выделенные после микробной ферментации молока, могут защищать от рака толстой кишки за счет изменения кинетики клеток (84). Kampa et al . (136) описали, что несколько пептидов казоморфина, группа опиоидных пептидов, полученных из ɑ- и β-казеина, подавляли пролиферацию некоторых линий клеток рака простаты, включая LNCaP, PC3 и DU145, за счет вовлечения опиоидных рецепторов. . Также апоптозу клеток HL-60 способствовали опиоидный пептид β-казоморфин-7 и фосфопептид β-CN (f1-25) 4P (137).Более того, очищенные пептиды, соответствующие биоактивным фракциям казеина, показали модулирующее действие на жизнеспособность, пролиферацию и апоптоз клеток в различных моделях культур клеток человека, включая лимфоциты периферической крови человека, HL-60, полиморфно-ядерные лейкоциты и клетки Caco-2 (138 -139).
Иммуномодулирующие эффекты
Было проведено несколько экспериментов для изучения влияния биоактивных пептидов, полученных из казеина, на иммунную функцию. Было обнаружено, что in vitro расщепление казеина, продуцируемого пептидазами Lactobacillus rhamnosus , ингибировало транслокацию протеинкиназы C и подавляло экспрессию мРНК IL-2.Эти результаты продемонстрировали подавление in vitro активации Т-клеток перевариванием казеина (140). Sütaset al. (141) сообщил, что казеины крупного рогатого скота, гидролизованные ферментами, продуцируемыми Lactobacillus GG , ингибировали продукцию IL-4 мононуклеарными клетками периферической крови у детей с атопией. В другом исследовании Sütas et al . (142) показали, что переваривание казеинов протеазами, полученными из Lactobacillus casei (L. casei) GG , дает некоторые фракции с подавляющим действием на пролиферацию лимфоцитов in vitro .Hata и др. . (143) продемонстрировали, что казеинофосфопептиды β-CN (f1–25) 4P и α S1 -CN (f59–79) 5P обладают иммуностимулирующим действием за счет увеличения продукции IgG в культурах клеток селезенки мышей. Более того, CPP, полученные из бычьего αs2- и β-казеина, проявляли иммуноусиливающую активность за счет повышения уровня сывороточного и кишечного антиген-специфического IgA у мышей, получавших препарат CPP (144).
ГМФ крупного рогатого скота может стимулировать человеческие моноциты и секрецию фактора некроза опухоли, IL-1β и IL-8 из человеческих моноцитов посредством воздействия на митоген-активируемую протеинкиназу и сигнальные пути ядерного фактора-kappaB.GMP может оказывать непрямое противовоспалительное действие на кишечник за счет усиления защиты хозяина от вторжения микроорганизмов (145). GMP и его производные, генерируемые пептическим гидролизом, могут стимулировать пролиферацию и фагоцитарную активность макрофагоподобных клеток человека U937 (146).
Противомикробное и противовирусное действие
Имеются некоторые данные об антимикробных свойствах пептидов, полученных из казеина. Макканн и др. . (147) обнаружили новый фрагмент коровьего α S1 -казеина, f (99-109), очищенный ферментативным расщеплением бычьего казеината натрия пепсином.Этот фрагмент проявлял ингибирующую активность против грамположительных и грамотрицательных бактерий.
Каппацин, монофосфорилированный фрагмент Ser (P) 149 k -казеин -A f (138-158), продуцируемый эндопротеиназой Glu-C переваривания CPP, проявлял ингибирующую активность против S. mutans, Porphyromonas gingivalis и E coli (148). Казеицидин, защитный пептид, очищенный химозиновым гидролизом казеина при нейтральном pH, показал ингибирующую активность против стафилококков , Sarcina spp , B.subtilis , Diplococcus pneumoniae и Streptoco ccus pyogenes (149). Иммуномодулирующий пептид, выделенный из бычьего β-казеина, β-CN (193-209) пептид, способствует антимикробной активности макрофагов мыши за счет усиления экспрессии антигена MHC класса II и усиления фагоцитарной активности (150). Противомикробные свойства казеицинов хорошо продемонстрированы. Казеицины A и B, соответствующие f (21-29) и f (30-38) коровьего α s1 -казеина, показали интенсивную активность против Enterobacter sakazakii (151).
Исследования in vitro показали, что казоцидин-I, С-концевой фрагмент коровьего α S2 -казеина, подавлял рост штаммов E. coli и Staphylococcus (152). GMP также были продемонстрированы. Способность GMP ингибировать связывание токсина холеры с нормальными клетками яичника китайского хомячка была описана Kawasaki et al . (153). Кроме того, он показал аналогичную ингибирующую активность против E.coli , термолабильные энтеротоксины LT-I и LT-II, связанные с антигенами фактора колонизации CFA / I и CFA / II, соответственно, в модели яичников китайского хомячка (154). GMP может также ингибировать гемагглютинацию 4 штаммами вируса гриппа человека в диапазоне концентраций от 10 9 10 25 -2 9 10 26 до 10 9 10 25 9 10 26 3 (155). Досако и др. . (156) продемонстрировали способность GMP ингибировать морфологические преобразования в лимфоцитах периферической крови, индуцированные вирусом Epstein Barr .
Антикариогенное действие
Некоторые исследователи исследовали способность биоактивных пептидов казеина ингибировать деминерализацию и усиливать реминерализацию зубной эмали. Полученные из молока биоактивные пептиды, такие как CPP и GMP, могут быть ответственны за кариостатические свойства сыра за счет подавления роста кариесогенных бактерий, концентрации кальция и фосфата в зубном налете, уменьшения деминерализации эмали и усиления реминерализации (25, 89, 157).
Антикариогенное воздействие CPP было продемонстрировано в экспериментах на животных и людях. Было высказано предположение, что СРР стабилизируют фосфат кальция, образуя комплексы фосфопептид казеина-фосфат кальция (СРР-КП) и увеличивая поглощение кальция и фосфата зубным налетом (158-159). Кроме того, CPP и аморфный фосфат кальция (ACP) связываются с зубным налётом, обеспечивая потенциальный источник кальция внутри налета и уменьшая диффузию свободного кальция. Следовательно, CPP-ACP может защищать от кариеса зубов, уменьшая потерю минералов во время кариесогенного эпизода и обеспечивая богатый источник кальция для последующей реминерализации (160–161).Кроме того, CPP могут оказывать антикариозное воздействие, конкурируя с бактериями, образующими бляшки, за связывание с кальцием (162).
Neeser et al . (163) исследовали способность компонентов казеина молока ограничивать адгезию некоторых одонтопатогенных бактерий к поверхности зубов. Казеинат натрия, CPP и GMP подавляли прилипание потенциальных стоматологических патогенов, включая Streptococcus sobrinusOMZ 176 , а также Streptococcus sanguis ( S.sanguis) ОМЗ для бусинок S-HA. В аналогичном исследовании Schüpbach et al . (164) рассматривали GMP и CPP как ингибиторы адгезии бактерий полости рта. Адгезионная способность S. sobrinus к слюнной пленке была снижена на 49%, 75% и 81% за счет GMP, CPP и комбинации GMP и CPP, соответственно.
Антигипертензивное действие
Были проведены обширные исследования влияния биологически активных пептидов, полученных из казеина, на кровяное давление.В одинарном слепом плацебо-контролируемом исследовании с участием взрослых японцев с высоким нормальным артериальным давлением или легкой гипертензией прием гидролизата казеина, содержащего биоактивные пептиды (в течение 6 недель), привел к значительному снижению систолического артериального давления с 1,7 до 10,1 мм рт. дозозависимым образом (165). Исследование с участием пациентов с нормальным и умеренным артериальным давлением показало, что потребление 10 г триптического гидролизата казеина (два раза в день в течение 4-недельного периода) оказывало антигипертензивное действие (166).В другом исследовании ежедневный прием 800 мг / кг массы тела продукта гидролизата казеина в течение 6 недель уменьшал развитие гипертонии и увеличивал экспрессию eNOS в SHR (167).
В плацебо-контролируемом исследовании ежедневное потребление 95 мл кислого молока, содержащего два ингибирующих АПФ пептида из β-казеина, f (84–86) и f (74–76), значительно снижало артериальное давление у пациентов с гипертонией после 4–8 недель (168). Сообщалось, что пептиды, производные от казеина L.helveticus показали ингибирующую активность АПФ (169). Ингибирующая активность АПФ трипептидов на основе казеина Ile-Pro-Pro и Val-Pro-Pro также была обнаружена Накамурой и др. . (170).
В плацебо-контролируемом двойном слепом перекрестном исследовании потребление продукта, содержащего трипептиды казеинового происхождения (Ile-Pro-Pro и Val-Pro-Pro) и растительные стеролы, резко снижало артериальное давление у лиц с легкой гипертонией (171) .
Белки казеина молока: древние, разнообразные и необходимые
- Белки казеина уникальны для молока и обеспечивают грудных млекопитающих незаменимыми аминокислотами, а также связывают кальций и фосфор, необходимые для роста скелета.
- Молоко содержит несколько типов казеиновых белков, которые очень разнообразны как среди видов млекопитающих, так и внутри них.
- Интерес к составу казеина коровьего молока достиг пика в связи с появлением молока А2 на молочных фермах.
- A2 — один из 13 различных белков бета-казеина, каждый из которых способствует высокому содержанию белка и кальция в молоке.
Возьмите ближайший пакет молока. Найдите этикетку с питанием.Под общим содержанием жира вы, вероятно, найдете информацию о том, сколько из этого жира является насыщенными, ненасыщенными и даже трансжирными кислотами. Под углеводами вы узнаете, сколько клетчатки и сахара содержится в вашем молоке. Но когда речь заходит о белке, есть только один ряд информации, создающий ложное впечатление, что молочный белок не так сложен, как молочный жир или сахар. Однако коровье молоко состоит из двух разных типов белков, сывороточного и казеина, большинство из которых — казеины. Существует четыре различных подтипа казеиновых белков, и для каждого из четырех подтипов существуют десятки различных генетических вариантов.Как вам такой комплекс?
До недавнего времени никогда особо не беспокоило, какие типы казеиновых белков содержатся в той или иной упаковке коровьего молока. Но это может измениться с появлением молока A2 для молочных продуктов в США и утверждений, что одни казеиновые белки полезнее других. Простого знания того, сколько белка содержится в стакане молока, может быть недостаточно; пришло время усложнить задачу, выйти за рамки пищевой ценности и понять разнообразие казеинов в вашем стакане молока.
Знакомство с казеинами
Молоко всех млекопитающих, от утконоса, откладывающего яйца, до человека, живущего в социальных сетях, содержит смесь белков сыворотки и казеина. У людей концентрация этих двух веществ почти поровну: 60% сыворотки и 40% казеина. У коров преобладают казеины, составляющие почти 80% белков молока. Эти различия в пропорциях связаны с разными потребностями развития новорожденных людей и коров. Сывороточные белки легче перевариваются и, как следствие, являются более быстрым источником аминокислот.Напротив, уникальная структура казеиновых белков, называемых мицеллами казеина, затрудняет их разрушение и требует более длительного времени переваривания.
Сывороточный протеин и казеин обеспечивают младенцев-млекопитающих аминокислотами, необходимыми для роста и развития. Но мицеллы казеина обеспечивают еще кое-что важное для роста: кальций и фосфор. Уникальная упаковка белков и минералов осуществляется только клетками молочной железы и позволяет суспендировать эти питательные молекулы в жидкости (в конце концов, молоко — это в основном вода), как если бы они были растворимы (хотя технически они нет).
Мицеллы казеина содержат два типа казеиновых белков: чувствительные к кальцию (включая три подтипа αs1-, αs2- и β-казеина) и нечувствительные к кальцию (только κ-казеин). Три чувствительных к кальцию казеина отвечают за связывание кальция и фосфора, тогда как κ-казеин отвечает за стабилизацию структуры [1]. Когда эти белково-минеральные сферы достигают пищеварительного тракта, определенные пищеварительные ферменты отрезают κ-казеин, превращая некогда растворимую мицеллу в нерастворимый творог.Это может показаться плохим, но на самом деле это очень полезно для всех потребителей молока, потому что оно дольше сохраняет чувство сытости и постепенно высвобождает питательные вещества в кровоток. То, что когда-то было жидкостью, теперь стало твердым, что требует больше усилий и времени на переваривание.
Но время и усилия, которые ребенок вкладывает в переваривание казеинового творога, того стоят — мицеллярная структура казеина позволяет концентрации кальция и фосфора в молоке превышать то, что было бы возможно, если бы эти минералы были доставлены сами по себе [1].Все новорожденные и младенцы млекопитающих имеют высокие потребности в кальции и фосфоре, поскольку эти минералы необходимы для роста скелета. Но потребности в этих минералах особенно высоки у древнейших линий млекопитающих — монотремов (млекопитающих, откладывающих яйца) и сумчатых (млекопитающих с мешочком), которые рождают чрезвычайно незрелое потомство. Сказать, что казеины ответственны за успех линии млекопитающих, не будет преувеличением. Способность казеинового белка связывать кальций и фосфор, одновременно доставляя высококачественный белок новорожденному и младенцу, позволила самым ранним млекопитающим успешно воспроизводить незрелое потомство в различных средах [2,3].
Разнообразное генеалогическое древо
Гены, которые обеспечивают инструкции по сборке кальций-чувствительных и нечувствительных к кальцию казеиновых белков, уникальны для млекопитающих и обнаружены у всех живых млекопитающих [2]. Исследования генеалогического древа казеиновых белков показывают, что они наиболее тесно связаны с генами, ответственными за минерализацию зубов и костей позвоночных [2]; очевидно, казеины всегда имели сродство с кальцием и фосфором.
Хотя в геномах всех млекопитающих есть инструкции по производству αs1-, αs2-, β- и κ-казеинов, язык этих инструкций (A, C, T и G кода ДНК) сильно различается у разных видов и внутри них. [2–4].Действительно, при сравнении генов молока у отдаленно родственных млекопитающих (например, утконоса, опоссума, коровы и человека) гены казеинового белка оказались наиболее дивергентными из белков молока [4]. Rijnkels [3] сообщает, что различия между видами в аминокислотных последовательностях αs1- и αs2-казеинов в первую очередь связаны с перетасовкой кодирующих частей генов, известных как экзоны. Напротив, вариация β-казеина — это в первую очередь результат точечных мутаций, изменение всего лишь одной буквы кода ДНК [3].
Изменение слов в инструкции по эксплуатации вряд ли приведет к созданию рабочего конечного продукта. Таким же образом изменение аминокислот в кодирующей части гена обычно изменяет функцию белка. Так обстоит дело с серповидно-клеточным гемоглобином — изменение одной буквы в одной аминокислоте в одной из четырех белковых цепей, составляющих белок гемоглобина, производит серповидные эритроциты, которые функционально уступают своим предкам с круглым гемоглобином в транспортировке кислорода по всему телу. тело.Как могут гены казеинового белка иметь перестройки кодирующих частей или изменения в аминокислотной последовательности без серьезных функциональных изменений?
Причина может быть связана с формой казеиновых белков. Многие белки плотно свернуты, как маленькие клубки пряжи. Аминокислоты, составляющие белковую цепь, заряжены либо положительно, либо отрицательно, и, таким образом, свертываясь, они вступают в реакцию друг с другом и изменяют форму белка. Однако описывается, что белки казеина имеют более открытую (или развернутую) форму с большим пространством между различными аминокислотами.Таким образом, мутации, которые изменяют аминокислоты в открытом белке, с меньшей вероятностью изменят форму и, следовательно, функцию белка. В результате белки казеина могут справляться с частыми мутациями лучше, чем другие типы белков. Они сильно расходятся, потому что могут быть; казеины не находятся под теми же ограничениями, что и другие белки [3].
Много шума о A2
Большинство потребителей могут знать, что их молоко содержит белки сыворотки и казеин, но они, вероятно, не могут сказать вам конкретный тип казеинового белка коровьего молока.Однако это может измениться для потребителей в США, поскольку молоко A2 становится все более распространенным в местных продуктовых магазинах. A2 относится к генетическому варианту β-казеина коровьего молока и считается предком β-казеина. Точечная мутация (C был изменен на A) привела к варианту гена A1 более 8000 лет назад [5]. Считается, что эта мутация произошла в европейских стадах, поскольку коровы европейского происхождения продуцируют как белки β-казеина A1, так и A2, но коровы, обитающие в Азии и Африке, имеют только аллель A2 [5].
Молоко A2 содержит только белки β-казеина A2, тогда как обычное (или обычное) молоко содержит некоторое количество β-казеина A1, где некоторое количество является ключевым словом. Большая часть молока в США, Канаде и Европе на самом деле содержит комбинацию белков β-казеина A1 и A2. Гены этих белков считаются содоминантными, что означает, что коровы A1 / A2 производят оба типа белков в молоке. Если стадо имеет в основном гены A2, молоко, которое они производят, может содержать только небольшое количество молока A1; стадо с преобладанием А1 будет давать совсем другое молоко.Таким образом, обычное молоко может быть в основном А2, в основном А1 или где-то посередине.
Если говорить только об А1 и А2, кажется, что существует только два типа коровьего β-казеинового белка, но на самом деле их 13 [6]. A2 и A1 являются генетическими вариантами, но также используются для обозначения «типов» белков β-казеина. Это упрощает разговор о белках коровьего молока, но маскирует разнообразие казеинов в разных породах и внутри них. Восемь белков β-казеина, сгруппированных под A2, имеют одну и ту же аминокислоту в положении 67 (пролин), тогда как пять сгруппированных под A1 имеют гистидин в положении 67.Это различие в аминокислотах имеет отношение к способу переваривания белков. Пищеварительные ферменты расщепляют А1 β-казеин в положении 67, производя пептид из семи аминокислот, называемый β-казоморфин 7 (BCM-7). Поскольку пролин образует прочную связь со своими соседними аминокислотами, типы β-казеина A2 остаются неизменными в положении 67 и не продуцируют BCM-7.
Производство цепочки из семи аминокислот кажется несущественным, если учесть все ингредиенты, содержащиеся в молоке, но есть утверждения, что BCM-7 может вызывать проблемы с пищеварением у некоторых потребителей.В настоящее время существует мало научных подтверждений различий в пищеварении между молоком, содержащим некоторые белки A1, и молоком, содержащим только A2. С другой стороны, оба типа β-казеина связаны с хорошо известной пользой для здоровья, получаемой от их незаменимых аминокислот, кальция и фосфора.
1. Мюллер-Бушбаум П., Гебхардт Р., Рот С.В., Метвалли Э., Достер В. 2007. Влияние концентрации кальция на структуру мицелл казеина в тонких пленках. Биофизический журнал, 93: 960-968.DOI: 10.1529 / biophysj.107.106385.
2. Кавасаки К., Лафонт АГ, сир Дж. 2011. Эволюция генов казеина молока от генов зубов до происхождения млекопитающих. Молекулярная биология и эволюция, 28 (7): 2053-2061.
3. Rijnkels M. 2002. Многовидовое сравнение локусов казеиновых генов и эволюция семейства казеиновых генов. Журнал биологии и неоплазии молочных желез, 7: 327-345.
4. Lemay DG, Lynn DJ, Martin WF, Neville MC, Casey TM, Rincon G, Kriventseva EV, Barris WC, Hinrichs AS, Molenaar AJ, Pollard KS, Maqbool NJ, Singh K, Murney R, Zdobnov EM.Теллам Р.Л., Медрано Дж. Ф., Герман Дж. Б., Рейнкельс М. 2009. Геном лактации крупного рогатого скота: понимание эволюции молока млекопитающих. Геномная биология, 10 (4): R43.
5. Брук-Тейлор С., Дуайер К., Вудфорд К., Кост Н. 2017. Систематический обзор желудочно-кишечных эффектов A1 по сравнению с A2 β-казеином. Успехи в питании, 8: 739-748.
6. Винсент Д., Элкинс А., Кондина М.Р., Эзерниекс В., Рохфорт С. 2016. Количественное определение и идентификация интактных основных белков молока для высокопроизводительных анализов LC-ESI-Q-TOF MS.PloS one, 11: p.e0163471.
Предоставлено
Д-р Лорен Миллиган Ньюмарк
Научный сотрудник
Смитсоновский институт
казеина | Определение, свойства, производство и использование
Казеин , главный белок молока и важнейший ингредиент сыра. В чистом виде это аморфное белое твердое вещество без вкуса и запаха, тогда как его коммерческий тип желтоватого цвета с приятным запахом. Коровье молоко содержит около 3 процентов казеина.
Свойства
Чистый казеин — это аморфное твердое вещество белого цвета без вкуса и запаха. Товарный казеин слегка желтоватый, с приятным запахом. Сухой казеин хорошо хранится при защите от насекомых и грызунов; влажный казеин быстро поражается плесенью и бактериями и приобретает неприятный запах. Удельный вес от 1,25 до 1,31. Казеин представляет собой смесь фосфопротеинов разной молекулярной массы.
Казеин — лиофильный коллоид, родственный альбумину и желатину. Он изоэлектрический при pH 4.6, где его растворимость в воде составляет всего 0,01 процента. Он амфотерный: ниже pH 4,6 казеин образует умеренно растворимые соли, такие как хлорид казеина; выше pH 4,6 казеин образует соли с основаниями. Казеинат натрия и другие соли щелочных металлов растворимы без ограничений, в то время как казеинат кальция, другие соли щелочноземельных металлов и соли тяжелых металлов почти нерастворимы. Казеинаты легко образуют гели при медленной коагуляции из концентрированных растворов. Формальдегид образует нерастворимое соединение с казеином. Казеин не растворяется в большинстве органических растворителей.Параказеин менее лиофильный, но в остальном идентичен казеину.
Производство
Казеин обычно получают из обезжиренного молока (реже из пахты) одним из трех способов: (1) естественным скисанием казеина, когда в результате ферментации молочного сахара постоянно присутствующей бактерией образуется достаточное количество молочной кислоты Streptococcus lactisi ; (2) кислый казеин осаждают путем добавления разбавленной соляной кислоты или серной кислоты; (3) для сычужного казеина в теплое обезжиренное молоко добавляют экстракт сычужного фермента до образования сгустков параказеината кальция, после чего сгусток разрезают на мелкие кусочки, чтобы дать сыворотке стечь.Во всех трех методах сыворотка отбирается, творог промывается водой, осушается или прессуется, сушится на теплом воздухе, измельчается и упаковывается для продажи. Сычужный казеин удерживает большую часть фосфата кальция из молока.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Используется
Казеин используется в готовых пищевых продуктах, в лекарствах и пищевых добавках, а также в косметике. Незначительные промышленные применения включают добавление приправ и отделку кожи, чистящие средства и полироли для обуви, печать по текстилю и калибровку, инсектицидные спреи, мыловарение и многие другие применения, в которых казеин служит в качестве защитного коллоида, эмульгирующего агента или связующего.Основные области применения казеина — это покрытия для бумаги, клеи, краски, пластмассы и искусственные волокна.
Покрытия для бумаги
Книжная и художественная бумага покрыта пигментированным казеином, чтобы обеспечить подходящую поверхность для полутоновых иллюстраций. Умеренно щелочной раствор естественно кислого или кислого казеина смешивают с водной суспензией пигментов. Формальдегид или известь могут быть добавлены для лучшей водостойкости. Смесь выкладывают на бумагу в лакировальной машине и сушат.
Клей
Деревянные стыки, выполненные казеиновым клеем, некоторое время выдерживают сырость.Приготовленный казеиновый клей представляет собой порошок, состоящий из естественно закисшего или кислого казеина, извести, подходящих солей натрия и фунгицида. Порошок растворяют в воде незадолго до использования клея, после чего соли натрия осаждают часть извести, выделяют гидроксид натрия и растворяют казеин в виде казеината натрия; позже остаток извести медленно превращает казеинат натрия в нерастворимый казеинат кальция.
Краски
Казеиновые краски или темпера обеспечивают умеренно смываемую, матовую отделку внутренних стен или наружной кладки.Порошковые казеиновые краски, смешиваемые с водой, по составу аналогичны казеиновому клею, за исключением дополнительного добавления пигментов. Краски на основе казеиновой пасты, разбавляемые водой, изготавливаются путем окрашивания слабощелочных растворов казеина. Казеин также используется в качестве эмульгатора в эмульсионных красках, которые представляют собой масляные краски, которые можно разбавлять водой.
Эдвард Мунк: Крик
Крик , темпера, казеин на картоне, Эдвард Мунк, 1893; в Национальной галерее Осло.
Национальная галерея, Осло, Норвегия / Библиотека искусств Бриджмена, Лондон / SuperStock
Пластмассы
Формованные пластмассовые изделия из казеина по внешнему виду напоминают рог, слоновую кость, черное дерево и мрамор. В основном используется для пуговиц на одежде. Сычужный казеин гранулируют, смачивают водой и тщательно вымешивают. Могут быть добавлены красители или пигменты. Гранулы впитывают воду и размягчаются. Затем материал пропускают через нагретый цилиндрический пресс с вращающимся шнеком, из которого под давлением экструдируется мягкий пластик в стержнях или трубках.Затем мягкому пластику можно придать желаемую форму. Формованный пластик затвердевает путем длительного замачивания в растворе формальдегида, после чего медленно сушится.
Искусственные волокна
Текстильные волокна, похожие на шерсть, получают из казеина путем экструзии щелочного раствора казеина через фильеры, которые используются при производстве вискозы, с последующим отверждением волокон в кислотной ванне, содержащей формальдегид. Впервые появившиеся на рынке в 1930-х годах под маркой Lanital в Италии и Aralac в Соединенных Штатах, искусственные казеиновые волокна нашли применение во время Второй мировой войны из-за нехватки шерсти.Интерес к казеиновому волокну возобновился в 21 веке, поскольку производители стремились изучить экологически безопасные альтернативы синтетическим волокнам на нефтяной основе, таким как нейлон.
The Editors of Encyclopaedia Britannica Эта статья была недавно отредактирована и обновлена Кара Роджерс, старшим редактором.
Узнайте больше в этих связанных статьях Britannica:
белок: молочные белки
Казеин осаждается не только под действием кислоты, но и под действием фермента реннина, который содержится в желудочном соке.Реннин из желудков теленка используется для осаждения казеина, из которого делают сыр. Молочный жир осаждается казеином; молоко…
молочный продукт: белок
Основным молочным белком является казеин, который на самом деле существует в виде многоэлементного белкового комплекса, распределенного по жидкой фазе молока.При определенных условиях комплексы казеина разрушаются, вызывая свертывание молока. Свертывание приводит к разделению молочных белков на две отдельные фазы, твердую фазу (…
молочные продукты: прививки и свертывания
… или и то, и другое, казеин молочного белка слипается и выпадает из раствора; это процесс, известный как свертывание или коагуляция.Скоагулированный казеин имеет твердую или гелеобразную структуру (творог), которая задерживает большую часть жира, бактерий, кальция, фосфата и других твердых частиц. Оставшаяся жидкость (сыворотка) содержит…
Казеин и пептиды, полученные из казеина, в качестве антилейкемических агентов
Молоко — это гетерогенная смесь молочного секрета, состоящая из множества компонентов, которые проявляют широкий спектр химических и функциональных активностей. Казеин, основной белок молока, состоит из α -, β — и κ -казеинов, каждый из которых важен для пищевой ценности и для стимулирования высвобождения цитокинов, а также связан с регуляцией кроветворения и иммунного ответа и подавляют пролиферацию и индуцируют дифференцировку лейкозных клеток.Было показано, что процесс переваривания казеинов приводит к высвобождению биоактивных пептидов, которые участвуют в регуляции артериального давления и ингибировании или активации иммунного ответа, выступая в качестве агонистов или антагонистов опиоидных рецепторов, тем самым контролируя экспрессию гены, осуществляющие эпигенетический контроль. Позже они связываются с опиоидным рецептором, блокируют ядерный фактор κ -бета, увеличивают окислительно-восстановительный потенциал и уменьшают окислительный стресс и провоспалительные агенты, которые способствуют созданию антиоксидантной и противовоспалительной среды.Следовательно, биоактивные пептиды казеина могут быть соединениями с потенциалом против лейкемии. В этом обзоре содержится сводка современных знаний о казеинах и казеиновых пептидах в иммунной системе, а также об их роли в естественной защите от развития лейкемии и в качестве соответствующих эпигенетических регуляторов, которые могут помочь искоренить лейкоз.
1. Введение
Молоко представляет собой гетерогенную смесь молочного секрета, состоящую из множества компонентов (углеводов в виде олигосахаридов, липидов в виде длинноцепочечных полиненасыщенных жирных кислот, специфической для молока микробиоты и т. Д.), которые проявляют широкий спектр химической и функциональной активности. Молоко считается функциональным продуктом питания, оказывающим прямое и измеримое влияние на здоровье реципиента [1], и в настоящее время широко признано, что компоненты молока могут влиять и направлять физиологическое развитие потомства.
Согласно традиционным представлениям, основная роль молока заключается в снабжении молодых млекопитающих аминокислотами и азотом, при этом использование взрослыми для большинства видов запрещено; то есть люди — единственные известные млекопитающие, которые потребляют молоко другого вида, и это уникальное поведение, появившееся во время неолитической революции и сохранившееся по сей день.Таким образом, коровье молоко было основным продуктом питания для многих популяций людей по всему миру и почти повсеместно использовалось в питании человека [2, 3], независимо от возраста потребителя [4]. В этом смысле среди всех млекопитающих коровье молоко наиболее изучено; Таким образом, мы фокусируемся на ней, особенно на белковой фракции коровьего молока, которая состоит в основном из двух основных семейств белков, казеинов (нерастворимых) и сывороточных белков (растворимых), а также других второстепенных белков и пептидов, таких как гормоны.
Мы также обсуждаем доступные исследования грудного молока и казеина человека, поскольку их данные имеют отношение к теме, которую мы рассматриваем в данном документе.
Есть надежные данные, указывающие на то, что казеины связаны с иммунной системой и с образованием клеток крови на моделях мышей и крыс. Исследования in vitro предполагают, что казеины и пептиды, полученные в результате ферментативного гидролиза казеина, обладают противоопухолевой активностью, что согласуется с исследованиями на людях, которые показывают, что у младенцев, находящихся на грудном вскармливании, развивается лейкемия с меньшей частотой [5], и аналогичный эффект имеет был описан для пожилых людей, потребляющих коровье молоко [6], что позволяет предположить, что некоторые факторы, передающиеся с грудным молоком, могут предотвратить развитие этого заболевания [7].
В этом описательном обзоре содержится краткое изложение текущих знаний о казеинах и казеиновых пептидах в иммунной системе и о том, как они могут иметь биомедицинское значение для защиты от развития лейкемии и как соответствующие эпигенетические регуляторы, которые могут помочь искоренить лейкемию.
Все исследовательские статьи для этой статьи были получены путем поиска в Google Scholar и PubMed (https://www.ncbi.nlm.nih.gov/pubmed/).
2. Потребление молока и риск рака
Потребление молока в детстве имеет основополагающее значение, поскольку оно является единственным источником макро- и микронутриентов [8], и поскольку грудное вскармливание оказывает защитное действие против инфекций у младенцев, и есть исследования которые предполагают, что грудное вскармливание обеспечивает защиту от рака у детей [9].Mathur et al. изучили взаимосвязь между продолжительностью полного грудного вскармливания и исключительно грудного вскармливания и детским раком (58% случаев лимфомы были неходжкинской лимфомой). Их результаты показывают, что грудное вскармливание имеет защитный эффект от рака у детей. Более того, они указывают на то, что исключительно грудное вскармливание обеспечивает более благоприятные иммунологические эффекты, чем грудное вскармливание, дополненное альтернативным кормлением [10].
Shu et al. проверили гипотезу о том, что грудное вскармливание снижает риск детской лейкемии в двух исследованиях случай-контроль детского острого миелоидного лейкоза (AML) с морфологическими подтипами M0, M1 и M2, а также для детского раннего пре-B-клеточного лимфобластного лейкоза (ALL) .Они показывают снижение риска среди младенцев, находящихся на грудном вскармливании, особенно тех, кто находится на грудном вскармливании более 6 месяцев [5]. Несколько исследований изучали связь между диетой и ОМЛ у взрослых. Было показано, что потребление цельного молока увеличивает риск рака легких и яичников [11, 12], но роль молочных продуктов, таких как молоко, в риске рака неубедительна [13]. Таким образом, в больничном исследовании 111 случаев и 439 контролей регулярное потребление молока было фактором, связанным со значительным снижением риска ОМЛ у женщин с самым высоким еженедельным потреблением молока по сравнению с теми, кто потреблял меньше всего молока. категория [13].Многоцентровое исследование случай-контроль было проведено в юго-восточном и северо-восточном Китае, и его результаты показывают, что диета, богатая овощами и достаточное количество молока, снижает риск лейкемии у взрослых [6]. Кроме того, потребление молока связано со снижением риска рака дистального и прямого отделов толстой кишки [14]. Эти эпидемиологические данные предполагают, что некоторые компоненты молока обладают противоопухолевым действием, но состав молока постоянно меняется в течение периода лактации, и было показано, что существуют значительные различия в составе молока между разными видами.Диета и окружающая среда — важные факторы, влияющие на состав молока. Некоторые питательные микроэлементы могут различаться в зависимости от статуса питания, а токсины в окружающей среде будут различаться в зависимости от уровня воздействия химических веществ, характерных для данного региона, в окружающей среде [10]. Необходимы дальнейшие исследования для изучения риска, связанного с потреблением молока.
3. Состав молока
Молоко содержит определенные белки, жиры, легко усваиваемые, углеводы, минералы, витамины и другие компоненты [15].Их состав отражает потребности в питании для роста и развития каждого вида. Таким образом, коровье молоко состоит из примерно 3,2% белка, 4% липидов, 5% углеводов и 0,7% минеральных солей [16], тогда как грудное молоко состоит из 1% белка, 4% липидов, 7% углеводов и 1% минеральных солей. соли [17] (табл. 1).
| |||||||||||||||||||||||||||||||||||||||||||||||||
Молочный белок имеет высокую биологическую ценность, поэтому молоко является хорошим источником незаменимых аминокислот; однако широкий спектр молочных белков обладает биологической активностью, которая варьируется от антимикробных функций до облегчения всасывания питательных веществ, а другие действуют как факторы роста, гормоны, ферменты, антитела и иммуностимуляторы [8].
Молочные белки можно в общих чертах разделить на 3 категории: казеины, сывороточные белки и муцины, которые присутствуют в мембране жировых шариков молока. В молоке казеины взаимодействуют с фосфатом кальция, образуя большие стабильные коллоидные частицы, называемые мицеллами. Эти мицеллы позволяют поддерживать концентрацию перенасыщенного фосфата кальция в молоке, обеспечивая новорожденного достаточным количеством фосфата кальция для минерализации кальцифицирующих тканей [21].
Белки молока также способствуют усвоению нескольких важных питательных веществ, таких как микроэлементы и витамины, и содержат группу белков, которые обеспечивают защитную функцию, что указывает на их важность как многофункциональных веществ [22].
Бычий сывороточный белок включает иммуноглобулины, α -лактальбумин, β -лактоглобулин, сывороточный альбумин, иммуноглобулин, лактоферрин, фракции протеозопептона и трансферрин. Также существуют меньшие количества других минорных белков и пептидов, например, при гормональной или другой физиологической активности [23]. В материнском молоке белки сыворотки, обнаруженные в значительных количествах, представляют собой α -лактальбумин, лактоферрин, IgA, остеопонтин и лизоцим [18].
Казеины крупного рогатого скота, наиболее изученные, включают α s1-, α s2-, β — и κ -казеины.Они синтезируются в молочной железе под мультигормональным контролем, а в геноме крупного рогатого скота они связаны в области 200 т.п.н. на хромосоме 6 в следующем порядке: α s1-, β -, α s2- , и κ -казеин [24].
β -Казеин содержит 209 аминокислот. Присутствие пролина или гистидина в 67-м положении β -казеина позволяет различать два типа молока, A1 и A2, и нет никаких других различий между этими казеинами.A1 β -казеин представляет собой основной вариант β -казеина в молоке обычных молочных коров североевропейского происхождения: фризских, эйрширских, британских шортгорнов и голштинских коров. A2 β -казеин в основном содержится в молоке коров с Нормандских островов, Гернси и Джерси, у южно-французских пород, шароле и лимузен [25], а также у коров африканского происхождения зебу. Присутствие пролина или гистидина в 67-й позиции β -казеина связано с основными эффектами высвобождения биоактивного пептида различными желудочно-кишечными ферментами [26]; таким образом, биоактивный пептид из семи аминокислот, β -казоморфин-7 (BCM7), может быть более легко высвобожден при переваривании в тонком кишечнике A1 β -казеина с пепсином, лейцинаминопептидазой и эластазой, но альтернативный пролин в положении 67 предотвращает расщепление белка в этом сайте [27].Существует гипотеза, что A1 (но не A2) β -казеин может повышать риск развития диабета I типа (DM-I) у генетически предрасположенных детей [28], и было высказано предположение, что A1 β -казеин может также быть фактором риска ишемической болезни сердца (ИБС) [29].
α s2-Казеин составляет до 10% казеиновой фракции коровьего молока; он состоит из 2 основных и нескольких второстепенных компонентов, которые демонстрируют различные уровни посттрансляционного фосфорилирования [30], а также незначительные степени межмолекулярного дисульфидного связывания [31].
α s2-казеин является наиболее чувствительным к кальцию представителем семейства казеинов, возможно, из-за высокого содержания в нем сложноэфирного фосфата, который образован от 10 до 13 фосфатных групп на каждой пептидной цепи [32].
4. Казеины как регуляторы гемопоэза и иммунной системы
Исторически казеинат натрия (SC), растворимая в воде соль казеина крупного рогатого скота с 65% белков [33], стал первым доказательством того, что белки молока связаны с биологией. иммунной системы.СК, используемая в качестве провоспалительной молекулы, индуцирует хемотаксис гранулоцитов и макрофагов в брюшной полости мышей [34, 35] и вызывает накопление миелоидных клеток-предшественников в костном мозге мышей [36]. Со временем было показано, что СК ускоряет переход полосовых клеток из костного мозга в полиморфно-ядерные клетки, индуцируя, таким образом, макрофагальный колониестимулирующий фактор (M-CSF) [37]. Клетки-предшественники костного мозга мышей, культивируемых с интерлейкином 3 (rmIL-3) в качестве фактора роста в присутствии SC, показывают увеличенное количество клеток, которое превышает 50% [38].Следовательно, введение SC каждые 48 ч в течение 6 дней мышам BALB / c, как было показано, увеличивает пролиферацию миелоидных клеток и количество общих и мононуклеарных клеток из костного мозга, события, которые считаются показателями активации костномозгового кроветворения [36]. SC также индуцирует пролиферацию клеток гранулоцитарного происхождения и увеличивает уровни цитокинов как гранулоцитарного колониестимулирующего фактора (G-SCF), так и цитокинов гранулоцитарного макрофагального колониестимулирующего фактора (GM-CSF) в сыворотке и G-CSF в плазме костного мозга, а образовавшиеся гранулоциты обладают повышенной фагоцитарной активностью [39].Этот усиленный гранулопоэз и последующее усиление активации врожденной иммунной системы может объяснить, почему мыши, которым вводили летальные дозы бактерий, выживают после введения казеина [40].
Поскольку SC состоит из молекул α -, β — и κ -казеина, кажется логичным сделать вывод, что казеины будут иметь биологические эффекты, аналогичные эффектам натриевой соли. Большинство белков молока восприимчивы к разрушающим эффектам обработки желудка, и при воздействии ферментов в кишечнике происходит обширный гидролиз; поэтому имеется несколько сообщений, которые демонстрируют биологический эффект казеинов крупного рогатого скота и человека как полных молекул in vitro без предшествующей ферментативной деградации (Таблица 2).
| ||||||||||||||||||||||||||||
CFMS, рецептор M-CSF; ИЛ-1 β , интерлейкин 1 β ; ИЛ-6, интерлейкин 6; CGP, казеиногликопептид; MAPK-p38, митоген-активированная протеинкиназа p38. | ||||||||||||||||||||||||||||
Доказательства показали, что казеины in vivo посредством продукции цитокинов могут участвовать в развитии иммунной системы слизистой оболочки у новорожденных мышей [49], в эритропоэзе мышей [50] и восстановление кроветворения на моделях миелосупрессии у крыс [51].
5. Системное действие пептидов, полученных из белков молока
Становится все более очевидным, что при рассмотрении ценности молочного белка необходимо учитывать взаимосвязь между структурой белка и количеством и составом пептидов, полученных из белков. казеин и лактальбумин при пищеварении в желудочно-кишечном тракте [52].Кроме того, следует учитывать соответствующую физиологическую активность младенца во время грудного вскармливания, а также детей и взрослых, потребляющих коровье молоко.
Биологически активные пептиды, полученные из белков молока, определяются как фрагменты из 3–20 аминокислотных остатков, которые положительно влияют на физиологические функции организма. Обычно эти пептиды неактивны в последовательности родительского белка; таким образом, функциональные свойства проявляются только после разрушения структуры нативного белка во время желудочно-кишечного переваривания или обработки пищи.Как только они становятся биоактивными, пептиды могут действовать как регуляторные соединения с гормоноподобной активностью [22], что в конечном итоге влияет на здоровье живого организма [53].
Это разложение в желудочно-кишечном тракте может быть следствием ферментативного гидролиза, ферментации молока заквасочными культурами протеолитических бактерий и других процессов, используемых в молочном производстве [54]. В большинстве случаев казеины ферментативно расщепляются в кишечнике эндогенными ферментами, секретируемыми пищеварительной системой, ферментами экзогенного происхождения, полученными из активно метаболизирующейся микрофлоры кишечника [52] или, альтернативно, ферментативной деградацией гранулоцитов и макрофагов [55, 56 ].В любом случае многие из пептидов, высвобождаемых при ферментативном гидролизе, обладают специфическими биологическими функциями на основе их способности связываться (и влиять) на клеточные функции [57, 58].
Биоактивные молочные пептиды были впервые описаны после того, как исследования показали, что прием фосфорилированных пептидов, полученных из казеина, приводит к усилению не зависящей от витамина D кальцификации у младенцев с рахитом. С момента этого открытия несколько иммуномодулирующих пептидов были обнаружены в коровьем и грудном молоке [23, 59, 60].Среди наиболее изученных пептидов — α -производные -лактальбумина, а также α -, β — и κ -казеины (таблица 3). Были изучены следующие пептиды: (1) фосфопептиды казеина, образующиеся при расщеплении α — и β -казеинов, участвуют в стимулировании абсорбции кальция в кишечнике, моделируя кальцификацию костей [76]. (2) Пептидные ингибиторы ангиотензин-1-превращающего фермента, полученные из α -лактальбумина и α — или β -казеина, имеют решающее значение для регуляции артериального давления [77].(3) Опиоидные агонисты, полученные из α — или β -казеина и α -лактальбумина, играют важную роль в режиме сна и необходимы для развития и функции желудочно-кишечного тракта у младенцев [78]. (4) Антиоксидантные пептиды β — или k-казеина устраняют активные формы кислорода, снижая окислительный стресс у новорожденных [79–81]. (5) Иммуностимулирующие пептиды β -казеина и α -лактальбумина стимулируют фагоцитарную активность макрофагов [64, 82].(6) Пептиды α -лактальбумина проявляют бактерицидную активность, поскольку они обладают высоким сродством к железу патогенов, которое они используют для оказания сильного бактериостатического действия [68, 78].
Все эти исследования предполагают, что эти системные последствия после употребления молока у людей, полученного от матери в первые месяцы жизни и коровьего происхождения в детстве и взрослом возрасте, могут представлять медицинский и клинический интерес и особого внимания. могут быть направлены на исследования опиоидных пептидов. 6. Опиоидные пептиды изβ -казеина, α -казеина и κ -казеина Опиоидные пептиды определяются как пептиды, такие как энкефалины, которые обладают как аффинностью к опиатным рецепторам, так и опиатоподобными эффектами. ингибируется специфическими антагонистами опиатных рецепторов, такими как налоксон.Типичные опиоидные пептиды происходят из трех белков-предшественников: проопиомеланокортина (эндорфины), проэнкефалина (энкефалина) и продинорфина (динорфины) [83]. Все эти типичные эндогенные опиоидные пептиды имеют одинаковую N-концевую последовательность: Tyr-Gly-Gly-Phe [22]. С другой стороны, опиоидные пептиды, полученные из пищевого белка, классифицируются как экзогенные опиоиды: хотя они содержат остаток Tyr в своей последовательности, обычно на N-конце или в N-концевой области (за исключением α s1-CN- экзорфин, казоксин 6 и лактоферроксин B и C), они отличаются от эндогенных опиоидных пептидов, которые часто содержат Tyr-Gly-Gly-Phe в качестве N-концевой последовательности [84], потенциально с другим ароматическим остатком, Phe или Tyr, на 3-я или 4-я позиция [85].Считается, что, как и в эндорфинах, этот домен важен для связывания пептидов с опиоидным µ -рецептором (MOR) в центральной нервной системе, желудочно-кишечном тракте и некоторых иммунных клетках [86, 87]. Помимо структурного сходства, активность пептидов подавляется налоксоном, и поэтому считается, что эти молочные пептиды влияют на путь опиоидных рецепторов [58, 88]. В большинстве случаев эти экзогенные пептиды были выделены и впоследствии идентифицированы путем ферментативного расщепления их родительских белковых молекул.Все основные молочные белки содержат опиоидные лиганды, которые были конкретно названы экзорфинами и казоксином D, когда они получены из α -казеина. Другими пептидами-агонистами опиоидов молока являются экзорфины α -казеина, соответствующие бычьему α s1-казеину f90–95 (Arg-Tyr-Leu-Gly-Tyr-Leu) и f90 ± 96 (Arg-Tyr- Leu-Gly-Tyr-Leu-Glu), оба из которых обладают опиоидными свойствами, которые ингибируются налоксоном [1]. β -казоморфины (BCM) представляют собой пептиды от 4 до 11 аминокислот, зашифрованные в неактивной форме и высвобождающиеся во время переваривания как in vivo, и in vitro, .Среди них наиболее активными являются BCM7 и BCM5, которые представляют собой фрагменты f60–66 и f60–64 β -казеина соответственно [89]. Оба эти BCM проникают через кишечный барьер и достигают спинномозговой жидкости у нормальных людей [90]. Физиологические последствия этого явления еще не выяснены, но было высказано предположение, что существует связь между BCM и аутизмом. β -казоморфин индуцирует иммунореактивность Fos-типа в областях мозга, связанных с аутизмом, и повышенные уровни BCM7 наблюдались у пациентов с этим состоянием, у которых он оказывает расслабляющее действие [90].Точно так же BCM7 и опиоидные рецепторы могут быть связаны с шизофренией у людей с небольшим количеством опиоидных рецепторов [91]. Таким образом, несмотря на высокие уровни BCM7 у этих пациентов [90], BCM7 не может оказывать расслабляющего эффекта, который он оказывает у аутичных пациентов. BCM были первоначально выделены из человеческого и бычьего β -казеина после гидролиза трипсином in vitro [92]. Пепсин и LAP ответственны за высвобождение остатка Tyr на N-конце всех типов про-BCM: пепсин расщепляет пептидную связь Leu58-Val59, а LAP удаляет валин с аминоконца.Следует отметить, что эти пептиды проявляют сильную опиоидную активность после удаления остатка валина [93]. BCM подавляет пролиферацию лимфоцитов , происходящих из собственной пластинки человека, in vitro . Этот антипролиферативный эффект отменяется добавлением к культуре антагониста опиатных рецепторов налоксона [92]. Однако BCM также повышает устойчивость мышей к Klebsiella pneumoniae , вероятно, за счет стимуляции перитонеальных макрофагов. Кроме того, введение опиоидного антагониста мышам in vivo приводит к подавлению этого стимулирующего эффекта, что позволяет предположить наличие активного сайта связывания опиоидного рецептора для биологически активного пептида [42]. BCM7 f60 ± 66 и BCM10 f193 ± 102 (Tyr-Pro-Phe-Pro-Gly-Pro-Ile и Tyr-Gln-Gln-Pro-Val-Leu-Gly-Pro-Val-Arg, соответственно) могут проявлять биполярные модулирующие эффекты на пролиферацию лимфоцитов периферической крови человека. В in vitro культурах с митоген-стимулированными Т-лимфоцитами было показано, что оба пептида в низких концентрациях подавляют пролиферацию, но усиливают пролиферацию при введении в высоких концентрациях [71]. 7. Казеины и пептиды, полученные из казеинов, при регулировании ракаСообщалось о большом разнообразии биоактивности компонентов молочного белка, причем один компонент имеет более одного типа биологической активности, но здесь мы представляем только примеры в какие казеины и казеиновые пептиды действуют на различные линии раковых клеток или модели животных.Затем мы сосредоточимся на антилейкемической активности этих пептидов. α -, β — и κ -казеиновые белки ингибируют миграцию in vitro опухолевых клеток молочной железы мыши линии клеток Met-1, линии клеток рака молочной железы человека MCF10A-H-Ras ( G12V) и MDA-MB-231, причем α -казеин является наиболее эффективным [94]. Гидролизаты казеина, полученные с использованием различных коммерчески доступных ферментных препаратов пищевого качества из источников млекопитающих, бактерий и растений, оказывают ингибирующее действие на жизнеспособность и рост как Т-клеток лейкемии Jurkat человека, так и линий клеток эпителиальной колоректальной аденокарциномы человека Caco-2, но СК не оказали значительного влияния на жизнеспособность и рост клеток Сасо-2 [95]. Пептиды, полученные из α s1-казеина и β -казеина, расщепленные молочнокислыми бактериями, ингибируют ферментативную активность очищенной рекомбинантной матричной металлопротеиназы (MMP) -2, MMP-7 и MMP-9 в человеческом HT-29 и клетки карциномы толстой кишки SW480 [96]. Лактаптин, протеолитический фрагмент (f57 ± 134) κ -казеина человека, индуцирует апоптоз клеток аденокарциномы MCF-7 [97]. Кроме того, RL2, рекомбинантный аналог лактаптина, индуцирует апоптоз в клетках MDA-MB-231 из эпителиальной линии клеток рака груди человека и клеток MCF-7, и оба подавляют экспрессию Bcl-2 и индуцируют р53-независимую гибель клеток [98] .С другой стороны, он снижает жизнеспособность клеток карциномы легкого A549 и клеток эпидермальной карциномы гортани Hep-2, но не сопровождается апоптозом, и, что интересно, незлокачественные мезенхимальные стволовые клетки человека (МСК) полностью устойчивы к действию RL2 [99]. Кроме того, 90-95 и 90-96 α -казоморфин, BCM7, BCM5 и морфицептин, амид β -казоморфина-4, обладают антипролиферативным действием на клетки T47D, блокируя клетки в G0. / G1 фаза [58]. Кроме того, 90–95 и 90–96 α -казоморфин, BCM5 и α s1-казоморфин амид ингибируют пролиферацию клеток DU145 и PC3 простаты человека [100]. Более того, f63-68 из β -казеина ингибирует пролиферацию клеток рака яичников человека SKOV3 частично, способствуя апоптозу посредством подавления пути BCL2 [101]. β -казеиновый пептид f41-45 индуцирует цитотоксичность в клетках меланомы B16F10 [102]. Среди первых результатов противоопухолевой активности казеина in vivo , крысы, получавшие диету, богатую казеином, показали заметное снижение канцерогенеза толстой кишки, вызванного азоксиметаном, по сравнению с канцерогенезом у крыс, получавших диету с низким содержанием казеина [103] . RL2, рекомбинантный аналог лактаптина, значительно подавлял рост солидных опухолей в ксенотрансплантатах мышей, несущих клетки рака молочной железы MDA-MB-231 [98]. 8. Казеины и пептиды, полученные из казеинов, обладают антилейкемическими свойствамиПервое доказательство антилейкемической активности протеинового молока было показано in vitro путем подкожного ингибирования пролиферации лейкемии в клетках мышей, таких как клетки WEHI-3. , J774 и P388, даже вызывая апоптоз в одной из них: клеточной линии миеломоноцитарного лейкоза WEHI-3.Однако в мононуклеарных нормальных клетках костного мозга мышей BALB / c (MNCs) СК индуцирует выраженный стимул пролиферации [38]. Доказательства показали, что нормальные ткани могут быть менее чувствительны к биологическим эффектам новых молекул с потенциальными антилейкемическими свойствами [104, 105]; Эти данные важны, поскольку полезность потенциального противоракового соединения зависит не только от его способности вызывать цитотоксичность в злокачественных клетках, но также от его относительной неспособности вызывать токсичность в нормальных тканях и, в случае SC, его способности подавлять пролиферации и вызывают гибель лейкозных клеток.Однако, помимо отсутствия цитотоксичности в отношении нелейкемических МНК, СК индуцирует их пролиферацию, что является редким свойством среди большинства лекарств, испытанных для использования при лечении острого миелоидного лейкоза. Затем стало ясно, что не только казеины, но и казеиновые пептиды оказывают ингибирующее действие на пролиферацию лейкозных клеток, когда гидролизат казеина ингибирует пролиферацию линий макрофагоподобных лейкозов J774 и P388, хотя цитотоксичность подтверждена только для последних. [106].Другие данные свидетельствуют о том, что κ -казеин f25-34 и f35-41 ингибируют пролиферацию нормальных клеток 32D и клеток миеломоноцитарного лейкоза WEHI-3 и индуцируют дифференцировку клеток в линиях моноцитарно-макрофагального и гранулоцитарно-нейтрофильного происхождения. κ -казеин f35-41 снижает пролиферацию клеток в обеих клеточных линиях и индуцирует дифференцировку 32D в направлении моноцитарно-макрофагальной линии, а также дифференцировку клеток WEHI-3 в направлении линии гранулоцитарных нейтрофилов, тогда как κ -казеин f58-61 не влияет на пролиферацию каких-либо клеток, но вызывает их дифференцировку с превращением в гранулоциты в обеих клеточных линиях.Это снижение пролиферации не связано с возможным цитотоксическим действием молекул [107]. β -казоморфин снижает пролиферацию клеток мыши 32D на 50% [108] и подавляет пролиферацию клеток линии клеток миеломоноцитарного лейкоза WEHI-3 [109]. Позже было показано, что SC вводил i.p. у мышей, смертельно инокулированных миеломоноцитарными лейкозными клетками WEHI-3, уменьшали опухолевую нагрузку и подавляли гепатомегалию, что в совокупности увеличивало выживаемость лейкемических мышей в значительной степени [38].Точно так же у мышей, инокулированных клетками линии макрофагоподобных клеток лейкемии J774, модели макрофагоподобной опухоли M5 AML, SC значительно уменьшал спленомегалию, гепатомегалию и наличие солидных опухолей [110]. В обоих случаях механизмы этого антилейкемического действия in vivo неизвестны, но было замечено, что i.p. введение СК здоровым мышам индуцирует продукцию цитокинов как в плазме, так и в костном мозге [39]; следовательно, противоопухолевые эффекты SC могут быть результатом индукции глубокой миграции воспалительных клеток в брюшную полость [34] либо через биоактивные компоненты SC [111], либо через секрецию факторов роста, дифференцировку клеток или эффект системное воспаление [40].Кроме того, SC может активировать механизмы, отличные от механизмов, связанных с простым воспалительным процессом, потому что, хотя другие агенты, такие как зимозан или тиогликолят, увеличивают уровни провоспалительных цитокинов (IL-1 β , TNF- α , MIP -2 и MCP-1 / CCL2) [112, 113], они не оказывают ингибирующего действия на пролиферацию кроветворных клеток [114]. Имеющиеся данные о казеинах, как в их полной форме, так и в виде фрагментов, образовавшихся в результате их ферментативной деградации, свидетельствуют об усилении различных аспектов иммунной системы, но их потенциал в качестве противоопухолевых агентов практически не изучен.Использование казеинов или их пептидов для усиления иммунной системы в борьбе с раком является рациональной стратегией, поскольку иммунная система постоянно работает, чтобы защитить нас от опухолей. Однако это, конечно, не всегда бывает успешным: в 2018 г. в США было диагностировано 19 520 новых случаев ОМЛ, что составляет примерно одну треть всех новых случаев лейкемии [115]. Тем не менее, укрепление иммунной системы для искоренения рака остается действенной и широко исследуемой стратегией против рака. Есть элементы, которые предполагают, что казеины или казеиновые пептиды могут искоренить лейкемию, действуя как усилитель иммунной системы и вызывая гибель злокачественных клеток. Как мы отмечали выше, механизмы антилейкемического действия SC in vivo неизвестны, но все эти данные о казоморфинах добавляются к тому факту, что и гранулоциты, и макрофаги способны гидролизовать казеины с высвобождением биологически активных пептидов [55 , 56], предполагают, что эти опиоидные пептиды могут быть ответственны за антилейкемические эффекты, наблюдаемые для SC или казеинов [116]. 9. Механизм действия казеинов и производных пептидов в гематопоэтических и лейкозных клеткахБыло показано, что в гематопоэтических клетках, таких как полиморфно-ядерные клетки и моноциты, есть специфические рецепторы для казеинов [117, 118], хотя этому уделялось мало внимания. уделялось внимание этой теме, и было изучено, может ли другой тип рецептора в гематопоэтических клетках быть вовлеченным в биологические эффекты казеинов. Гематопоэтические стволовые / предшественники (HSPCS) и их дифференцированное потомство экспрессируют толл-подобные рецепторы (TLR), которые обеспечивают эффективный иммунный ответ в ответ на острое повреждение или инфекцию. Они также несут ответственность за распознавание и удаление опухолевых клеток. Следовательно, распознавание TLR4 на антигенпрезентирующих клетках усиливает антигенспецифический противоопухолевый иммунитет [119, 120], и был разработан иммунотерапевтический режим, способный устранять крупные сформировавшиеся опухоли у мышей с использованием HMGN1, DC-активирующего агониста TLR4, способного индукции противоопухолевого иммунитета [121].Недавно было показано, что α -казеин связывается с TLR [47, 122]; таким образом, казеин может оказывать иммуномодулирующее действие на лейкоциты и даже участвовать в генезе клеток крови через TLR (рис. 1), что может объяснить противоопухолевый эффект α -казеина в лейкозных клетках WEHI-3 [116]. Однако сверхэкспрессия или аберрантная трансляция передачи сигналов TLR также связаны с неэффективным или злокачественным гематопоэзом, как в случае лейкемии. Таким образом, сверхэкспрессия TLR-4 и TLR-2 наблюдалась при остром миелоидном лейкозе и более выражена при остром промиелоцитарном лейкозе (таблица 4), но снижена в клетках пациентов, получавших химиотерапию, что предполагает участие клеточных сигналов. которые способствуют развитию и распространению лейкемии [128, 131].Активация TLR вызывает выработку интерлейкина 8 (IL-8), который привлекает супрессорные клетки, происходящие из миелоцитов (MDSC), ответственные за умиротворение онкогенного микроокружения [132]. Кроме того, было показано, что лейкозные клетки стимулируют собственные стромальные клетки костного мозга продуцировать IL-8, цитокин, который поддерживает развитие лейкозных клеток [132]. Во время передачи сигнала TLR активирует ядерный фактор κ -beta (NF κ B) [133], главный провоспалительный промотор, преобладающий в микроокружении опухоли, что приводит к увеличению количества провоспалительных цитокинов, таких как TNF- α , IL-1 β и IFN-γ, но снижение количества противовоспалительных молекул, таких как интерлейкин 10 (IL-10), SOD, CAT и GPx (рисунок 1 (a)).Таким образом, роль TLR в генезе и / или элиминации лейкемии является спорной; следовательно, уместно предположить, что необходимы дополнительные исследования, чтобы прояснить обстоятельства, при которых TLR связаны с развитием рака, и при каких условиях эти же рецепторы могут служить терапевтической альтернативой против развития лейкемии.
Нам известно, что подкожное введение в брюшную полость способствует выживанию лейкемических мышей [38, 110]. Возможный механизм этого антилейкемического эффекта может быть связан с активацией TLR α -казеином для оказания противоопухолевой активности (рис. 1 (b)). Альтернативно, эти резидентные клетки брюшной полости мышей могут индуцировать фрагментацию казеина с высвобождением казоморфинов с активностью опиоидных рецепторов, как указано ниже. Было замечено, что отсутствие MOR у мышей усиливает генез гематопоэтических клеток-предшественников [134], показывая возможную негативную регуляторную роль гематопоэза для этого типа рецепторов.Напротив, сверхэкспрессия этого типа рецептора наблюдалась в лейкозных клетках (таблица 4), и было даже предложено использование опиоидных агонистов для лечения различных типов опухолей, включая опухоли лейкемии [135]; в этом смысле метадон, специфический лиганд MOR, был предложен для лечения рака [135, 136], поскольку он индуцирует апоптоз и увеличивает чувствительность лейкозных клеток к действию доксорубицина по механизму, который включает снижение цАМФ. , промотор клеточной пролиферации [124]. В рамках развития лейкемии, помимо высоких уровней активных форм кислорода (ROS), экспрессия и активация антиоксидантных ферментов, таких как супероксиддисмутаза (SOD), каталаза (CAT) и пероксид глутатиона (GPx) нарушаются, в частности, снижается активность как СОД, так и КАТ в лимфоцитах пациентов с ОЛЛ и ХЛЛ [137, 138]. Было показано, что BCM7, используя эпигенетический контроль, повышает уровни глутатион-S-трансферазы (GST), детоксифицирующего фермента агентов, способствующих развитию рака [139], который экспрессируется на низких уровнях у пациентов с лейкемией [140].Фактически, ген GST гиперметилирован при раке легких, груди и печени; лейкемия; и лимфомы [141]. После 15 дней перорального введения BCM7 диабетическим мышам уровень малонового диальдегида поджелудочной железы заметно снизился с увеличением активности CAT и снижением экспрессии гена NF κ B и iNOS. Таким образом, BCM7 вызывает выраженное снижение окислительного стресса и ингибирует сигнальный путь NF κ B-iNOS-NO [142]. Кроме того, было показано, что BCM7, связываясь с MOR, увеличивает соотношение GSH / GSSG и снижает уровень ферментов, участвующих в метилировании SAM / SAH, что приводит к снижению метилирования области CpG [139], показывая его роль как эпигенетический модулятор соответствующих генов в окислительно-восстановительном контроле. Все эти элементы предполагают, что BCM7 может замедлять лейкемогенез посредством MOR или, как альтернатива, CN и α s1-казеинов через TLR4. В любом случае, в результате активации любого рецептора или их обоих, передача сигналов NF κ B, основного провоспалительного промотора, преобладающего в микроокружении опухоли, может быть заблокирована, тем самым снижая уровни про- воспалительные цитокины, но увеличивают количество противовоспалительных молекул, которые могут уменьшить лейкемогенную среду (рис. 1 (b)). 10. Перспективы на будущееБесспорно, что лейкозные клетки сверхэкспрессируют TLR и опиоидные рецепторы, которые связывают казеины и казоморфины соответственно. В обоих случаях взаимодействие приводит к снижению провоспалительного микроокружения, преобладающего при развитии опухолей, поэтому было бы интересно оценить, будет ли за счет эффективного снижения окислительного стресса более выгодным производство противовоспалительных цитокинов по сравнению с производством провоспалительных цитокинов; такая информация может подтвердить потенциальное антионкогенное использование казеинов и казоморфинов. Казеины и некоторые казоморфины подавляют пролиферацию и индуцируют дифференцировку лейкемических, но не нормальных клеток, а казеины способствуют пролиферации и дифференцировке клеток и даже продлевают выживаемость лейкемических мышей. Было бы очень интересно определить, зависит ли причина этих биологических эффектов от присутствия TLR и / или MOR. Учитывая важность физиологического действия пептидов, полученных из казеина, разумно предположить, что они могут играть важную роль в качестве питательных микроэлементов и что их отсутствие может вызывать развитие не только лейкемии, но и других типов рака. Не следует упускать из виду, что α S1-казеин экспрессируется в клетках, отличных от молочной железы, в основном у пациентов с аутоиммунными заболеваниями, что заставляет с осторожностью анализировать роль этого соединения как противоопухолевого агента. 11. ВыводыСуществуют доказательства того, что казеины, как в их полной форме, так и в виде фрагментов, образующихся в результате их ферментативной деградации, усиливают различные аспекты иммунной системы, такие как пролиферация лимфоцитов и образование антител.Они также могут регулировать нормальный гематопоэз in vitro и in vivo посредством секреции цитокинов, тем самым вызывая дифференцировку и усиливая пролиферацию. Однако в лейкозных клетках они вызывают апоптоз и негативно регулируют пролиферацию. Это явление подчеркивает потенциал белков молока как противоопухолевых агентов, но необходимы дальнейшие исследования, чтобы полностью понять механизмы, лежащие в основе эффектов биоактивных пептидов молока. До сих пор нам было показано, что TLR и OPR участвуют в передаче сигналов от казеиновых пептидов при лейкозах и нормальных гематопоэтических клетках.Хотя люди потребляют молоко в течение гораздо более длительного периода времени, чем другие млекопитающие, мы еще не понимаем полного объема применения казеина или его пептидов в качестве лечебного режима против лейкемии. Однако окончательное доказательство того, что продукт, полученный из молока, принесет или не принесет пользу здоровью человека, можно будет получить только в ходе клинических испытаний. Конфликт интересовАвторы не заявляют о конфликте интересов. БлагодарностиЭта работа была поддержана Генеральным директором Асунтос дель Персональной Академии, UNAM (номер гранта PAPIIT IN221017).Авторы выражают признательность Генеральному директору Асунтос дель Персональной Академии, UNAM (номер гранта PAPIIT IN221017) за финансирование. Ана Росио Ривера-Мартинес (270102) получила стипендию Consejo Nacional de Ciencia y Tecnología (CONACYT) и благодарит аспирантуру по биологическим наукам Национального автономного университета Мексики (UNAM) за обучение, полученное во время обучения. Произошла ошибка при настройке пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Настройка вашего браузера для приема файлов cookieСуществует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie? Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie Что сохраняется в файле cookie?Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Национальное руководство (ред. Хаитова Р.М., Ильиной Н.И.). — М.: Изд. «ГЭОТАР-Медиа». 2013:640.
Национальное руководство (ред. Хаитова Р.М., Ильиной Н.И.). — М.: Изд. «ГЭОТАР-Медиа». 2013:640.